一种基于喹喔啉骨架的有机光催化剂及其制备方法和应用
1.本发明涉及光催化剂技术领域,具体涉及到一种基于喹喔啉骨架的有机光催化剂及其制备方法和应用。
背景技术:
2.可见光光氧化还原催化是活化有机小分子的强大工具,在许多的合成和官能团化中得到了广泛的应用,通过立体选择性地活化和激活特定的官能团或化学键,以实现之前具有挑战性甚至不可能实现的化学转化。经典的光催化剂,无论是过渡金属配合物还是有机染料,在吸收可见光时,都能够达到电子激发态,从而能够将单电子转移或能量转移到各种底物。钌基和铱基光催化剂由于其优异的光物理性能,已经作为光氧化还原催化剂被广泛的研究和应用,其突出的效用和令人印象深刻的性能已得到充分证实。然而,使用这些贵金属催化剂的成本高昂,并且由于其陆地稀缺性和与其开发相关的环境问题,也与可持续性发展形成鲜明对比。因此,人们对开发可持续的替代光催化剂产生了广泛的兴趣。
技术实现要素:
3.针对上述的不足,本发明的目的是提供一种基于喹喔啉骨架的有机光催化剂及其制备方法和应用。
4.为达上述目的,本发明采取如下的技术方案:
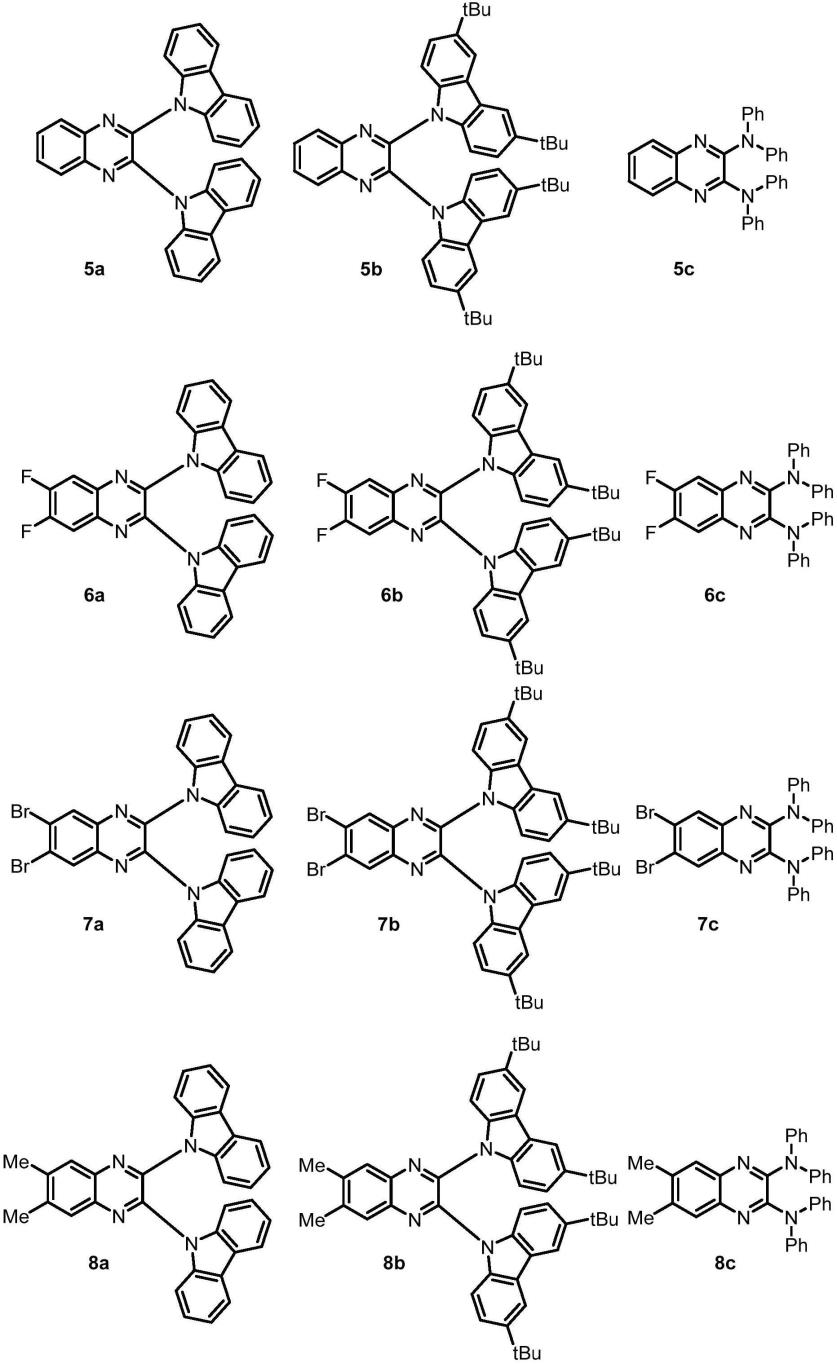
5.本发明提供一种基于喹喔啉骨架的有机光催化剂,其化学通式如式(i)所示:
[0006][0007][0008]
其中,r1为氢、取代或未取代的c
1-c
60
烷基、取代或未取代的c
2-c
60
烯基、取代或未取代的c
2-c
60
炔基、取代或未取代的c
1-c
60
烷氧基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
1-c
10
杂环烷基、取代或未取代的c
3-c
10
环烯基、取代或未取代的c
1-c
10
杂环烯基、取代或未取代的c
6-c
60
芳基、取代或未取代的c
1-c
60
杂芳基、羟基、羧基、酯基、氰基、氨酰基或卤素原子(比如氟,氯,溴,碘);r2为咔唑基、萘基、螺-芴基、菲基、蒽基、芘基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基、n,n-二苯基、n,n-二甲基、吗啉基、哌嗪基、吩噻嗪基或吩恶嗪基。
[0009]
本发明中,喹喔啉及其衍生物是具有d(电子受体)-a(电子给体)结构的杂环化合物,并且具有较好的热稳定性以及化学稳定性。同时,由于空间位阻效应,电子受体(喹喔啉)与不同的电子给体之间存在一定的二面角,避免了在可见光激发时发生的电子淬灭,提高了荧光量子产率。喹喔啉及其衍生物能够在可见光的激发下电子从电子给体跃迁到电子受体,此时为单重激发态s1,s1可以通过荧光(辐射跃迁)或内部转换ic(非辐射跃迁)返回到基s0,或者它可以通过自旋禁止的非辐射过程(称为系统间穿越(isc))进入三重激发态
t1。激发的喹喔啉及其衍生物成为比基态更强的氧化剂和还原剂,之后与底物发生单电子转移,实现喹喔啉及其衍生物的氧化淬灭循环或者还原淬灭循环,进而引发后续的反应,实现多样化的化学转换。
[0010]
进一步地,r1优选为氢、卤素、苄基、酯基、酰基、氰基、氨酰基、杂芳环、取代或未取代的c
1-10
烷基、取代或未取代的c
3-10
环烷基。
[0011]
进一步地,r2优选为n,n-二苯基、咔唑基、萘基、螺-芴基、菲基、蒽基、芘基、吗啉基、哌嗪基、吩噻嗪基或吩恶嗪基。
[0012]
进一步地,咔唑基包括但不限于3,6-二甲基咔唑基、3,6-二叔丁基咔唑基、3,6-二甲氧基咔唑基等。
[0013]
进一步地,基于喹喔啉骨架的有机光催化剂的优选结构式如下所示:
[0014][0015]
本发明还提供上述基于喹喔啉骨架的有机光催化剂的制备方法,包括以下步骤:
[0016][0017]
步骤(1):将邻苯二胺类化合物1和草酸化合物1’于盐酸溶液中,加热搅拌回流状态下反应0.5~24小时;反应结束后,将反应体系冷却至室温,随后将反应体系倒入冰水中,待有沉淀析出后过滤得到固体,得到1,4-二氢喹喔啉-2,3-二酮类化合物2;
[0018]
步骤(2):将步骤(1)所得1,4-二氢喹喔啉-2,3-二酮类化合物2溶于溶剂中,然后加入二氯亚砜,再缓慢滴加n,n-二甲基甲酰胺,加热搅拌回流状态下反应5~12小时;反应结束后对反应体系分离纯化,得到2,3-二氯喹喔啉类化合物3;
[0019]
步骤(3):将步骤(2)所得2,3-二氯喹喔啉类化合物3与化合物4进行亲核取代反应,对反应体系分离纯化后得到目标产物5;
[0020]
其中,r1为氢、取代或未取代的c
1-c
60
烷基、取代或未取代的c
2-c
60
烯基、取代或未取代的c
2-c
60
炔基、取代或未取代的c
1-c
60
烷氧基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
1-c
10
杂环烷基、取代或未取代的c
3-c
10
环烯基、取代或未取代的c
1-c
10
杂环烯基、取代或未取代的c
6-c
60
芳基、取代或未取代的c
1-c
60
杂芳基、羟基、羧基、酯基、氰基、氨酰基或卤素原子(比如氟,氯,溴,碘);r2为咔唑基、萘基、螺-芴基、菲基、蒽基、芘基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基、n,n-二苯基、n,n-二甲基、吗啉基、哌嗪基、吩噻嗪基或吩恶嗪基。
[0021]
进一步地,步骤(1)中邻苯二胺类化合物1和草酸化合物1’的摩尔比为1~2:1~3,优选为1:1~1.2;步骤(2)中1,4-二氢喹喔啉-2,3-二酮类化合物2、二氯亚砜,和n,n-二甲基甲酰胺的摩尔比为10~30:20~70:1,优选为20:50:1;步骤(3)中2,3-二氯喹喔啉类化合物3与化合物4的摩尔比为1~2:1~8,优选为1:4。
[0022]
本发明还提供上述基于喹喔啉骨架的有机光催化剂在可见光催化有机反应中的应用。
[0023]
进一步地,可见光催化有机反应包括但不限于有机光氧化还原催化与lewis酸(路易斯酸)协同催化的脱氢/(3+2)环加成反应、饱和氮杂环的有机光氧化还原催化
ɑ-c(sp3)-h磷酸化、有机光氧化还原催化饱和含氮杂环脱氢/[2+2]环加成反应、有机光氧化还原催化的饱和含氮杂环的芳基化反应。
[0024]
需要说明的是,本发明中若无特殊限定和具体说明的实验步骤,可采用本领域的常规步骤;本发明中若无特殊限定和具体说明的使用试剂,可采用本领域现有方法制备或直接购买市售产品。
[0025]
综上所述,本发明具有以下优点:
[0026]
本发明提供了一种基于喹喔啉骨架的有机光催化剂及其制备方法,在如有机光氧化还原催化与lewis酸(路易斯酸)协同催化的脱氢/(3+2)环加成反应等可见光催化有机反
应中表现出优异的光催化效率和立体选择性,具有广泛的实际应用价值。
具体实施方式
[0027]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明,即所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
[0028]
因此,以下对提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0029]
实施例1
[0030]
一种基于喹喔啉骨架的有机光催化剂的制备方法,合成化合物结构如下所示,其制备方法具体按照下列步骤进行:
[0031][0032]
(1)合成1,4-二氢喹喔啉-2,3-二酮2a
[0033]
向圆底烧瓶中加入邻苯二胺1(0.193mol)和草酸1’(0.215mol),再将4n的盐酸(200ml)溶液加入到圆底烧瓶中,然后加热搅拌回流,反应结束后,将反应体系冷却至室温,随后将反应体系倒入冰水中,待有沉淀析出后过滤得到固体,得到1,4-二氢喹喔啉-2,3-二酮2a(不用纯化,直接进行下一步反应)。
[0034]
(2)合成2,3-二氯喹喔啉3a
[0035]
在圆底烧瓶中,将1,4-二氢喹喔啉-2,3-二酮2a(0.012mol)用二氯甲烷溶解,然后加入二氯亚砜(0.031mol),再缓慢滴加dmf(0.00062mol),反应加热到回流6小时。反应结束后冷却到室温,加入少量的水后再用二氯甲烷萃取,最后有机相用饱和食盐水洗,有机相用无水硫酸钠干燥,之后将滤液真空旋干,通过快速柱层析纯化产物。最终得到2,3-二氯喹喔啉3a。
[0036]
(3)合成2,3-二(咔唑)喹喔啉5a
[0037]
在氮气氛围下,将亲核反应物咔唑(4.0当量),碳酸钾(4.1当量)溶解到7毫升dmso中,室温搅拌30分钟后加入2,3-二氯喹喔啉3a(1mmol),然后将反应体系加热到90℃,反应过夜。反应结束后,冷却到室温,加入饱和食盐水后,过滤,得到黄色固体,然后通过快速柱层析纯化产物。最终得到2,3-二(9氢-咔唑)喹喔啉5a(78%)。
[0038]
2,3-二(9氢-咔唑)喹喔啉5a的表征数据为:1h nmr(400mhz,cdcl3)δ8.28(dd,j=
6.4,3.4hz,1h),7.92(dd,j=6.4,3.4hz,1h),7.79(d,j=7.4hz,2h),7.35(d,j=8.1hz,2h),7.13
–
7.07(m,2h),7.06
–
6.99(m,2h).
13
c nmr(101mhz,cdcl3)δ141.91,140.52,138.74,130.67,128.60,125.84,124.34,121.28,119.85,110.32.
[0039]
实施例2
[0040]
在实施例1所得2,3-二氯喹喔啉3a的基础上,具体合成路线如下:
[0041][0042]
(1)合成2,3-二(3,6-二叔丁基咔唑)喹喔啉5b
[0043]
在氮气氛围下,将2,3-二(3,6-二叔丁基咔唑)(2.6当量),叔丁醇钠(2.7当量)溶解到7毫升dmf中,室温搅拌30分钟后加入2,3-二氯喹喔啉3a(1mmol),然后将反应体系加热到90℃,反应过夜。反应结束后,冷却到室温,向反应体系中加入饱和食盐水,乙酸乙酯萃取,有机相加入无水硫酸钠干燥,真空旋干,然后通过快速柱层析纯化产物。最终得到2,3-二(3,6-二叔丁基咔唑)喹喔啉5b(72%)。
[0044]
2,3-二(3,6-二叔丁基咔唑)喹喔啉5b的表征数据为:
[0045]1h nmr(400mhz,cdcl3)δ8.27(dd,j=6.4,3.4hz,2h),7.87(dd,j=6.4,3.4hz,2h),7.60(d,j=1.6hz,4h),7.08(d,j=8.6hz,4h),6.90(dd,j=8.6,1.9hz,4h),1.34(s,36h).13c nmr(101mhz,cdcl3)δ144.0,142.2,140.4137.0,130.1,128.5,124.3,123.2,115.3,109.6,34.5,31.8.
[0046]
在实施例1的基础上,将亲核反应物-咔唑调整为r
2-h,其中,r2为咔唑基、萘基、螺-芴基、菲基、蒽基、芘基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基、n,n-二苯基、n,n-二甲基、吗啉基、哌嗪基、吩噻嗪基或吩恶嗪基;均可相应顺利制得本发明所述的目标产物-有机光催化剂(目标产物的收率在65~87%之间)。需要说明的是,上述中若无特殊限定和具体说明的实验步骤,可采用本领域的常规步骤;上述中若无特殊限定和具体说明的使用试剂,可采用本领域现有方法制备或直接购买市售产品。
[0047]
在实施例1的基础上,将实施例1的步骤(1)中反应物-邻苯二胺1调整为其中,r1为卤素(f、cl、br、i)、c
1-10
烷基、c
3-10
环烷基。
[0048][0049]
(1)合成6,7-二氟-1,4-二氢喹喔啉-2,3-二酮2b
[0050]
向圆底烧瓶中加入4,5-二氟苯-1,2-二胺2(0.193mol)和草酸1’(0.215mol),再将4n的盐酸(200ml)溶液加入到圆底烧瓶中,然后加热搅拌回流,反应结束后,将反应体系冷却至室温,随后将反应体系倒入冰水中,待有沉淀析出后过滤得到固体,得到6,7-二氟-1,4-二氢喹喔啉-2,3-二酮2b(不用纯化,直接进行下一步反应)。
[0051]
(2)合成2,3-二氯-6,7-二氟喹喔啉3b
[0052]
在圆底烧瓶中,将6,7-二氟-1,4-二氢喹喔啉-2,3-二酮2b(0.012mol)用二氯甲烷溶解,然后加入二氯亚砜(0.031mol),再缓慢滴加dmf(0.00062mol),反应加热到回流6小时。反应结束后冷却到室温,加入少量的水后再用二氯甲烷萃取,最后有机相用饱和食盐水洗,有机相用无水硫酸钠干燥,之后将滤液真空旋干,通过快速柱层析纯化产物。最终得到2,3-二氯-6,7-二氟喹喔啉3b。
[0053]
实施例3
[0054]
(3)合成9,9'-(6,7-二氟喹喔啉-2,3-二基)双(9h-咔唑)6a
[0055]
在氮气氛围下,将亲核反应物-咔唑(4.0当量),碳酸钾(4.1当量)溶解到7毫升dmso中,室温搅拌30分钟后加入2,3-二氯-6,7-二氟喹喔啉3b(1mmol),然后将反应体系加热到90℃,反应过夜。反应结束后,冷却到室温,加入饱和食盐水后,过滤,得到黄色固体,然后通过快速柱层析纯化产物。最终得到9,9'-(6,7-二氟喹喔啉-2,3-二基)双(9h-咔唑)6a(82%)。
[0056]
9,9'-(6,7-二氟喹喔啉-2,3-二基)双(9h-咔唑)6a的表征数据为:
[0057]1h nmr(400mhz,cdcl3):δ8.01(t,j=9.1hz,2h),7.79(d,j=7.7hz,4h),7.31(d,j=8.2,4h),7.16
–
6.99(m,8h).
13
c nmr(101mhz,cdcl3):δ142.0,138.4,137.7,125.9,124.4,121.5,119.9,114.3(d,j
c-f
=7.1hz),114.2(d,j
c-f
=6.6hz),110.2.
19
f nmr(376mhz,cdcl3):δ-128.5.
[0058]
实施例4
[0059][0060]
(4)合成9,9'-(6,7-二氟喹喔啉-2,3-二基)双(3,6-二叔丁基-9h-咔唑)6b
[0061]
在氮气氛围下,将2,3-二(3,6-二叔丁基咔唑)(2.6当量),叔丁醇钠(2.7当量)溶解到7毫升dmf中,室温搅拌30分钟后加入2,3-二氯-6,7-二氟喹喔啉3b(1mmol),然后将反应体系加热到90℃,反应过夜。反应结束后,冷却到室温,向反应体系中加入饱和食盐水,乙酸乙酯萃取,有机相加入无水硫酸钠干燥,真空旋干,然后通过快速柱层析纯化产物,得到黄色固体9,9'-(6,7-二氟喹喔啉-2,3-二基)双(3,6-二叔丁基-9h-咔唑)6b。
[0062]
9,9'-(6,7-二氟喹喔啉-2,3-二基)双(3,6-二叔丁基-9h-咔唑)6b的表征数据为:
[0063]1h nmr(600mhz,cdcl3)δ7.99(t,j=9.1hz,1h),7.60(d,j=1.5hz,2h),7.05(d,j=8.5hz,2h),6.90(dd,j=8.5,1.5hz,2h),1.33(s,21h).
13
c nmr(151mhz,cdcl3)δ144.30,136.78,124.45,123.29,115.41,109.55,34.53,31.77.实验例
[0064]
下面结合具体的光氧化还原催化剂在有机合成中的应用进行说明。
[0065]
案例一:有机光氧化还原催化与lewis酸协同催化的脱氢/(3+2)环加成反应
[0066][0067]
反应条件:
[0068]
向干燥的10ml反应管中加入光催化剂(0.001mmol)、phb(oh)2(6.1mg,0.05mmol,0.5当量)、mg(otf)2(3.2mg,0.01mmol,0.1当量),ms(25mg),ch2cl2(0.5ml,0.2m),1a(16.1mg,0.1mmol,1.0equiv)和2a(36.5mg,0.22mmol,2.2当量)。反应混合物通过三次冷冻循环脱气。充分脱气后,将反应混合物置于光反应器中,用白光照射6小时。在光照过程中,反应混合物的温度通过冷却循环泵保持在25℃。反应结束后通过tlc检测。反应混合物通过硅胶快速柱色谱法(石油醚/乙酸乙酯)纯化,得到相应的产物。使用5b(实施例2所得)、6b实施例4所得)作为光催化剂的催化效果明显高于传统金属光催化剂和有机染料。
[0069]
在上述案例一的基础上,将5b替换为实施例3-6所得的有机光催化剂,上述反应均可顺利进行,收率为60~78%之间,d.r.》20:1。需要说明的是,上述中若无特殊限定和具体说明的实验步骤,可采用本领域的常规步骤;上述中若无特殊限定和具体说明的使用试剂,可采用本领域现有方法制备或直接购买市售产品。
[0070]
案例二:饱和氮杂环的有机光氧化还原催化
ɑ-c(sp3)-h磷酸化
[0071][0072]
反应条件:
[0073]
向干燥的10ml反应管中加入光催化剂(0.001mmol)、tsoh.h2o(0.01mmol,1.9mg)、pfnb(0.05mmol,6.5μl),1a(0.13mmol,1.3当量)和2a(0.1mmol,1.0当量),1.0ml chcl3。反应混合物通过三次冷冻循环脱气。充分脱气后,将反应混合物置于光反应器中,用白光照射24小时。在光照过程中,反应混合物的温度通过冷却循环泵保持在25℃。反应结束后通过tlc检测。反应混合物通过硅胶快速柱色谱法(石油醚/乙酸乙酯)纯化,得到相应的产物。使用5a(实施例1所得)作为光催化剂的催化效果明显高于传统金属光催化剂和有机染料。
[0074]
在上述案例二的基础上,将5a替换为实施例2-6所得的有机光催化剂,上述反应均可顺利进行,收率为86~98%。需要说明的是,上述中若无特殊限定和具体说明的实验步骤,可采用本领域的常规步骤;上述中若无特殊限定和具体说明的使用试剂,可采用本领域现有方法制备或直接购买市售产品。
[0075]
以上内容仅仅是对本发明所作的举例和说明,所属本领域的技术人员不经创造性劳动即对所描述的具体实施例做的修改或补充或采用类似的方式替代仍属本专利的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1