植物乳杆菌O2
nigrum)、金黄色葡萄球菌(staphylococcusaureus)、大肠杆菌(escherichia coli)、沙门氏菌(salmonella)、志贺氏菌(shigella)、阪崎肠杆菌(enterobacter sakazakii)、单核细胞增生李斯特氏菌(listeria monocytogenes),均为现有常规菌株,由湖南农业大学提供。
12.培养基:下面实施例用到的培养基未作特殊说明则为常规培养基。mrs肉汤培养基、na培养基、马铃薯葡萄糖培养基(pdb)、脑心浸液肉汤(bhi)培养基加入18g琼脂粉即配制为相对应的固体培养基。
13.实施例1 本菌株o2的分离筛选及鉴定
14.初步分离:
15.采用稀释涂布平板法采集10g衡阳市盐浸辣椒样品至50ml无菌0.85%(w/v)nacl,旋涡混匀,依次进行10-1-10-4
浓度梯度的稀释。各梯度取100μl涂布在含2%caco3(w/v)的mrs固体培养基,37℃培养48h-72h。挑取具有明显溶钙圈的菌落,多次划线纯化直至菌落形态单一、镜检无杂菌,将革兰氏染色阳性、过氧化氢酶阴性的乳酸菌株,4℃斜面保藏备用。
16.筛选:
17.挑取备用的保藏菌株单菌落mrs肉汤培养基活化两次,以3%添加量转接至mrs肉汤培养基,37℃静置培养72h得乳酸菌发酵液,4℃备用。取4℃保存的辣椒疫霉菌平皿,用直径10mm打孔器制备疫霉菌菌饼,接种于pda培养基上,28℃黑暗条件下培养5d后备用。采用平板对峙法,倒入25ml马铃薯琼脂培养基于培养皿中,等待凝固后在培养皿中接入4mm的辣椒疫霉菌菌饼,在间隔菌饼25mm处用打孔器在培养皿中打出两个直径为6mm对称的孔,封底后在各孔中加入100μl乳酸菌发酵液,4℃静置4h后转移至28℃培养72h,同时以加入100μl无菌水作为对照。经筛选得到一株抑菌效果最佳的菌株乳酸菌o2,-80℃甘油冻存管保藏菌株备用。
18.鉴定:
19.该菌株o2在2%caco3(w/v)mrs固体培养基呈乳白色菌落,周边具有典型溶钙圈,菌落呈圆形、边缘整齐、表面光滑且湿润、中央隆起、不透明;在光学显微镜下观察,菌体革兰氏染色呈阳性、短杆状,无芽孢、无荚膜、无鞭毛。
20.经生理生化试验,菌株o2碳水化合物反应皆为阳性,触酶试验、葡萄糖产气试验、硝酸盐还原试验、vp试验、h2s试验、明胶液化试验、吲哚试验皆为阴性,在ph 4.5、ph 6.5、4-8%nacl、37℃环境下生长良好,45℃生长停滞。
21.该菌株o2的16s rdna序列比对鉴定结果表明,该菌株o2与植物乳杆菌同源性为98%,结合形态学特征和生理生化试验结果,鉴定该菌株o2为植物乳杆菌(lactobacillus plantarum),命名为植物乳杆菌(lactobacillus plantarum)o2,于2022年2月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为cgmcc no.24430。
22.实施例2 本发明菌株o2发酵上清液抑制辣椒疫霉菌试验
23.本发明菌株o2发酵上清液制备:取备用菌株o2,经mrs肉汤活化两次后,以3%添加量添加菌株至mrs肉汤,37℃静置培养72h,8000r/min离心10min,上清液经0.22μm滤膜过滤除菌,4℃保存。
24.试验方法:采用固体稀释法,待pda培养基冷却至55℃左右,以o2发酵上清液为试验组、无菌水为对照,按照1:9(v:v)的比例(试液为1,pda培养基为9)将试液与培养基混合均匀,每平皿注入约20ml混合液。培养基凝固后,中央加入一块4mm辣椒疫霉菌菌饼,28℃正
置培养7d,采用十字交叉法测量菌落生成直径,计算菌落生长抑制率,重复三次。菌落生长抑制率(%)=((对照组菌落直径-试验组菌落直径)/对照组菌落直径)
×
100%。
25.结合参见图1,加入o2发酵上清液的试验组培养基中辣椒疫霉菌菌落直径为10.13
±
0.52mm,无菌水对照组的辣椒疫霉菌落直径为79.01
±
0.13mm,发酵上清液的对疫霉菌的生长抑制率为87.18%,表明菌株o2发酵上清液对辣椒疫霉菌具有明显的抑菌活性。
26.实施例3 本发明菌株发酵上清液对辣椒疫霉菌最小抑菌浓度(mic)和最小杀菌浓度(mbc)测定
27.本发明菌株o2发酵上清液冻干制备:取本发明菌株o2,以3%添加量添加至mrs肉汤,37℃静置培养72h,8000r/min离心10min,上清液经0.22μm滤膜过滤除菌后取10ml分装于50ml离心管,-80℃预冷12h,冷冻干燥48h后得到褐色蜂窝状冻干粉0.4946g,冻干转化率为49.46mg/ml,置于-80℃保藏备用。
28.称取适量上述菌株o2发酵上清液冻干粉溶解于pdb培养基中,采用二倍稀释法分别配制成256.0、128.0、64.0、32.0、16.0、8.0、4.0、2.0、1.0mg/ml九个浓度梯度,以无菌水为对照,使用0.22μm滤膜过膜除菌,4℃保存备用。按照实施例2的方法进行处理,使发酵上清液终浓度分别为25.6、12.8、6.4、3.2、1.6、0.8、0.4、0.2、0.1、0mg/ml,以无疫霉菌生长的最低发酵上清液浓度为最小抑菌浓度。在最小抑菌浓度试验的基础上,继续培养7d,以在14d内无辣椒疫霉菌生长的最低发酵上清液浓度为最小杀菌浓度。
29.结果如表1和图2所示,从浓度为0.8mg/ml开始,o2发酵上清液对疫霉菌的生长出现显著抑制作用(p《0.05),菌落生长抑制率达到7.87%。随着pda培养基中植物乳杆菌o2发酵上清液含量的上升,疫霉菌的菌落生成直径逐渐减小,其对疫霉菌的生长抑制率逐渐上升。当o2发酵上清液浓度达到12.8mg/ml后,菌落生长抑制率达到100%,7d内未见菌丝生长,故确定12.8mg/ml为菌株o2发酵上清液对辣椒疫霉菌的mic。由表2可知,28℃培养14d时,浓度为12.8mg/ml的o2发酵上清液对疫霉菌的生长抑制率为91.30%,具有较好的抑菌效果,但要使疫霉菌生长抑制率达到100%,需进一步提高o2发酵上清液浓度至25.6mg/ml,故25.6mg/ml为菌株o2发酵上清液对辣椒疫霉菌的mbc。
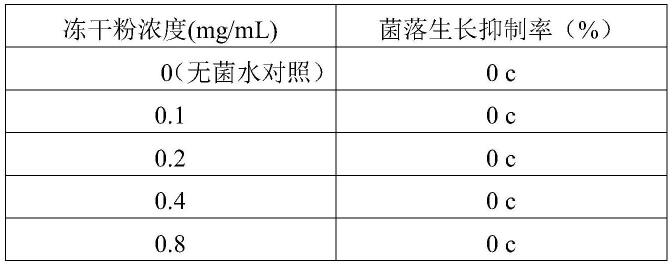
30.表1 植物乳杆菌o2发酵上清液对辣椒疫霉菌的最小抑菌浓度(mic)
31.冻干粉浓度(mg/ml)菌落生长抑制率(%)0(无菌水对照)0f0.10.51
±
1.21f0.20.44
±
2.16f0.41.30
±
1.78f0.87.87
±
1.46e1.610.56
±
1.31d3.217.58
±
1.49c6.427.83
±
3.57b12.8100.00a25.6100.00a
32.表2 植物乳杆菌o2发酵上清液对辣椒疫霉菌的最小杀菌浓度(mbc)
[0033][0034][0035]
实施例4 本发明菌株o2发酵上清液抑菌谱测定
[0036]
1.对4种辣椒采后致病菌(辣椒疫霉菌、辣椒红色炭疽菌、辣椒黑色炭疽菌以及辣椒根霉菌)的抑菌试验
[0037]
试验以实施例2制备的乳酸菌o2发酵上清液为试验组、无菌mrs肉汤为对照、5μg/ml多菌灵为阳性对照,无菌水为空白对照,按照实施例2的方法进行抑菌检测。
[0038]
本试验用以上四种致病菌为指示菌进行抑菌试验,结果由表3可知,o2菌株发酵上清液对4种指示菌的菌落生长抑制率分别为87.18%、31.43%、0.00%和0.00%。其中,o2发酵上清液对辣椒疫霉菌的生长抑制率最佳,差异显著(p<0.05);o2发酵上清液对辣椒红色炭疽菌的生长抑制率可达到阳性对照组抑菌效果,差异不显著(p》0.05);o2发酵上清液对于辣椒黑色炭疽菌和辣椒根霉菌无抑制效果。
[0039]
表3 本发明o2菌株发酵上清液对4种辣椒致病菌抑菌谱测定
[0040][0041]
注:不同小写字母表示同行指标数据后呈显著性差异(p《0.05),下同。
[0042]
2.常见食源性致病菌抑菌试验
[0043]
食源性致病菌抑菌试验采用牛津杯法,每平皿注入约20ml与致病菌相对应的固体培养基(金黄色葡萄球菌、大肠杆菌、沙门氏菌使用na培养基;志贺氏菌、阪崎肠杆菌、单核细胞增生李斯特氏菌使用bhi固体培养基),调整致病菌浓度至1
×
108个/ml,每平皿涂布100μl菌悬液,静置5min后,将无菌牛津杯置于固体培养基表面,添加100μl实施例2制备的o2菌株发酵液至牛津杯,同时以无菌mrs肉汤作为对照,以100μg/ml氨苄青霉素钠作为阳性对照,4℃静置4h后,37℃静置16h,测量抑菌圈直径,每个处理重复三次。
[0044]
结果参见表4,由表4可知,本发明的o2菌株发酵上清液对6种指示菌的抑菌直径分别为11.06
±
1.33mm、10.06
±
0.58mm、13.56
±
0.84mm、14.38
±
0.82mm、18.40
±
0.54mm、13.20
±
0.23mm。与对照组相比,试验组对六种食源性致病菌的抑菌试验结果均具有显著差异(p<0.05)。与阳性对照组相比较,在沙门氏菌和志贺氏菌抑菌试验中,试验组抑菌效果优于阳性对照组,差异显著(p<0.05);在大肠杆菌和阪崎肠杆菌抑菌试验中,试验组抑菌效果与阳性对照组差异不显著(p》0.05)。表明本发明o2菌株发酵上清液的抑菌物质对大肠杆菌、沙门氏菌、志贺氏菌和阪崎肠杆菌这四种食源性致病菌具有良好的抑制效果。
[0045]
表4 o2菌株发酵上清液食源性致病菌抑菌谱测定
[0046][0047]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1