一种抗性基因SpCIPK25、蛋白、表达载体和应用
一种抗性基因spcipk25、蛋白、表达载体和应用
技术领域
1.本发明属于植物基因工程技术领域,具体涉及一种抗性基因spcipk25、蛋白、表达载体和应用。
背景技术:
2.紫花针茅(stipapurpurea griseb.)是禾本科(gramineae)针茅属(stipa l.)的多年生旱生草本植物。是青藏高原、帕米尔高原和中亚高山地区的特有植物,具有耐寒、耐旱、耐践踏和抗风沙等特性,在我国主要分布在海拔1900~5150m的西藏、青海、甘肃、新疆和四川等地,是高寒草原特有的优势种、建群种,对高原环境的干旱、低温、强紫外线及贫瘠土壤等胁迫条件具有极强的适应性,在高寒草地中分布面积极广。
3.cipks(cbl-interactingproteinkinase)是在cbl-cipk复合体中具有信号转导功能的丝氨酸/苏氨酸蛋白激酶,参与植物在胁迫响应中的第二信使之一的ca
2+
信号转导,为植物所特有的一类蛋白激酶,其c端的naf/fisl结构域能与cbl相互作用使底物与激酶结构域结合。植物受到非生物胁迫后,体内ca
2+
浓度发生改变形成ca
2+
信号,cbl是ca
2+
信号接收的直接受体,cbl蛋白本身无功能,当其接受到ca
2+
信号,蛋白构象发生变化进而与cipk特异性结合形成cbl-cipk复合体,调控下游基因,响应逆境胁迫。此前cipk25基因的相关研究很少,对紫花针茅spcipk25基因的研究尚未见报道。
技术实现要素:
4.本发明的目的在于提供一种抗性基因spcipk25、蛋白、表达载体和应用,本发明提供的spcipk25基因可以提高植物的抗旱性和耐盐性。
5.为了实现上述目的,本发明提供了一种抗性基因spcipk25,所述抗性基因spcipk25的核苷酸序列如seq id no.1所示。
6.本发明提供了所述的抗性基因spcipk25编码的spcipk25蛋白质,所述spcipk25蛋白质的氨基酸序列如seq id no.2所示。
7.本发明还提供了一种表达载体,包括初始载体和上述技术方案所述的抗性基因spcipk25。
8.优选的,所述初始载体包括pri101-gfp。
9.本发明还提供了所述抗性基因spcipk25、spcipk25蛋白质或上述技术方案所述的表达载体在提高植物抗旱性和/或耐盐性中的应用。
10.优选的,所述植物包括紫花针茅。
11.本发明还提供了一种抗旱性和/或耐盐性植物的培育方法,包括如下步骤:
12.将上述技术方案所述抗性基因spcipk25连接到pri101-gfp,得到35s:spcipk25-gfp表达载体;
13.将所述35s:spcipk25-gfp表达载体转入到农杆菌中,得到工程菌;
14.将所述工程菌转入到植物中,得到抗旱性和/或耐盐性植物。
15.优选的,将所述抗性基因spcipk25连接到pri101-gfp的sali和ecori酶切位点之间。
16.优选的,所述spcipk25阳性克隆质粒的构建方法包括:
17.通过克隆得到,克隆所用的引物对包括seq id no.3所示的上游引物,和seq id no.4所示的下游引物。
18.优选的,所述农杆菌包括农杆菌gv3101。
19.有益效果:
20.本发明提供了一种抗性基因spcipk25,所述抗性基因spcipk25的核苷酸序列如seq id no.1所示,所述抗性基因spcipk25具有提高植物抗旱性和耐盐性的作用。实施例结果表明,spcipk25转基因植物株系在甘露醇的胁迫下,较野生株系的根更长;在干旱胁迫下,spcipk25转基因植物株系较野生株系的根系更长,且具有更高的叶片含水量,spcipk25转基因植株叶片具有更好的抗过氧化能力和膜系统修复能力,进而降低胁迫环境造成的损伤,使植株有更强的抗旱能力,为植物抗逆基因库增加了基因资源,对于提高植物的抗逆性研究具有重要意义,也为提高植物抗性的分子育种研究提供有价值的依据。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
22.图1为实施例1中spcipk25转基因植株的pcr鉴定结果图;
23.图2为实施例1中spcipk25转基因植株的western blot鉴定结果图;
24.图3为实施例1中不同浓度nacl胁迫下spcipk25转基因拟南芥株系和wt野生型拟南芥株系的根系生长对比图;
25.图4为实施例1中不同浓度nacl胁迫下spcipk25转基因拟南芥株系和wt野生型拟南芥株系的根长数据图;
26.图5为实施例2中不同浓度甘露醇胁迫下spcipk25转基因拟南芥株系和wt野生型拟南芥株系的根系生长对比图;
27.图6为实施例2中不同浓度甘露醇胁迫下spcipk25转基因拟南芥株系和wt野生型拟南芥株系的根长数据图;
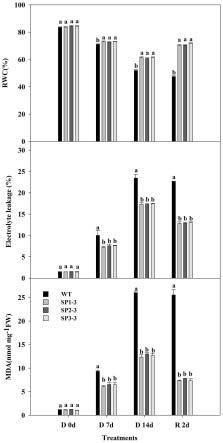
28.图7为实施例3中干旱胁迫下spcipk25转基因拟南芥株系和wt野生型拟南芥株系的丙二醛、叶片相对含水量和离子渗漏率对比图;
29.图8为实施例4中干旱胁迫下spcipk25转基因拟南芥株系和wt野生型拟南芥株系的生长情况对比图;a为干旱处理下各试验组拟南芥的叶片表型;b用fv/fm图像表示干旱处理下spcipk25转基因拟南芥和野生型拟南芥的光合能力。b图中的下标数字对应的不同颜色表示fv/fm的范围从0(黑色)到1.0(紫色)。
30.图9为实施例4中干旱胁迫下spcipk25转基因拟南芥株系和wt野生型拟南芥株系的fv/fm数据图;
31.图10为实施例4中干旱胁迫下spcipk25转基因拟南芥株系和wt野生型拟南芥株系的存活率数据图。
具体实施方式
32.本发明提供了一种抗性基因spcipk25,所述抗性基因spcipk25的核苷酸序列如seq id no.1所示,具体如下所示:
[0033]5’‑
atgggggacaggccaaaactcccggggcagtacgtgcagggcaagctgctcggcgagggtaacttcgccaaggtgtaccacgcgcgccgcgcggacacgggggaggaagtggccatcaaggtcatggacaaggacaagctgatcaagctcggggcggtgcaccagatcaagcgcgagatcgccgtcatgcgccgcctgcgccacccaaacatcgtgcagctccacgaggtgatggcgtccaagtcgcggatcttcgtcgtcatggagtacgtccgcggcggcaccctctaccgtcacatccccgccagcggcggctccaaggaggacgacgcgcgccgcttcttccagcagctggtgtccgcgctctccttctgccacgcgcaaggggtgtaccaccgcgatatcaagcccgacaacctcctcgtcgacgagcacggcaacctcaaggtcgccgacttcggcctctccgccgtcgctgacacggcacgccgggaggcgctcctccacaccgtctgcggcacgccgctgtacgtccctcccgaggtcttcgcgcgccggggatacgacggcgccaaggcggacgcctggtcctgcggcatcgtcctcttcgtgctcgccgccggccgcaagcccttccgcgacgacgacttcatgaacctgtaccgcatgatctgccgcggcgactaccgttgcccgcgctggttcagccccgacctcgtccgcatggtgcgccgcctcctccagccaaacccggcgcaccggatcaccctgccgcaggtcatggagacaagctggttcaggaagggcttcaaggaggtcagcttctacatcgacaacaaggactgcctgcgcagcctcgatgggcccgaagagcctgacctgtacgactccgacgccgaggccgacaccgactcgaccgcgtcctcgtcgtcgggatcttcctcccctgtggtgggcacggcccatggcgacggtggcatgcacacctcgctgtcagcgccgtcgctggtcgagctcgagaagatgggcagtgccgccgcccagccacgcatgcggcggatcaagagcctgaacgcgttcgacatcatcgcctcctcgccgagcttcgacctgtccgggctgttcgaggagcgcggagagcagatgcgattcgtctccggcgcgccggtgcccaagatcatctccaagctggaggagatcgccgggcaggtcagcttcacgacgcgcaccaaggagtgccaggtgagcttcgaggcgacgaggaatgggcacaagggcgcgctcgccatctccgccaagatattccagctcacgccgcagctcgtcatggtccaggtgtgcaagaaggccggagacaccgccgagtaccggcagttctgccacaacgagctcaagcccggcctgcgtggcctcgtggatggcctgccggaggagggcctgcctccggcgttgaatgttgggtga-3’。本发明所述抗性基因spcipk25为以紫花针茅的叶片rna为模板,通过转录组测序和克隆得到的紫花针茅抗旱相关基因cipk25,依据拟南芥中的同源基因而命名为spcipk25。
[0034]
本发明提供了所述的抗性基因spcipk25编码的spcipk25蛋白质,所述spcipk25蛋白质的氨基酸序列如seq id no.2所示,具体如下所示:mgdrpklpgqyvqgkllgegnfakvyharradtgeevaikvmdkdkliklgavhqikreiavmrrlrhpnivqlhevmasksrifvvmeyvrggtlyrhipasggskeddarrffqqlvsalsfchaqgvyhrdikpdnllvdehgnlkvadfglsavadtarreallhtvcgtplyvppevfarrgydgakadawscgivlfvlaagrkpfrdddfmnlyrmicrgdyrcprwfspdlvrmvrrllqpnpahritlpqvmetswfrkgfkevsfyidnkdclrsldgpeepdlydsdaeadtdstassssgssspvvgtahgdggmhtslsapslvelekmgsaaaqprmrrikslnafdiiasspsfdlsglfeergeqmrfvsgapvpkiiskleeiagqvsfttrtkecqvsfeatrnghkgalaisakifqltpqlvmvqvckkagdtaeyrqfchnelkpglrglvdglpeeglppalnvg*。
[0035]
本发明还提供了一种表达载体,包括初始载体和上述技术方案所述的spcipk25基因。本发明所述的初始载体优选包括pri101-gfp。
[0036]
本发明还提供了抗性基因spcipk25、spcipk25蛋白质或上述技术方案所述的表达载体在提高植物抗旱性和/或耐盐性中的应用。本发明所述植物优选包括紫花针茅。本发明所述的抗性基因spcipk25参与紫花针茅干旱胁迫和/或盐胁迫响应,干旱胁迫和/或盐胁迫
可诱导抗性基因spcipk25的上调表达,且过表达抗性基因spcipk25可以提高植物的抗旱性和或耐盐性。
[0037]
本发明提供了一种抗旱性和/或耐盐性植物的培育方法,包括如下步骤:
[0038]
将上述技术方案所述抗性基因spcipk25连接到pri101-gfp,得到35s:spcipk25-gfp表达载体;
[0039]
将所述35s:spcipk25-gfp表达载体转入到农杆菌中,得到工程菌;
[0040]
将所述工程菌转入到植物中,得到抗旱性和/或耐盐性植物。
[0041]
本发明将所述抗性基因spcipk25连接到pri101-gfp前,优选还包括制备抗性基因spcipk25阳性克隆质粒。
[0042]
本发明所述抗性基因spcipk25阳性克隆质粒的制备方法优选通过克隆得到,具体为:以扩增引物对植物cdna进行pcr扩增,得到扩增产物;
[0043]
将所述扩增产物与pmd18-t载体(pmdtm18-t vector cloning kit,takara)连接,转入大肠杆菌,得到spcipk25阳性克隆质粒。
[0044]
本发明在进行所述pcr扩增前,优选还包括提取植物总rna,反转录,得到植物cdna。本发明对所述提取没有特殊限定,本领域常规提取方式即可。
[0045]
本发明对提取植物总rna以及总rna反转录的方法均没有特殊限定,采用本领域常规rna提取和rna反转录的方法即可。
[0046]
得到所述植物cdna后,本发明优选以扩增引物对所述植物cdna进行pcr扩增,得到扩增产物;本发明所述扩增引物优选包括上游引物spcipk25-f1和下游引物spcipk25-r1;所述spcipk25-f1的序列优选如seq id no.3所示,具体为5
’‑
atgggggacaggccaaaactc-3’;所述spcipk25-r1的序列优选如seq id no.4所示,具体为5
’‑
tcacccaacattcaacgccgg-3’。本发明对获得所述扩增引物的方式没有特殊限定,采用本发明常规设计软件均可,如本发明采用的是ncbi primer designing tool设计引物。本发明所述pcr扩增的体系以50μl计,优选包括:选用高保真的2
×
taq pcr mastermix 25μl,ddh2o 23μl,10μmol/l的上游引物0.5μl,10μmol/l的下游引物0.5μl,cdna模板1.0μl。本发明所述pcr扩增的程序优选为94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸1.5min,30个循环;72℃再延伸5min;4℃保存。本发明在进行所述pcr扩增后,优选还包括对扩增得到的片段进行测序和胶回收纯化,本发明对所述测序和胶回收纯化的方式没有特殊限定,采用本领域常规测序方式和胶回收方式即可,如本发明实施例中采用omega公司的gel extraction kit试剂盒进行胶回收的。本发明对所述目的片段与pmdtm18-t载体连接的方式没有特殊限定,采用本领域常规连接方式即可,如采用t4连接酶。本发明所述大肠杆菌优选包括大肠杆菌escherichia coli(e.coli)dh5α。本发明对转入大肠杆菌的方式没有特殊限定,本领域常规转化方式即可。
[0047]
本发明在得到所述抗性基因spcipk25阳性克隆质粒前,优选还包括对质粒进行抗性培养基筛选、菌落pcr和测序鉴定。本发明所述抗性培养基优选为添加了卡那霉素的1/2ms培养基,所述1/2ms培养基中卡那霉素的添加浓度优选为30~50mg/l。本发明对所述菌落pcr和测序鉴定的方式没有特殊限定,本领域常规菌落pcr和测序鉴定方式即可。
[0048]
得到所述抗性基因spcipk25阳性克隆质粒后,本发明将所述抗性基因spcipk25阳性克隆质粒连接到pri101-gfp,得到35s:spcipk25-gfp表达载体。本发明优选将所述抗性
基因spcipk25连接到pri101-gfp的sali和ecori酶切位点之间。本发明优选以sali和ecori双酶切spcipk25阳性克隆质粒,得到酶切后抗性基因spcipk25;将所述酶切后抗性基因spcipk25与经过sali和ecori双酶切后的pri101-gfp连接,得到35s:spcipk25-gfp表达载体。本发明将所述酶切后抗性基因spcipk25与经过sali和ecori双酶切后的pri101-gfp连接后,优选还包括将连接后的重组子转入到大肠杆菌e.coli dh5α中进行阳性重组子的鉴定。本发明对所述鉴定方式没有特殊限定,本领域常规鉴定方式即可。
[0049]
得到所述35s:spcipk25-gfp表达载体后,本发明将所述35s:spcipk25-gfp表达载体转入到农杆菌中,得到工程菌。本发明所述农杆菌优选包括农杆菌(agrobacterium tumefaciens)gv3101。本发明对所述转入农杆菌的方式没有特殊限定,本领域常规转入方式即可。
[0050]
得到所述工程菌后,本发明将所述工程菌转入到植物中,得到抗旱性和/或耐盐性植物。本发明所述植物优选包括拟南芥,更优选为哥伦比亚型拟南芥。本发明将所述工程菌转入到植物中前,优选还包括挑取阳性克隆和摇菌活化,本发明对所述挑取阳性克隆和摇菌活化的方式没有特殊限定,采用本领域常规方式即可。本发明所述转入方式优选包括浸花法。经过本发明培育方法得到植物,在干旱或盐胁迫下,较野生型植物的抗旱性和耐盐性更强。
[0051]
为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
[0052]
实施例1
[0053]
载体构建:以紫花针茅的叶片为材料,trizol法(invitrogen,carlsbad,ca,usa)提取总rna,并使用试剂盒(goscript
tm
reverse transcription system,promega公司)反转成cdna,以上述cdna为模板,用引物对spcipk25-f1和spcipk25-r1进行pcr扩增(2
×
vazyme lamp mastermix dye plus,vazyme/诺唯赞),紫花针茅spcipk25基因pcr扩增的体系为50μl体系,包括2
×
vazyme lamp mastermix 25.0μl,ddh2o 23μl,上游引物0.5μl,下游引物0.5μl,cdna模板1.0μl。pcr扩增反应程序优选为:94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸1.5min,30个循环;72℃5min;4℃保存。进行琼脂糖凝胶电泳后,切胶回收目的条带(gel extractionkit,omega公司),与pmd18-t载体(pmd18-tvector cloning kit,takara公司)连接,转入大肠杆菌e.coli dh5α感受态细胞。在目的片段两端添加sali和ecori酶酶切位点,然后与已用sali和ecori(new england biolabs公司)酶切的pri101-gfp质粒重组(clonexpress ii one step cloning kit,vazyme/诺唯赞),并转化e.coli dh5α感受态细胞,在抗性平板上挑取阳性重组子,提取质粒,进行spcipk25序列测序,测序正确后,载体35s:spcipk25-gfp构建完成。
[0054]
spcipk25转基因植株的获得:挑选培养健康无病虫害的哥伦比亚型拟南芥进行花序侵染。重组载体35s:spcipk25-gfp转入农杆菌a.tumefaciens gv3101后,将pcr检测的阳性克隆,pcr检测采用的引物对为spcipk25-f1和spcipk25-r1,摇菌至od600为0.6~0.8时,进行拟南芥花器官浸泡转化。具体过程如下:1)将菌液4000rpm,离心3~5min,收集沉淀,再用配好的侵染液(5%蔗糖溶液+0.4%ms)悬浮;2)在浸染拟南芥前,加入silwetl-77,使用浓度为0.03%(300μl/l);3)将拟南芥的花序部分在侵染液中轻轻摇动浸泡15到20s;4)将浸泡过的拟南芥横放在托盘里,用塑料膜覆盖保湿,避光24h后正常培养;5)每间隔7d~10d
后再侵染2~3次,当种子成熟时停止浇水,收获种子后用卡那霉素(筛选培养基:1/2ms+10g/l蔗糖+卡那霉素50mg/l)筛选及pcr鉴定和westernblot鉴定t1代种子,土培筛选获得的阳性植株,成熟后收取t2种子继续同样的方法进行筛选鉴定,直至获得纯合t3代株系。其中pcr鉴定的具体方法为:取样,提取dna,用spcipk25-f1和spcipk25-r1引物来进行pcr,具体体系为2
×
taqmix 10μl,ddh2o 8μl,上游引物(spcipk25-f1)0.5μl,下游引物(spcipk25-r1)0.5μl,cdna模板1.0μl。pcr扩增反应程序为:94℃预变性1min30s;94℃变性20s,55℃退火20s,72℃延伸1.5min,35个循环;72℃5min;4℃保存。t1代种子鉴定结果如图1所示;western blot鉴定的具体方法参照qian chen,et al.functionalfrigida allele enhances drought tolerance by regulating the p5cs1 pathway inarabidopsis thaliana.biochemical and biophysical research communications,2018,495(1),1102
–
1107中进行,t1代种子鉴定结果如图2所示;
[0055]
将3个t3代纯合转抗性基因spcipk25拟南芥株系(分别为sp1-1,sp2-1,sp3-1)和野生型哥伦比亚拟南芥(wt)各55粒种子分别放在含有0mmol/l和125mmol/lnacl的1/2ms培养基上萌发,10天后统计分析根长,结果如表1和图3~4所示。
[0056]
表1 nacl胁迫下转抗性基因spcipk25拟南芥株系和wt野生型拟南芥株系的根长(cm)
[0057]
nacl含量wtsp1-1sp2-1sp3-10mm4.50
±
0.05a4.39
±
0.08a4.31
±
0.06a4.35
±
0.07a125mm1.48
±
0.04b1.89
±
0.08a1.92
±
0.08a1.94
±
0.04a
[0058]
注:表中的数值为平均值
±
标准误差;同行数据后不同字母表示差异显著(p《0.05)。下同。
[0059]
结果表明,在125mm nacl的1/2ms培养基上生长10天的转抗性基因spcipk25拟南芥株系的根长与野生型拟南芥相比有显著差异,sp1-1,sp2-1,sp3-1的根长分别比wt长约27.41%,29.25%和30.67%,而在没有nacl处理的正常1/2ms培养基上的根长没有显著差异。
[0060]
实施例2
[0061]
采用实施例1中相同的方法,区别在于在得到纯合t3代株系后,将3个t3代纯合转抗性基因spcipk25拟南芥株系(分别为sp1-2,sp2-2,sp3-2)和野生型哥伦比亚拟南芥(wt)各55粒种子分别放在含有0mmol/l和100mmol/l甘露醇的1/2ms培养基上萌发,10天后统计分析根长,结果如表2和图5~6所示。
[0062]
表2转抗性基因spcipk25拟南芥株系和wt野生型拟南芥株系的根长(cm)
[0063]
甘露醇含量wtsp1-2sp2-2sp3-20mm4.50
±
0.05a4.39
±
0.08a4.31
±
0.06a4.35
±
0.07a100mm2.26
±
0.10b3.08
±
0.09a3.22
±
0.07a3.28
±
0.06a
[0064]
结果表明,在没有甘露醇处理的正常1/2ms培养基上的根长没有显著差异,而在100mmol/l甘露醇的1/2ms培养基上生长10天的转spcipk25基因拟南芥株系的根长与野生型拟南芥相比有显著差异,sp1-2,sp2-2,sp3-2的根长分别比wt长约36.40%,42.57%和45.27%。
[0065]
实施例3
[0066]
采用与实施例1相同的方法,区别在于在得到纯合t3代株系后,将3个t3代纯合转抗性基因spcipk25拟南芥株系(分别命名为sp1-3,sp2-3,sp3-3)和野生型哥伦比亚拟南芥(wt)种子在暗培养室中培养发芽,待7天后移栽至土培容器(10cm
×
10cm
×
8cm)中(sp1-3,sp2-3,sp3-3和wt移栽至一个土培容器中)。之后选择强健、长势较一致的3周龄幼苗用于试验和处理。所有植物均在24℃(相对湿度为75~80%,光强为200μmol m-2
s-1
),光周期为16h/8h的环境中培养。之后模拟干旱条件给拟南芥幼苗停止浇水14天,分别于停止浇水7(d7d)和14天(d14d),和恢复浇水2天(r2d)取样,以未停止浇水时的样本为对照组(d0d)分别测定各项生理指标,具体测定的指标和测定方法如下:
[0067]
1)干旱胁迫会对植物细胞造成过氧化伤害。而丙二醛(mda)是细胞膜脂过氧化的一个产物,通常细胞内的mda含量能直接反映出过氧化产生的活性氧类物质对植物细胞的伤害程度。
[0068]
mda(丙二醛)测定:将约0.5g新鲜叶片在10ml的10%三氯乙酸(tca)中研磨,12000g离心10min后,吸取2ml上清液,加入2ml的0.6%硫代巴比妥酸(tba)。将混合物在沸水中加热30min,然后在冰浴中快速冷却。10000g离心10min后,测定上清液在450nm、532nm和600nm处的吸光度。计算公式:
[0069][0070]
v1为反应液总体积(ml);v2为反应液中的提取液体积(ml);v为提取液总体积(ml);w为植物样品鲜重(g),结果如图7和表3所示:
[0071]
表3干旱处理下转抗性基因spcipk25拟南芥株系和wt野生型拟南芥株系叶片的mda含量
[0072][0073]
结果表明:
[0074]
在未干旱处理前,各实验组间的mda含量没有显著差异。经过干旱处理后,各实验组的mda含量都呈现出逐步上升的趋势。干旱处理7天时,wt比正常培养时上升了约7.19倍,转基因株系sp1上升了约4.56倍,转基因株系sp2上升了约4.68倍,转基因株系sp3上升了约5.27倍,sp1-3、sp2-3、sp3-3与wt之间差异极显著(p《0.01);干旱处理14天时,wt比正常培养时上升了约21.86倍,转基因株系sp1上升了约10.21倍,转基因株系sp2上升了约10.31倍,转基因株系sp3上升了约11.32倍,sp1-3、sp2-3、sp3-3与wt之间差异极显著(p《0.01);复水2天后,野生型比正常培养时上升了约21.46倍,转基因株系sp1上升了约5.64倍,转基
因株系sp2上升了约5.71倍,转基因株系sp3上升了约6.2倍,sp1-3、sp2-3、sp3-3与wt之间差异极显著(p《0.01)。由本结果进一步表明,spcipk25转基因植株叶片细胞具有更好的抗过氧化能力或膜系统修复能力,降低了胁迫环境造成的损伤,使植株有更强的抗旱能力。
[0075]
2)叶片相对含水量(rwc)能体现植物不同生境下的渗透调节能力,维持相对较高的含水量可以维持蛋白质的结构稳定,提高对胁迫环境的适应能力。
[0076]
rwc(叶片相对含水量)测定:每株待测植物随机选取5片叶子并进行记录,叶片摘取后立即记录新鲜重量(fw)。然后将摘取的叶片放在黑暗处的4℃蒸馏水中孵育24h,记录膨胀重量(tw)。然后将这些叶片放入65℃恒温干燥箱内,48h后测定叶片干重(dw)。rwc根据以下公式进行计算:
[0077]
rwc
·
(%)=[(fw-dw)/(tw-dw)]
×
100。
[0078]
结果如图7和表4所示:
[0079]
表4干旱处理下转抗性基因spcipk25拟南芥株系和wt野生型拟南芥株系的叶片含水量(%)
[0080][0081]
实验结果表明,在正常培养条件下,野生型组和三个转抗性基因spcipk25组之前无显著差异;经过干旱处理,各实验组的rwc都出现了不同程度的下降,其中干旱处理7天时,野生型wt比正常培养时下降了约14.95%,转基因株系sp1下降了约12.91%,转基因株系sp2下降了约13.80%,转基因株系sp3下降了约13.24%,sp1-3、sp2-3、sp3-3与wt之间差异极显著(p《0.01);干旱处理14天时,wt比正常培养时下降了约37.90%,转基因株系sp1下降了约26.78%,转基因株系sp2下降了约28.06%,转基因株系sp3下降了约27.20%,sp1-3、sp2-3、sp3-3与wt之间差异极显著(p《0.01);复水2天后,wt比正常培养时下降了约43.17%,转基因株系sp1下降了约15.97%,转基因株系sp2下降了约16.47%,转基因株系sp3下降了约14.84%,sp1-3、sp2-3、sp3-3与wt之间差异极显著(p《0.01)。由rwc结果表明,三个转抗性基因spcipk25组在干旱胁迫处理下相比野生型具有更高的叶片含水量。
[0082]
3)逆境胁迫会引起活性氧类物质在植物细胞内大量积累,从而导致细胞膜脂过氧化,使细胞膜稳定性降低,膜透性增加,离子渗漏率(el)增加,所以el可表示细胞膜受损伤的程度。
[0083]
el(离子渗漏率)测定:共将15个叶圆片(每个直径0.5厘米)放入装有10ml去离子水的试管中,并摇晃振荡,使用电导计(上海雷磁,ddbj-350)测量初始电导率(c0)及振荡3h后的电导率(c3)。然后经煮沸15min,以相同的方法测定总电解质含量(tc)。el根据以下公
式进行计算:
[0084]
el(%)=100
×
(c3-c0)/tc。
[0085]
结果如图7和表5所示:
[0086]
表5干旱处理下转抗性基因spcipk25拟南芥株系和wt野生型拟南芥株系叶片的离子渗漏率
[0087][0088]
在未干旱处理前,各实验组间的el没有显著差异。经过干旱处理后,各实验组的el都呈现出逐步上升的趋势。干旱处理7天时,wt比正常培养时上升了约5.97倍,转基因株系sp1上升了约3.92倍,转基因株系sp2上升了约4.19倍,转基因株系sp3上升了约4.30倍,sp1-3、sp2-3、sp3-3与wt之间差异极显著(p《0.01);干旱处理14天时,wt比正常培养时上升了约15.33倍,转基因株系sp1上升了约10.74倍,转基因株系sp2上升了约10.83倍,转基因株系sp3上升了约11.06倍,sp1-3、sp2-3、sp3-3与wt之间差异极显著(p《0.01);复水2天后,wt比正常培养时上升了约14.76倍,转基因株系sp1上升了约7.69倍,转基因株系sp2上升了约7.82倍,转基因株系sp3上升了约8.02倍,sp1-3、sp2-3、sp3-3与wt之间差异极显著(p《0.01)。由el的结果可知,干旱处理过程中,转基因实验组的el比野生型组上升的程度要小,而复水后spcipk25转基因植株的el又较快的得到了部分恢复,这表明转抗性基因spcipk25植株叶片细胞可能具有更强的抵抗过氧化的能力或膜系统的修复能力。
[0089]
实施例4
[0090]
采用与实施例1相同的方法,区别在于在得到纯合t3代株系后,将3个t3代纯合转抗性基因spcipk25拟南芥株系(分别命名为sp1-4,sp2-4,sp3-4)和野生型哥伦比亚拟南芥(wt)种子在暗培养室中培养发芽,待7天后移栽至土培容器(10cm
×
10cm
×
8cm)中(sp1-4,sp2-4,sp3-4和wt移栽至一个土培容器中)。之后选择强健、长势较一致的3周龄幼苗用于试验和处理。所有植物均在24℃(相对湿度为75~80%,光强为200μmol m-2
s-1
),光周期为16h/8h的环境中培养。之后模拟干旱条件给拟南芥幼苗停止浇水共21天,然后恢复浇水,并在干旱7天(d7d)和14天(d14d)时间点取样,并以未停止浇水时的样本为对照组(d0d)进行psii最大光化学效率fv/fm测定。在干旱处理21天(d21d)并复水7天后统计各试验组拟南芥存活率。
[0091]
fv/fm测定:在对各处理组的拟南芥植株进行了30min暗适应后,采用调制(pam)叶绿素荧光计(heinz-walz-gmbh,effeltrich,germany)测量各处理组拟南芥植株的fv/fm(饱和脉冲强度为4000μmol m-2
s-1
)。
[0092]
高等植物的光合作用发生在叶绿体的类囊体膜上。类囊体膜上分布着多种光合作用相关的蛋白复合物,包括光系统ii(psii)、光系统i(psi)和atp合酶等。psii是拥有众多蛋白亚基、色素分子和辅助因子的色素蛋白超级复合物,在光合作用中发挥着接收光能,将水分解为氧气并且传递电子等重要功能。水分是影响植物生长发育和生理活动的重要因素,光合作用对水分限制非常敏感。psii类囊体薄膜能以热耗散的形式释放过剩光能从而保护植物免受胁迫的伤害。有研究表明缺水可导致植物psii反应中心永久受损。叶绿素荧光动力学特征对生境胁迫十分敏感,psii最大光化学效率(fv/fm)的下降是植株受到胁迫的可靠指标之一。实验结果如图8~9和表6所示:
[0093]
表6干旱处理下转抗性基因spcipk25拟南芥株系和wt野生型拟南芥株系的psii最大光化学效率fv/fm
[0094][0095]
由图8~9及表6可以看出,当干旱处理7天时,wt比对照组的psii最大光化学效率fv/fm下降了约20.67%,转基因株系sp1下降了约6.44%,转基因株系sp2下降了约7.14%,转基因株系sp3下降了约6.29%,干旱处理7天时sp1-4,sp2-4,sp3-4与wt之间的fv/fm值差异极显著(p《0.01);干旱处理14天时,wt的fv/fm比各转基因株系低了近40%,sp1-4,sp2-4,sp3-4与wt之间的fv/fm值差异极显著(p《0.01)。
[0096]
存活率结果如图10和表7所示:
[0097]
表7干旱处理下转抗性基因spcipk25拟南芥株系和wt野生型拟南芥株系的存活率
[0098][0099]
由图10和表7可以看出,sp1-4,sp2-4及sp3-4在干旱处理21天并复水7天后的存活率分别比wt高约38.18%(p《0.01),34.55%(p《0.05),43.64%(p《0.01)。
[0100]
由以上实施例可知,本发明提供的抗性基因spcipk25具有提高植物抗旱性和耐盐性的作用。
[0101]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1