一种手性超分子水凝胶因子及制备方法与应用
1.本发明属于生物材料领域,具体涉及一种手性超分子水凝胶因子及手性超分子结构的制备方法与应用。
背景技术:
2.20世纪初,抗生素的发现改变了人类健康,使人们能够在将感染风险降到最低的情况下进行外科手术。然而,抗生素的持续过度使用,以及耐药性的迅速蔓延,已使许多抗生素失去活性。因此,亟需能够规避抗生素耐药性的替代策略。
3.水凝胶的出现改变了应用抗生素时普遍存在的耐药性现象。这是因为水凝胶具有优越的生物相容性、可调节的机械强度、可编程的抗菌能力、模拟细胞外基质等优势,并为组织再生和伤口愈合提供理想的环境。研究表明,水凝胶的抗菌活性主要通过三种方法实现:1)将无机纳米颗粒掺入水凝胶基质中;2)外部抗生素或抗菌剂与水凝胶共组装;3)水凝胶固有的抗菌能力。第一种方法中,纳米银被广泛地探索。然而,纳米银也存在一些缺陷,如对正常细胞和组织的损伤,以及在器官中沉积。第二种情况涉及到水凝胶与抗生素(如脱氧土霉素、链霉素和青霉素)或其他抗菌药物的共组装,通常会出现水凝胶结构发生改变,由此带来形态和流变性能的改变。这些变化对水凝胶的整体性能具有潜在不利影响。第三类抗菌水凝胶具有固有的抗菌能力,这些水凝胶具有多种优点,包括作为自传递载体、生物相容性、生物可吸收性和生物降解性。尽管如此,复杂的化学合成、纯化过程、和快速酶促降解等障碍仍然是第三类水凝胶面临的重大挑战。
4.所以,有必要研究开发替代的第三种抗菌水凝胶。众所周知,手性是普遍存在的生命现象,在许多生物过程中发挥着重要作用,不同手性的药物分子可能会对同一种疾病产生截然不同的治疗效果。在多数研究中,人们往往关注水凝胶本身的抗菌能力,但对手性分子和超分子手性对抗菌活性的影响仍知之甚少。加之超分子具有与其构筑基元完全不同的性质,因此,有必要对手性分子和超分子手性的抗菌活性展开系统研究,这种手性依赖的抗菌概念不仅为理解超分子手性对细菌细胞行为的影响提供了有趣的见解,而且还拓宽和增强了新手性功能纳米结构的开发,使设计和定制具有特殊生物学和医学用途的材料成为可能。
技术实现要素:
5.本发明的目的在于提供一种手性超分子水凝胶因子,同时提供了手性水凝胶制备方法是本发明的第二发明目的,本发明的第三发明目的在于提供了利用手性超分子水凝胶因子制备的具有抗菌功能手性超分子水凝胶及其制备方法,同时本发明还给出了手性超分子水凝胶在抗菌领域的应用。
6.为实现上述目的,本发明采用以下技术方案:
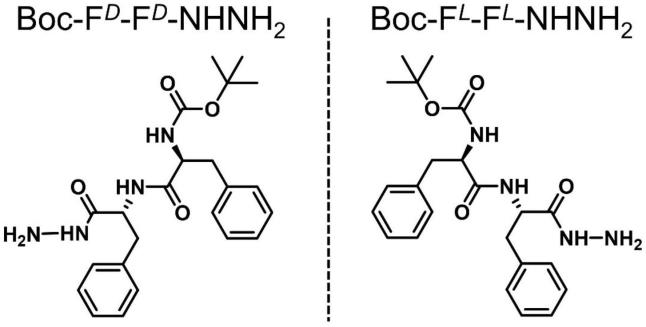
7.一种手性超分子水凝胶因子,其结构为boc-f
d-f
d-nhnh2和boc-f
l-f
l-nhnh2中的至少一种,所述boc-f
d-f
d-nhnh2和boc-f
l-f
l-nhnh2的结构如下:
[0008][0009]
所述手性超分子水凝胶因子的制备方法,包括以下步骤:
[0010]
s1、将d-苯丙氨酸甲酯盐酸盐(d-phe-hcl)溶于二氯甲烷(dcm)中,搅拌溶解后,加入三乙胺,随后加入boc-d-phe,搅拌溶解后加入1-羟基苯并三氮唑(hobt),继续搅拌0-40min后加入1-乙基-3(3-二甲基丙胺)碳二亚胺(edci),反应过夜;
[0011]
s2、反应结束后,上述反应液依次经过饱和碳酸氢钠溶液、饱和柠檬酸溶液和饱和氯化钠溶液萃取,收集有机相,经过无水硫酸钠处理后,减压干燥得boc-f
d-f
d-ome;
[0012]
s3、用甲醇溶解干燥的boc-f
d-f
d-ome,加热助溶解后加入水合肼(n2h4),反应过夜;
[0013]
s4、反应液加水形成白色固体,抽滤即得boc-f
d-f
d-nhnh2;
[0014]
将上述d-构型底物替换为l-构型,即得boc-f
l-f
l-nhnh2。
[0015]
步骤s1中,d-phe-hcl:boc-d-phe:hobt:edci的摩尔比为20:20:(21-30):(30-40);所述d-phe-hcl、dcm与三乙胺的用量比为0.02mol:(100-200)ml:5ml;过夜时间为(16-18)h。
[0016]
步骤s3中,用甲醇溶解时采用油浴加热至75-85℃;反应过夜时间为(8-12)h;所述水合肼的体积浓度不低于80%。
[0017]
利用所述的手性超分子水凝胶因子在良溶剂-不良溶剂的诱导下自组装得到的具有抗菌功能的手性超分子水凝胶。
[0018]
所述具有抗菌功能手性超分子水凝胶的制备方法,包括以下步骤:
[0019]
a)取适量手性超分子水凝胶因子,加入乙醇溶解得乙醇储备液;
[0020]
b)向步骤a)的乙醇储备液中加水,静置即得稳定的自组装体。
[0021]
步骤a)中,所述乙醇储备液中,手性超分子水凝胶因子的浓度为(25-30)mg/ml。
[0022]
步骤b)中,乙醇储备液与加入水的用量比例为:100ml:(100-2000)ml。
[0023]
本发明进一步公开了具有抗菌功能的手性水凝胶在抑制金黄色葡萄球菌增殖中的应用。
[0024]
本发明中,手性超分子水凝胶首先通过酰化反应和胺酯交换合成手性超分子凝胶因子;随后手性超分子凝胶因子在溶剂诱导下,首先进行规律堆砌随后通过手性级联放大,最终形成具有微纳米纤维结构的手性超分子水凝胶。本发明的手性水凝胶是一种具有抗菌功能的手性生物材料,不同的手性结构表现出不同的抗菌效果,结构手性比分子手性的抗菌能力更强。手性超分子水凝胶制备方法操作方便,更具有实际应用价值。且本发明解决了现有技术中水凝胶的合成及纯化复杂以及手性结构抗菌能力不明确的问题。
[0025]
与现有技术相比,本发明具有如下有益效果:
[0026]
1)本发明的抗菌功能的手性水凝胶(图1)是一种具有手性结构的纳米纤维超分子水凝胶(图2),boc-f
d-f
d-nhnh2和boc-f
l-f
l-nhnh2的圆二色谱(cd)信号具有镜像对称关系(图3)。
[0027]
2)手性因素在抑制细菌增殖中起到相当大的促进作用,抗菌能力有如下顺序:l-构型的超分子水凝胶>l-构型的手性分子>d-构型的超分子水凝胶>d-构型的手性分子水凝胶(图4),说明抗菌能力由手性分子和超分子手性共同决定。
附图说明
[0028]
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
[0029]
图1是bfd的核磁共振氢谱;
[0030]
图2是bfl的核磁共振氢谱;
[0031]
图3是本发明的抗菌功能的手性水凝胶;图中,从左至右依次为bfl,bfl:h2o(1:1),bfl:h2o(1:2),bfl:h2o(1:4),bfl:h2o(1:6),bfl:h2o(1:8),bfl:h2o(1:10),bfl:h2o(1:12),bfl:h2o(1:15);
[0032]
图4是本发明的两种手性水凝胶的宏观结构图;
[0033]
图5为boc-f
d-f
d-nhnh2和boc-f
l-f
l-nhnh2的扫描电镜图;
[0034]
图6为bfd手性组装体的cd图;
[0035]
图7为bfl手性组装体的cd图;
[0036]
图8为bfl和bfd消旋体的cd图;
[0037]
图9为手性超分子水凝胶boc-f
d-f
d-nhnh2和boc-f
l-f
l-nhnh2,手性分子boc-f
d-f
d-nhnh2和boc-f
l-f
l-nhnh2的抗菌情况图。
具体实施方式
[0038]
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变化和改进。这些都属于本发明的保护范围。需要说明的是,本实施例中,水合肼的体积浓度不低于80%。
[0039]
实施例1
[0040]
一种手性超分子水凝胶因子,其结构为:
[0041]
[0042]
其制备方法为:
[0043]
s1、d-phe-hcl(4.3136g,0.02mol)溶于dcm(100ml)中,搅拌溶解后,加入三乙胺(5ml),随后加入boc-d-phe(5.306g,0.02mol),搅拌溶解后加入hobt(3.51g,0.026mol),继续搅拌0.5h后加入edci(7.23g,0.037mol),继续搅拌16h。在其他实施例中,继续搅拌0-40min均可实现本发明效果。
[0044]
s2、反应结束后,上述反应液依次经过饱和碳酸氢钠溶液、饱和柠檬酸溶液和饱和氯化钠溶液萃取,每个饱和溶液分别萃取3次后再进入下一个饱和溶液萃取,收集有机相,加入足够的无水硫酸钠处理直至无水硫酸钠不再结块为止,减压干燥得boc-f
d-f
d-ome;本发明加入无水硫酸钠的目的是除去有机相中的水分;
[0045]
s3、用甲醇溶解干燥的boc-f
d-f
d-ome(10mmol),油浴加热至85℃,促进固体溶解,随后加入n2h4(40mmol),反应12h;
[0046]
s4、将反应溶液倾入烧杯中,随后加入蒸馏水直至白色固体不再增加,抽滤即得固体boc-f
d-f
d-nhnh2;
[0047]
实施例2
[0048]
本实施例中的一种手性超分子水凝胶因子,与实施例1不同之处在于:步骤s1中,所述d-phe-hcl:boc-d-phe:hobt:edci的摩尔比为20:20:21:30,所述d-phe-hcl、dcm与三乙胺的用量比为0.02mol:200ml:8ml;过夜时间为18h,其余均与实施例1相同。
[0049]
实施例3
[0050]
本实施例中的一种手性超分子水凝胶因子,与实施例1不同之处在于:步骤s1中,所述d-phe-hcl:boc-d-phe:hobt:edci的摩尔比为20:20:30:40,所述d-phe-hcl、dcm与三乙胺的用量比为0.02mol:200ml:12ml;其余均与实施例1相同。
[0051]
实施例4
[0052]
本实施例中的一种手性超分子水凝胶因子,与实施例1不同之处在于:步骤s3中,boc-f
d-f
d-ome与n2h4的物质的量之比为1:2,用甲醇溶解时采用油浴加热至75℃,反应时间为8h,其余均与实施例1相同。
[0053]
实施例5
[0054]
本实施例中的一种手性超分子水凝胶因子,与实施例1不同之处在于:步骤s3中,boc-f
d-f
d-ome与n2h4的物质的量之比为1:10,反应时间为8h,其余均与实施例1相同。
[0055]
实施例6-10
[0056]
实施例6-10中的一种手性超分子水凝胶因子,分别与实施例1-5对应,不同之处在于:将实施例1-5中的d-构型底物替换为l-构型,即得boc-f
l-f
l-nhnh2;其结构为:
[0057]
[0058]
通过以上方法得到的两种分子,分别做核磁共振氢谱确定结构。如图1和图2所示,实例1-5得到的l-构型分子或实例6-10得到的d-构型分子都具有相同的核磁共振氢谱数据,由此可以确定通过实例1-5或实例6-10的方法都可以得到两种手性凝胶因子。boc-f
d-f
d-nhnh2和boc-f
l-f
l-nhnh2的核磁共振氢谱略有不同,主要体现在2.5-2.8ppm的化学位移内,这与合成过程中所用不同构型的苯丙氨酸有关,同时从核磁共振谱图上还可以说明本合成方法得到的分子具有较高的纯度。
[0059]
实施例11、制备boc-f
d-f
d-nhnh2和boc-f
l-f
l-nhnh2超分子水凝胶
[0060]
本实施例提供了一种制备超分子水凝胶的方法,包括如下步骤:
[0061]
(a)精确称取boc-f
d-f
d-nhnh2(bfd)和boc-f
l-f
l-nhnh2(bfl),分别加入乙醇,加热促溶得30mg/ml的乙醇储备液;在其他实施例中,浓度为25-30mg/ml均可;
[0062]
(b)吸取100μl储备液于ep管中,随后加入100-2000μl水,静置即可成胶,其中其用量比见下表;
[0063]
bfd体积h2o体积100μl100μl100μl400μl100μl500μl100μl600μl100μl800μl100μl900μl100μl1100μl100μl1200μl100μl1500μl100μl2000μl
[0064]
bfl体积h2o体积100μl100μl100μl400μl100μl500μl100μl600μl100μl800μl100μl900μl100μl1100μl100μl1200μl100μl1500μl100μl2000μl
[0065]
bfd:bfl体积h2o体积50μl:50μl100μl50μl:50μl400μl50μl:50μl500μl
50μl:50μl600μl50μl:50μl800μl50μl:50μl900μl50μl:50μl1100μl50μl:50μl1200μl50μl:50μl1500μl50μl:50μl2000μl
[0066]
(c)测试cd信号,结果见图5、图6和图7所示。
[0067]
图3给出了本发明的抗菌功能的bfl手性水凝胶;图中,从左至右依次为bfl,bfl:h2o(1:1),bfl:h2o(1:2),bfl:h2o(1:4),bfl:h2o(1:6),bfl:h2o(1:8),bfl:h2o(1:10),bfl:h2o(1:12),bfl:h2o(1:15);
[0068]
图4给出了本发明的两种手性水凝胶的宏观结构。从图中可以看出,储能模量g'>损耗模量g”,这说明可以通过溶剂诱导方法得到宏观稳定的超分子水凝胶。
[0069]
其次,通过对得到的两种构型的水凝胶进行扫描电镜测试,观测其微观形貌,如图5所示,两种构型的水凝胶都是纳米纤维结构,但看不出明显的手性差异。
[0070]
图6为bfd手性组装体的cd图,从图6可以看出,所形成的组装体具有手性,信号峰为一个负的cotton效应峰和一个正cotton峰。
[0071]
图7是bfl手性组装体的cd图,由图可知,所形成的的组装体具有手性,信号峰为一个正的cotton效应峰和一个负cotton峰,与bfd呈镜像关系。
[0072]
图8是bfl和bfd消旋体的cd数据,由图可知,所形成的组装体不具有手性。
[0073]
实施例12、测定boc-f
d-f
d-nhnh2和boc-f
l-f
l-nhnh2超分子水凝胶的抗菌性能
[0074]
采用菌落计数法测定抗菌能力,包括以下步骤:
[0075]
(a)精确称取boc-f
d-f
d-nhnh2(bfd)和boc-f
l-f
l-nhnh2(bfl),分别加入乙醇,加热促溶得30mg/ml的乙醇储备液;
[0076]
(b)分别吸取100μl上述两种储备液于涂布有lb的琼脂凝胶平板上,随后加入700μl培养基,形成超分子水凝胶后,加入浓度为108cfu/ml的金黄色葡萄球菌(悬浮于ph7.4的磷酸盐缓冲液中),涂布均匀;
[0077]
(c)37℃下培养24小时,人工计算存活菌落数。结果见图9所示。
[0078]
图中:
[0079]
control:不做任何处理;
[0080]
bfl:取30mg/ml的bfl 100μl于平板中,随后加入700μl培养基,形成的超分子结构的抗菌测试;
[0081]
bfd:取30mg/ml的bfd 100μl于平板中,随后加入700μl培养基,形成的超分子结构的抗菌测试;
[0082]
bfl+bfd:各取30mg/ml的bfl和bfd 50μl于平板中,混合均匀,随后加入700μl培养基,形成的不具有手性结构的材料;
[0083]
bfl-sol.:取30mg/ml的bfl 100μl于平板中,随后加入700μl乙醇,乙醇挥干后的分子聚集体的抗菌测试;
[0084]
bfd-sol.:取30mg/ml的bfd 100μl于平板中,随后加入700μl乙醇,乙醇挥干后所
得分子聚集体的抗菌测试;
[0085]
从图4可以看出,l-构型的超分子水凝胶(bfl)>l-构型的手性分子(bfl-sol.)>d-构型的超分子水凝胶(bfd)>d-构型的手性分子(bfd-sol.)≈消旋体的组装体(bfl+bfd)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1