西拉菌素在制备治疗冠状病毒感染性疾病的药物的用途
西拉菌素在制备治疗冠状病毒感染性疾病的药物的用途
1.本技术为2021年02月08日提交的,发明名称为“穿山甲冠状病毒xcov及其应用和药物抗冠状病毒感染的应用”的中国专利申请202110172158.7的分案申请。
技术领域
2.本发明属于药物领域,具体涉及一种穿山甲冠状病毒xcov及其用于抗sars-cov-2病毒药物的筛选的用途,包含该穿山甲冠状病毒xcov的药物筛选模型、药物筛选方法,还涉及基于该xcov筛选出的活性化合物用于制备治疗sars-cov-2病毒感染性疾病的药物的用途。
背景技术:
3.新型冠状病毒(被世界卫生组织命名为“sars-cov-2”,先前命名为2019新型冠状病毒或2019ncov)属于β属冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多形性,直径60-140nm。其基因特征与sars-cov和mers-cov有明显区别。目前研究显示其与蝙蝠sars样冠状病毒(bat-sl-covzc45)同源性达85%以上。sars-cov-2的防治迫切需要有效的疫苗和特异性治疗,如何快速筛选能够抑制该病毒复制的药物成为迫在眉睫的问题。同时,由于该病毒的传染性极强,如何安全地进行药物筛选等相关研究、保护研究人员不受感染也成为亟待解决的问题。
技术实现要素:
4.本发明人从海关查获的死亡的穿山甲中分离并培养的一株新型冠状病毒xcov,称为穿山甲冠状病毒xcov(在本发明的上下文中也称为“穿山甲xcov”或者“xcov”),其全基因组序列分析结果显示与sars-cov-2的s蛋白同源性达92.5%,是迄今为止成功分离培养的与sars-cov-2的s蛋白同源性最高的病毒。进一步实验显示穿山甲xcov感染细胞的受体与sars-cov-2一致,均为血管紧张素转化酶2(ace2)。但是该病毒不感染人,因此,对人而言是非常安全的。
5.本发明提供一种冠状病毒(也称为“穿山甲冠状病毒xcov”、“穿山甲xcov”或者“xcov”),该冠状病毒毒株xcov于2020年2月14日保藏在中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏编号为cgmcc no.19295。
6.根据本发明的穿山甲冠状病毒毒株xcov,其全基因组核苷酸序列如序列表中seq id no:1所示。
7.根据本发明的穿山甲冠状病毒毒株xcov,其s基因的核酸序列如序列表中seq id no:2所示。
8.根据本发明的穿山甲冠状病毒毒株xcov,其s蛋白的氨基酸序列如序列表中seq id no:3所示。
9.根据本发明的穿山甲冠状病毒毒株xcov,其与sars-cov-2的s蛋白同源性达
92.5%。其中,所述sars-cov-2的s基因的核酸序列如序列表中seq id no:4所示,其s蛋白的氨基酸序列如序列表中seq id no:5所示。
10.其中,xcov与sars-cov-2的序列一致性结果在图1中示出。
11.本发明还提供所述穿山甲冠状病毒毒株xcov的应用,其用于抗sars-cov-2病毒的活性药物的筛选与评价,抗sars-cov-2病毒的疫苗的筛选与评价,以及用于制备抗sars-cov-2病毒的减毒疫苗或灭活疫苗,以及用于sars-cov-2病毒感染的诊断和治疗性抗体的制备。其中所述疫苗中还包括药学上可接受的佐剂。
12.本发明还提供一种用于筛选和/或评价抗冠状病毒活性药物的药物筛选模型,其包括所述保藏编号为cgmcc no.19295的冠状病毒(也称为“穿山甲冠状病毒xcov”、“冠状病毒xcov”、“穿山甲xcov”或者“xcov”)。
13.根据本发明的药物筛选模型,其为采用所述穿山甲冠状病毒xcov感染的哺乳动物细胞,优选vero e6细胞(非洲绿猴肾细胞)。
14.根据本发明的药物筛选模型,其中所述模型优选用于筛选和/或评价有抗sars-cov-2病毒活性的药物。
15.本发明还提供一种筛选和/或评价抗冠状病毒活性药物的方法,其采用上述药物筛选模型进行;优选地,该方法用于筛选和/或评价有抗sars-cov-2活性的药物。
16.根据本发明的筛选和/或评价抗冠状病毒活性药物的方法,其包括步骤(1):向所述药物筛选模型中加入待测试的药物并进行培养。
17.根据本发明的筛选和/或评价抗冠状病毒活性药物的方法,其在步骤(1)之后还任选地包括以下步骤(2a)或步骤(2b),或同时包含步骤(2a)和步骤(2b):
18.步骤(2a):在显微镜下观察细胞病变;
19.步骤(2b):测定细胞和上清中的病毒核酸。
20.根据本发明的筛选和/或评价抗冠状病毒活性药物的方法,步骤(1)中的培养时间可以为12-90小时,如24-72小时,48-72小时,24小时,48小时或72小时等。
21.在步骤(2a)中,当观察到存在完整的细胞单层或细胞病变不明显时,表明待测试的药物具有抑制病毒复制的活性。
22.此外,本发明还提供以下化合物中的任一种、两种或三种用于制备治疗冠状病毒感染性疾病的药物的用途:千金藤素(千金藤碱)、西拉菌素、盐酸甲氟喹和甲氟喹。
23.根据本发明的用途,所述冠状病毒为sars-cov-2病毒。
24.此外,本发明还通过time-of-addition试验发现了千金藤素、西拉菌素和盐酸甲氟喹对xcov病毒生命周期的影响,并通过转录组学分析解释了千金藤素抑制xcov病毒复制的机理。
25.有益效果
26.本发明的穿山甲冠状病毒xcov与sars-cov-2的s蛋白同源性高,xcov感染细胞的受体与sars-cov-2一致,均为血管紧张素转化酶2(ace2)。并且该xcov病毒不感染人,因此对人而言是非常安全,可用于抗sars-cov-2病毒的药物筛选与评价、疫苗筛选与评价、减毒及灭活疫苗的制备。基于该xcov病毒筛选抗sars-cov-2病毒的药物对研发人员非常安全,不必担心被感染。基于该筛选模型筛选出了抗sars-cov-2的活性药物千金藤素(千金藤碱)、西拉菌素、盐酸甲氟喹(甲氟喹),并证明了千金藤素、西拉菌素和盐酸甲氟喹在xcov入
胞后发挥抑制作用,还解释了千金藤素抗xcov机制。千金藤素主要通过干扰细胞应激反应,包括内质网应激/未折叠蛋白反应和热休克因子1(hsf1)介导的热休克反应来逆转受感染细胞中大多数失调的基因和通路,从而发挥抗冠状病毒效果。
附图说明
27.图1示出了xcov与其他冠状病毒的序列一致性结果。
28.图2示出了xcov全基因组与sars-cov-2全基因组的进化树分析。
29.图3示出了xcov的s基因与sars-cov-2的s基因的进化树分析。
30.图4示出了sirna敲降ace2后ace2 mrna的表达情况。
31.图5示出了sirna敲降ace2表达后对xcov病毒感染的影响。
32.图6示出了本发明的药物筛选的流程。
33.图7示出了感染复数为0.01的xcov感染72小时后,不加药时的vero e6细胞形态图。
34.图8示出了不加病毒培养72小时后,不加药时的vero e6细胞形态图。
35.图9示出了加入终浓度10μm(微摩尔每升)的千金藤素和感染复数为0.01的xcov感染72小时后的vero e6细胞形态图。
36.图10示出了加入终浓度10μm(微摩尔每升)的西拉菌素和感染复数为0.01的xcov感染72小时后的vero e6细胞形态图。
37.图11示出了加入终浓度10μm(微摩尔每升)的盐酸甲氟喹和感染复数为0.01的xcov感染72小时后的vero e6细胞形态图。
38.图12示出了三种化合物对xcov的抑制作用,10μm的千金藤素抑制xcov病毒复制的倍数为15393倍,10μm的西拉菌素抑制xcov病毒复制的倍数为5053倍,10μm的盐酸甲氟喹抑制xcov病毒复制的倍数为31倍。
39.图13示出了千金藤素对xcov的半数有效浓度(ec
50
)为0.9851μm、对vero e6细胞的半数细胞毒性浓度(cc
50
)为39.32μm,以及选择指数(si)为39.91。
40.图14示出了西拉菌素对xcov的半数有效浓度(ec
50
)为1.908μm、对vero e6细胞的半数细胞毒性浓度(cc
50
)为6.227μm,以及选择指数(si)为3.290。
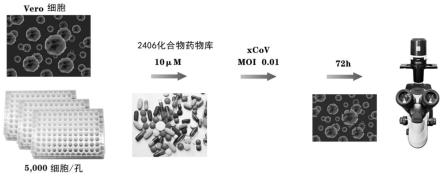
41.图15示出了盐酸甲氟喹对xcov的半数有效浓度(ec
50
)为2.728μm、对vero e6细胞的半数细胞毒性浓度(cc
50
)为10.08μm,以及选择指数(si)为3.695。
42.图16示出了千金藤素对xcov的time-of-addition试验结果。
43.图17示出了西拉菌素对xcov的time-of-addition试验结果。
44.图18示出了盐酸甲氟喹对xcov的time-of-addition试验结果。
45.图19示出了千金藤素抗xcov复制的转录组分析结果。
具体实施方式
46.以下结合实施例对本发明做进一步描述。需要说明的是,下述实施例不能作为对本发明保护范围的限制,任何在本发明基础上作出的改进都不违背本发明的精神。本发明所用原料和设备,如无特殊说明,均可商业购买。
47.一、实验方法
48.1.细胞培养和病毒培养
49.非洲绿猴肾细胞系vero e6是从美国模式培养物集存库(atcc,1586号)中获得的,在37℃、5%co2的条件下,在含有10%胎牛血清(fbs;gibco invitrogen)的dmem培养基(gibco)中培养。
50.将穿山甲分离株xcov在vero e6细胞中繁殖,用噬斑实验测定病毒滴度。所有感染实验均在生物安全2级(bls2)实验室进行。
51.上市药物库(产品号l1000,含2080种已经上市的药物)和抗病毒化合物库(产品号l1700,含326抗病毒药物)从上海陶素生化科技有限公司购买。所有药物的初始浓度均为10mm(毫摩尔每升)。
52.千金藤素(t0131)、西拉菌素(t0124)、盐酸甲氟喹(t0860)从上海陶素生化科技有限公司购买。所有药物的初始浓度均为10mm(毫摩尔每升)。
53.2.探究ace2是否为xcov感染细胞受体
54.转染前一天,在12孔细胞培养板中每孔接种2
×
105个vero e6细胞。第二天,当细胞贴壁好时利用ace2 sirna smart pool(苏州吉玛基因)通过rnaimax转染试剂反式转染的方式沉默ace2基因表达。将细胞分别与2、10和50nm的sirnas转染液在37℃条件下孵育48小时。48小时后,将细胞与xcov在37℃共孵育2小时。用pbs洗去未结合的病毒,加入新鲜培养基继续培养24小时。用pbs洗去未结合的病毒,提取总rna,采用两步法qrt-pcr测定ace2 mrna和病毒感染情况。
55.3.利用sars-cov-2高度同源的穿山甲冠状病毒xcov从上市药物库中筛选潜在的抗新型肺炎病毒药物
56.96孔细胞板中种上2.5
×
104个vero e6细胞,24小时后用moi=0.01的xcov感染vero e6细胞,同时向其中加入终浓度为10μm的各种已知药物(2406种上市药物和iii期临床试验药物),在第3天时通过显微镜镜下观察细胞病变,对没有明显细胞病变的培养孔提取细胞和上清中的rna,用qrt-pcr测定细胞和上清中的病毒复制情况。
57.4.病毒rna提取及实时定量rt-pcr(qrt-pcr)
58.根据制造商的说明,使用axyprep
tm
体液病毒dna/rna微型制备试剂盒(axygen,产品编号ap-mn-bf-vna-250)和axyprep
tm
多用途总rna微型制备试剂盒(axygene,产品编号ap-mn-ms-rna-250g)采集细胞培养上清液和vero e6细胞进行rna提取。用带有gdna酶的hifairⅱ1链cdna合成试剂盒(上海翊圣生物科技有限公司,产品编号11121es60)进行反转录,用hieff-qpcr-sybr-green-master mix(上海翊圣生物科技有限公司,货号:11202es08)或两步taqman探针检测qrt-pcr系统(applied-biosystem)进行qpcr,所用引物的序列信息在表1中示出。经测序确认后,由北京瑞博兴科生物科技有限公司将pcr产物插入t载体,产生标准质粒。标准曲线是通过测定质粒连续稀释(10
3-109)的拷贝数而产生的。sybr-green法的qpcr扩增:95℃5min,40个循环,95℃10s,55℃20s,72℃31s。
59.taqman法:50℃2min,95℃10min,40次循环,95℃10s,60℃1min,用graphpad-prism 8软件分析图12的数据。
60.本发明的药物筛选流程如图6所示。
61.5.ec
50
与cc
50
检测及time-of-addition试验
62.使用实验方法3筛选出的3种化合物-千金藤素、西拉菌素、盐酸甲氟喹进行试验,
在使用moi=0.01的xcov感染vero e6细胞。
63.ec
50
检测:vero e6细胞接种至24孔细胞培养板,细胞密度达到60%-80%时进行试验;药物稀释至200μm,后按两倍比梯度稀释至0.39μm。vero e6细胞换液后,药物溶液与病毒悬液1:1稀释后加至细胞。试验药物终浓度分别为100μm、50μm、25μm、12.5μm、6.25μm、3.125μm、1.56μm、0.78μm、0.39μm、0.195μm、0μm。37℃5%co2培养60-72h,观察cpe,提取细胞核酸进行qpcr检测,用graphpad-prism 8软件进行数据分析计算ec
50
。
64.cc
50
检测:使用cell-titer-blue法进行cc
50
的检测。vero e6细胞接种至96孔细胞培养板,细胞密度达到60%-80%时进行试验。药物两倍比梯度稀释,vero e6细胞换液后加入稀释后的药物。试验药物终浓度分别为100μm、50μm、25μm、12.5μm、6.25μm、3.125μm、1.56μm、0.78μm、0.39μm、0.195μm、0μm。37℃5%co2培养48h,每孔加20μl cell-titer-blue,分别在0min、30min、60min、120min检测593nm发光强度,用graphpad-prism 8软件进行数据分析计算cc
50
。
65.si为cc
50
除以ec
50
计算得出。
66.time-of-addition检测:vero e6细胞接种至24孔细胞培养板,细胞密度达到60%-80%时进行试验。选择试验药物浓度为6.25μm。“全时程”实验方法:加入药物-病毒混合液,37℃5%co2培养2h后换液,加入药物-病毒混合液;“入胞前”实验方法:加入药物-病毒混合液,37℃5%co2培养2h后换液,加入纯培养基;“入胞后”实验方法:加入纯培养基,37℃5%co2培养2h后换液,加入药物-病毒混合液。37℃5%co2继续培养60-72h,观察cpe,提取细胞核酸进行qpcr检测,用graphpad-prism 8软件进行数据分析。
67.6.千金藤素抗xcov感染的转录组学分析
68.千金藤素(cep)试验浓度为6.25μm,使用moi=0.01的xcov感染vero e6细胞。实验设置四个分组:vero、vero+virus、vero+cep、vero+virus+cep。培养72h后,收集细胞样品后使用trizol进行rna提取,使用qiaseq fastselect-rrna hmr kit(qiagen,产品编号334387)去除rrna,使用nebnext ultra
tm rna library prep kit for illumina(neb,产品编号e7770l)建立mrna测序文库,使用illumina hiseq 2500 sequencing system(安诺优达生物科技有限公司)进行rna测序(rna-seq)。
69.fastqc(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)工具和fastx工具包中的fastx_trimmer用于去除低质量数据和接头序列;使用hisat2(v2.1.0)将修剪后的rna-seq序列映射到参比绿猴基因组chlsab1.1(gca_000409795.2);使用samtools(v1.5)删除双末端数据重复序列;使用htseq对每个不同基因进行计数;使用deseq2鉴定不同实验组之间的差异表达基因;使用benjamini-hochberg法调整p值来计算错误发现率(fdr);fdr q值《0.05和|log2(倍数变化)|》1的基因被认为是差异表达基因;使用r语言的ggplot2软件包绘制火山图。
70.gct格式文件(包括vero对vero+virus,vero+virus对vero+virus+cep)用作处理文件。基因集包括(1)热休克因子1(hsf1)介导的热休克反应调节、细胞致热性调节、hsf1依赖性反式激活、hypoxia、对病毒的防御反应、对病毒的反应、hif1靶标、脂肪细胞分化和自噬,可从msigdb、kegg和reactome数据库下载,(2)病毒的上/下调基因,是上述rna-seq数据中差异表达的基因,其fdr q值《0.05和|log2(倍数变化)|》1。使用signal2noise模式运行gsea4.0.3(https://www.gsea-msigdb.org/gsea/index.jsp)进行1000个排列计算得出的
基因组富集p值,得出归一化富集得分(nes)值和fdr值。可视化热图由gene-e的r软件包绘制。并从msigdb、kegg和reactome数据库绘制热图,以通过途径模式显示所选基因集。
71.使用metascape工具(https://metascape.org)对上所述获得差异表达的基因进行基因本体(go)分析。p值《0.05的途径作为显着富集的途径,最显著富集的途径使用r包ggplot2创建的气泡图展示,使用metascape网站中cytoscape绘制每个重要的富集途径的相互作用网络和蛋白质-蛋白质相互作用(ppi)网络。并使用biogrid和omnipath对每个给定的基因列表进行详细地ppi富集分析。
72.表1研究中使用的引物序列
[0073][0074][0075]
二、实验结果
[0076]
通过全基因组和各个病毒编码基因(核苷酸水平和氨基酸水平)比较分析发现:xcov与sars-cov-2高度同源,与sars-cov-2的s蛋白同源性达92.5%,是迄今为止成功分离培养的与sars-cov-2的s蛋白同源性最高的病毒(图1)。不论是全基因组水平(图2)还是病毒吸附进入细胞的关键基因s基因(图3),xcov与sars-cov-2的同源性均远高于sars病毒。
[0077]
通过加入不同浓度的sirna特异性敲降ace2的表达,发现随着ace2mrna表达水平逐渐降低(图4),xcov感染细胞的能力显著逐渐下降,强烈提示ace2是xcov进入细胞的受体(图5)。
[0078]
96孔细胞培养孔中,每个孔中分别加入终浓度为10μm的各种已知药物(2080多种上市药物和326种抗病毒化合物)中的一种化合物和moi=0.01的xcov,处理后的vero e6细胞在37℃、5%的co2细胞培养箱中培养72小时。此时加入病毒不加化合物的细胞培养孔和绝大多数加入各种化合物的细胞培养孔中,细胞发生明显的细胞病变效应(图7),同时,没有加入病毒和药物的细胞培养中细胞未见任何细胞病变(图8)。然后,在加入终浓度为10μm的千金藤素(图9)、西拉菌素(图10)和盐酸甲氟喹(图11)的病毒感染细胞培养孔中,未见明显细胞病变。强烈提示千金藤素、西拉菌素、盐酸甲氟喹是潜在的强力抗xcov感染细胞抑制剂。
cov-2高度同源,且xcov感染细胞的受体与sars-cov-2一致,如果药物对xcov感染细胞有抑制作用,则其对sars-cov-2的感染也有抑制作用。
[0087]
值得注意的是,王一飞等人2003的专利“千金藤素在制备抗sars病毒药物中的应用”中提到千金藤素对2003年引起非典的sars-cov病毒的半数抑制剂量为8μg/ml(13.186μm),即13.186μm的千金藤素终浓度能抑制50%的病毒感染。而发明人的实验结果显示,使用更低浓度的千金藤素(10μm),抑制xcov病毒复制的能力达到15393倍。因此,千金藤素对xcov病毒复制的抑制能力至少比对sars-cov病毒复制的抑制能力强30786倍。此外,千金藤素对sars-cov的抑制(实际上是低效抑制)并不能说明其能强力有效地抑制xcov和sars-cov-2。事实上,发明人已测试了的上市药物库中包含了很多可以有效抑制sars-cov病毒复制的药物(如磷酸奥司他韦),但它们(如磷酸奥司他韦)对xcov和sars-cov-2的复制却几乎没有抑制作用。这其中的主要原因之一是由于sars-cov病毒与sars-cov-2病毒同源性较远,sars-cov病毒和sars-cov-2病毒在基因组和氨基酸水平差异较大,造成对sars-cov病毒有抑制作用的药物很可能对xcov和sars-cov-2没有任何影响(如磷酸奥司他韦)。而xcov分离自从海关查获的死亡的穿山甲中,与sars-cov-2高度同源,是目前可分离培养的冠状病毒中与sars-cov-2同源性最高的病毒。因此,本发明中的对xcov有强烈抑制作用的千金藤素、西拉菌素和盐酸甲氟喹也能够抑制sars-cov-2的病毒复制,极有可能成为新型冠状病毒肺炎的特效药,并建议这些药物可用于sars-cov-2患者的临床试验。
[0088]
发明人认为,作为一种潜在的治疗sars-cov-2的药物,千金藤素具有特别重大的的药用价值。该药是从防己科植物头花千金藤、地不容中分离提取的双节基异哇琳生物碱,被批准用于白细胞减少症。它具有多种功能,如抑制抗肿瘤药物的外排转运体abcc10,通过降低质膜流动性抑制hiv-1的进入,与hsp90的中心部分结合。重要的是,大剂量的这种药物在动物身上具有低毒性,在人类中没有明显的副作用。此外,有研究表明sars-cov-2可以引起外周血单个核细胞的细胞应激反应和自噬途径相关基因的富集,而千金藤素可以有效逆转受感染细胞中大多数失调的基因和途径,尤其是内质网应激/未折叠蛋白应答和hsf1介导的热休克应答,由此发挥抗冠状病毒感染效果。鉴于所观察到的对病毒复制的强烈抑制作用和该药物已确立的抗炎作用,发明人认为,千金藤素是治疗sars-cov-2感染的一个有前途的候选药物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1