一种自组装铽-半胱氨酸纳米颗粒及其制备方法和应用
1.本发明属于生物医学和医药评估技术领域,具体涉及一种自组装铽-半胱氨酸纳米颗粒及其制备方法和应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.稀土元素(rare earth elements,rees)因其独特的性质在生物医学领域得到了广泛的应用。rees通常被掺杂到宿主材料中,表现不同颜色的荧光以用于生物成像和示踪。此外,基于rees的纳米材料近年来已被开发用于光遗传学,包括激活神经元触发大脑记忆,哺乳动物近红外视觉成像以及精确免疫治疗调节等。由于稀土元素在生物医学领域的广泛应用,其生物安全性受到越来越多的关注。值得注意的是,骨组织和肝脏组织已被证实为rees的主要靶点,由于rees在肝脏内代谢迅速,因此对肝脏的毒性通常较低。随着时间的推移,rees最终会在骨组织中积累并重新分布,半衰期可长达数年,这主要是由于稀土元素与骨组织中钙离子的半径相似有关。然而,目前rees对骨组织和主要器官的长期影响却鲜有详细报道,这使得人们对其体内应用的生物安全性缺乏足够的信心。因此,基于合适的模型以模拟rees在骨组织中的富集状态来准确评估稀土元素对骨骼和体内主要器官的影响尤为重要。
4.铽(terbium,tb)是一种典型的rees,由于良好的生物活性和荧光特性,在成像和体内示踪等方面研究广泛。然而,tb主要应用形式是掺杂,因此难以短期内有效模拟rees在骨组织中高浓度富集的情况。同时由于宿主材料其他组分的干扰,也难以准确评估rees自身在骨组织中的长期影响。例如,羟基磷灰石中tb与ca的掺杂摩尔浓度通常低于10%。同时,根据我们之前的研究,掺杂后羟基磷灰石的结晶度和降解行为也发生了变化,降解产物同样也会干扰tb对骨组织的作用。另外一项研究表明,tb以tbcl3的形式作用促进了间充质干细胞(mesenchymal stem cells,mscs)的粘附和成骨分化。然而,tbcl3是水溶性的,并不适合作为体内研究tb生物效应的模型。因此,构建合适的模型以模拟tb在骨组织中的富集状态以及减低甚至排除其他组分的干扰,是目前准确探究tb生物效用的研究难点和重点。
技术实现要素:
5.为了克服上述技术问题,本发明提供一种自组装铽-半胱氨酸纳米颗粒(tb-cys nps)及其制备方法和应用。本发明以tb-cys nps为模型,评估tb对骨组织的潜在影响及其在体内的长期安全性。结果证实tb-cys nps具有较高的细胞相容性,可通过补体/凝血级联和细胞周期信号通路分别促进bmscs的成骨和血管分化,同时,排除了cys对细胞行为的影响。重要的是,tb-cys nps促进骨生成和血管生成,并诱导体内高效的骨修复。因此,tb-cys nps不仅可以作为tb生物安全性评估的合适模型,同时可作为一种调节因子,在促进高效骨
修复方面具有很大的潜力。基于上述研究成果,从而完成本发明。
6.为实现上述技术目的,本发明采用的技术方案如下:
7.本发明的第一个方面,提供一种自组装铽-半胱氨酸纳米颗粒的制备方法,所述制备方法包括:将铽盐溶液加入含半胱氨酸的碱性溶液中进行搅拌即得。
8.本发明的第二个方面,提供上述方法制备得到的自组装铽-半胱氨酸纳米颗粒。经检测,采用上述方法制备得到的自组装铽-半胱氨酸纳米颗粒,其尺寸相对均匀,约为100nm。与tb配位后,cys的-sh官能团的峰几乎消失,表明-sh基团参与了cys与tb的反应。同时,自组装铽-半胱氨酸纳米颗粒具有典型的tb
3+
激发光谱和发射光谱,在488nm光激发下,tb-cys nps可以发出主要为543nm波长的绿色荧光。
9.本发明的第三个方面,提供上述自组装铽-半胱氨酸纳米颗粒在如下任意一种或多种的应用:
10.a)评估铽在富集状态下对骨组织的影响或制备评估铽在富集状态下对骨组织的影响的产品;
11.b)评估铽的生物安全性或制备评估铽的生物安全性的产品;
12.c)促进骨修复或制备促进骨修复的产品。
13.所述应用b)中,评估铽的生物安全性包括评估铽在生物体内的短期安全性和长期安全性。
14.所述应用c)中,促进骨修复具体表现包括:
15.c1)促进骨髓间充质干细胞(bone mesenchymal stem cells,bmscs)增殖;
16.c2)促进骨髓间充质干细胞成骨分化;
17.c3)促进骨髓间充质干细胞成血管分化。
18.所述产品可以是药物或检测试剂,所述检测试剂可供基础研究使用。
19.上述一个或多个技术方案的有益技术效果在于:
20.上述技术方案提供设计并制备了具有高细胞相容性的自组装tb-cys nps模型以合理准确评估tb
3+
在富集状态下对骨组织的影响。细胞实验证明了适当浓度的tb-cys nps可以促进bmscs成骨和成血管分化,并且排除了cys对生物学效应的干扰;体内实验证实了tb-cys nps能够有效促进骨组织修复,同时tb在体内长期生物安全性较高,对主要脏器无明显损伤。
21.上述技术方案不仅证明tb的生物安全性以及对骨组织的修复能力,同时以金属-氨基酸组装的形式为合理评价其他rees的长期生物安全性和对组织的影响提供了一种合适的参考模型,因此具有良好的实际应用之价值。
附图说明
22.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
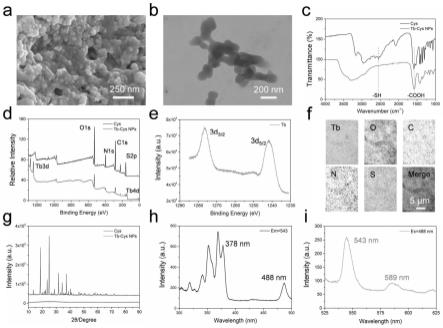
23.图1为本发明实施例中tb-cys nps表征图;(a)tb-cys nps的sem图;(b)tb-cys nps的tem图;(c)tb-cys nps和cys的ft-ir光谱图;(d)tb-cys nps和cys的xps能谱;(e)tb的xps高分辨率能谱;(f)tb-cys nps的eds元素分布图;(g)tb-cys nps和cys的xrd图谱;(h)tb-cys nps的激发光谱;(i)tb-cys nps的发射光谱。
24.图2为本发明实施例中tb-cys nps的细胞相容性评价;(a)bmscs在不同浓度tb-cys nps培养基中共培养24h后的活/死细胞染色。(b)bmscs在不同浓度tb-cys nps培养基中共培养24、48和72h后的cck8检测结果。(c-f)tb-cys nps进入细胞内的荧光图像。数据以均数
±
标准差表示,n=3。
**
p《0.01,
***
p《0.001,
****
p《0.0001;
25.图3为本发明实施例中3tb-cys nps对bmscs成骨分化的影响;(a)alp染色实验;(b)茜素红s染色实验;(c)alp活性测定;(d)定量检测钙离子相对含量;(e-h)rt-qpcr分析培养7和14d后alp(e)、runx-2(f)、bsp(g)和ocn(h)的相对mrna水平。数据以均数
±
标准差表示,n=3。
*
p《0.05,
**
p《0.01,
***
p《0.001,
****
p《0.0001;
26.图4为本发明实施例中4tb-cys nps对bmscs血管生成分化的影响;(a)不同培养基培养的bmscs小管形成实验的代表性图像;(b)对形成的小管的网格数、节点数、段数和总管长进行定量分析。(c)rt-qpcr分析培养3d和7d后angpt-1、vegf、hif-1和hgf的相对mrna水平。数据以均数
±
标准差表示,n=3。
*
p《0.05,
**
p《0.01,
***
p《0.001,
****
p《0.0001;
27.图5为本发明实施例中5bmscs在不同浓度的cys中的成骨和血管分化;(a)rt-qpcr分析培养7和14d后alp,runx-2,bsp,ocn的相对mrna水平。(b)rt-qpcr分析培养3d和7d后angpt-1,vegf,hif-1,hgf的相对mrna水平。数据以均数
±
标准差表示,n=3。
*
p《0.05,
***
p《0.001,
****
p《0.0001;
28.图6为本发明实施例中tb-cys nps促进bmscs成骨分化机制;(a)对照组和tb-cys nps组在成骨方面的差异基因的数量;(b)对照组和tb-cys nps组之间差异表达的成骨基因的go功能分类图;(c)对照组和tb-cys nps组差异表达的成骨相关基因的kegg通路富集分析图,显示了20个最显著富集的通路;(d)聚类热图显示补体和凝血级联信号通路的相对mrna表达;
29.图7为本发明实施例中tb-cys nps促进bmscs成血管分化机制;(a)对照组和tb-cys nps组在成血管方面的差异基因的数量;(b)对照组和tb-cys nps组之间差异表达的成血管基因的go功能分类图;(c)对照组和tb-cys nps组差异表达的成血管相关基因的kegg通路富集分析图,显示了20个最显著富集的通路;(d)聚类热图显示细胞周期信号通路的相对mrna表达;
30.图8为本发明实施例中tb-cys nps体内长期安全性评价;(a,b)大鼠器官(a)和血清(b)中的tb浓度。(c)各组大鼠心、肝、脾、肺、肾、缺损周围肌肉和皮肤组织的h&e染色。数据以均数
±
标准差表示,n=3。
*
p《0.05,
**
p《0.01,
***
p《0.001,
****
p《0.0001;
31.图9为本发明实施例中骨再生能力的micro-ct分析;(a,b)术后1、2、4和8w股骨缺损重建micro-ct图像,浅灰色代表股骨的修复区域,黑色矩形表示从前向后看缺陷的位置,虚线矩形表示从下向上看缺损的位置;(c)术后1、2、4和8wbv/tv,tb.n,tb.th和tb.sp的micro-ct定量分析图像。数据以均数
±
标准差表示,n=3。
*
p《0.05,
**
p《0.01,
***
p《0.001,
****
p《0.0001;
32.图10为本发明实施例中tb-cys nps成骨-成血管潜能的体内研究;(a)术后1、2、4、8w股骨缺损的h&e染色;(b)术后1、2、4、8wcol-i(棕色)免疫组化染色。(c,d)术后1、2、4wcd31(c)和α-sma(d)免疫组化染色;(e)col-i表达量的定量分析;(f)cd31表达量的定量分析;(g)α-sma表达量的定量分析。数据以均数
±
标准差表示,n=3。标尺=20μm,
***
p《0.001,
****
p《0.0001;
33.图11为本发明实施例中股骨缺损h&e染色术后1、2、4、8w对股骨缺损进行h&e染色。黑色实线矩形框为缺陷区域,虚线矩形框为(图3-10a)放大部分。n=3,比例尺=200μm。
具体实施方式
34.应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
35.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
36.如前所述,构建合适的模型以模拟tb在骨组织中的富集状态以及减低甚至排除其他组分的干扰,是目前准确探究tb生物效用的研究难点和重点。
37.有鉴于此,本发明的一个典型具体实施方式中,提供一种自组装铽-半胱氨酸纳米颗粒的制备方法,所述制备方法包括:将铽盐溶液加入含半胱氨酸的碱性溶液中进行搅拌即得。
38.本发明的又一具体实施方式中,铽盐与半胱氨酸的摩尔比为0.1~10:1,进一步为0.5~5:1,优选为1:1;通过控制铽盐与半胱氨酸的摩尔比,从而有利于后续铽-半胱氨酸纳米颗粒自组装的完成。
39.所述铽盐可以是任意一种溶于水的铽盐,在本发明的一个具体实施方式中,所述铽盐为硝酸铽(tb(no3)3·
5h2o);更具体的,硝酸铽水溶液中硝酸铽浓度为0.1-0.5mmol/ml,优选为0.2mmol/ml;
40.所述含半胱氨酸的碱性溶液为含半胱氨酸的naoh溶液,更具体的,所述含半胱氨酸的naoh溶液中半胱氨酸浓度为0.05-0.5mmol/ml,优选为0.1mmol/ml;naoh浓度为0.1-0.5mmol/ml,优选为0.2mmol/ml;
41.本发明的又一具体实施方式中,所述含半胱氨酸的naoh溶液采用如下方法制得:将naoh和半胱氨酸各自溶于水中后混合搅拌均匀即得。
42.所述制备方法还包括:将所得产物进行离心,洗涤。
43.本发明的又一具体实施方式中,提供上述方法制备得到的自组装铽-半胱氨酸纳米颗粒。经检测,采用上述方法制备得到的自组装铽-半胱氨酸纳米颗粒,其尺寸相对均匀,约为100nm。与tb配位后,cys的-sh官能团的峰几乎消失,表明-sh基团参与了cys与tb的反应。同时,自组装铽-半胱氨酸纳米颗粒具有典型的tb
3+
激发光谱和发射光谱,在488nm光激发下,tb-cys nps可以发出主要为543nm波长的绿色荧光。
44.本发明的又一具体实施方式中,提供上述自组装铽-半胱氨酸纳米颗粒在如下任意一种或多种的应用:
45.a)评估铽在富集状态下对骨组织的影响或制备评估铽在富集状态下对骨组织的影响的产品;
46.b)评估铽的生物安全性或制备评估铽的生物安全性的产品;
47.c)促进骨修复或制备促进骨修复的产品。
48.所述应用b)中,评估铽的生物安全性包括评估铽在生物体内的短期安全性和长期安全性。
49.所述应用c)中,促进骨修复具体表现包括:
50.c1)促进骨髓间充质干细胞(bone mesenchymal stem cells,bmscs)增殖;
51.c2)促进骨髓间充质干细胞成骨分化;
52.c3)促进骨髓间充质干细胞成血管分化。
53.更具体的,所述促进骨髓间充质干细胞成骨分化具体表现包括:促进碱性磷酸酶(alkaline phosphatase,alp)以及成骨相关基因alp、runt相关转录因子2(runt-related transcription factor 2,runx-2)、骨涎蛋白(bone sialoprotein,bsp)和骨钙素(osteocalcin,ocn)的表达;
54.所述促进骨髓间充质干细胞成血管分化具体表现包括:促进血管相关基因血管生成素-1(angiopoietin-1,angpt-1)、血管内皮生长因子(vascular endothelial growth factor,vegf)、缺氧诱导因子1(hypoxia inducible factor 1,hif-1)和肝细胞生长因子(hepatocyte growth factor,hgf)的表达。
55.其中,所述产品可以是药物或检测试剂,所述检测试剂可供基础研究使用。
56.所述产品施用对象可以是人和非人动物,如哺乳动物,包括但不限于小鼠、大鼠、豚鼠、兔、狗、猴、猩猩等。
57.当所述产品为药物时,所述药物还可以包括所述药物还包括至少一种药物非活性成分。
58.所述药物非活性成分可以是药学上通常使用的载体、赋形剂及稀释剂等。而且,根据通常的方法,可以制作成粉剂、颗粒剂、片剂、胶囊剂、混悬剂、乳剂、糖浆剂、喷雾剂等的口服剂、外用剂、栓剂及无菌注射溶液形式的剂型使用。
59.所述可以包含的载体、赋形剂及稀释剂等非药物活性成分在领域内是熟知的,本领域普通技术人员能够确定其符合临床标准。
60.本发明的又一具体实施方式中,所述载体、赋形剂及稀释剂包括但不限于有乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石粉、硬脂酸镁和矿物油等。
61.本发明的又一具体实施方式中,本发明的药物可通过已知的方式施用至体内。例如通过口服、静脉全身递送或者局部注射递送到感兴趣组织中。可选地经由静脉内、经皮、鼻内、粘膜或其他递送方法进行施用。这样的施用可以经由单剂量或多剂量来进行。本领域技术人员理解的是,本发明中有待施用的实际剂量可以在很大程度上取决于多种因素而变化,如靶细胞、生物类型或其组织、待治疗受试者的一般状况、给药途径、给药方式等等。
62.以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中为注明具体条件的试验方法,通常按照常规条件进行。
63.实施例
64.1.材料与方法
65.1.1实验动物
66.4w龄的wistar雄性大鼠4只,体重80-120g;8w龄的wistar雄性大鼠24只,体重200~250g,购于北京斯贝福生物技术有限公司。
67.1.2实验步骤和方法
68.1.2.1 tb-cys nps的合成与性质表征
69.1.2.1.1 tb-cys nps的合成
70.将2mmol的naoh和1mmol的cys各溶于5ml去离子水中,待其完全溶解后混合,并搅拌均匀,然后将tb(no3)3·
5h2o(5ml,1mmol)水溶液滴加至naoh和cys的混合溶液中,搅拌5min,形成tb-cys nps。反应结束后,将沉淀进行离心收集(8000rpm,5min),然后用去离子水和无水乙醇先后洗涤三次,将洗涤完成的tb-cys nps保存在无水乙醇中,放置于4℃环境中,以备后续实验使用。
71.1.2.1.2 tb-cys nps的性质表征
72.通过sem和tem观察了tb-cys nps和cys的形貌。ft-ir在thermo nexus 670光谱仪上得到。通过x射线光电子能谱仪测定了元素种类和价态谱。采用能谱仪对tb-cys nps进行了元素分布分析。利用bruker d8粉末衍射仪记录了tb-cys nps和cys的xrd谱图。采用fls测定tb-cys nps的激发光谱和发射光谱。
73.1.2.2 tb-cys nps的生物相容性、成骨分化能力、成血管分化能力及成骨-成血管分化机制的体外研究
74.1.2.2.1 tb-cys nps的生物相容性评价
75.活死细胞染色:大鼠bmscs在含不同浓度tb-cys nps(0、25、50、100和200μg/ml)的α-mem(含1%抗生素,10%fbs)培养基中以2
×
105个细胞/孔的密度进行培养,在6孔板上培养24h后,吸弃旧培养液,用pbs冲洗孔板三次,配好染色工作液。将配好地染液加入6孔板中,将6孔板置于37℃恒温箱中避光孵育20min,取出孔板,弃去染液,加入pbs轻柔地冲洗细胞2-3次,弃去冲洗液,加入适量pbs防止细胞干燥,于荧光显微镜下观察,随机选取3个非重叠视野拍照。每组独立进行3次实验。
76.cck8法检测bmscs的增殖情况:bmscs在含不同浓度tb-cys nps(0、25、50、100和200μg/ml)的α-mem(含1%抗生素,10%fbs)培养基中以5000个细胞/孔的密度进行培养,在96孔板上分别培养1、2、3d后,用pbs轻柔冲洗,每孔分别加入20μlcck8液和180μlα-mem,在37℃下避光孵育2h后,在450nm波长下,使用酶标分析仪避光检测光密度(optical density,od)值,graphpad prism 6.0软件进行统计分析并绘制统计图。每组独立进行3次实验。
77.tb-cys nps的细胞成像:bmscs在含1%抗生素,10%fbs的α-mem培养基中以2
×
105个细胞/孔的密度进行培养,在6孔板上培养24h后,然后用含50μg/ml tb-cys nps的新α-mem培养基更换培养基,培养6h后,用pbs洗涤3次,然后将所有样品在488nm波长的共聚焦激光扫描显微镜进下行观察,随机选取3个非重叠视野拍照。每组独立进行3次实验。
78.1.2.2.2 tb-cys nps成骨分化的检测
79.细胞的接种:bmscs在含不同浓度tb-cys nps(0、25、50、100和200μg/ml)以及含有不同浓度cys(0和50μg/ml最佳浓度)的α-mem(含1%抗生素,10%fbs)培养基中以2
×
105个
细胞/孔的密度分别进行成骨诱导,在6孔板上培养7和14d,之后用trizol(ag)试剂处理bmscs。
80.alp染色和活性定量分析:成骨诱导至第7d进行alp染色和活性测定。alp染色,光镜下观察,随机选取3个非重叠视野拍照。alp活性测定:在第3和第7d采集细胞培养液,1000rpm离心5min后取上清,按alp活性测定试剂盒说明书加入alp工作液,酶联免疫分光光度仪上测定520nm波长处的od值,根据说明书提供的公式计算出各组细胞的alp活性,graphpad prism 6.0软件进行统计分析并绘制统计图。每组独立进行3次实验。
81.茜素红s染色和钙结节定量分析:成骨诱导至第14d进行茜素红s染色和钙离子相对含量测定。每组独立进行3次实验。
82.使用rt-qpcr对成骨相关标志物基因表达水平进行检测。
83.1.2.2.3 tb-cys nps成血管分化的检测
84.细胞的接种:bmscs在含不同浓度tb-cys nps(0、25、50、100和200μg/ml)以及含有不同浓度cys(0和50μg/ml最佳浓度)的α-mem(含1%抗生素,10%fbs)培养基中以2
×
105个细胞/孔密度分别培养,在6孔板上培养3和7d,之后用trizol(ag)试剂处理bmscs。
85.小管形成实验和定量分析:将基质胶放置于在4℃环境下过夜解冻,预冷48孔板,每孔内加入基质胶100μl,37℃放置30min。在此过程中0.25%胰蛋白酶消化并收集细胞。然后,将细胞(5
×
104细胞/孔)在37℃下接种到涂有基质胶涂层的48孔板上6h,在光学显微镜下观察细胞的成管能力。使用image j 6.0分析各组的网格数、节点数、段数和总管长的结果。每组独立进行3次实验。
86.rt-qpcr对相关成血管标志物基因表达水平的检测:除了成血管诱导至3、7d检测bmscs向成血管方向分化的基因为:angpt-1,vegf,hif-1,hgf外,其余步骤与“rt-qpcr对相关成骨标志物基因表达水平的检测”一致。每组独立进行3次实验。
87.1.2.2.4 tb-cys nps成骨-成血管分化的机制研究
88.细胞的培养:bmscs在含不同浓度tb-cys nps(0和50μg/ml)的α-mem(含1%抗生素,10%fbs)培养基中以2
×
105个细胞/孔的密度培养,在6孔板上进行成血管诱导7d,成骨诱导14d,之后用trizol(ag)试剂处理bmscs。
89.tb-cys nps促进成骨成血管机制基因测序及分析:rna测序由武汉华大基因研究所完成。采用deseq2(v1.4.5)进行差异基因的表达分析,q≤0.05;为了深入了解表型的变化,在超几何检验的基础上,利用phyper对差异基因进行go功能分类和kegg富集分析。在严格的q≤0.05基础上,采用bonferroni校正方法对功能条目和通路的显著性水平进行校正。用pheatmap(v1.0.12)对不同通路的差异基因进行聚类分析。
90.1.2.3体内实验进一步评估tb-cys nps长期安全性及促进成骨-成血管分化潜能
91.1.2.3.1糊状tb-cys nps的制备
92.将制备好的tb-cys nps悬浊液于4℃,5000rpm高速离心机中离心3min,沉淀物放于冻干机中进行冻干,材料现配现用,冻干后的粉末放于无菌生物安全柜中紫外线照射30min,用生理盐水将tb-cys nps粉末调制成糊状。
93.1.2.3.2大鼠股骨双侧缺损模型的建立
94.术前准备:实验用8w龄健康雄性wistar大鼠24只,购于北京斯贝福生物技术有限公司,术前8h禁止进食和饮水。术前用紫外线灯照射手术室30min将术中需要用到的大鼠固
定板、慢速涡轮机、小动物麻醉机等实验用品进行灭菌。术中需用到的手套、骨膜剥离器、刀柄、剪刀、眼科颞、持针器、血管钳、纱布、棉球、铺巾及材料等用品使用高压蒸汽消毒灭菌。
95.大鼠股骨双侧缺损模型的制备:
96.(1)麻醉:使用小动物麻醉使大鼠机持续吸入异氟烷而麻醉。
97.(2)备皮:将已经麻醉好的wistar大鼠固定在大鼠固定板上,对双侧股骨区域进行备皮后,用碘伏消毒,生理盐水脱碘伏,铺洞巾。
98.(3)手术切口:以大鼠膝关节为中点,沿中线纵向切开约2cm的皮肤切口,用骨膜剥离器将肌肉组织钝性分离,并向两侧翻开以暴露股骨远心端表面。
99.(4)制备股骨缺损:使用生理盐水连续冲洗,用低转速涡轮机、外径为1mm的裂钻制备直径1mm深度4mm的圆柱形缺损,圆柱形缺损长轴方向与股骨长轴垂直。手术过程中及时用无菌纱布块吸干液体,时刻观察大鼠呼吸和心跳频率,及时调整麻醉剂用量,保证手术安全顺利进行。
100.(5)填充材料:实验组大鼠双侧放入tb-cysnps糊状制剂,阴性对照组大鼠双侧不放置。
101.(6)缝合:用生理盐水冲洗创面周围,并用无菌纱布块轻轻吸收多余渗出液,将组织瓣对位,轻轻挤压排净空气,将筋膜和皮下组织逐层对位缝合(图2-1所示)。
102.(7)术后:观察大鼠呼吸和心跳频率,待其正常苏醒后移入一般饲养笼,给予常规饮食,肌注青霉素钠。
103.术后处理:连续3d肌注青霉素钠,每日观察皮肤切口处愈合情况并使用碘伏消毒切口处皮肤,注意观察大鼠精神状态和饮食情况。
104.1.2.3.3标本收集
105.分别于术后1、2、4、8w取材。注射适量1%戊巴比妥钠溶液麻醉大鼠后,将大鼠以仰卧位固定在大鼠固定板上,寻找剑突,使用组织剪自剑突处打开胸腔,向上翻起胸骨和剑突,暴露心脏、肝脏,用注射器针头刺破心尖取血1ml/只,之后剪掉心脏放血,使血液快速流出大鼠体内,之后取大鼠心、肝、脾、肺、肾、缺损周围肌肉和皮肤组织,去除脂肪组织,当场称量,使所取组织的重量在10-20mg之间,记录准确重量,分别放入1.5ml ep管中并标记,放于-80℃冰箱冻存;取出剩余全部心、肝、脾、肺、肾,缺损周围部分肌肉和部分皮肤组织放入4%多聚甲醛固定液中48h进行外固定;取出大鼠双侧股骨放入4%多聚甲醛固定液中48h进行外固定。
106.1.2.3.4体内长期安全性评价
107.icp-ms:取对照组和实验组大鼠1、2、4、8w的心、肝、脾、肺、肾、缺损周围肌肉组织、皮肤和20μl血清(n=3),将组织块和血清分别放于玻璃瓶内,标记名称重量,加入1ml浓硝酸加热消化,至瓶中的硝酸完全挥发后再次加入1ml浓硝酸加热至完全挥发,之后用2%稀硝酸定容至10ml,进行icp-ms测定各主要脏器及血清中tb的浓度。
108.制备石蜡切片,h&e染色。
109.1.2.3.5 micro-ct分析股骨缺损区域的愈合情况
110.每组样品中随机选取三个,用micro-ct扫描仪对股骨标本进行360
°
三维扫描,工作电压90kv,电流88μa,高分辨率模式。然后,应用avatar软件进行三维重建,并使用ctan进行测量和分析。
111.1.2.3.6组织学分析股骨缺损区域的愈合情况
112.(1)脱钙:将固定完成的股骨样本放置于10%edta脱钙液液中进行脱钙,3天更换一次脱钙液,直到针头能够无阻力穿透样本。流水冲洗脱钙完成后的股骨标本4h,修剪去除标本上的多余组织。
113.(2)脱水包埋:将修剪好的样本放入脱水机中进行梯度酒精脱水。组织脱水完成后,用二甲苯进行透明使样本在阳光下呈现透明状态。之后将股骨样本放入融化的蜡池中浸蜡(蜡池i1h;蜡池ii 1h),待样本被蜡液完全浸透,将股骨标本前端向下放置于包埋盒中,迅速注入蜡液,放置于4℃,待蜡块完全冷却取出修整,标记蜡块,放于4℃保存。
114.(3)切片:用leica切片机对股骨缺损区矢状切面进行由前向后连续切片,自缺损边缘开始制备5mm厚的连续切片。甲苯胺蓝染色后在光学显微镜下观察,切至圆柱形缺损区域接近中心处开始连续留片,按顺序进行编号。用镊子夹起以45℃展片,待蜡片完全舒展后载玻片捞片,放于65℃烤片机上烤片2h,放于4℃环境下保存,以备后续染色使用。
115.h&e染色,免疫组织化学染色检测col-i,cd31和α-sma表达。
116.1.2.4数据分析
117.所有数据均显示为平均值
±
标准差(standard deviation,sd)。所有统计计算均采用graphpadprism 6.0软件进行分析,统计显著性分析采用单向或双向方差分析,然后采用tukey检验。显著性水平设为p《0.05。
118.2.实验结果
119.2.1 tb-cys nps的表征
120.通过sem和tem观察了tb-cys nps的形貌。tb-cys nps相对均匀,尺寸约为100nm(图1a和b)。为了研究与tb
3+
配位前后cys官能团的变化,我们对比了cys粉末和tb-cys nps的ft-ir图谱(图1c)。cys在2554cm-1
(-sh)和1583cm-1
(-cooh)处有典型峰。与tb配位后,cys的-sh官能团的峰几乎消失,表明-sh基团参与了cys与tb的反应。xps能谱(图1d)显示,在cys粉末和tb-cys nps中均出现o1s、n1s、c1s和s2p峰。如图3-1e显示,tb的峰仅出现在tb-cys nps的能谱中,并且结合能峰的位置(3d3/2~1276ev;3d5/2~1241ev)证明tb的价态为+3。与xps结果相似,eds能谱同样显示tb-cys nps中存在tb、o、c、n和s,且不同元素的分布一致(图1f),证明产物组分均一。cys的xrd图谱具有典型的衍射峰(图1g),然而与tb配合后,tb-cys nps呈现无定型结构。同时,对tb-cys nps的荧光特性进行了评价(图1h,i)。tb-cys nps具有典型的tb
3+
激发光谱和发射光谱,在488nm光激发下,tb-cys nps可以发出主要为543nm波长的绿色荧光。上述结果证明,通过自组装法成功制备了tb-cys nps。
121.2.2 tb-cys nps的生物相容性、成骨分化能力、成血管分化能力及成骨-成血管分化机制的体外研究
122.2.2.1 tb-cys nps的生物相容性评价
123.为了验证tb-cys nps对细胞活力的影响,将不同浓度的tb-cys nps与bmscs共培养不同时间。为了观察细胞状态,24h后进行活/死细胞染色,与对照组相似,tb-cys nps处理组各组活/死细胞数目无差别,细胞状态良好(图2a)。为了定量评估tb-cys nps的细胞相容性,使用cck8分析不同浓度、不同时间处理tb-cys nps后的细胞活力(图2b)。培养24、48、72h后,各个时间点内浓度为50μg/mltb-cys nps组中的bmscs活性最高,其次是25μg/ml与100μg/ml组。200μg/mltb-cys nps组中的细胞活性72h后受到轻微的抑制。此外,通过激光
共聚焦荧光显微镜观察tb-cys nps在488nm激发下的细胞成像,可以证明细胞能够有效摄取tb-cys nps。(图2c-f)。
124.2.2.2 tb-cys nps体外调控bmscs成骨分化潜能的评估
125.为了研究tb-cys nps对干细胞分化的作用,我们首先分析了不同浓度tb-cys nps对bmscs成骨分化的影响。alp作为一种典型的表型标志物,其活性可以反映成骨分化程度。50μg/ml tb-cys nps处理bmscs后,bmscs中alp的表达和活性最高(图3a和c)。当浓度超过50μg/ml时,tb-cys nps的促进能力逐渐下降,甚至出现抑制作用(200μg/ml)。同时,通过茜素红s染色观察钙矿化结节,以确定分化后的bmscs的功能。同样,50μg/ml tb-cys nps组出现大量钙结节,高浓度的tb-cys nps抑制了钙结节的形成(图3b和d)。为了在rna水平上进一步评估tb-cys nps对bmscs成骨分化的影响,我们使用rt-qpcr分析了几种典型标记物(图3e-h)。结果显示,无论是早期成骨基因alp和runx-2,还是晚期成骨基因bsp和ocn(除第7d为100μg/ml组表达最为显著外),均在50μg/ml tb-cys nps浓度组中表达最为显著,且特定时间点内各浓度组之间的表达趋势与alp染色及茜素红s染色结果基本一致。因此,50μg/ml浓度下的tb-cys nps具有最佳促进成骨的效果。
126.2.2.3 tb-cys nps体外调控bmscs成血管分化潜能的评估
127.在骨组织修复过程中,血液供应起着关键作用。因此,我们检测了不同浓度tb-cys nps处理bmscs后的小管形成情况和血管生成的典型基因标记物。不同组的bmscs在基质上形成了毛细血管样网络结构(图4a)。与与其他组相比,50μg/ml组的促成管作用最为明显。网格数、节点数、节段数和管柱总长度的分析结果也呈现出相同的趋势(图3-4b)。在bmscs与tb-cys nps共培养3和7d后,分析不同血管生成的典型基因标记物水平。与成骨分化不同的是,angpt-1,vegf,hif-1和hgf的表达随着tb-cys nps浓度的增加而增加(图3-4c),尽管我们目前的研究结果显示200μg/ml组具有较好的促进成血管分化的效果,但是综合小管形成实验的相关结果与促进成骨分化的结果,我们仍将50μg/ml浓度组视为促进成血管分化的最优浓度组。因此,tb-cys nps有利于bmscs在体外向成血管方向分化,是一种有效的血管生成调节剂。为了排除cys对评估tb调控的成骨-成血管分化的干扰,将bmscs与cys共培养,采用rt-qpcr检测成骨-成血管相关基因的表达水平。结果显示,cys几乎不影响成骨及成血管相关基因的表达(图3-5),从而确保cys不会干扰评估tb在体内对骨组织的长期作用及其应用的安全性。
128.2.2.4 tb-cys nps体外调控bmscs成骨-成血管分化机制的探究
129.适当浓度的tb-cys nps可促进bmscs成骨和血管分化。因此,探讨成骨分化和血管分化的机制具有重要意义。在bmscs成骨分化过程中,与对照组相比tb-cys nps组中差异表达的基因有2471个(
│
log2 fc
│
≥0,qvalue≤0.05)(差异倍数,flod change,fc),其中上调基因1063个,下调基因1408个(图6a)。基于以上分析,筛选出两组间存在显著差异的444个基因(
│
log2 fc
│
≥1,qvalue≤0.05)进行go功能分类分析,包括生物过程、细胞组分和分子功能。结果表明(图6b),按生物学过程分类,这些差异基因在细胞过程、生物调控和代谢过程中显著富集;按细胞组分分类,差异基因在细胞、细胞组成和细胞膜中显著富集;在分子功能分类中,差异基因主要参与结合功能。随后我们使用kegg富集分析来展示两组中差异基因的富集情况(图6c),结果表明,这些差异基因主要在补体和凝血级联通路、细胞粘附分子和破骨细胞分化信号通路中富集。其中,补体和凝血级联信号通路与成骨显著相关。因
此,我们主要研究了补体和凝血级联信号通路中差异基因的表达情况,图6d显示,有6个基因参与了补体和凝血级联信号通路,其中包括serpinf家族f成员2(serpin family f member 2,serpinf2)、补体c3a受体1(complement c3a receptor 1,c3ar1)、整合素亚基x(integrin subunit alpha x,itgax)、纤溶酶原激活物尿激酶(plasminogen activator urokinase,plau)、凝血因子xiii a1(coagulation factor xiii a1,f13a1)和补体c5a受体1(complement c5a receptor1,c5ar1)。在这些基因中,serpinf 2表达上调,其他基因表达下调。
130.在血管生成方面,如图7a所示,与对照组相比tb-cys nps组中差异表达的基因有1941个(
│
log2 fc
│
≥0,qvalue≤0.05),其中上调基因771个,下调基因1170个。基于以上分析,筛选出两组间存在显著差异的471个(
│
log2 fc
│
≥1,qvalue≤0.05)基因进行go功能分类分析,包括生物过程、细胞组分和分子功能。结果如图7b所示,按生物学过程分类,这些差异基因在细胞过程、生物调控和代谢过程中均显著富集;按细胞成分分类,差异基因在细胞、细胞组成和细胞器中显著富集;在分子功能分类中,差异基因主要参与结合功能。根据kegg结果显示(图7c),差异基因主要在细胞周期、卵母细胞减数分裂和核因子κ-b(nuclear factor-kappa b,nf-κb)信号通路中显著富集,其中细胞周期信号通路与血管生成密切相关。为了进一步研究细胞周期信号通路中血管生成相关基因的表达情况,我们绘制了细胞周期信号通路中相关基因的差异聚类热图(图7d)。在图7d中,6个基因参与了细胞周期信号通路,包括细胞周期蛋白依赖性激酶抑制剂2b(cyclin-dependent kinase inhibitor 2b,cdkn2b),细胞周期蛋白a2(cyclin a2,ccna2),细胞分裂周期素20(cell division cycle 20,cdc20),细胞分裂周期素6(cell division cycle 6,cdc 6),ttk和细胞分裂周期素45(cell division cycle 45,cdc45)。在这些基因中,cdkn2b表达上调,其他基因表达下调。
131.2.3体内实验进一步评估tb-cys nps长期安全性及促进成骨-成血管分化潜能
132.2.3.1体内长期安全性评价
133.尽管tb-cys nps在体外具有较高的细胞相容性,并在适当浓度下促进成骨和血管分化,但仍需要进一步的体内长期安全性评估。由于骨组织是tb或其他rees的主要靶器官之一,因此构建大鼠股骨缺损模型,以证实其在体内的长期生物安全性。tb-cys nps填充骨缺损后,采用icp-ms分析心、肝、脾、肺、肾等主要脏器tb含量变化(图8a)。与对照组相比,在第1w和第2w主要器官中的tb浓度非常高,这可能与tb-cys nps释放tb有关。但4w后主要脏器内tb水平明显下降,8w时与对照组基本持平。此外,我们还检测了血清中tb浓度的变化(图8b)。同样,虽然在第1w和第2w时血清中tb浓度增加,但在第8w时下降到正常水平。同时,在不同时间点对主要器官和组织进行h&e染色(图8c)。结果显示,从进入体内到完成代谢(1-8w),tb没有对重要器官和组织造成显著损害。
134.2.3.2 tb-cys nps促进骨修复的体内评估
135.采用micro-ct、组织学和免疫组化方法评价tb对体内骨再生的影响。micro-ct图像如图9a,b所示,在第1、2、4和8w,tb-cys nps组股骨缺损新成骨率高于对照组。根据三维图像,评估相关参数以定量和定性分析新形成骨的特征(图9c)。两组的骨体积/总体积的百分比(bone volume/total volume,bv/tv)和骨小梁数(trabecular number,tb.n)均随时间增加而增加,但tb-cys nps组在各时间点的bv/tv和tb.n的值均明显高于对照组,这与micro-ct图像一致,这说明tb-cys nps促进了更多的新骨形成。此外,骨小梁厚度
(trabecular thickness,tb.th)随时间的增加而增加,其中tb-cys nps组在第2、4w显著高于对照组。骨小梁分离(trabecular separation,tb.sp)随时间变化呈下降趋势,在第4、8wtb-cys nps组低于对照组。
136.为了进一步探讨tb-cys nps对体内骨修复的影响,我们通过h&e染色显示其组织学变化(图10a,图11)。术后1w,缺损区域几乎没有新骨形成,对照组缺损区纤维缺乏,而tb-cys nps组缺损区纤维丰富。2w后,tb-cys nps组新生骨数量明显多于对照组;4w后,虽然缺损区域几乎被新生骨填充,但tb-cys nps组新生皮质骨密度高于对照组;8w后,tb-cys nps组缺损区域的皮质骨和松质骨得到了很大程度的修复,新生骨的连续性优于对照组。
137.免疫组化染色进一步研究tb-cys nps对成骨和血管生成的影响。col-i的形成在骨再生和骨结构重建中起重要作用。col-i染色的od值随术后时间的延长而逐渐升高,在2、4和8w时间点tb-cys nps组(高表达)与对照组(低表达)之间的差异有统计学意义(图10b,e)。众所周知,充足的血液供应对骨组织再生是必不可少的。因此,我们评估了血管相关标志物cd31(血管内皮稳态的关键因子)、和α-sma(血管重塑的关键因子)的表达。术后cd31染色新生血管环面积随时间逐渐增大(图10c,f),在第2w和第4w,tb-cys nps组血管面积明显大于对照组。α-sma的表达趋势与cd31的表达变化趋势相似(图10d,g)。这些结果为tb-cys nps促进骨再生提供了更加充分的证据。
138.综上,本发明设计并制备了具有高细胞相容性的自组装tb-cys nps,作为评价tb生物安全性和骨修复能力的模型。tb-cys nps通过调节补体和凝血级联信号通路以及细胞周期信号通路,分别有效促进bmscs成骨和成血管分化。同时,cys对bmscs成骨和成血管分化几乎没有影响,从而排除了其对评估tb生物效应的干扰。tb-cys nps植入大鼠股骨缺损模型体内模拟tb在骨组织中的富集状态。结果表明其体内的长期生物安全性较高,对主要器官无明显损伤,并且8w后可通过机体代谢逐渐排出。此外,体内实验证实tb-cys nps可通过诱导缺损处的骨再生和新生血管重建从而促进骨修复。本研究通过金属-氨基酸自组装策略为合理评价rees的长期生物安全性和对组织的影响提供了一种合适的模型,并且证明了tb-cys nps可作为一种调节因子有效的促进骨缺损修复。
139.最后应该说明的是,以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。上述虽然对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1