一种(S)-1-(3-溴-2-甲氧基苯基)乙-1-醇的制备方法与流程
一种(s)-1-(3-溴-2-甲氧基苯基)乙-1-醇的制备方法
技术领域
1.本发明涉及手性药物中间体的制备方法,属于化学原料药中间体制备技术领域,具体涉及一种鲁索曲波帕关键中间体(s)-1-(3-溴-2-甲氧基苯基)乙-1-醇的制备方法。
背景技术:
2.(s)-1-(3-溴-2-甲氧基苯基)乙-1-醇是鲁索曲波帕((lusutrombopag)的一个关键中间体,结构式如下式1所示,鲁索曲波帕是日本盐野义(shionogi)公司研发的,商品名为mulpleta。结构式如式2所示。
[0003][0004]
2018年8月1日由日本盐野义(shionogi)公司研发的鲁索曲波帕(lusutrombopag)经美国fda批准上市,商品名为mulpleta。该药物主要供血小板低下的慢性肝病患者在手术前进行短期使用。mulpleta是一款口服的人类血小板生成素(tpo)受体激动剂,可上调血小板的产生,已于2015年9月获得日本厚生劳动省的批准,在选择进行侵入性手术的慢性肝脏疾病患者中用于改善患者的血小板减少症状。
[0005]
中国约有1360万慢性肝病成人患者,其中多数患者会接受选择性侵入性治疗。另一方面,由于患者在更高水平医疗护理中对于输血需求的不断增加,加之无偿献血的比例要低于欧洲、美国和日本,因此国内长期面临血液库存短缺的问题。另外,众所周知,采集的血液有较高的传播感染性疾病风险。在现在中国血液供应的大环境下,芦曲波帕在中国的上市,与输血小板相比,无疑是一种更优的选择。
[0006]
鲁索曲波帕目前主要合成路线,如图一所示,以(s)-1-(3-溴-2-甲氧基苯基)乙-1-醇(化合物1)为起始原料,经过一系列反应得到目标产物鲁索曲波帕(化合物2)。
[0007][0008]
而化合物1就成为了制备弗雷拉纳的关键中间体,化合物1的合成目前报道的只有以1-(3-溴-2-甲氧苯基)乙酮为原料,用(r)-2-甲基-cbs-恶唑硼烷为手性催化剂,硼烷四氢呋喃溶液为还原剂,有以下几种方法。
[0009]
路线一(cn106565625a,wo201550471),如图二所示,以3-溴-2-甲氧基苯甲酸(3)为起始原料,在氯化亚砜或者草酰氯的作用下,得到中间体3-溴-2-甲氧基苯甲酰氯(中间体4);3-溴-2-甲氧基苯甲酰氯(中间体4)和n,o-二甲基羟胺盐酸盐反应得到中间体3-溴-2,n-二甲氧基-n-甲基苯甲酰胺(中间体5);3-溴-2,n-二甲氧基-n-甲基苯甲酰胺(中间体5)再和甲基溴化镁反应得到中间体3-溴-2-甲氧基苯乙酮(中间体6),最后在手性硼烷试剂的催化下,对羰基进行不对称还原得到目标化合物(s)-1-(3-溴-2-甲氧基苯基)乙-1-醇(化合物1)。该方法中起始原料3-溴-2-甲氧基苯甲酸没有商业化生产,价格非常昂贵,另外最后一步手性羟基的形成,用r-cbs作为催化剂,价格较高,且还原后的光学选择性不高,难以达到客户要求。
[0010][0011]
路线二,edwin vedejs等人报道了一种制备中间体3-溴-2-甲氧基苯乙酮(化合物6)的方法(org lett.,vol.2,no.8,2000),如图三如所示,以2,6-二溴苯甲醚(化合物7)为起始原料,在正丁基锂的作用下和乙醛反应,得到中间体1-(3-溴-2-甲氧苯基)乙醇(中间体8);
[0012]
1-(3-溴-2-甲氧苯基)乙醇羟基物8经过swern氧化得到3-溴-2-甲氧基苯乙酮(化合物6)。该工艺用整体收率偏低,物料浪费严重,且用到正丁基锂,需要-78℃,不利于工业化放大生产。
[0013]
技术实现要素:
[0014]
本发明的目的在于克服现有技术的不足,提供一种易于工业化放大、成本低的(s)-1-(3-溴-2-甲氧基苯基)乙-1-醇的制备方法。
[0015]
本发明所采用的技术方案是:
[0016]
一种(s)-1-(3-溴-2-甲氧基苯基)乙-1-醇的制备方法,包括以下步骤:
[0017]
(1)2,6-二溴苯酚经甲基化得到2,6-二溴苯甲醚;
[0018]
(2)2,6-二溴苯甲醚经格氏反应得到3-溴-2-甲氧基苯乙酮或2,6-二溴苯甲醚经heck芳基化反应得到2-甲氧基苯乙酮;
[0019]
(3)2-甲氧基苯乙酮在手性催化剂的作用下,经不对称还原得到(s)-1-(3-溴-2-甲氧基苯基)乙-1-醇;
[0020]
合成路线如下所示:
[0021]
。
[0022]
优选的,步骤(1)的具体反应过程为:
[0023]
在氮气保护下,将2,6-二溴苯酚、甲基化试剂、碳酸钾和溶剂中加入到反应容器中,加热保持回流反应17-20小时,然后降温至室温,减压蒸馏,除去溶剂后将所得混合物倒入水中,用萃取剂萃取,有机相用饱用食盐水洗涤,有机相用无水硫酸钠干燥,减压除去溶剂,高真空蒸馏得2,6-二溴苯甲醚。
[0024]
优选的,步骤(1)中所使用的甲基化试剂为硫酸二甲酯、碘甲烷或重氮甲烷;
[0025]
步骤(1)中所使用的溶剂为丙酮、乙腈、四氢呋喃、2-甲基四氢呋喃、n,n-二甲基甲酰胺或1,4-二氧六环;
[0026]
步骤(1)中所使用的萃取剂为二氯甲烷;
[0027]
步骤(1)中2,6-二溴苯酚和甲基化试剂的摩尔比为1:1-1:4、2,6-二溴苯酚和碳酸钾的摩尔比为1:1-1:5、每克2,6-二溴苯酚所需要溶剂的量为5ml-20ml、混合物和水的体积比为1:1—1:3;水和萃取剂的体积比为1:0.2-1:1;
[0028]
步骤(1)中加热回流反应温度为25℃-100℃;
[0029]
步骤(1)中减压蒸馏的温度为92℃-94℃,真空度为2-5mmhg;
[0030]
步骤(1)中减压除去溶剂的温度为30℃-70℃,真空度为10mmhg-20mmhg。
[0031]
优选的,步骤(2)的具体反应过程为:
[0032]
(2)在氮气保护下,将溶剂、2,6-二溴苯甲醚和异丙基氯化镁的四氢呋喃溶液加入到反应容器中,保持温度0-5℃,搅拌4小时后升温到25℃,继续搅拌2小时,然后向反应体系中滴加n-甲氧基-n-甲基乙酰胺,保持温度不高于25℃,滴加结束后继续反应5小时,将反应液倒入氯化铵水溶液中,分液,用乙酸乙酯萃取水相,合并有机相,有机相用饱和食盐水洗涤,用无水硫酸钠干燥,减压除去溶剂,高真空蒸馏得3-溴-2-甲氧基苯乙酮。优选的,步骤(2)中2,6-二溴苯甲醚和异丙基氯化镁的摩尔比是1:1-1:3,每克2,6-二溴苯甲醚所需溶剂量为5-15ml,2,6-二溴苯甲醚与n-甲氧基-n-甲基乙酰胺的摩尔比是1:1-1:2,异丙基氯化镁的四氢呋喃溶液中异丙基氯化镁的浓度为2.0mol/l;
[0033]
步骤(2)中2,6-二溴苯甲醚和氯化铵水溶液的质量比为1:100-1:300,氯化铵水溶液与乙酸乙酯的体积比1:0.05-1:0.5,乙酸乙酯和饱和食盐水的体积比为1:0.1-1:1,氯化铵水溶液的质量浓度为5%-10%;
[0034]
步骤(2)中减压除去溶剂的真空度为10mmhg-20mmhg,温度为30℃-70℃;
[0035]
步骤(2)中高真空蒸馏的真空度为2-5mmhg,温度为95℃-100℃;
[0036]
步骤(2)中溶剂为四氢呋喃、2-甲基四氢呋喃或甲基叔丁基醚。
[0037]
优选的,步骤(2)的具体反应过程为:
[0038]
在氮气保护下,将溶剂、2,6-二溴苯甲醚、乙烯基正丁醚、膦配体、三乙胺和催化剂加入到反应器中,升温至度115℃,反应36小时,反应体系降至室温,然后向反应体系中加入稀盐酸,萃取剂萃取,有机相用饱和食盐水洗涤,用无水硫酸钠干燥,减压除去溶剂,高真空
蒸馏得中间体6。
[0039]
优选的,步骤(2)中2,6-二溴苯甲醚与乙烯正丁醚的摩尔比是1:1-1:3,2,6-二溴苯甲醚和膦配体的摩尔比是1:0.05-1:0.2,2,6-二溴苯甲醚与三乙胺的摩尔比是1:1-1:2;2,6-二溴苯甲醚与催化剂的摩尔比是1:0.01-1:0.1,每克2,6-二溴苯甲醚所需溶剂量为10ml-15ml;
[0040]
步骤(2)中稀盐酸的浓度为8%-15%,2,6-二溴苯甲醚和稀盐酸的质量比为1:20-1:60,稀盐酸与萃取剂的体积比为1:0.05-1:0.5,萃取剂与饱和食盐水的体积比为1:0.05-1:0.5;
[0041][0042]
步骤(2)中减压除去溶剂的温度为30℃-70℃,真空度为10mmhg-20mmhg;
[0043]
步骤(2)中高真空蒸馏的温度为95℃-100℃,真空度为2-5mmhg;
[0044]
步骤(2)中反应所用溶剂为dmso、dmf或1,4-二氧六环;
[0045]
步骤(2)中催化剂为醋酸钯或氯化钯;
[0046]
步骤(2)中的萃取剂为二氯甲烷;
[0047]
步骤(2)中膦配体为三苯基膦、1,2-双(二苯基膦)乙烷(dppe)、双二苯基膦甲烷(dppm)、1,3-双(二苯基膦)丙烷(dppp)、1,4-双(二苯基膦)丁烷(dppb)、1,1'-双(二苯基膦)二茂铁(dppf)、双(2-二苯基磷苯基)醚或1,1'-联萘-2,2'-双二苯膦(binap)。
[0048]
优选的,(3)的具体反应过程为:
[0049]
在氮气保护下,将溶剂、3-溴-2-甲氧基苯乙酮、碱和催化剂加入到加氢釜中,氮气置换两次,氢气置换两次,然后保持氢气压力,反应24小时,反应结束后,排除氢气,放出反应液,减压浓缩,脱除甲醇,剩余物用正庚烷和二氯甲烷的混合溶剂重结晶,抽滤干燥后得目标化合物1。
[0050]
优选的,步骤(3)中反应的温度为20℃-80℃;
[0051]
步骤(3)中氢气压力为10atm-100atm;
[0052]
步骤(3)中所用的溶剂为甲醇或乙醇;
[0053]
步骤(3)中所用的碱为叔丁醇钾及叔丁醇钠;
[0054]
步骤(3)中所用的催化剂为手性催化剂;
[0055]
步骤(3)中3-溴-2-甲氧基苯乙酮和手性催化剂的摩尔比为20000:1-500:1;
[0056]
步骤(3)中3-溴-2-甲氧基苯乙酮与碱的摩尔比是1:0.05-1:0.2,每克3-溴-2-甲氧基苯乙酮所需溶剂为10ml-15ml,3-溴-2-甲氧基苯乙酮与催化剂的摩尔比为1:0.00005-0.002;
[0057]
步骤(3)中减压浓缩的温度为30℃-70℃,真空度为10mmhg-20mmhg;
[0058]
步骤(3)中高真空蒸馏的温度为98℃-103℃,真空度为2-5mmhg。
[0059]
优选的,所述手性催化剂为rucl2{(r)-binap}{(r,r)-dpen}、rucl2{(r)-xylbinap}{(r,r)-dpen}、rucl2{(r)-binap}{(r,r)-daipen}或rucl2{(r)-xylbinap}{(r,r)-daipen}。
[0060]
本发明的室温为4-35℃。
[0061]
本发明的有益效果:
[0062]
本发明方法路线短,起始原料已商业化生产,便宜易得,不对称氢化的方法建立手
性中心,手性选择性较高,且绿色环保,整个工艺收率较高,易于工业化放大。
附图说明
[0063]
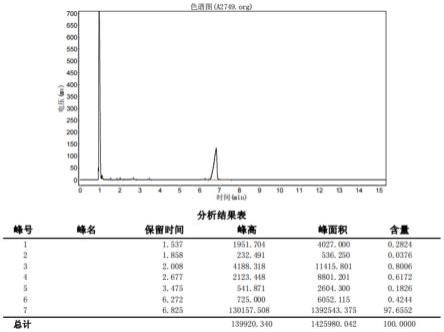
图1为本发明实施例1的gc纯度图谱;
[0064]
图2为本发明实施例2的gc纯度图谱;
[0065]
图3为本发明实施例3的gc纯度图谱;
[0066]
图4为本发明实施例4的gc纯度图谱;
[0067]
图5为本发明实施例5的gc纯度图谱;
[0068]
图6-1为本发明实施例6的gc纯度图谱;
[0069]
图6-2为本发明实施例6的hplc混旋图谱;
[0070]
图6-3为本发明实施例6的hplc手性图谱;
[0071]
图7-1为本发明实施例7的gc纯度图谱;
[0072]
图7-2为本发明实施例7的hplc手性图谱;
[0073]
图8-1为本发明实施例8的gc纯度图谱;
[0074]
图8-2为本发明实施例8的hplc手性图谱;
[0075]
图9-1为本发明实施例9的gc纯度图谱;
[0076]
图9-2为本发明实施例9的hplc手性图谱;
[0077]
图10-1为本发明实施例10的gc纯度图谱;
[0078]
图10-2为本发明实施例10的hplc手性图谱;
[0079]
图11-1为本发明实施例11的gc纯度图谱;
[0080]
图11-2为本发明实施例11的hplc手性图谱。
具体实施方式
[0081]
中间体2,6-二溴苯甲醚的制备
[0082]
实施例1
[0083]
如图1所示,在氮气保护下,将化合物9(25.0g,100mmol),碘甲烷(28.4g,200mmol)和碳酸钾(20.7g,150mmol)及200ml丙酮中加入到500ml四口瓶中,加热42℃保持回流反应18小时,然后降温至室温,35℃减压(15mmhg)脱除溶剂,除去丙酮后将所得混合物倒入120ml水中,用50ml二氯甲烷萃取,有机相用100ml饱和食盐水洗涤,有机相用无水硫酸钠干燥,35℃减压(15mmhg)脱除溶剂,高真空(2mmhg)蒸馏收集92℃-94℃馏分得中间体7(25.1g),纯度(gc)97.65%,收率95.08%。
[0084]
实施例2
[0085]
如图2所示,在氮气保护下,将化合物9(25.0g,100mmol),硫酸二甲酯(18.9g,150mmol)和碳酸钾(41.4g,300mmol)及300ml丙酮中加入到500ml四口瓶中,加热58℃保持回流反应18小时,然后降温至室温,35℃减压(15mmhg)脱除溶剂,除去丙酮后将所得混合物倒入120ml水中,用50ml二氯甲烷萃取,有机相用100ml饱和食盐水洗涤,有机相用无水硫酸钠干燥,35℃减压(15mmhg)脱除溶剂,高真空(2mmhg)蒸馏收集92℃-94℃馏分得中间体7(23.5g),纯度(gc)98.25%,收率89.02%。
[0086]
2-甲氧基苯乙酮的制备
[0087]
实施例3
[0088]
如图3所示,在氮气保护下,将四氢呋喃(240ml),中间体7(26.4g,100mmol)和异丙基氯化镁的四氢呋喃溶液(75ml,150mmol)加入到500ml四口瓶中,保持温度0-5℃,搅拌4小时后升温到25℃,继续搅拌2小时,然后向反应体系中滴加n-甲氧基-n-甲基乙酰胺(15.5g,150mmol),保持温度不高于25℃,滴加结束后继续反应5小时,将反应液倒入5l氯化铵水溶液中,分液,用500ml乙酸乙酯萃取水相,合并有机相,有机相用100ml饱和食盐水洗涤,用无水硫酸钠干燥,40℃减压(15mmhg)脱除溶剂,高真空(2mmhg)蒸馏收集95℃-98℃馏分得中间体6(18.5g),纯度(gc)98.56%,收率81.14%。
[0089]
实施例4
[0090]
如图4所示,在氮气保护下,将dmso(300ml),中间体7(26.4g,100mmol),乙烯基正丁醚(20.0g,200mmol)1,2-双(二苯基膦)乙烷(4.0g,10mmol),三乙胺(15.2g,150mmol)和醋酸钯(0.5g,2mmol)加入到500ml四口瓶中,升温至度115℃,反应36小时,反应体系降至室温,然后向反应体系中加入800ml稀盐酸,二氯甲烷200ml萃取,有机相用100ml饱和食盐水洗涤,用无水硫酸钠干燥,40℃-70℃减压(10mmhg)脱除溶剂,高真空(2mmhg)蒸馏收集95℃-98℃馏分得中间体6(19.2g),纯度(gc)98.43%,收率84.21%。
[0091]
实施例5
[0092]
如图5所示,在氮气保护下,将dmso(300ml),中间体7(26.4g,100mmol),乙烯基正丁醚(20.0g,200mmol)1,1'-联萘-2,2'-双二苯膦(6.2g,10mmol),三乙胺(15.2g,150mmol)和醋酸钯(0.5g,2mmol)加入到500ml四口瓶中,升温至度115℃,反应36小时,反应体系降至室温,然后向反应体系中加800ml入稀盐酸,200ml二氯甲烷萃取,有机相用100ml饱和食盐水洗涤,用无水硫酸钠干燥,40℃-70℃减压(10mmhg)脱除溶剂,高真空(2mmhg)蒸馏收集95℃-98℃馏分得中间体6(20.6g),纯度(gc)98.36%,收率90.35%。
[0093]
(s)-1-(3-溴-2-甲氧基苯基)乙-1-醇的制备
[0094]
实施例6
[0095]
如图6-1、6-2和6-3所示,在氮气保护下,将甲醇(300ml),中间体6(22.8g,100mmol),叔丁醇钾(1.1g,10mmol)及rucl2{(r)-binap}{(r,r)-dpen}(50.4mg,0.05mmol)加入到500ml加氢釜中,氮气置换两次,氢气置换两次,然后保持氢气压力为20atm,温度为35℃,反应24小时,反应结束后,排除氢气,放出反应液,40℃-45℃减压(20mmhg)脱除溶剂,高真空(2mmhg)蒸馏,收集98℃-101℃馏分得目标化合物1(19.48g),化学纯度(gc)98.93%,收率85.44%,光学纯度(hplc)93.44%。
[0096]
实施例7
[0097]
如图7-1和7-2所示,在氮气保护下,将乙醇(300ml),中间体6(22.8g,100mmol),叔丁醇钾(1.1g,10mmol)及rucl2{(r)-binap}{(r,r)-dpen}(50.4mg,0.05mmol)加入到500ml加氢釜中,氮气置换两次,氢气置换两次,然后保持氢气压力为20atm,温度为35℃,反应24小时,反应结束后,排除氢气,放出反应液,40℃-45℃减压(20mmhg)脱除溶剂,高真空(2mmhg)蒸馏,收集98℃-101℃馏分得目标化合物1(19.78g),化学纯度(gc)99.66%,收率86.00%,光学纯度(hplc)91.57%。
[0098]
实施例8
[0099]
如图8-1和8-2所示,在氮气保护下,将甲醇(300ml),中间体6(22.8g,100mmol),叔
丁醇钾(1.1g,10mmol)及rucl2{(r)-xylbinap}{(r,r)-dpen(59.9mg,0.05mmol)加入到500ml加氢釜中,氮气置换两次,氢气置换两次,然后保持氢气压力为20atm,温度为35℃,反应24小时,反应结束后,排除氢气,放出反应液,40℃-45℃减压(20mmhg)脱除溶剂,高真空(2mmhg)蒸馏,收集98℃-101℃馏分得目标化合物1(19.77g),化学纯度(gc)98.78%,收率85.96%,光学纯度(hplc)99.57%。
[0100]
实施例9
[0101]
如图9-1和9-2所示,在氮气保护下,将甲醇(300ml),中间体6(22.8g,100mmol),叔丁醇钾(1.1g,10mmol)及rucl2{(r)-xylbinap}{(r,r)-dpen(59.9mg,0.05mmol)加入到500ml加氢釜中,氮气置换两次,氢气置换两次,然后保持氢气压力为80atm,温度为25℃,反应24小时,反应结束后,排除氢气,放出反应液,40℃-45℃减压(20mmhg)脱除溶剂,高真空(2mmhg)蒸馏,收集98℃-101℃馏分得目标化合物1(19.83g),化学纯度(gc)99.38%,收率86.22%,光学纯度(hplc)90.76%。
[0102]
实施例10
[0103]
如图10-1和10-2所示,在氮气保护下,将甲醇(300ml),中间体6(22.8g,100mmol),叔丁醇钾(1.1g,10mmol)及rucl2{(r)-xylbinap}{(r,r)-daipen}(61.1mg,0.05mmol)加入到500ml加氢釜中,氮气置换两次,氢气置换两次,然后保持氢气压力为10atm,温度为35℃,反应24小时,反应结束后,排除氢气,放出反应液,40℃-45℃减压(20mmhg)脱除溶剂,高真空(2mmhg)蒸馏,收集98℃-101℃馏分得目标化合物1(19.53g),化学纯度(gc)98.82%,收率84.91%,光学纯度(hplc)99.77%。
[0104]
实施例11
[0105]
如图11-1和11-2所示,在氮气保护下,将甲醇(300ml),中间体6(22.8g,100mmol),叔丁醇钾(1.1g,10mmol)及rucl2{(r)-xylbinap}{(r,r)-daipen}(61.1mg,0.05mmol)加入到500ml加氢釜中,氮气置换两次,氢气置换两次,然后保持氢气压力为80atm,温度为25℃,反应24小时,反应结束后,排除氢气,放出反应液,40℃-45℃减压(20mmhg)脱除溶剂,高真空(2mmhg)蒸馏,收集98℃-101℃馏分得目标化合物1(20.23g),化学纯度(gc)98.87%,收率87.96%,光学纯度(hplc)99.27%。
[0106]
注:实施例1-11中化合物9为2,6-二溴苯酚;中间体7为2,6-二溴苯甲醚;中间体6为2-甲氧基苯乙酮;化合物1为(s)-1-(3-溴-2-甲氧基苯基)乙-1-醇。
[0107]
本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭示如上,然而并非用以限定本发明,任何本领域技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的技术内容做出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简介修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1