一种可以高效分泌木聚糖酶的工程菌株、构建方法与应用与流程
1.本发明属于基因工程技术领域,具体涉及一种可以高效分泌木聚糖酶的工程菌株、构建方法与应用。
背景技术:
2.木聚糖是半纤维素的主要组成部分,是仅次于纤维素的含量丰富的多糖。木聚糖酶是可以水解木聚糖生产低聚木糖或木糖的一类酶,主要包括外切-β-1,4-木聚糖酶、内切-β-1,4-木聚糖酶和β-木糖苷酶等。
3.嗜热纤维梭菌是目前自然界中已知的降解纤维素最高效的微生物之一,分泌的纤维小体具有极强的纤维素降解能力,降解纤维素的能力大约是木霉属的50倍。但在热纤梭菌的木质纤维素水解应用中,木质纤维素中的成分之一半纤维素的存在会增加植物细胞壁的结构强度和空间抗性,导致木质纤维素水解效率的降低。因此,构建可以高效表达木聚糖酶的热纤梭菌工程菌,以提高半纤维素水解效率,从而提高整个木质纤维素水解效率,是需要解决的问题。
技术实现要素:
4.为了克服上述现有技术的不足,本发明提供一种可以高效分泌木聚糖酶的工程菌株、构建方法与应用,通过高效表达热纤梭菌的木聚糖酶,增强了热纤梭菌工程菌的木聚糖酶酶活力,该工程菌株应用在半纤维素水解糖化中,可以显著提高秸秆纤维中半纤维素的水解率。
5.为了实现上述目的,本发明采用如下技术方案:本发明一方面提供了一种可以高效分泌木聚糖酶的工程菌株,该菌株携带有用于重组表达木聚糖酶的重组质粒。该菌株为将热纤梭菌中的木聚糖酶a xyna基因、木聚糖酶c xync基因和木聚糖酶y xyny基因过表达得到的热纤梭菌工程菌株。
6.所述热纤梭菌为野生型热纤梭菌,优选为热纤梭菌clostridium thermocellum pn2102,保藏日期为 2021年07月09日,保藏单位为中国普通微生物菌种保藏管理中心,保藏编号为cgmcc no.22869。
7.所述表达基因的核苷酸序列如seq id no:1所示。
8.本发明另一方面还提供了一种可以高效分泌木聚糖酶的热纤梭菌工程菌株的构建方法,在原始热纤梭菌中导入用于过表达木聚糖酶a xyna基因、木聚糖酶c xync基因和木聚糖酶y xyny基因的重组质粒。
9.优选的,通过在热纤梭菌基因组上增加木聚糖酶a xyna、木聚糖酶c xync和木聚糖酶y xyny的基因拷贝数同时加入强启动子的方法过表达木聚糖酶a xyna基因、木聚糖酶c xync基因和木聚糖酶y xyny基因。
10.优选的,在热纤梭菌基因组上l-乳酸脱氢酶基因的下游插入热纤梭菌的gapd启动子和木聚糖酶表达基因序列。插入的表达基因序列具有如seq id no.1所示的核苷酸序列。
11.作为进一步的优选方案,本发明的工程菌株的构建方法,具体包括如下步骤:(1)设计及构建木聚糖酶基因插入重组质粒puc-xyn;(2)电转化将重组质粒puc-xyn转入热纤梭菌,经过同源重组和抗性筛选将目的基因序列插入基因组;(3)挑选及验证阳性单克隆。
12.本发明另一方面还提供了一种可以高效分泌木聚糖酶的热纤梭菌工程菌株在半纤维素水解糖化中的应用,将热纤梭菌工程菌株厌氧发酵的发酵液复配纤维素酶对秸秆纤维进行水解。具体包括如下步骤:(1)木质纤维素的预处理:以常见农业秸秆为原料,通过物理、化学法中的一种或两种进行预处理;(2)热纤梭菌的厌氧发酵:将热纤梭菌工程菌进行种子液培养与发酵,得到发酵液;(3)纤维水解:将步骤(2)中所得发酵液复配纤维素酶(0-10 fpu)对步骤(1)处理得到的纤维进行水解。
13.作为进一步的优选方案,所述步骤(1)中,木质纤维素的预处理具体步骤为:将秸秆原料洗净切碎,在碱性条件下进行水热反应,充分脱除木质素后,提取秸秆纤维,脱水并充分洗去残留碱液;所述无机碱为氢氧化钠与亚硫酸钠;所述氢氧化钠重量:秸秆原料绝干重为1:(4-6),亚硫酸钠:氢氧化钠重量比为1:(3-5);处理条件为:反应温度为150-160℃,时间为1-3 h。
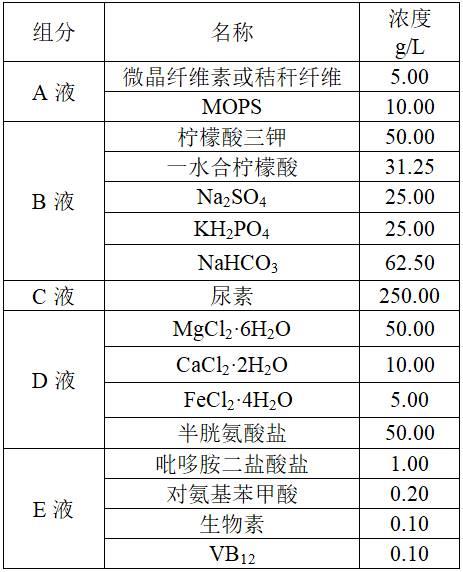
14.作为进一步的优选方案,所述步骤(2)中,培养基采用mtc培养基,该培养基分为abcde液五种,其中,a液为5 g/l碳源(微晶纤维素或秸秆纤维)与10.00 g/l mops;b液为50.00 g/l柠檬酸三钾、31.25 g/l一水合柠檬酸、25.00 g/l na2so4、25.00 g/l kh2po4、62.50 g/l nahco3;c液为250.00 g/l尿素、d液为50.00 g/l mgcl2·
6h2o、10.00 g/l cacl2·
2h2o、5.00 g/l fecl2·
4h2o、50.00 g/l半胱氨酸盐;e液为1.00 g/l吡哆胺二盐酸盐、0.20 g/l对氨基苯甲酸、0.10 g/l生物素、0.10 g/l vb12。a液配制结束后,121℃、20 min灭菌处理;b、c、d、e液按上述浓度配制完成,装于厌氧瓶中,加胶塞铝盖密封后反复抽真空充入高纯氮气3次,最后保持厌氧瓶内为正压。5种培养液按照40:2:1:1:1(v/v)在超净台内使用一次性无菌注射器和0.22 μm无菌滤膜注入已灭菌装有a液的厌氧瓶中,总体积不超过厌氧瓶体积的40%。
15.作为进一步优选的技术方案,所述步骤(2)中,种子液培养与发酵过程为:将从-80℃保藏的热纤梭菌工程菌菌种置于4℃冰箱解冻,无菌条件下吸取1 ml菌种注入种子培养基中,55℃、200 rpm条件下培养16-24 h;随后以5%-10%(v/v)的接种量接入发酵培养基中,55℃、200 rpm下培养16-24 h。其中种子培养基a液中的碳源为5.00 g/l微晶纤维素(avicel ph 105),发酵培养基中碳源为5.00 g/l的秸秆纤维(制备方法如步骤(1)所述)。
16.作为进一步优选的技术方案,所述步骤(3)中,纤维水解的具体步骤为:ph 4.5-5.5,固(秸秆纤维绝干重)液比1:(10-30),反应温度45-55℃,单位质量秸秆纤维投加上述热纤梭菌发酵液10-20 ml,纤维素酶0-10 fpu,水解时间12-48 h,搅拌速率为200 rpm。
17.本发明的有益效果为:(1)本发明提供了一种热纤梭菌工程菌,经过代谢改造,增强了木聚糖酶a xyna、木聚糖酶c xync和木聚糖酶y xyny的启动子表达,热纤梭菌可以高效表达木聚糖酶,从而
增强热纤梭菌的木聚糖酶酶活力。在相同酶解条件下,相比热纤梭菌出发菌株,半纤维素的水解效率可以提高50%。
18.(2)本发明提供的秸秆纤维的制备以及热纤梭菌水解半纤维素的方法,水解效率高,水解24 h时秸秆纤维中的木聚糖大部分已水解成木糖。该方法可工业化生产,具有很好的应用前景。
附图说明
19.图1为实施例1中热纤梭菌插入的基因序列结构示意图。
20.图2为实施例1中插入木聚糖酶基因的重组质粒puc-xyn图谱。
具体实施方式
21.为了使本发明的目的、技术方案和优点更加清楚,下面将结合实施例对本发明作进一步地详细描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
22.本发明的可以高效分泌木聚糖酶的工程菌株,是以野生型热纤梭菌为出发菌株,将热纤梭菌中的木聚糖酶a xyna基因、木聚糖酶c xync基因和木聚糖酶y xyny基因过表达得到的热纤梭菌工程菌株。
23.具体地,本发明的热纤梭菌工程菌株,是由野生型热纤梭菌经过基因改造,在热纤梭菌基因组上增加木聚糖酶a xyna、木聚糖酶c xync和木聚糖酶y xyny基因拷贝数和强启动子的工程菌株,该工程菌株包括序列表中seq id no.1所示的核苷酸序列。
24.所述野生型热纤梭菌分离自棉花堆、牛粪等,是一种嗜热、严格厌氧的革兰氏阳性细菌,杆状,表面菌落湿润,低突,生长温度在50-65℃,生长速度快。本发明优选为热纤梭菌clostridium thermocellum pn2102,保藏日期为 2021年07月09日,保藏单位为中国普通微生物菌种保藏管理中心,保藏编号cgmcc no.22869。
25.本发明另一方面还提供了一种可以高效分泌木聚糖酶的热纤梭菌工程菌株的构建方法,在热纤梭菌中导入用于重组表达木聚糖酶a xyna基因、木聚糖酶c xync基因和木聚糖酶y xyny基因的重组质粒。
26.通过在热纤梭菌基因组上增加木聚糖酶a xyna基因、木聚糖酶c xync基因和木聚糖酶y xyny基因的基因拷贝数同时加入强启动子的方法表达木聚糖酶a xyna基因、木聚糖酶c xync基因和木聚糖酶y xyny基因。
27.作为本发明的优选,所述强启动因子为热纤梭菌的gapd启动子。
28.作为本发明的优选,在热纤梭菌基因组上l-乳酸脱氢酶基因的下游插入热纤梭菌的gapd启动子和木聚糖酶表达基因序列。
29.所述表达基因的核苷酸序列如seq id no:1所示。
30.本发明另一方面还提供了一种可以高效分泌木聚糖酶的热纤梭菌工程菌株在半纤维素水解糖化中的应用,可将热纤梭菌工程菌株厌氧发酵的发酵液复配纤维素酶对秸秆纤维进行水解,单位质量秸秆纤维投加热纤梭菌发酵液10-20 ml,纤维素酶0-10 fpu。包括秸秆纤维制备、热纤梭菌种子液厌氧发酵和纤维水解的步骤。
31.为了更好的理解上述技术方案,下面将结合具体实施例对上述的技术方案进行详细的说明。实施例所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。实施例中的实验方法,如无特殊说明,均为常规方法。
32.本发明使用的ctfud培养基各组分及组成为(g/l):3.00二水柠檬酸钠、1.30 (nh4)2so4、1.50 kh2po4、0.13 cacl2•
2h2o、0.5 l-半胱氨酸盐酸盐、11.56 mops-na、2.60 mgcl2•
6h2o、0.001 feso4•
7h2o、5.00 avicel ph 105、4.50 ye,若配制固体培养基则加入10 g/l琼脂。
33.实施例1 热纤梭菌木聚糖酶高效表达工程菌的构建在热纤梭菌pn2102基因组上替换l-乳酸脱氢酶基因插入表达基因序列(seq id no:1所示)。利用电转化将重组质粒(puc-xyn)转入热纤梭菌pn2102,经过同源重组将目的基因(xyn a 、xyn c、xyn y)序列插入热纤梭菌pn2102基因组,插入基因序列结构的示意图如图1所示,插入的基因序列为序列表中seq id no.1所示的核苷酸序列。
34.具体方法步骤如下:(1)重组质粒puc-xyn的设计及构建木聚糖酶基因序列(xyn a、xyn c、xyn y)与gapd启动子皆来源于热纤梭菌,从文献中(application of long sequence reads to upgrade genomes for clostridium thermocellum ad2, clostridium thermocellum lqri, and pelosinus fermentans r7)获得热纤梭菌的木聚糖酶基因序列,genbank号为genbank: cp016502.1,通过南京金斯瑞生物科技有限公司合成。构建重组质粒的表达载体为ppn01模板质粒,可由市售购买或由基因设计公司合成后实验室保存。模板质粒包含gapdh启动子、甲砜霉素抗性基因、hpt基因、puc19起始区、tdk基因、复制蛋白和氨苄抗性基因。
35.1)pcr基因扩增以ppn01为模板质粒,在启动子(gapd启动子)前段插入l-乳酸脱氢酶ldh上游、木聚糖酶目的基因(xyn a 、xyn c、xyn y)、l-乳酸脱氢酶ldh下游基因重组片段,在hpt基因后端插入l-乳酸脱氢酶中游基因重组片段,得到重组质粒puc-xyn。用于基因插入质粒构建的l-乳酸脱氢酶基因的上、中、下游基因重组片段由下面三对引物加上20-25 bp模板质粒首尾连接片段经pcr获得。
36.上游引物1:tcttcctctgtcctggct,上游引物2:tgcaccaactacggttactttt;中游引物1:aaaaagccgacggagaag,中游引物2:ataccgtttacacccacga;下游引物1:agtccggaaacactctaaaa,下游引物2:gtataaagcccatgcctg。
37.pcr反应体系为:上、中、下游引物1 各0.4
ꢀµ
l,上、中、下游引物2 各0.4
ꢀµ
l,菌液或质粒1
ꢀµ
l,prime star 5
ꢀµ
l (效率10 s/kb),无菌水3.2
ꢀµ
l,其中各引物浓度均为10 μm。
38.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
39.2)模板质粒ppn01的线性化及载体片段回收:
将ppn01模板质粒线性化,使用的引物及pcr条件如下:引物1:cttactctagcagacttggcaatg,引物2:tccatctgtttcgtttgccctttcc。
40.pcr反应体系为:引物1用量 0.4
ꢀµ
l,引物2 用量0.4
ꢀµ
l,菌液或质粒用量1
ꢀµ
l,prime star 用量5
ꢀµ
l (效率10 s/kb),无菌水用量3.2
ꢀµ
l。其中各引物浓度均为10 μm。
41.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
42.将上、中、下游基因重组片段、木聚糖酶基因片段与线性化后的模板质粒ppn01用gibson assembly(三段重组片段30 ng、木聚糖酶基因片段60 ng、线性化后的模板质粒ppn01 30 ng,gibson assembly 5
ꢀµ
l,无菌水补足至10
ꢀµ
l,50℃保温1 h)连接,然后转入大肠杆菌感受态细胞bl21并在含氨苄的胶板上涂布,长出菌落后用下面一对引物做pcr筛选确认。
43.引物1:agcggtaaaagtgaagaac,引物2:tgggcccctactaaaatga。
44.pcr反应体系为:引物1 为0.4
ꢀµ
l,引物2 为0.4
ꢀµ
l,菌液或质粒1
ꢀµ
l,prime star 5
ꢀµ
l (效率10 s/kb),无菌水3.2
ꢀµ
l,其中各引物浓度均为10 μm。
45.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
46.将pcr扩增之后的反应液进行琼脂糖凝胶电泳实验(2%琼脂糖,110 v,30 min),阳性验证胶图条带大小为473 bp,说明puc-xyn重组质粒构建成功。
47.图2为插入木聚糖酶基因的重组质粒puc-xyn图谱,其中ldh上游为967 bp,ldh下游为948 bp,ldh中游为727bp。
48.(2)重组质粒puc-xyn的转入利用电转化将重组质粒puc-xyn转入热纤梭菌pn2102,经过同源重组和抗性筛选将目的基因序列在基因组上删除。其操作步骤如下:1)细胞生长将50 ml的菌液培养至od600=0.6-1后,将其置于冰上放置20分钟。
49.2)细胞收集与洗涤在6500 g、4℃条件下离心10分钟收集细胞,离心完成后小心倒掉上清液,再向离心管或离心瓶中小心加入洗涤缓冲液(经蒸汽灭菌过的反渗透纯化水),加的过程中不要搅动沉淀,然后再次在6500 g、4℃条件下离心10分钟,小心倒掉上清液,重复上述步骤两次。
50.3)电转化将收集到的细胞放进厌氧室中,用100 μl 厌氧的洗涤缓冲液将其轻轻重悬。随后在标准的 1 mm 电转杯中,加入 20 μl 细胞悬液和1 μg dna,充分混匀。设置电转条件为电压1500 v、持续时间1.5 ms 进行电转化。
51.4)孵育电转化细胞用1 ml ctfud培养基将电转后的热纤梭菌pn2102感受态细胞重新混合,在51℃下孵育16小时。
52.(3)阳性单克隆挑选及验证1)筛选转化细胞
ctfud 固体培养基融化并冷却至55℃,将6 mg/ml 的甲砜霉素1 ml与50 μl 孵育后的电转化细胞加入到20 ml ctfud 固体培养基中倒入平板,室温下让平板中的培养基凝固30分钟,随后将平板放置在55℃下培养3-5天。
53.2)挑选单克隆菌落,用下面一对引物做pcr验证质粒puc-xyn是否已经转入热纤梭菌pn2102感受态细胞。
54.引物1:agcggtaaaagtgaagaac;引物2:tgggcccctactaaaatga。
55.pcr反应体系为:引物1 为0.4
ꢀµ
l,引物2 为0.4
ꢀµ
l,菌液或质粒1
ꢀµ
l,prime star 5
ꢀµ
l (效率10 s/kb),无菌水3.2
ꢀµ
l,其中各引物浓度均为10 μm。
56.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
57.将pcr扩增产物进行跑胶验证(2%琼脂糖凝胶电泳,条件为110v,30min),阳性验证胶图条带大小为473 bp,证明重组质粒puc-xyn已经转入热纤梭菌感受态细胞。
58.把经过验证的单克隆细胞菌落接入含有甲砜霉素(6 mg/ml)的ctfud液体培养基在55℃培养1-2天。
59.3)取10 μl到1ml培养液加入到20 ml 含有甲砜霉素(6 mg/l)和fudr(10 mg/l)的ctfud固体培养基中倒入平板,室温下让平板中的培养基凝固30分钟,随后将平板放置在55℃下培养2-5天。
60.4)挑选单克隆菌落,用下面一对引物做pcr验证质粒puc-xyn中的ldh上游和ldh中游是否已重组到热纤梭菌pn2102基因组上。
61.引物1:tcttcctctgtcctggct;引物2:gtataaagcccatgcctg。
62.pcr反应体系为:引物1 为0.4
ꢀµ
l,引物2 为0.4
ꢀµ
l,菌液或质粒1
ꢀµ
l,prime star 5
ꢀµ
l (效率10 s/kb),无菌水3.2
ꢀµ
l,其中各引物浓度均为10 μm。
63.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
64.将pcr扩增产物进行2%琼脂糖凝胶电泳(110 v,30 min)实验。阳性验证胶图条带大小为13262 bp。说明ldh上游和ldh中游已重组到热纤梭菌pn2102基因组上。
65.把经过验证的单克隆细胞菌落加入到20 ml 含有8azh(500mg/l)的ctfud固体培养基中倒入平板,室温下让平板中的培养基凝固30分钟,随后将平板放置在55℃下培养2-5天。
66.5)挑选单克隆菌落,用下面一对引物做pcr验证重组热纤梭菌基因组上两个ldh下游是否已重组。
67.引物1:tcttcctctgtcctggct;引物2:gtataaagcccatgcctg。
68.pcr反应体系为:引物1 为0.4
ꢀµ
l,引物2 为0.4
ꢀµ
l,菌液或质粒1
ꢀµ
l,prime star 5
ꢀµ
l (效率10 s/kb),无菌水3.2
ꢀµ
l,其中各引物浓度均为10 μm。
69.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
70.将pcr扩增产物跑胶(2%琼脂糖凝胶电泳,110 v,30 min),阳性验证胶图条带大小为9684 bp。说明两个ldh下游已重组到热纤梭菌基因组上。
71.把经过验证的单克隆细胞菌落加入5 ml培养基培养1-2天后保存,得到重组热纤
梭菌工程菌。
72.实施例2 热纤梭菌工程菌的发酵培养(1)培养基的配制与除氧培养基采用mtc培养基,按照表1配制。a液配制结束后,121℃、20 min灭菌处理;b、c、d、e液按表配制完成,装于厌氧瓶中,加胶塞铝盖密封后反复抽真空充入高纯氮气3次,最后保持厌氧瓶内为正压。5种培养液按照40:2:1:1:1(v/v)在超净台内使用一次性无菌注射器和0.22 μm无菌滤膜注入已灭菌装有a液的厌氧瓶中,总体积不超过厌氧瓶体积的40%。其中,a液中的碳源(微晶纤维素或者秸秆纤维),种子培养基中使用微晶纤维素avicel ph105,浓度为5 g/l;发酵产酶时使用秸秆纤维,浓度为5 g/l。
73.表1 培养基配方(2)种子液的制备:将从-80℃保藏的热纤梭菌工程菌菌种置于4℃冰箱解冻,无菌条件下吸取1 ml注入种子培养基中,55℃、200 rpm条件下培养24 h;其中种子培养基的配方如表1所示,a液中的碳源为5.00 g/l的微晶纤维素(avicel ph 105)。
74.(3)发酵:将上述种子液以10%(v/v)的接种量接入发酵培养基中,55℃、200 rpm下培养16 h。发酵培养基的配方如表1所示,碳源为5.00 g/l的秸秆纤维,秸秆纤维可通过对
农业秸秆预处理提取得到,参见实施例3步骤(1)。
75.实施例3 热纤梭菌工程菌在半纤维素水解糖化中的应用(1)小麦秸秆纤维的制备:将小麦秸秆原料洗净切碎,采用氢氧化钠和亚硫酸钠进行处理,氢氧化钠重量:小麦秸秆原料绝干重为1:6,亚硫酸钠:氢氧化钠重量比为1:3,处理条件为:反应温度为150℃,时间为2 h。充分脱除木质素后,提取小麦秸秆纤维,脱水并充分洗去残留碱液;此法获得的秸秆纤维中,纤维素约占70%,半纤维素占15%,灰分与木质素占15%。
76.(2)小麦秸秆纤维的水解:将秸秆纤维浸泡在乙酸-乙酸钠(或同类具备缓冲效应的缓冲对)缓冲液中,投加热纤梭菌发酵液,进行秸秆纤维的水解。水解条件如下:ph 5,固液比1:10,单位质量秸秆纤维(每克秸秆纤维)的热纤梭菌发酵液投加量为20 ml、纤维素酶10 fpu,反应温度为50℃、反应时间24 h,震荡速率为200转/分钟。
77.水解结束时,水解液中的木糖浓度约为12.50 g/l,葡萄糖浓度为65.00 g/l。相同条件下,使用热纤梭菌野生菌株pn2102(即本发明菌株改造的出发菌株)发酵液进行水解时,水解24 h,木糖浓度约为8.10 g/l,葡萄糖浓度为56.00 g/l。
78.以上对本发明的实例进行了详细说明,但内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1