apoc1基因启动子及其应用和由其构建的动物模型和方法
1.本发明涉及神经细胞标记方法以及相关动物模型技术领域,具体涉及apoc1基因启动子及其应用和由其构建的动物模型和方法。
背景技术:
2.小神经胶质细胞(microglia或microglial cells)是中枢神经系统(cns)的组织定居巨噬细胞,在胚胎早期发育过程中定植在大脑中。这些吞噬细胞在中枢神经系统中起着许多作用:包括清除细胞碎片、向神经元和星形胶质细胞传递信号以介导突触连接以及保持总数神经系统的稳态。因此,非常有必要对小神经胶质细胞的发生发展机制、其在外界刺激下的生理过程的变化以及其与中枢神经系统的其他细胞间的作用关系等进行充分的了解。
3.现有技术中,已发现一些小神经胶质细胞特异性表达的标志基因,例如:apoeb基因(载脂蛋白e)和ccl34b.1基因(chemokine(c-c motif)ligand 34b,duplicate 1)。上述两个基因的表达模式和作用机制等方面均研究得较为透彻,可以用于研究特异性标记小神经胶质细胞。为了更为深入地研究小神经胶质细胞以及对小神经胶质细胞进行特异性地操作(例如在体内模型中定点调控小神经胶质细胞的生物学过程,而不影响其他细胞或者组织),研究人员通常使用特定基因的启动子来控制效应基因的表达。因此寻找获得小神经胶质细胞特异性表达的基因的启动子序列,是实现上述研究的关键。目前,用于标记小神经胶质细胞的基因也仅有apoeb和ccl34b.1两个,基于上述两基因的转基因品系均通过bac(bacterial artificial chromosome,人工染色体)介导的转基因技术获得,但是仍未确定可靠的标记小胶质细胞的启动子序列,不能够根据研究目的进行随意操作。同时,由于bac片段太大,不易将其与效应基因融合;且通过bac获得的稳定品系的效率极低,约13%。这就限制了对小神经胶质细胞的深入研究,亟需研究发现更多的小神经胶质细胞特异性基因,以及克隆获取能够标记和操作小神经胶质细胞的启动子序列。
技术实现要素:
4.本发明意在提供apoc1基因启动子,以解决现有技术中缺少用于标记小神经胶质细胞的具可操作性的启动子序列的技术问题。
5.为达到上述目的,本发明采用如下技术方案:
6.apoc1基因启动子,其核苷酸序列如seq id no.1所示。
7.本方案还提供了一种apoc1基因启动子在标记或者操作小神经胶质细胞中的应用。
8.本方案还提供了一种apoc1基因启动子在构建斑马鱼转基因品系中的应用。
9.本方案的原理及优点是:
10.发明人通过对小神经胶质细胞中基因的测序以及表达模式研究,发现apoc1基因以及其他的9种基因在小神经胶质细胞中富集表达。进一步研究发现apoc1基因的表达模式
和已知的小神经胶质细胞的marker基因重合。因此,apoc1基因具有作为小神经胶质细胞标志基因的潜能。由于控制基因表达的关键因素之一是该基因的启动子,在小神经胶质细胞在发育过程中,通过调控apoc1基因的启动子来实现对apoc1基因表达的调控,apoc1基因的启动子也可用于小神经胶质细胞的标记。除此之外,利用apoc1基因的启动子还可实现对小神经胶质细胞的一系列操作,有助于对小神经胶质细胞的研究工作。其中,标记小神经胶质细胞是指通过apoc1基因的启动子调控标记基因在小神经胶质细胞中特异性表达,使得小神经胶质细胞产生相对于其他组织细胞的特异性的识别信号;操作小神经胶质细胞是指通过apoc1基因的启动子调控特定的操作基因,对小神经胶质细胞的生物过程产生影响(包括引起小神经胶质细胞的增殖、分化、凋亡、杀伤等过程)或者对小神经胶质细胞中的特定的基因进行敲除以及在小神经胶质细胞中的特定的表达外源基因/过表达特定的基因。更具体地,利用apoc1基因的启动子,将其与具有特殊作用的效应基因(包括标记基因和效应基因)相整合,可以实现根据小神经胶质细胞的发育进程来对效应基因的表达进行调控;也可以控制效应基因在小神经胶质细胞中特异表达;即实现对效应基因的表达的在时间和空间上的控制。
11.另外,将含有apoc1基因启动子和效应基因的载体转基因到斑马鱼体内,使用apoc1基因启动子构建的斑马鱼转基因品系是非常好的用于研究小神经胶质细胞的斑马鱼动物模型,可以用于神经退行性相关疾病中小神经胶质细胞的作用的机理研究,也可以用于药物筛选和药效测试。
12.在现有技术中,使用apoc1基因或者其启动子标记小胶质细胞的研究未见报道,同时用于特异性标记斑马鱼小神经胶质细胞且能进行操作的启动子序列也未见报道。发明人通过大量研究,首先发现了apoc1基因与小神经胶质细胞的关系。虽然存在一些在小神经胶质细胞中富集表达的基因,但是基因的核心启动子的确认是一项较为复杂的工作,细胞表达特异性的核心启动子序列本身是未知的,并且核心启动子的位置和长度难以预测的。这都对小神经胶质细胞相关基因的启动子序列的发现造成了阻碍。发明人对小神经胶质细胞中富集表达的基因的启动子进行了研究,大量富集表达基因的启动子难以获取。经大量尝试之后,终于克隆获得了apoc1基因的启动子序列,该序列可以在小神经胶质细胞中,有效控制下游编码区的表达。再将该启动子序列与效应基因整合,并制备稳定遗传的斑马鱼品系,为深入研究小神经胶质细胞以及进行相关的药物筛选和药效测试创造了条件。
13.进一步,所述apoc1基因启动子用于在小神经胶质细胞中控制效应基因的表达。
14.本方案提供了一个可操作性的标记小胶质细胞的启动子序列,可以通过该启动子特异性对小胶质细胞进行操作。比如,启动子后携带硝基还原酶基因能够特异质杀伤小胶质细胞而不损伤其他的巨噬细胞;或者利用该启动子特异性的在小胶质细胞或者朗格汉斯细胞中补充或者敲除某个基因;还可以在启动子后整合荧光蛋白,用于定位小神经胶质细胞。针对于特异性的敲除某个基因,举例如下:通过分子克隆在该启动子序列后添加某一基因cdna序列,并将构建好的质粒导入模式动物后能实现在小胶质细胞或者朗格汉斯细胞中对某个基因的补充。同时,通过与现有的crispr/cas9联合,在该启动子后特异性表达cas9基因,同时融合标记基因(便于检测cas9基因是否表达),然后通过与全身性稳定表达某个基因靶位点的target rna相互作用,能够实现在小胶质细胞或者朗格汉斯细胞中敲除某个基因。
15.进一步,所述效应基因为硝基还原酶基因、荧光蛋白基因和条件性敲除的cas9基因中的一种。
16.采用上述技术方案,硝基还原酶可使得无毒性的甲硝唑被硝基还原酶还原为具有细胞毒性的代谢物,能够特异性诱导apoc1基因启动子控制的表达甲硝唑被硝基的细胞发生凋亡。受apoc1基因启动子调控,可使得小神经胶质细胞产生荧光信号,以区别于其他类型细胞,便于对小神经胶质细胞进行观察。在小神经胶质细胞中,特异性表达现有技术中常规的条件性敲除的cas9基因,可实现小神经胶质细胞中的基因敲除,而不影响其他类型的细胞。
17.本方案还提供了一种使用apoc1基因启动子构建动物模型的方法,包括以下依次进行的步骤:
18.s1:获取apoc1基因启动子;
19.s2:质粒构建:将apoc1基因启动子、效应基因和空质粒通过同源重组的方法整合,然后转化感受态细胞,经筛选和质粒提取,获得用于转基因操作的质粒;
20.s3:获取f0代斑马鱼;
21.s4:获取稳定遗传的转基因斑马鱼品系。
22.采用上述技术方案,通过dna聚合酶链式反应获得apoc1基因的启动子片段(4212bp);然后进行表达载体的构建、转基因到斑马鱼受精卵,最后经多代杂交,获得稳定的转基因鱼系。
23.进一步,在s1中,通过聚合酶链式反应获得apoc1基因启动子;引物包括序列如seq id no.3和seq id no.4所示的上游引物和序列如seq id no.5和seq id no.6所示的下游引物。由于apoc1基因启动子的序列较长,所以采用分段pcr的方式克隆。
24.进一步,在s3中,将用于转基因操作的质粒和转座酶混合后注射到斑马鱼单细胞受精卵中;受精后3天,挑选出整合有效应基因的受精卵;然后培养至性成熟,获得f0代转基因斑马鱼。转座酶的使用,可以提高目的基因插入斑马鱼基因组的效率。
25.进一步,在s4中,将f0代转基因斑马鱼与野生型斑马鱼交配,获得f1代转基因斑马鱼;将f1代转基因斑马鱼与野生型斑马鱼交配,获得稳定遗传的转基因斑马鱼品系。通过多次交配以及筛选,可以获得稳定遗传的转基因斑马鱼品系。采用上述手段为现有技术中常规的获取稳定的转基因斑马鱼品系的手段。
26.进一步,使用apoc1基因启动子构建动物模型的方法获得的转基因斑马鱼品系。在本方案获得的转基因斑马鱼品系中,apoc1基因启动子控制效应基因在小神经胶质细胞中特异表达,为研究小神经胶质细胞的发生发展机制以及研发相关药物创造了条件。
27.综上所述,发明人通过对斑马鱼脑中免疫细胞进行单细胞测序分析发现,脑中免疫细胞能分为多个类群,并筛选出与apoeb基因和ccl34b.1基因(现有技术公认的小神经胶质细胞marker基因)表达模式相似的多个基因,将这些基因作为克隆启动子的候选基因。并且apoeb基因和ccl34b.1基因虽然在小神经胶质细胞中大量表达,但是他们的表达并非集中在脑部的免疫细胞中。以apoeb基因为例,其还在神经元细胞中有一定的表达量。所以筛选出能够在小神经胶质细胞中特异性表达的基因非常有必要。
28.由于具有细胞表达特异性的核心启动子序列的复杂性,发明人通过大量尝试仅仅获得了部分候选基因起始密码子上游的序列。将这些获得的起始密码子上游的序列整合到
表达质粒中,并转基因到斑马鱼中,发现并不是所有克隆获得的起始密码子上游的序列都具有启动效应基因表达的活性。最后仅仅只发现克隆获得的apoc1基因的起始密码子上游的序列以及lgals3bpb基因的起始密码子上游的序列,可以启动效应基因的表达,即获得了核心启动子序列。并且在进一步的实验中,我们发现了apoc1基因的启动子和lgals3bpb基因的启动子可以启动效应基因在小神经胶质细胞中特异性表达,不会在神经元中表达,也不会在非小神经胶质细胞的其他免疫细胞中表达。这样的效果,使得我们对小神经胶质细胞进行特异性观察和操作变得可能。apoc1基因和lgals3bpb基因的表达模式以及apoc1基因的启动子和lgals3bpb基因的启动子的发现,获得了预料不到的技术效果,克服了决现有技术中由于缺少能够对小神经胶质细胞进行定位和操作的动物模型的技术问题。
附图说明
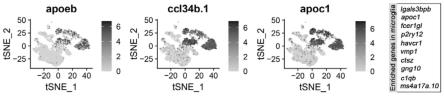
29.图1为实施例1的apoc1基因以及已知的小神经胶质细胞的marker基因的表达模式研究结果。
30.图2为现有技术研究中的apoeb基因启动子调控的绿色荧光蛋白的表达情况。
31.图3为实施例2的斑马鱼tg(coro1a:dsred;vmp1-egfp)品系的荧光显微图像。
32.图4为实施例2的斑马鱼tg(coro1a:dsred;havcr1-egfp)品系的荧光显微图像。
33.图5为实施例3的apoc1基因启动子两dna片段的电泳图。
34.图6为实施例3的pt2al-cryaa-apoc1-egfp质粒的构建流程示意图。
35.图7为实施例3的pt2al-cryaa-apoc1-egfp质粒模式图。
36.图8为实施例3的菌落pcr实验结果。
37.图9为实施例3的初步筛选cryaa-cerulean结果显微图像。
38.图10为实施例3的转基因斑马鱼构建及筛选模式图。
39.图11为实施例3的斑马鱼全身egfp阳性信号检测荧光显微图像。
40.图12为实施例3的转基因斑马鱼egfp和中脑泛小胶质细胞的共定位结果。
41.图13为实施例3的转基因品系在发育至12个月时,egfp与中脑部分泛小胶质细胞的共定位结果。
具体实施方式
42.下面结合实施例对本发明做进一步详细的说明,但本发明的实施方式不限于此。若未特别指明,下述实施例以及实验例所用的技术手段为本领域技术人员所熟知的常规手段,且所用的材料、试剂等,均可从商业途径得到。
43.实施例1:apoc1基因表达模式研究
44.apoc1基因全称为apolipoprotein c1(载脂蛋白c1),接收号为nm_001291886.1。发明人通过测序发现apoc1基因的表达模式和已知的小神经胶质细胞的marker基因重合(详见图1)。
45.通过对斑马鱼脑中免疫细胞进行单细胞测序分析发现,脑中免疫细胞能分为多个类群,然后,我们通过检测apoeb基因(载脂蛋白e,接收号为nm_131098.2)和ccl34b.1基因(chemokine(c-c motif)ligand 34b,duplicate 1,接收号为nm_001115054.2)的时候发现,这两种基因仅在部分类群中表达,如图1所示。在图1中,坐标轴代表数据点之间的梯度,
用来模拟它们在高维和低维空间中的距离函数。其中,梯度的正值表示低维空间中数据点之间的吸引作用,而负值表示排斥作用。右侧渐变图示中的0-6代表的是该基因在不同类群中的表达水平,使用颜色的深浅来表示表达水平。图1中,右侧方框中的基因与apoeb基因和ccl34b.1基因在斑马鱼脑部的免疫细胞中的表达模式相同,即富集表达的细胞类群相同,包括apoc1基因、p2ry12基因、vmp1基因、fcer1gl基因、havcr1基因等。关于apoeb基因和ccl34b.1基因作为小神经胶质细胞的marker基因的报道,请详见现有技术文献(francesca peri,live imaging of neuronal degradation by microglia reveals a role for v0-atpase a1 in phagosomal fusion in vivo,cell.2008may 30;133(5):916-27.doi:10.1016/j.cell.2008.04.037;shuting wu,two phenotypically and functionally distinct microglial populations in adult zebrafish,sci adv.2020nov 18;6(47):eabd1160.doi:10.1126/sciadv.abd1160.)。
46.文献报道(francesca peri,live imaging of neuronal degradation by microglia reveals a role for v0-atpase a1 in phagosomal fusion in vivo,cell.2008may 30;133(5):916-27.doi:10.1016/j.cell.2008.04.037.),在已有的bac构建的apoeb的转基因表达模式中,apoeb携带的效应基因(gfp)不止在小胶质细胞中表达,同时在脑神经元细胞(非斑马鱼脑部的免疫细胞)中也能检测到(参见图2,该图来源于上述francesca peri的论文)。在图2中细箭是指小胶质细胞,粗箭是指神经元细胞,神经元细胞的形态特点为带有较长的线状分支的细胞。这就说明,使用apoeb基因标记小神经胶质细胞的特异性不强,同时会对神经元细胞形成标记,并不利于对于小神经胶质细胞的观察以及操作。我们通过单细胞测序分析发现apoc1基因在脑部免疫细胞中的表达模式一致,本领域技术人员可能会预期apoc1基因和apoeb基因在非脑部免疫细胞中的表达模式也会一致。这样的话,apoc1基因则不是脑微环境中小胶质细胞的特异性基因,可能会在其他脑神经元细胞中表达。但是,经发明人研究发现本发明克隆的apoc1启动子不在神经元细胞表达,可以有效地区分小神经胶质细胞和神经元细胞。因此,apoc1基因(及其启动子)具有作为小神经胶质细胞标记基因(启动子)的潜能。在本专利申请之前,apoc1标记小胶质细胞的研究未见报道,同时用于特异性标记斑马鱼小神经胶质细胞且能进行操作的启动子序列也未见报道。
47.实施例2:apoc1基因的启动子的获取
48.基于实施例1中筛选出的在小神经胶质细胞中高表达基因,并选择了其中10个作为备选基因,用以捕获标记小胶质细胞的启动子序列。基因核心启动子的确认是一项较为复杂的工作,具有细胞表达特异性的核心启动子序列本身是未知的,并且核心启动子的位置和长度在研究发现之前是难以预测的。某些基因的核心启动子仅几百个碱基对,而有些是上万个碱基对。某些基因的启动子距离编码序列较近,某些基因的启动子距离编码序列较远,某些基因的启动子位于编码区上游,有的位于下游。这些因素都对基因的启动子的发现造成了阻碍。
49.在针对备选基因进行的启动子研究的尝试中,发明人针对fcer1gl基因、p2ry12基因等设计引物,欲克隆获得起始密码子前的碱基序列信息,最终扩增失败,无法获知上述序列信息.另外,发明人针对vmp1基因等克隆得到了起始密码子前的碱基序列(4000bp左右),然而在连接egfp和pt2al载体进而注射斑马鱼后,发明人发现包括vmp1基因、havcr1基因在
内的其他基因平行构建的转基因斑马鱼并没有egfp信号,说明启动子捕获失败。含vmp1基因启动子的转基因斑马鱼的小神经胶质细胞的荧光图像参见图3(受精后3天),其中,dsred的表达受已知的coro1a基因的启动子的调控,dsred大量表达,说明视野中的细胞为小神经胶质细胞,而在这些细胞中,未出现egfp信号,说明克隆获得的vmp1基因的起始密码子上游序列并不具有启动egfp基因表达的功能。针对havcr1基因的起始密码子上游序列进行转基因斑马鱼研究,情况同vmp1基因(参见图4)。发明人分析了造成上述现象的原因:可能是vmp1基因启动子不位于其起始密码子上游的4000bp处;或者可能是虽然成功克隆了该基因的启动子,但是在动物模型中,该启动子无法有效启动效应基因的表达。上述实验结果说明了并不是随意的具有启动子效果的序列都可以启动效应基因的表达,即并不是随意的启动子都具有可操作性,以及克隆启动子以及将其应用于在特定细胞中控制效应基因表达的难度。另外,关于现有技术的coro1a基因的启动子的功能进一步说明如下:coro1a基因的启动子能标记所有的免疫细胞(包括巨噬细胞、单核细胞、粒细胞、淋巴细胞等在内的免疫细胞),但是基于现阶段认为小神经胶质细胞是中枢神经系统区唯一的免疫细胞,所以我们认为coro1a基因的启动子在脑中标记是泛小神经胶质细胞(可能包含成熟,未成熟及未分化状态)。
50.针对本方案中的apoc1基因,其起始密码子前的碱基序列富含多个连续t降低了dna聚合酶链式反应扩增效果。通过大连尝试,最终得到4212bp的启动子序列,其序列参见seq id no.1。通过dna聚合酶链式反应扩增apoc1基因的起始密码子前4212bp序列能够起始携带的egfp的表达,且egfp表达的细胞定位于脑,表明对小神经胶质细胞的特异性标记,这是一个全新的发现。作为对比,发明人还尝试了克隆了apoc1基因的起始密码子前2000bp序列(seq id no.2),但是此部分序列并不能够启动报告基因egfp的表达(操作方式参见实施例3)。
51.本方案提供了一个可操作性的标记小胶质细胞的启动子序列,可以通过该启动子特异性对小胶质细胞进行操作。比如,启动子后携带硝基还原酶基因能够特异质杀伤小胶质细胞而不损伤其他的巨噬细胞;或者利用该启动子特异性的在小胶质细胞或者朗格汉斯细胞中补充或者敲除某个基因;还可以在启动子后整合荧光蛋白,用于定位小神经胶质细胞,并且观测该基因(apoc1基因)在发育过程中的表达情况以及作用。以下实施例以整合egfp为例来说明本方案的启动子的功能。
52.实施例3:基于apoc1基因启动子序列的斑马鱼小神经胶质细胞标记模型
53.基于apoc1启动子序列的斑马鱼小神经胶质细胞标记模型,通过以下步骤实现:
54.(1)通过dna聚合酶链式反应扩增apoc1基因的起始密码子前4212bp序列作为启动子(seq id no.1)。其中,使用到的引物序列为:
55.f1-apoc1:5
’‑
agacagcaggaataaaggtt-3’,seq id no.3;
56.r1-apoc1:5
’‑
tcctcgcccttgctcaccatggaatcactgttagagagct-3’,seq id no.4。
57.f2-apoc1:5
’‑
atcgaattcctgcagcccgggcagttgtttggactccttgc-3’,seq id no.5;
58.r2-apoc1:5
’‑
aacctttattcctgctgtctacaaacatagatacatgcag-3’,seq id no.6。
59.pcr体系(使用翌圣生物科技(上海)股份有限公司pcr试剂盒)为:
60.水:18μl;2
×
heiff buffer:25μl;heiff酶:0.5μl;基因组模板(斑马鱼基因组dna):1.5μl;f端引物(10μm):2.5μl;r端引物(10μm):2.5μl。
61.pcr程序为:98℃,3min,
×
1;(98℃、10s)
→
(60℃、20s)
→
(72℃、2min),
×
40;72℃,5min,
×
1。
62.通过现有技术常规的琼脂糖电泳以及切胶回收的手段,获得纯化富集后的apoc1基因启动子扩增产物,并送第三方公司测序确认回收产物为目的序列,两段dna片段的电泳图参见图5。
63.(2)通过dna聚合酶链式反应获得egfp荧光蛋白序列作为标记基因,egfp的序列如seq id no.7所示。其中,使用到的引物为:
64.f1-egfp:5
’‑
atggtgagcaagggcgagga-3’,seq id no.8;
65.r1-egfp:5
’‑
tggatcatcatcgataggcctttacttgtacagctcgtcca-3’,seq id no.9。
66.pcr体系为:水:18μl;2
×
heiff buffer:25μl;heiff酶:0.5μl;质粒模板:1.5μl;f端引物:2.5μl;r端引物:2.5μl。pcr程序同(1)。
67.通过现有技术常规的琼脂糖电泳以及切胶回收的手段,获得纯化富集后的egfp荧光蛋白基因扩增产物,并送第三方公司测序确认回收产物为目的序列。
68.(3)通过同源重组的方式将apoc1基因的启动子,egfp荧光蛋白序列和ptal2-cryaa载体(货号:#31823;参见文献:darius balciunas,harnessing a high cargo-capacity transposon for genetic applications in vertebrates,plos genet.2006nov;2(11):e169.doi:10.1371/journal.pgen.0020169)融合,得到pt2al-cryaa-apoc1-egfp质粒,大致过程参见图6。具体过程如下:
69.使用限制性内切酶xma1和cla1酶切处理ptal2-cryaa载体,使用dna聚合酶链式反应获得apoc1基因启动子扩增产物1,经纯化回收获得pcr产物a;使用dna聚合酶链式反应获得apoc1基因启动子扩增产物2,获得经纯化回收pcr产物b;通过dna聚合酶链式反应扩增含有egfp荧光蛋白序列质粒获得egfp序列扩增产物,经纯化回收获得pcr产物c。然后,使用同源重组酶将pcr产物物a、pcr产物b和pcr产物c连接形成pt2al-cryaa-apoc1-egfp质粒,该质粒的模式图参见图7。
70.连接体系为:2
×
同源重组酶:10μl;酶切后的ptal2-cryaa载体:100μg;pcr产物a:20μg;pcr产物b:25μg;pcr产物c:30μg。连接时间为:15min;温度为:50℃。
71.(4)构建得到的质粒通过现有技术常规手段转入大肠杆菌dh5感受态细胞中进行转化。分别挑取单克隆到40ml含有氨苄抗生素的培养液中,37℃180rpm培养12-16h,利用无内毒素质粒提取试剂盒对质粒进行去内毒素质粒纯化提取,从而获得去除大肠杆菌胞体等物质的纯度较高的质粒载体pt2al-cryaa-apoc1-egfp。其中,菌落pcr筛选阳性菌落图像参见图8。
72.(5)将pt2al-cryaa-apoc1-egfp质粒(40ng/μl)和转座酶(100ng/μl,tol2 transposase mrna,其模板dna序列如seq id no.10所示)按照体积比1:1混合后注射入斑马鱼单细胞受精卵(ab品系斑马鱼,注射量1nl),从而通过转座酶的作用将质粒载体随机整合入斑马鱼基因组中。转座子是一段能够改变自身位置的序列,包含中间序列和末端方向重复序列,中间序列可以表达转座酶。转座酶可以识别末端重复序列,进而将转座序列切除,并转移到基因组其他位置。本方案中的转座酶是提高质粒插入效率的工具,若不使用,外源基因在斑马鱼基因组上的插入也能进行,但是效率会降低。
73.(6)单细胞受精卵胚胎显微注射受精后2天在荧光显微镜下检测眼中cryaa荧光蛋
白信号表达情况,从而确定显微注射是否成功。然后,在受精后3天在荧光显微镜下检测egfp是否有表达及其表达位置以确定重组质粒是否能够驱动egfp表达,是否能够特异性标记小神经胶质细胞。受精后3天的cryaa-cerulean标记结果参见图9(cryaa-cerulean能特异性在斑马鱼晶状体中表达蓝色荧光,通常用来检测质粒注射到斑马鱼后是否整合到染色体)。
74.(7)将有荧光表达的受精卵挑选出来,于标准温度28.5℃下培养至性成熟(f0代;founder)。将f0代与野生型斑马鱼交配,获得荧光后代个体为f1代。继续将f1代培养至性成熟,与野生型斑马鱼交配,获得荧光f2代。自此,荧光品系的斑马鱼tg(apoc1:egfp)构建完成。
75.(4)-(7)的转基因构建及筛选模式图参见图10。检测f1代斑马鱼全身egfp信号,实验结果参见图11,发现egfp信号在脑中和皮肤特异性定植,apoc1基因的启动子除了上述标记之外,会标记卵黄囊和尾鳍。其中,皮肤中表达egfp信号的细胞主要是朗格汉斯细胞,是一种组织定居型巨噬细胞。apoc1基因参与的脂蛋白转运,除了小神经胶质细胞之外,一些其他非脑部的细胞也存在表达apoc1基因的情况。如果利用apoc1基因的启动子对表达该基因的细胞进行操作,在小神经胶质细胞中,这些基因操作更多的是会影响脑部微环境,如神经元发育和功能;在其他非脑部细胞中,这些基因操作是不会影响脑部微环境。所以,利用apoc1基因的启动子在相应细胞中启动效应基因的表达,并不会影响对小神经胶质细胞的操作和实验结果。另外,如果我们使用mtz-ntr特异性消除含有apoc1基因的启动子的细胞,我们可以通过控制mtz的浓度的方式来保证只消除脑中的小胶质细胞而不影响其他部位的细胞。
76.将斑马鱼tg(coro1a:dsred)品系与前述表达egfp的f0代(tg(apoc1:egpf))杂交,获得杂交品系tg(coro1a:dsred;apoc1:egpf)。参见图12,在3dpf时,对coro1a-dsred+细胞(红色,左图)和apoc1-egfp+细胞(绿色,中图)进行观测,发现apoc1基因的启动子标记的细胞和coro1a基因的启动子标记的细胞的重合度较高(融合图像为右图),说明apoc1基因的启动子可启动效应基因在小神经胶质细胞中特异性表达。其中,斑马鱼tg(coro1a:dsred)品系的获取方式参见本实施例中前文描述,只是将启动子和效应基因更换为现有技术中的coro1a基因的启动子(该启动子的信息可参见文献li,l.,live imaging reveals differing roles of macrophages and neutrophils during zebrafish tail fin regeneration.2012,journal of biological chemistry 287,25353-25360.)以及dsred荧光蛋白。在图12中,箭头(arrowhead)表示dsred和egfp共染的细胞,箭(arrow)表示部分没有共染的细胞(只有dsred信号)。coro1a基因的启动子主要用于特异性标记免疫细胞(白细胞),包括小神经胶质细胞,而apoc1基因的启动子主要标记小神经胶质细胞。脑部的免疫细胞主要是小神经胶质细胞,所以出现了标记细胞重合的情形。荧光图像中存在只被coro1a基因的启动子标记而不被apoc1基因的启动子标记的细胞。发明人分析原因在于,这些非apoc1基因的启动子标记的细胞不是组织定居型细胞(即非小神经胶质细胞),而是巨噬细胞巡逻到该处被coro1a基因的启动子标记。该实验结果进一步说明了apoc1基因的启动子标记的特异性,只对小神经胶质细胞进行标记,而不对其他的脑部的免疫细胞以及神经元细胞形成标记。我们可以利用apoc1基因的启动子的特性来进行小神经胶质细胞的特异性的研究以及相关操作。
77.新构建转基因品系(荧光品系的斑马鱼tg(apoc1:egfp))在发育至12个月时与中脑部分泛小胶质细胞的共定位结果参见图13(左图为红色lcp1标记,中图为绿色egfp标记,右图为两幅图的融合图像)。anti-lcp1是指lcp1(lymphocyte cytosolic protein 1)的抗体。lcp1和coro1a基因的启动子标记的是一类细胞,一般用这个抗体来标记斑马鱼脑袋中的泛小胶质细胞。上述实验结果说明由coro1a基因的启动子控制的效应基因的表达集中在中脑部分泛小胶质细胞处。在图13中,箭头(arrowhead)表示lcp1和egfp共染的细胞,箭(arrow)表示部分没有共染的细胞(只有lcp1信号)。成年斑马鱼会有其他来源的巨噬细胞代替部分脑中的小胶质细胞,所以会有不表达egfp的细胞,进一步说明了apoc1基因的启动子标记的特异性,只对小神经胶质细胞进行标记,而不对其他的免疫细胞以及神经元细胞形成标记。
78.以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本技术要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1