用于HEK293细胞培养及腺病毒、腺相关病毒复制扩增的化学成分限定培养基的制作方法
用于hek293细胞培养及腺病毒、腺相关病毒复制扩增的化学成分限定培养基
技术领域
1.本发明属于腺病毒及腺相关病毒及生物工程领域,具体涉及一种适用于hek293悬浮规模化放大培养及腺病毒、腺相关病毒复制扩增生产的化学成分限定培养基。
背景技术:
2.腺病毒和腺相关病毒(aav)是两种不同类型的病毒载体,常用于基因传递。这两个重组病毒系统在感染宿主方面有着明显的优势,例如免疫原性低、可感染分裂和非分裂细胞等。两者之前的区别主要在于包装能力、水平,基因复制扩增的起效和持续时间以及免疫应答的不同。腺病毒有约8.5千碱基的容量,可复制扩增高水平的蛋白质和瞬时基因。aav的包装容量约为4.5千碱基,蛋白质复制扩增水平相对较低,有长效基因复制扩增的潜力。与腺病毒不同,aav传递系统所产生的免疫应答水平非常低。除此以外,aav还可以稳定地整合到宿主基因中。腺病毒系统的局限性主要在于该系统会引起靶细胞的高水平免疫应答,而aav的缺点主要在于其对目的基因的包装容量较小,并且复制扩增起效较晚。
3.hek293细胞系,又称293细胞,是1973年产生的人胚肾293细胞。顾名思义,它们是一种典型的细胞系,起源于人体胚胎肾细胞人胚胎肾细胞,发展至今,有293t、293f及293sg等多种衍生细胞株。hek293细胞具有转染效率高、可悬浮培养应用大规模复制扩增生产、复制扩增蛋白接近人体结构、以及快速高密度生长等优势,被广泛应用于蛋白生产、疫苗、腺病毒及腺相关病毒包装生产等领域,以新冠疫苗为例,目前上市的新冠疫苗接近一半都是hek293生产的腺病毒疫苗。
4.hek293细胞培养是hek293应用于产品规模化生产的重要技术,反应器贴壁培养、微载体培养、无血清悬浮培养均适应于hek293细胞培养,其中无血清悬浮培养作业方式相对简单,易于大规模放大,是hek293规模化放大的重要方式,要实现293细胞悬浮培养必须先将贴壁培养293细胞改造为悬浮培养293s细胞并寻找适合高密度无血清培养的培养液配方。
5.近几年,我国培养基市场规模逐年增长,对hek293细胞培养技术的需求也逐步增加。我国培养基行业已开始逐步发展,产能也在逐渐提升。但是国内hek293细胞培养基现阶段的供应仍被国外大企业垄断,存在着交货期限长、售后服务没有保障等问题。由于新冠疫情影响,培养基需求急剧增加,进口培养基供不应求,导致价格飙升、交付时间延长和采购受限。
6.目前市场上,hek293细胞无血清培养基成分设计不满足细胞培养及产物复制扩增需求,需在使用中另外添加人源或动物源的蛋白或蛋白水解物等物质,存在以下问题:
7.1、配方中含有非化学成分限定成分的蛋白、蛋白水解物等物质,使得最终产品的安全性不足;
8.2、非化学成分限定成分的培养基,其稳定性不足,在培养基规模化生产过程中,批间差难以受控;
9.3、含有的非化学成分限定物质对环境敏感,导致培养基产品运送及保存条件苛刻;
10.4、蛋白或蛋白水解物等物质影响最终产品分离纯化,在下游分离纯化过程中难以去除,对分离纯化要求高,纯化柱清洗困难,拉长分离纯化时间,降低纯化柱使用寿命;
11.5、全配方研磨无法有效保证产品品质,大多数产品含基础培养基及添加剂等多个组分,给产品运送保存及客户配液造成不便;
12.6、化学成分限定的培养基产品单一,且并未针对腺病毒及腺相关病毒研发生产进行对应开发,在病毒转染后细胞的活性及持续扩增能力下降,导致产物滴度不足。
13.因此,急需一款适应于hek293细胞培养、腺病毒及腺相关病毒复制扩增生产的化学成分限定的优质无血清培养基产品来克服以上困难。
技术实现要素:
14.本发明的目的,就是为了解决上述问题而提供了一种用于hek293细胞培养及腺病毒、腺相关病毒复制扩增生产的化学成分限定培养基,该培养基化学要素成分明确,无血清无蛋白,也不添加植物水解物,采用了一些已知结构与功能的小分子化合物作为替代,更有利于进行hek293细胞培养代谢及进行腺病毒、腺相关病毒的复制扩增,更加安全有效。
15.本发明的目的是这样实现的:
16.本发明用于hek293细胞培养及腺病毒、腺相关病毒复制扩增生产的化学成分限定培养基,其由氨基酸、维生素、微量元素、无机盐及脂肪酸组成;
17.所述氨基酸的组分及其含量为:
[0018][0019]
所述维生素的组分及其含量为:
[0020][0021][0022]
所述微量元素的组分及其含量为:
[0023][0024]
所述无机盐的组分及其含量为:
[0025][0026]
所述脂肪酸的组分及其含量为:
[0027]
亚油酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.02-1mg/l
[0028]
亚麻酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.02-0.5mg/l。
[0029]
上述用于hek293细胞培养及腺病毒、腺相关病毒复制扩增生产的化学成分限定培养基,所述化学成分限定培养基的组分及其含量优选如下:
[0030]
所述氨基酸的组分及其含量为:
[0031]
[0032][0033]
所述维生素的组分及其含量为:
[0034]
所述微量元素的组分及其含量为:
[0035]
所述无机盐的组分及其含量为:
[0036]
[0037][0038]
所述脂肪酸的组分及其含量为:
[0039]
亚油酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.5mg/l
[0040]
亚麻酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.3mg/l。
[0041]
本发明与现有技术相比,具有以下有益效果:
[0042]
1、本发明化学成分限定培养基性能优越,在倍增时间、最高密度及产物滴度上都超越了国际知名同类产品;
[0043]
2、本发明属于完全化学成分限定配方,不含蛋白或蛋白水解物等物质,产品安全性及稳定性高,适用于hek293细胞的培养;
[0044]
3、本发明使得规模化生产过程中批间差易受控,且培养基性质稳定,运送及保存条件相对宽松;
[0045]
4、本发明不含蛋白或蛋白水解物等物质,在生产过程中不引入非目的蛋白,简化分离纯化,有利于下游纯化过程的时间和成本控制;
[0046]
5、本发明可全配方研磨生产,组分简单,无添加剂,客户端应用配液简便;
[0047]
6、本发明专门针对腺病毒及腺相关病毒研发生产进行配方设计,调控铁离子等相关物质浓度以控制细胞生长速度,在病毒转染后可有效保证细胞活率及扩增速度,有效提高病毒扩增效率,提高最终产品滴度;
[0048]
7、本发明添加了脂肪酸,脂肪酸的添加和配方中其他组分结合对于后期腺病毒及腺相关病毒的复制扩增起到正向的作用,亚油酸、亚麻酸的添加可促进腺病毒及腺相关病毒的复制扩增。
附图说明
[0049]
图1是实施例1中hek293悬浮细胞传代与扩增培养步骤的hek293细胞生产曲线;
[0050]
图2是实施例1中hek293悬浮细胞传代与扩增培养步骤的hek293细胞传代稳定性曲线;
[0051]
图3是实施例1中hek293悬浮细胞传代与扩增培养步骤的hek293细胞倍增时间图;
[0052]
图4是hek293细胞大规模培养步骤的hek293细胞生长曲线;
[0053]
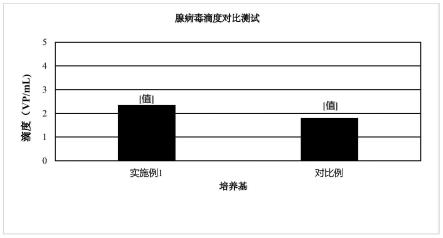
图5是采用实施例1和对比例进行腺病毒复制扩增测试得到的滴度测试结果。
具体实施方式
[0054]
下面将结合实施例,对本发明作进一步说明。
[0055]
本发明用于hek293细胞规模化复制扩增生产的化学成分限定培养基,其由氨基酸、维生素、微量元素、无机盐及脂肪酸组成;
[0056]
氨基酸的组分及其含量为:
[0057][0058]
维生素的组分及其含量为:
[0059][0060][0061]
微量元素的组分及其含量为:
[0062][0063]
所述无机盐的组分及其含量为:
[0064][0065]
所述脂肪酸的组分及其含量为:
[0066]
亚油酸(linoleic acid)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.02-1mg/l
[0067]
亚麻酸(linolenic acid)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.02-0.5mg/l。
[0068]
以上原料均为市售产品。
[0069]
实施例1
[0070]
本实施例化学成分限定培养基的组分及其含量如下:
[0071]
氨基酸的组分及其含量为:
[0072][0073]
维生素的组分及其含量为:
[0074]
微量元素的组分及其含量为:
[0075]
[0076][0077]
无机盐的组分及其含量为:
[0078][0079]
脂肪酸的组分及其含量为:
[0080]
亚油酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.5mg/l
[0081]
亚麻酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.3mg/l。
[0082]
按照以上具体含量准备原料组分,并充分溶解于无菌去离子水中,调节ph至6.9~7.0,定容至10l后用孔径为0.22μm的滤膜过滤,4℃保存待用(以下称为cdm培养基)。
[0083]
本实施例所使用细胞为hek293细胞,购自中国ctcc(美森细胞)。
[0084]
采用上述制备的cdm培养基进行hek293细胞培养,具体步骤如下:
[0085]
步骤1:准备所需试剂耗材
[0086]
预先置于细胞制备全站内,开启全站主腔体hpv灭菌模式;将已配置好的cdm培养基放在37℃二氧化碳培养箱中预热1小时,用75%的乙醇喷洒培养液瓶的外壁,再将其传递至细胞制备全站的传递窗内,开启hpv灭菌结束后,转入细胞制备全站内。
[0087]
步骤2:细胞复苏
[0088]
37℃水浴锅打开预热,提前将程序降温盒放置在-80℃冰箱内;从液氮罐中取出待复苏的细胞,放置在已经预冷的程序降温盒内,取出冻存细胞37℃水浴,样本即将全部融化(90%左右)时取出后用75%酒精擦拭冻存管旋口处及外壁,防止污染,传到工作站内;将复苏细胞转移到准备好的15ml离心管中,轻柔吹打;向离心管内按1:9的比例缓慢加入cdm培养基;再向冻存管中加入1ml培养基轻柔吹打并吸取冻存管中残留的细胞至离心管中。离心管置于离心机中,300g,离心5min。向细胞沉淀中加入5ml新的培养基,轻柔吹打均匀,取100-200μl细胞悬液,进行细胞数及活性检测。根据细胞计数及活性检测结果进行计算,将细胞密度按0.5
×
106cells/ml接种至摇瓶中,放入37℃,5.0%co2,》90%rh,120rpm的培养摇床中培养.
[0089]
步骤3:hek293悬浮细胞传代与扩增培养
[0090]
将cdm培养基放在37℃二氧化碳培养箱中预热1小时,再将其传递至细胞制备全站传递窗内,开启hpv灭菌结束后,转入细胞制备全站内;将培养至第2-3天的细胞从培养箱中
取出,用75%的乙醇喷洒摇瓶的外壁,再将其传递至细胞制备全站的传递窗内,开启hpv灭菌结束后,转入细胞制备全站内;取100-200μl细胞悬液,进行细胞数和细胞活率检测;选择合适的细胞传代或扩增培养容器,计算接种所需细胞和培养基的体积,将细胞密度调整至0.5
×
106cells/ml左右;每3天重复上述内容,进行种子培养,后期作为种子细胞用于供给ces系统扩增培养,状态正常标准:活力大于95%,细胞形态规则圆整,正常生长;
[0091]
根据记录数据,形成的hek293细胞生产曲线(图1)、细胞传代稳定性曲线(图2)以及细胞倍增时间图(图3)。
[0092]
从图1中可见,hek293细胞在培养7天时,细胞密度达到最大,即peak vcd(活细胞密度峰值)为11.76
×
106cells/ml,且该峰值的细胞活率(via)为95.2%。
[0093]
从图2中可见,使用本实施例cdm培养基培养hek293细胞,初始接种密度为0.5
×
106cells/ml时,72h扩增至4.0
×
106cells/ml以上,细胞扩增8倍以上,平均倍增时间低于24h,稳定性良好。
[0094]
从图3中可见,使用本实施例cdm培养基培养hek293细胞,细胞倍增时间均小于24h,细胞扩增效果佳。
[0095]
步骤4:hek293细胞大规模培养
[0096]
安装2l灌流ces-bag,(本实施例采用放大培养设备为tofflon 10l-ces)进行蠕动泵校正,将种子细胞以一定的密度接种至ces设备,按参考文件设定ces培养参数,开始培养,培养过程中,每天取样检测,细胞数、细胞活率并记录,根据细胞检测结果,按照一定密度补充培养基,扩大培养,当培养体积扩大到1l且密度达到2-3x106cell时,将备好的补液瓶和收获瓶连接至ces-bag上,采用同速灌流模式每24h换液1l,准备好电子天平,开始灌流培养,每日观察并记录电子天平显示值与补液瓶出液值,对比灌流模式性能的精准度,培养过程中每天取样检测,细胞数、细胞活率并记录,当细胞活率下降至80%测试结束。
[0097]
根据记录数据,形成的hek293细胞大规模培养生产曲线(图4),从图4可见,使用本实施例cdm培养基培养hek293细胞,初始接种密度为0.4
×
106cells/ml,培养时间10天,细胞密度最大到达44
×
106cells/ml,同时期的细胞活率(via)为76.8%。
[0098]
采用本实施例制备的cdm培养基进行腺病毒复制扩增测试,具体测试步骤如下:
[0099]
1.按0.5
×
106密度将hek293细胞接种于cdm培养基中。
[0100]
2.将细胞置于ces-25l(tofflon大规模细胞培养设备)上,加入5l cdm培养基,37℃,5%co2,摇摆速度18rpm,摇摆速度6,通气量0.2lpm。
[0101]
3.每天2次细胞计数,当细胞密度大于2
×
106时,1:1添加新鲜cdm培养基,按照moi(10:1)加入腺病毒。
[0102]
4.将细胞置于ces-25l上,37℃,5%co2,摇摆速度20rpm,摇摆速度8,通气量0.4lpm。72h后收集细胞沉淀,裂解收获腺病毒,作为测试品。
[0103]
5.调用超微量分光光度计检测方法,以测试品相对应的缓冲溶液为空白参比,将测试品平行准备3份,在波长260nm处测量3份平行样品的od值,取平均值,病毒颗粒数浓度c=1.1
×
10
12
×
od平均值
×
d,其中,d是测试品的稀释倍数。
[0104]
采用本实施例制备的cdm培养基,腺病毒滴度测试结果如图5所示,为2.35vp/ml,其中1vp=5.87
×
107。
[0105]
对比例:
[0106]
采用来自进口市场主流培养基进行腺病毒复制扩增测试,测试步骤与实施例1一致,腺病毒滴度测试结果如图5所示,为1.35vp/ml,其中1vp=5.87
×
107。
[0107]
通过以上测试数据可见,本发明不含蛋白或蛋白水解物等物质,产品安全性及稳定性高,适用于hek293细胞的培养,并且使得规模化生产过程中批间差易受控,且培养基性质稳定。
[0108]
本发明专门针对腺病毒及腺相关病毒研发生产进行配方设计,调控铁离子等相关物质浓度以控制细胞生长速度,在病毒转染后可有效保证细胞活率及扩增速度,有效提高病毒扩增效率,提高最终产品滴度。
[0109]
本发明添加了脂肪酸,脂肪酸的添加和配方中其他组分结合对于后期腺病毒及腺相关病毒的复制扩增起到正向的作用,亚油酸、亚麻酸的添加可促进腺病毒及腺相关病毒的复制扩增。
[0110]
以上实施例仅供说明本发明之用,而非对本发明的限制,有关技术领域的技术人员,在不脱离本发明的精神和范围的情况下,还可以作出各种变换或变型,因此所有等同的技术方案也应该属于本发明的范畴,应由各权利要求所限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1