提高产油微生物的油脂产量的方法和微生物油脂的制备方法
1.本发明涉及微生物油脂,具体地,涉及一种提高产油微生物的油脂产量的方法和微生物油脂的制备方法。
背景技术:
2.多不饱和脂肪酸通常是指含有2个或以上的共轭或非共轭双键的一类脂肪酸,主要以甘油三酯的形式存在于动植物和微生物等来源的脂肪中,多不饱和脂肪酸被认为与人体正常新陈代谢有重要关联,并且具有抗炎症反应,抗氧化和降低高密度脂蛋白等特定的生理调节功能。多不饱和脂肪酸的来源主要是海洋鱼类油脂,木本植物油脂以及工业发酵法制备的微生物油脂。其中,微生物油脂(如裂殖壶菌藻油、被孢霉生产的油脂等)中的多不饱和脂肪酸含量能达到40%甚至更高,在医药、食品、日化、能源等领域具有广泛的应用。
3.裂殖壶菌(schizochytrium sp.)是一种典型的异养型产油真菌,与其他真菌类产油微生物(如解脂耶氏酵母、小球藻等)相比,生物量和油脂产量都处于较高水平。裂殖壶菌等微生物生成油脂是一个典型的高度消耗还原力过程,该过程以乙酰-coa为起始单元,以丙二酰-coa为延伸单元,经过多轮的“缩合-还原-脱水-还原”后生成长链脂肪酸。因此,实现微生物高效油脂积累的一个关键性因素是细胞质中能够产生足够的还原力,这也为寻找提高产油微生物的油脂产量的生产方式提供新的研发方向。
技术实现要素:
4.本发明的目的是为了克服现有技术存在的产油微生物油脂产量待进一步提高的问题,提供一种提高产油微生物的油脂产量的方法和微生物油脂的制备方法,能够促进产油微生物高效合成油脂,提高油脂的产量。
5.为了实现上述目的,本发明第一方面提供一种提高产油微生物的油脂产量的方法,该方法包括:将产油微生物与纳米量子点进行偶联形成量子点复合菌体,将所述量子点复合菌体接种至培养基中在光照条件下进行培养。
6.优选地,所述纳米量子点选自镓化砷纳米粒子、磷化铟纳米粒子和氮化镓纳米粒子中的至少一种,优选为磷化铟纳米粒子。
7.优选地,所述磷化铟纳米粒子为多酚官能化的磷化铟纳米粒子。
8.优选地,所述多酚官能化的磷化铟纳米粒子的制备方法包括以下步骤:
9.(1)将磷化铟粉末经研磨后与水混合,再进行超声处理、固液分离得到磷化铟纳米颗粒;
10.(2)在反应溶剂存在的条件下,将所述磷化铟纳米颗粒与铁盐、单宁酸混合进行反应i得到反应颗粒,将所述反应颗粒洗涤后与低级有机醇混合进行孵育。
11.优选地,步骤(1)中所述研磨的时间为30min以上,所述磷化铟粉末与水的重量比为1:400-2000。
12.优选地,所述固液分离的过程包括:将超声处理后的混合液进行离心得到附着在
管壁上的微颗粒,将所述微颗粒用水进行至少一次重悬、离心,得到平均粒径小于300nm的所述磷化铟纳米颗粒。
13.优选地,每次所述离心的条件包括:转速为6000-10000rpm,时间为3-8min。
14.优选地,步骤(2)中所述反应溶剂为水,所述铁盐选自氯化铁、硫酸铁和硝酸铁中的至少一种。
15.优选地,所述磷化铟纳米颗粒、单宁酸和铁盐的摩尔量比为2-4.5:1-2:1。
16.所述反应i的条件包括:温度为20-30℃,ph为6-7,时间为10-20min;
17.优选地,所述低级有机醇选自甲醇、乙醇、正丙醇和异丙醇中的至少一种,所述孵育的时间为8-12min。
18.优选地,所述偶联的过程包括:将所述产油微生物与聚烯丙基胺盐酸盐混合进行反应ii得到产油微生物修饰细胞,将所述产油微生物修饰细胞与所述纳米量子点混合进行反应iii。
19.优选地,所述产油微生物与聚烯丙基胺盐酸盐混合的过程包括:将含有所述产油微生物的悬浮液与含有所述聚烯丙基胺盐酸盐的溶液以体积比5-15:1进行混合,其中,所述产油微生物的悬浮液的od
600
为10-15,所述聚烯丙基胺盐酸盐的溶液浓度为40-60mg/l;
20.所述反应ii的条件包括:温度为20-40℃,时间为20-40s。
21.优选地,所述产油微生物修饰细胞与所述纳米量子点混合的过程包括:将含有所述产油微生物修饰细胞的悬浮液与含有所述纳米量子点的悬浮液以体积比40-150:1进行混合,其中,所述产油微生物修饰细胞的悬浮液的od
600
为10-15,所述纳米量子点的悬浮液的od
600
为30-40;
22.所述反应iii的条件包括:温度为20-40℃,时间为10-60s。
23.优选地,所述光照的波长为400nm-480nm。
24.优选地,所述培养的条件包括:接种量为5-12体积%,温度为25-35℃,转速为150-200rpm,时间为48-120h。
25.优选地,所述培养基含有碳源、氮源、无机盐离子和微量元素,所述微量元素选自mn
2+
、zn
2+
、co
2+
、cu
2+
、ni
2+
和fe
2+
中的任意一种或多种。
26.优选地,所述培养基含有:40-60g/l葡萄糖、0.3-0.5g/l酵母提取物、8-12g/l na2so4、0.5-1.5g/l(nh4)2so4、2-6g/l kh2po4、0.1-0.3g/l kcl、1-3g/l mgso4、15-25g/l谷氨酸钠、0.05-0.2g/l cacl2、4-8g/l na2edta、0.15-0.45g/l feso4、0.5-1.5g/l mncl2·
4h2o、0.5-1.5g/l znso4、0.01-0.02g/l cocl2·
6h2o、0.01-0.02g/l na2moo4·
2h2o、0.02-0.1g/l niso4·
6h2o和0.2-1g/l cuso4·
5h2o。
27.优选地,所述产油微生物选自裂殖壶菌、微藻和高山被孢霉中的至少一种,优选为裂殖壶菌。
28.本发明第二方面提供一种微生物油脂的制备方法,该制备方法包括:将产油微生物采用前述的方法进行培养得到培养液,将所述培养液进行破壁、提取。
29.优选地,所述破壁采用破壁酶酶解的方式,所述破壁酶选自纤维素酶和/或蛋白酶;相对于1l的所述培养液,所述破壁酶的用量为2-4g;所述提取溶剂为正己烷和/或乙醇。
30.通过上述技术方案,本发明的有益效果为:
31.本发明提供的提高产油微生物的油脂产量的方法,通过将产油微生物细胞与纳米
量子点进行偶联形成量子点复合菌体,在量子点复合菌体的发酵过程中,纳米量子点能够作为半导体捕获光照中的蓝光产生高活性光电子,使得产油微生物能够接收高活性光电子并将其转化为胞内还原力,进而实现产油微生物中油脂的高效合成,提高微生物油脂的生产效率、降低微生物油脂的生产成本,对于产油微生物具有极大的应用前景。
附图说明
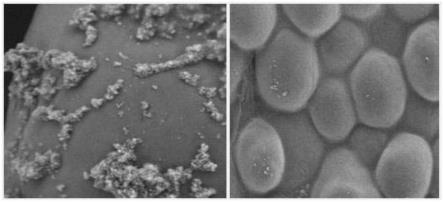
32.图1是实施例1中量子点复合菌体表面的纳米离子的电镜图。
具体实施方式
33.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
34.第一方面,本发明提供了一种提高产油微生物的油脂产量的方法,该方法包括:将产油微生物与纳米量子点进行偶联形成量子点复合菌体,将所述量子点复合菌体接种至培养基中在光照条件下进行培养。
35.本发明的发明人在研究过程中发现,通过将产油微生物细胞与具有半导体特性的纳米量子点相偶联结合,形成的量子点复合菌体为微生物-半导体复合体系,通过纳米量子点吸收光照中的蓝光产生高活性光电子,用于氧化还原辅因子的胞质再生,以满足微生物合成油脂过程中高度消耗还原力的需要,并进一步提高微生物生长过程中合成油脂的效率,提高微生物油脂的生产效率。
36.根据本发明,优选地,所述纳米量子点选自镓化砷纳米粒子、磷化铟纳米粒子和氮化镓纳米粒子中的至少一种,进一步优选为磷化铟纳米粒子。发明人发现,在该优选的具体实施方式下,应用于裂殖壶菌发酵时,能够有效增加裂殖壶菌胞内还原力水平,提高发酵液中的油脂含量。
37.根据本发明,磷化铟纳米粒子可以自行制备获得,也可以是商购获得;可以是磷化铟原料研磨成的纳米颗粒,也可以对磷化铟的纳米颗粒进行功能化修饰。优选地,所述磷化铟纳米粒子为多酚官能化的磷化铟纳米粒子。发明人发现,在该优选的具体实施方式下,有利于进一步促进产油微生物合成油脂。
38.根据本发明,优选地,所述多酚官能化的磷化铟纳米粒子的制备方法包括以下步骤:
39.(1)将磷化铟粉末经研磨后与水混合,再进行超声处理、固液分离得到磷化铟纳米颗粒;
40.(2)在反应溶剂存在的条件下,将所述磷化铟纳米颗粒与铁盐、单宁酸混合进行反应i得到反应颗粒,将所述反应颗粒洗涤后与低级有机醇混合进行孵育。
41.本发明中,所述水均采用超纯水,例如,采用美国millipore公司生产的milli-q academic a10或milli-q biocel型超纯水系统生产的超纯水(简称mq水)。
42.本发明中,优选地,步骤(1)中所述研磨的时间为30min以上,通过研磨将磷化铟粉末进一步粉碎成细粉。所述磷化铟粉末与水的重量比为1:400-2000,两者混合后通过超声
使得磷化铟颗粒在水中充分进行分散,以能够与固液分离相配合,将磷化铟颗粒中粒径较大的颗粒与粒径较小的颗粒进行分离。
43.本发明中,固液分离可以采用离心、过滤、静置等本领域常规的分离方式。优选地,所述固液分离采用离心,发明人发现,在该优选的具体实施方式下,通过离心的方式能够将具有较大尺寸的磷化铟颗粒在离心管的底部旋转形成颗粒,而较小的磷化铟颗粒附着在离心管的管壁上,更好地实现粒径较大的颗粒与粒径较小的颗粒进行有效分离。
44.根据本发明,优选地,所述固液分离的过程包括:将超声处理后的混合液进行离心,小心丢弃离心管中的沉淀物和上清液,得到附着在管壁上的微颗粒,将所述管壁上微颗粒用水进行至少一次重悬、离心,得到平均粒径小于300nm的所述磷化铟纳米颗粒。发明人发现,在该优选的具体实施方式下,磷化铟纳米颗粒能够更高效地进行多酚官能化的修饰,进而提高磷化铟纳米粒子与产油微生物的偶联效率。
45.根据本发明,优选地,每次所述离心的条件包括:转速为6000-10000rpm,时间为3-8min。
46.根据本发明,优选地,步骤(2)中所述反应溶剂为水,所述铁盐选自氯化铁、硫酸铁和硝酸铁中的至少一种,更优选为氯化铁。
47.本发明中,步骤(2)中磷化铟纳米颗粒与铁盐、单宁酸可以分别与反应溶剂混合形成各自对应的溶液后,再进行混合。示例性地,磷化铟纳米颗粒(平均粒径小于300nm)以od
600
为30-40的水溶液(磷化铟纳米颗粒的浓度约为10mg/ml)进行混合;铁盐为氯化铁时,其以fecl3·
6h2o的浓度为0.3-0.8g/ml的水溶液进行混合,以能够提高反应i的反应效率。
48.根据本发明,优选地,所述磷化铟纳米颗粒、单宁酸和铁盐的摩尔量比为2-4.5:1-2:1。所述反应i的条件包括:温度为20-30℃,ph为6-7,时间为10-20min;其中,ph可以通过在反应溶液中添加tris缓冲溶液(ph8.0,100mm)来进行调节。
49.本发明中,反应i结束后可以通过常规的固液分离方式将固体分离出,并用水洗涤3-4次得到反应颗粒。
50.根据本发明,优选地,所述低级有机醇选自甲醇、乙醇、正丙醇和异丙醇中的至少一种,所述孵育的时间为8-12min。孵育结束后,可以继续用水洗涤3-4次,再经固液分离得到固体颗粒,即为多酚官能化的磷化铟纳米粒子。
51.根据本发明,所述偶联的过程能够将产油微生物与纳米量子点进行接触使得两者偶联形成结合体即可。优选地,所述偶联的过程包括:将所述产油微生物与聚烯丙基胺盐酸盐混合进行反应ii得到产油微生物修饰细胞,将所述产油微生物修饰细胞与所述纳米量子点混合进行反应iii。发明人发现,在该优选的具体实施方式下,将微生物细胞利用聚烯丙基胺盐酸盐(pah)进行修饰,能够消除纳米量子点之间的电排斥作用,以提升产油微生物与纳米量子点偶联结合的效率,提高量子点复合菌体的稳定性。
52.根据本发明,优选地,所述产油微生物与聚烯丙基胺盐酸盐混合的过程包括:将含有所述产油微生物的悬浮液与含有所述聚烯丙基胺盐酸盐的溶液以体积比5-15:1进行混合,其中,所述产油微生物的悬浮液的od
600
为10-15,所述聚烯丙基胺盐酸盐的溶液浓度为40-60mg/l。所述反应ii的条件包括:温度为20-40℃,时间为20-40s。发明人发现,在该优选的具体实施方式下,有利于提高反应ii的反应效率。具体地,反应ii的过程为:在室温条件下,将混合液在低转速(500-2000rpm)下离心20-40s,得到反应固体,再用水洗涤2-4次后得
到产油微生物修饰细胞。
53.根据本发明,优选地,所述产油微生物修饰细胞与所述纳米量子点混合的过程包括:将含有所述产油微生物修饰细胞的悬浮液与含有所述纳米量子点的悬浮液以体积比40-150:1进行混合,其中,所述产油微生物修饰细胞的悬浮液的od
600
为10-15,所述纳米量子点的悬浮液的od
600
为30-40。所述反应iii的条件包括:温度为20-40℃,时间为10-60s。发明人发现,在该优选的具体实施方式下,有利于提高反应iii的反应效率,进而提升产油微生物合成油脂的效率。具体地,反应iii的过程为:在室温条件下,将混合液旋转10-60s,经过固液分离得到反应固体,再用水洗涤2-4次后得到量子点复合菌体。
54.根据本发明,所述光照可以采用本领域内常规的光照波长、光照强度等条件。优选地,所述光照的波长为400nm-480nm,即采用蓝光光照,发明人发现,在该优选的具体实施方式下,有利于纳米量子点高效捕光产生高活性光子,进而实现微生物中油脂的高效合成。
55.本发明对量子点复合菌体培养的方法没有特别的限制,只要通过该培养的方法可以使量子点复合菌体中的产油微生物大量增殖即可。优选地,所述培养的条件包括:接种量为5-12体积%,温度为25-35℃,转速为150-200rpm,时间为48-120h。发明人发现,在该优选的具体实施方式下,有利于促进产油微生物的生长,提高发酵的生物量。
56.本发明中,与纳米量子点进行偶联的产油微生物可以是将产油微生物进行常规培养增殖后获得的微生物菌体。根据产油微生物的生长特性,产油微生物菌中需要经过种子培养和发酵培养,以获得高活力、高浓度的产油微生物细胞,与纳米量子点进行偶联。具体地,将产油微生物菌种接种至种子培养基中进行活化培养得到活化培养液,将活化培养基接种至种子培养基中进行至少一次种子培养得到种子培养液,再将种子培养液接种至发酵培养基中进行发酵培养得到发酵培养液,最后将发酵培养液经固液分离得到菌体,将菌体用水洗涤2-4次后获得与纳米量子点进行偶联的产油微生物。
57.根据本发明,优选情况下,种子培养基的接种量为1-5体积%,发酵培养基的接种量为5-12体积%;活化培养和种子培养所采用的温度、ph、转速、时间等参数,可以是本领域内的常规设置。优选地,活化培养、种子培养和发酵培养的条件各自独立地包括:温度为25-35℃,转速为150-200rpm,时间为20-30h。发明人发现,在该优选的具体实施方式下,有利于促进产油微生物的生长,提高发酵的生物量。
58.根据本发明,优选地,所述培养基含有碳源、氮源、无机盐离子和微量元素,所述微量元素选自mn
2+
、zn
2+
、co
2+
、cu
2+
、ni
2+
和fe
2+
中的任意一种或多种。
59.根据本发明,为了能够进一步提高产油微生物生产的油脂含量,优选地,所述培养基含有:40-60g/l葡萄糖、0.3-0.5g/l酵母提取物、8-12g/l na2so4、0.5-1.5g/l(nh4)2so4、2-6g/l kh2po4、0.1-0.3g/l kcl、1-3g/l mgso4、15-25g/l谷氨酸钠、0.05-0.2g/l cacl2、4-8g/l na2edta、0.15-0.45g/l feso4、0.5-1.5g/l mncl2·
4h2o、0.5-1.5g/l znso4、0.01-0.02g/l cocl2·
6h2o、0.01-0.02g/l na2moo4·
2h2o、0.02-0.1g/l niso4·
6h2o和0.2-1g/l cuso4·
5h2o。
60.上述种子培养基和发酵培养基的组分与量子点复合菌体的培养基组分相同。
61.根据本发明,所述产油微生物可以选用任意一种能够经培养合成含有多不饱和脂肪酸的油脂的微生物。优选地,所述产油微生物选自裂殖壶菌、微藻和高山被孢霉中的至少一种,更优选为裂殖壶菌。发明人发现,在该优选的具体实施方式下,量子点复合菌体能够
对裂殖壶菌的生长和油脂合成形成更优的提升作用。
62.基于上述提高产油微生物的油脂产量的方法,第二方面,本发明提供一种微生物油脂的制备方法,该制备方法包括:将产油微生物采用前述的方法进行培养得到培养液,将所述培养液进行破壁、提取。
63.根据本发明,培养液中产油微生物的细胞破壁可以采用本领域常规的方式,优选地,采用破壁酶酶解方法进行所述破壁,以能够提高破壁效率,减小对微生物细胞中代谢产物的破坏。
64.根据本发明,优选地,所述破壁酶选自纤维素酶和/或蛋白酶。进一步优选地,相对于1l的所述培养液,所述破壁酶的用量为2-4g,具体可以为2g/l、3g/l、4g/l,或上述任意两个数值所构成的范围中的任意值。
65.根据本发明,优选地,所述破壁的条件包括:ph为10-12,具体可以为10、11、12,或上述任意两个数值所构成的范围中的任意值;转速为150-200rpm,具体可以为150rpm、160rpm、170rpm、180rpm、190rpm、200rpm,或上述任意两个数值所构成的范围中的任意值;温度为45-55℃,具体可以为45℃、50℃、55℃,或上述任意两个数值所构成的范围中的任意值;时间为1-3h,具体可以为1h、2h、3h,或上述任意两个数值所构成的范围中的任意值。
66.根据本发明,为了提高对微生物油脂的提取效率,优选地,所述提取溶剂为正己烷和/或乙醇,优选为正己烷和乙醇,以利用乙醇破碎微生物细胞的同时,利用正己烷萃取油脂。所提取的油脂中含有油酸、棕榈酸(c16)、亚油酸、二十碳五烯酸(epa)、二十二碳五烯酸(dpa)、二十二碳六烯酸(dha)等多不饱和脂肪酸。
67.根据本发明一种特别优选的实施方式,提供一种微生物油脂的制备方法,该方法包括:
68.(1)将甘油管保藏的菌种按1-5%(v/v)的接种量接入种子培养基中,在温度为25-35℃,转速为150-200rpm的条件下培养20-30h得到活化培养液,取活化培养液按1-5%(v/v)的接种量接入种子培养基中,在温度为25-35℃,转速为150-200rpm的条件下培养20-30h得到一代种子液,再将一代种子液按1-5%(v/v)的接种量接入种子培养基中,在温度为25-35℃,转速为150-200rpm的条件下培养20-30h得到二代种子液;
69.(2)将二代种子液以5-12%(v/v)的接种量接入发酵培养基中,在温度为25-35℃,转速为150-200rpm的条件下发酵20-30h,得到发酵培养液;
70.(3)将发酵培养液经固液分离得到菌体,将菌体用水洗涤2-4次后,重悬于水中,得到含有产油微生物的悬浮液(od
600
为10-15),再与浓度为50mg/ml的烯丙胺盐酸盐溶液以体积比为5-15:1混合后,在室温条件下以低转速(500-2000rpm)的离心20-40s,得到反应固体,再用水洗涤2-4次后得到产油微生物修饰细胞;
71.(4)将产油微生物修饰细胞重悬于水中形成产油微生物修饰细胞的悬浮液(od
600
为10-15),再与含有多酚官能化的磷化铟纳米粒子的悬浮液(od
600
为30-40)以体积比40-150:1进行混合后在室温条件下,将混合液旋转10-60s,经过固液分离得到反应固体,再用水洗涤2-4次后得到量子点复合菌体;
72.(5)将量子点复合菌体用水重悬(od
600
为5-20)后,以5-12%(v/v)的接种量接入培养基中,在波长为400nm-480nm的光线照射、温度为25-35℃,转速为150-200rpm的条件下,进行培养48h-120h,定时补充碳源,直至碳源消耗为0,得到培养液;
73.(6)将破壁酶以2-4g/l的添加量加入步骤(5)得到的培养液中,在ph为10-12、转速为150-200rpm、温度为45-55℃的条件下酶解1-3h得到破壁液,将破壁液与正己烷、乙醇以体积比1:1:1混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂。
74.以下将通过实施例对本发明进行详细描述。
75.以下实施例和对比例中,裂殖壶菌为schizochytrium sp.hx-308,由本实验室自主从沿海区域分离筛选获得,现保藏在中国典型培养物保藏中心(简称cctcc),保藏号为cctcc m 209059,已在公开号为cn106947706a的专利申请中记载;超纯水(md水)采用美国millipore公司生产的milli-q academic a10超纯水系统生产;磷化铟原料购于阿拉丁公司、型号为22398-80-7,单宁酸购于默克公司、型号为1401-55-4,聚烯丙基胺盐酸盐(pah)购于上海贤鼎生物科技有限公司、型号为71550-12-4,其他原料和试剂均为商购获得,所述室温为25
±
5℃。
76.种子培养基、发酵培养基和量子点复合菌体的培养基的组分为:50g/l葡萄糖、0.4g/l酵母提取物、10g/l na2so4、0.8g/l(nh4)2so4、4g/l kh2po4、0.2g/l kcl、2g/l mgso4、20g/l谷氨酸钠、0.1g/l cacl2、6g/l na2edta、0.29g/l feso4、0.86g/l mncl2·
4h2o、0.8g/l znso4、0.01g/l cocl2·
6h2o、0.01g/l na2moo4·
2h2o、0.06g/l niso4·
6h2o和0.6g/l cuso4·
5h2o,121℃高温灭菌20min后备用。
77.以下实施例和对比例中,培养时波长为400nm-480nm的光照条件通过蓝光毯实现。
78.葡萄糖浓度的测定:取一定量的培养液,离心,取上清稀释100倍,用生物传感器(生产厂家为山东省科学院生物研究所、型号sba-40c)进行检测。
79.细胞干重的测定:取一定体积的培养液(5-10ml)至离心管进行离心(4000rpm,5min),去离子水洗涤两次,弃上清,将菌体置于60℃烘箱中烘干至恒重,计算。
80.油脂含量的测定:取一定体积的培养液(50ml),用naoh将ph调至10-12之间,按3
‰
(g/l)的比例添加破壁酶,50℃下搅拌并保温2h;按1:1:1(发酵液:乙醇:正己烷)(v/v)比例分别添加乙醇、正己烷,搅拌、分层、萃取,连续萃取2-3次,取正己烷相真空旋转蒸干获取油脂,置于烘箱中烘至恒重,冷却后称重。
81.脂肪酸组成的测定采用甲酯化方法:取20μl油脂,加入400μl naoh浓度为0.5mol/l的naoh-甲醇溶液重悬,震荡2h加入40μl浓硫酸,再加400μl的正己烷进行萃取震荡结束后,离心取上清有机部分进行气相分析;
82.气相分析条件:色谱柱:db-23(60m*0.25mm*0.25μm);检测器:fid;载气:氮气;分流比:30/l;进样口温度:250℃;检测器温度:280℃;进样量:1μl;升温程序:初始柱温为100℃,先以25℃/min的速度升至196℃,再以2℃/min的速度升至220℃,保持12min。柱流速:3.0ml/min;尾吹流速:30ml/min;氢气流速:40ml/min;空气流速:400ml/min。
83.制备例1
84.(1-1)称量约2.0g磷化铟(inp)原料并转移至研钵中,通过温和粉碎成细粉(30min以上)并转移到2ml的ep管中,使用1.0ml超纯水悬浮研磨后的inp粉末(1.5mg),进行超声处理以分散颗粒,以转速8000g离心5min以分离大小,具有较大尺寸的颗粒在底部旋转形成颗粒,而较小的颗粒附着在管壁上;小心丢弃ep管中的沉淀物和上清液,ep管中加入超纯水进行3次超声处理重悬、离心,获得平均粒径小于300nm的inp纳米颗粒;
85.(1-2)将inp纳米颗粒加入一定量的超纯水制成od
600
约为35的inp纳米颗粒溶液,
将100μl浓度为0.5g/ml的fecl3·
6h2o溶液加入10ml的inp纳米颗粒溶液中,再加入0.4g单宁酸,加入tris缓冲溶液(ph8.0,100mm)将ph调节为6.5,在温度为25℃下反应15min,反应结束后经离心得到固体,将固体用超纯水洗涤3-4次得到反应颗粒,将反应颗粒与70体积%乙醇-水溶液混合进行孵育10min,再用超纯水洗涤3-4次(洗涤过程中以8000g离心5min,以离心分离出颗粒,并除去上清液),得到多酚官能化的磷化铟纳米粒子。
86.制备例2
87.(1-1)称量约2.0g磷化铟(inp)原料并转移至研钵中,通过温和粉碎成细粉(30min以上)并转移到2ml的ep管中,使用1.0ml超纯水悬浮研磨后的inp粉末(0.5mg),进行超声处理以分散颗粒,以转速6000g离心8min以分离大小,具有较大尺寸的颗粒在底部旋转形成颗粒,而较小的颗粒附着在管壁上;小心丢弃ep管中的沉淀物和上清液,ep管中加入超纯水进行3次超声处理重悬、离心,获得平均粒径小于300nm的inp纳米颗粒;
88.(1-2)将inp纳米颗粒加入一定量的超纯水制成od
600
约为30的inp纳米颗粒溶液,将180μl浓度为0.5g/ml的fecl3·
6h2o溶液加入10ml的inp纳米颗粒溶液中,再加入0.58g单宁酸,加入tris缓冲溶液(ph8.0,100mm)将ph调节为6,在温度为20℃下反应20min,反应结束后经离心得到固体,将固体用超纯水洗涤3-4次得到反应颗粒,将反应颗粒与70体积%乙醇-水溶液混合进行孵育10min,再用超纯水洗涤3-4次(洗涤过程中以8000g离心5min,以离心分离出颗粒,并除去上清液),得到多酚官能化的磷化铟纳米粒子。
89.制备例3
90.(1-1)称量约2.0g磷化铟(inp)原料并转移至研钵中,通过温和粉碎成细粉(30min以上)并转移到2ml的ep管中,使用1.0ml超纯水悬浮研磨后的inp粉末(2.5mg),进行超声处理以分散颗粒,以转速8000g离心5min以分离大小,具有较大尺寸的颗粒在底部旋转形成颗粒,而较小的颗粒附着在管壁上;小心丢弃ep管中的沉淀物和上清液,ep管中加入超纯水进行3次超声处理重悬、离心,获得平均粒径小于300nm的inp纳米颗粒;
91.(1-2)将inp纳米颗粒加入一定量的超纯水制成od
600
约为40的inp纳米颗粒溶液,将85μl浓度为0.5g/ml的fecl3·
6h2o溶液加入10ml的inp纳米颗粒溶液中,再加入0.5g单宁酸,加入tris缓冲溶液(ph8.0,100mm)将ph调节为7,在温度为30℃下反应10min,反应结束后经离心得到固体,将固体用超纯水洗涤3-4次得到反应颗粒,将反应颗粒与70体积%乙醇-水溶液混合进行孵育10min,再用超纯水洗涤3-4次(洗涤过程中以8000g离心5min,以离心分离出颗粒,并除去上清液),得到多酚官能化的磷化铟纳米粒子。
92.制备例4
93.(1-1)称量约2.0g磷化铟(inp)原料并转移至研钵中,通过温和粉碎成细粉(30min以上)并转移到2ml的ep管中,使用1.0ml超纯水悬浮研磨后的inp粉末(1.5mg),进行超声处理以分散颗粒,以转速8000g离心5min以分离大小,具有较大尺寸的颗粒在底部旋转形成颗粒,而较小的颗粒附着在管壁上;小心丢弃ep管中的沉淀物和上清液,ep管中加入超纯水进行3次超声处理重悬、离心,获得平均粒径小于300nm的inp纳米颗粒;
94.(1-2)将inp纳米颗粒加入一定量的超纯水制成od
600
约为35的inp纳米颗粒溶液,将100μl浓度为0.5g/ml的fecl3·
6h2o溶液加入10ml的inp纳米颗粒溶液中,再加入0.4g单宁酸,加入tris缓冲溶液(ph8.0,100mm)将ph调节为6.5,在温度为25℃下反应15min,反应结束后经离心得到固体,将固体用超纯水洗涤3-4次得到多酚官能化的磷化铟纳米粒子。
95.制备例5
96.按照制备例1的方法制备多酚官能化的磷化铟纳米粒子,不同的是,将步骤(1-2)中的0.4g单宁酸替换为46mg柠檬酸。
97.制备例6
98.按照制备例1的方法制备多酚官能化的磷化铟纳米粒子,不同的是,将步骤(1-2)中不添加0.4g单宁酸。
99.制备例7
100.(1-1)称量约2.0g磷化铟(inp)原料并转移至研钵中,通过温和粉碎成细粉(30min以上)并转移到2ml的ep管中,使用1.0ml超纯水悬浮研磨后的inp粉末(1.5mg),进行超声处理以分散颗粒,以转速8000g离心5min以分离大小,具有较大尺寸的颗粒在底部旋转形成颗粒,而较小的颗粒附着在管壁上;小心丢弃ep管中的沉淀物和上清液,ep管中加入超纯水进行3次超声处理重悬、离心,获得平均粒径小于300nm的inp纳米颗粒;
101.(1-2)将0.1g的inp纳米颗粒在121.3℃进行高压湿热灭菌3h,然后与含有10重量%胎牛血清的1640培养基混合,配置成inp纳米颗粒浓度为1mg/ml的浑浊液,将浑浊液经过超声震荡48h,获得分散均匀的母液,4℃储存备用。
102.实施例1
103.(1)将甘油管保藏的裂殖壶菌菌种按2%(v/v)的接种量接入种子培养基中,在温度为28℃,转速为170rpm的条件下培养24h得到活化培养液,取活化培养液按2%(v/v)的接种量接入种子培养基中,在温度为28℃,转速为170rpm的条件下培养24h得到一代种子液,再将一代种子液按2%(v/v)的接种量接入种子培养基中,在温度为28℃,转速为170rpm的条件下培养24h得到二代种子液;
104.(2)将二代种子液以10%(v/v)的接种量接入发酵培养基中,在温度为28℃,转速为170rpm的条件下发酵24h,得到发酵培养液;
105.(3)将发酵培养液经固液分离得到菌体,将菌体用水洗涤3次后,重悬于水中,得到含有产油微生物的悬浮液(od
600
约为12),再与浓度为50mg/ml的烯丙胺盐酸盐溶液以体积比为10:1混合后,在室温条件下以低转速(1000rpm)的离心30s,得到反应固体,再用水洗涤3次后得到产油微生物修饰细胞;
106.(4)将产油微生物修饰细胞重悬于水中形成产油微生物修饰细胞的悬浮液(od
600
约为12),再与含有制备例1得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35)以体积比125:1进行混合后,在室温条件下旋转30s,经过离心分离得到反应固体,再用水洗涤3次后得到量子点复合菌体;利用扫描电镜对量子点复合菌体表面的纳米离子进行检测,以证明微生物-半导体系统的形成,结果见图1,发现磷化铟纳米粒子有效地结合到裂殖壶菌细胞表面(图1);
107.(5)将量子点复合菌体用水重悬(od
600
约为10)后,以10%(v/v)的接种量接入培养基中,在波长为400nm-480nm的光线(蓝光)照射、温度为28℃,转速为170rpm的条件下,进行培养48h-120h,每隔24h补充5ml浓度为500g/l的葡萄糖溶液,直至葡萄糖消耗为0,得到培养液;
108.(6)将破壁酶以3g/l的添加量加入步骤(5)得到的培养液中,在ph为11、转速为180rpm、温度为50℃的条件下酶解2h得到破壁液,将破壁液与正己烷、乙醇以体积比1:1:1
混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂。
109.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
110.实施例2
111.(1)将甘油管保藏的裂殖壶菌菌种按2%(v/v)的接种量接入种子培养基中,在温度为25℃,转速为200rpm的条件下培养30h得到活化培养液,取活化培养液按5%(v/v)的接种量接入种子培养基中,在温度为25℃,转速为200rpm的条件下培养30h得到一代种子液,再将一代种子液按5%(v/v)的接种量接入种子培养基中,在温度为25℃,转速为200rpm的条件下培养30h得到二代种子液;
112.(2)将二代种子液以5%(v/v)的接种量接入发酵培养基中,在温度为35℃,转速为150rpm的条件下发酵20h,得到发酵培养液;
113.(3)将发酵培养液经固液分离得到菌体,将菌体用水洗涤2次后,重悬于水中,得到含有产油微生物的悬浮液(od
600
约为10),再与浓度为50mg/ml的烯丙胺盐酸盐溶液以体积比为5:1混合后,在室温条件下以低转速(500rpm)的离心40s,得到反应固体,再用水洗涤2次后得到产油微生物修饰细胞;
114.(4)将产油微生物修饰细胞重悬于水中形成产油微生物修饰细胞的悬浮液(od
600
约为10),再与含有制备例2得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为40)以体积比40:1进行混合后,在室温条件下旋转15s,经过离心分离得到反应固体,再用水洗涤2次后得到量子点复合菌体;
115.(5)将量子点复合菌体用水重悬(od
600
约为8)后,以5%(v/v)的接种量接入培养基中,在波长为400nm-480nm的光线照射、温度为35℃,转速为150rpm的条件下,进行培养48h-120h,每隔24h补充5ml浓度为500g/l的葡萄糖溶液,直至碳源消耗为0,得到培养液;
116.(6)将破壁酶以2g/l的添加量加入步骤(5)得到的培养液中,在ph为10、转速为150rpm、温度为45℃的条件下酶解3h得到破壁液,将破壁液与正己烷、乙醇以体积比1:1:1混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂。
117.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
118.实施例3
119.(1)将甘油管保藏的裂殖壶菌菌种按1%(v/v)的接种量接入种子培养基中,在温度为35℃,转速为150rpm的条件下培养20h得到活化培养液,取活化培养液按1%(v/v)的接种量接入种子培养基中,在温度为35℃,转速为150rpm的条件下培养20h得到一代种子液,再将一代种子液按1%(v/v)的接种量接入种子培养基中,在温度为35℃,转速为150rpm的条件下培养20h得到二代种子液;
120.(2)将二代种子液以12%(v/v)的接种量接入发酵培养基中,在温度为25℃,转速为200rpm的条件下发酵30h,得到发酵培养液;
121.(3)将发酵培养液经固液分离得到菌体,将菌体用水洗涤4次后,重悬于水中,得到含有产油微生物的悬浮液(od
600
约为15),再与浓度为50mg/ml的烯丙胺盐酸盐溶液以体积比为15:1混合后,在室温条件下以低转速(2000rpm)的离心20s,得到反应固体,再用水洗涤4次后得到产油微生物修饰细胞;
122.(4)将产油微生物修饰细胞重悬于水中形成产油微生物修饰细胞的悬浮液(od
600
约为15),再与含有制备例3得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为30)以体积比150:1进行混合后,在室温条件下旋转60s,经过离心分离得到反应固体,再用水洗涤4次后得到量子点复合菌体;
123.(5)将量子点复合菌体用水重悬(od
600
为15)后,以12%(v/v)的接种量接入培养基中,在波长为400nm-480nm的光线照射、温度为25℃,转速为200rpm的条件下,进行培养48h-120h,每隔24h补充5ml浓度为500g/l的葡萄糖溶液,直至碳源消耗为0,得到培养液;
124.(6)将破壁酶以4g/l的添加量加入步骤(5)得到的培养液中,在ph为12、转速为200rpm、温度为55℃的条件下酶解1h得到破壁液,将破壁液与正己烷、乙醇以体积比1:1:1混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂。
125.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
126.实施例4
127.按照实施例1的方法制备微生物油脂,不同的是,将步骤(4)中含有制备例1得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35),替换为含有制备例1的步骤(1-1)得到的inp纳米颗粒的悬浮液(od
600
约为35)。
128.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
129.实施例5
130.按照实施例1的方法制备微生物油脂,不同的是,将步骤(4)中含有制备例1得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35),替换为含有制备例4得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35)。
131.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
132.实施例6
133.按照实施例1的方法制备微生物油脂,不同的是,将步骤(4)中含有制备例1得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35),替换为含有制备例5得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35)。
134.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
135.实施例7
136.按照实施例1的方法制备微生物油脂,不同的是,将步骤(4)中含有制备例1得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35),替换为含有制备例6得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35)。
137.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
138.实施例8
139.按照实施例1的方法制备微生物油脂,不同的是,将步骤(4)中含有制备例1得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35),替换为含有制备例7得到的inp纳米
颗粒浑浊液。
140.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
141.实施例9
142.按照实施例1的方法制备微生物油脂,不同的是,将步骤(3)和步骤(4)替换为:
143.(3)将发酵培养液经固液分离得到菌体,将菌体用水洗涤3次后,重悬于水中,得到含有产油微生物的悬浮液(od
600
约为12);
144.(4)将含有产油微生物的悬浮液(od
600
约为12),与含有制备例1得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35)以体积比125:1进行混合后,在室温条件下旋转30s,经过离心分离得到反应固体,再用水洗涤3次后得到量子点复合菌体。
145.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
146.实施例10
147.按照实施例1的方法制备微生物油脂,不同的是,将步骤(3)中50mg/ml的烯丙胺盐酸盐溶液替换为50mg/ml的乙二胺四乙酸溶液。
148.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
149.实施例11
150.按照实施例1的方法制备微生物油脂,不同的是,将步骤(5)中波长为400nm-480nm的光线(蓝光)照射替换为白炽灯光线照射。
151.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
152.对比例1
153.(1)将甘油管保藏的裂殖壶菌菌种按2%(v/v)的接种量接入种子培养基中,在温度为28℃,转速为170rpm的条件下培养24h得到活化培养液,取活化培养液按2%(v/v)的接种量接入种子培养基中,在温度为28℃,转速为170rpm的条件下培养24h得到一代种子液,再将一代种子液按2%(v/v)的接种量接入种子培养基中,在温度为28℃,转速为170rpm的条件下培养24h得到二代种子液;
154.(2)将二代种子液以10%(v/v)的接种量接入发酵培养基中,在温度为28℃,转速为170rpm的条件下发酵48h-120h,每隔24h补充5ml浓度为500g/l的葡萄糖溶液,直至葡萄糖消耗为0,得到发酵培养液;
155.(3)将破壁酶以3g/l的添加量加入步骤(2)得到的发酵培养液中,在ph为11、转速为180rpm、温度为50℃的条件下酶解2h得到破壁液,将破壁液与正己烷、乙醇以体积比1:1:1混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂。
156.对步骤(2)得到的发酵培养液进行生物量测定,步骤(3)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
157.对比例2
158.按照实施例1的方法制备微生物油脂,不同的是,将步骤(4)中含有制备例1得到的多酚官能化的磷化铟纳米粒子的悬浮液(od
600
约为35),替换为含有磷化铟原料的悬浮液
(浓度为10mg/ml)。
159.对步骤(5)得到的发酵培养液进行生物量测定,步骤(6)得到的微生物油脂进行油脂含量计算,并测定微生物油脂中多不饱和脂肪酸的含量,结果见表1。
160.通过表1的结果可以看出,实施例采用本发明提供的方法将裂殖壶菌与多酚官能化的磷化铟纳米粒子进行偶联形成量子点复合菌体,使得产油微生物能够接收高活性光电子并将其转化为胞内还原力,进而实现产油微生物中油脂的高效合成,提高微生物油脂的生产效率。
161.表1
[0162][0163]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1