一种具有特定功能的氢氧化菌菌群及其筛选方法和应用
1.本发明属于微生物领域,具体涉及一种具有特定功能的氢氧化菌菌群及其筛选方法和应用。
背景技术:
2.氢氧化菌(hob)是一类能够以h2作为电子供体,以o2作为电子受体,同化co2和氨氮的细菌。研究表明,利用氢氧化菌可合成许多高附加值产物,如phb、单细胞蛋白、醇类、萜类,植物促生剂等。
3.目前,有关氢氧化菌的利用报道大多都是单一的氢氧化菌,根据不同种类的单一氢氧化菌的自身特性,发酵生产不同的高附加值产物。另外,也有少数几篇报道是将几种单一氢氧化菌复配混合后发酵生产各种物质。现有技术的方式均要求培养过程不能受到外界环境的干扰和污染,生产成本高,工艺复杂,且往往氢氧化菌并不能实现其最大化生产。
4.在氢氧化菌可以生成的高附加值产物中,单细胞蛋白(single cell protein,scp)和聚β-羟基丁酸(poly-β-hydroxybutyric acid,phb)具有广泛的应用前景。单细胞蛋白是一种性价比高的蛋白质来源,在饲料、食品乃至医疗领域都潜力巨大。phb是一种碳源类贮藏物,物理性质与结构与聚丙烯相似,具有无毒、可塑和易降解等特点,因此在医用器材、工业器具、农用产品等领域都具有诸多优势。
5.如果能够提供一种生产成本低、方法简单、对培养环境要求低的筛选特定功能的氢氧化菌菌群的方法,可通过简单调整培养条件即可获得具有不同功能的氢氧化菌菌群,从而获得不同的高附加值产物,将具有广泛的应用前景。
技术实现要素:
6.本发明的目的是提供一种具有特定功能的氢氧化菌菌群及其筛选方法和应用。
7.为实现上述发明目的,本发明所采用的技术方案是:一种可调整微生物产物种类和产量的氢氧化菌菌群筛选方法,通过调整培养环境中的氢气和氧气用量关系实现。
8.优选的,所述微生物产物包括单细胞蛋白和聚β-羟基丁酸中的任意一种或两种混合。
9.优选的,氢气与氧气的体积比为2:1时,获得高产聚β-羟基丁酸的氢氧化菌菌群。
10.优选的,氢气与氧气的体积比为4:1时,获得高产单细胞蛋白的氢氧化菌菌群。
11.相应的,利用所述方法筛选获得的氢氧化菌菌群。
12.相应的,利用所述方法筛选获得的一种氢氧化菌菌群,按活菌量,包括:25~27%pandoraea、20~22%dyella、21~23%xanthobacter、18~20%chujaibacter。
13.相应的,利用所述方法筛选获得的一种氢氧化菌菌群,按活菌量,包括:33~35%achromobacter、24~26%enterobacter、9~11%dyella、5~7%pandoraea、5~7%starkeya。
14.相应的,利用所述方法筛选获得的一种氢氧化菌菌群,按活菌量,包括:90~92%
hydrogenophaga、2~4%starkeya、1~3%chryseobactetium、0.5~1.5%xanthobacter。
15.相应的,利用所述方法筛选获得的一种氢氧化菌菌群,按活菌量,包括:53~55%starkeya、16~18%hydrogenophaga、7~9%xanthobacter、4~6%nubsella、3~5%filimonas。
16.相应的,利用所述方法筛选获得的一种氢氧化菌菌群,按活菌量,包括:37~39%chryseobacterium、22~24%bradyrhizobium、10~12%sphingobacterium、6~8%starkeya、3~5%xanthobacter、2~4%mesorhizobium、1~3%dysgonomonas、1~3%enterobacter、1~3%devosia、1~3%pleomorphomonas、0.5~1.5%mucilaginibacter。
17.本发明具有以下有益效果:本发明提供了一种新的筛选氢氧化菌混合菌群的方法。利用发酵罐对氢氧化菌混菌体系进行培养,通过改变气体比例和水力停留时间,可优化氢氧化菌的种群结构,分别获得高产单细胞蛋白和高产phb的混合菌群。通过培养条件的优化,可稳定维持氢氧化菌的种群结构,且对培养环境要求不高,即使存在少量杂菌,也不会影响整体发明目的的实现,可有效克服氢氧化纯菌发酵的缺陷,实现对氢氧化菌菌群功能的调节和产物的高效生产,达到与纯菌发酵相当的水平。
18.本发明还具有重要的环保意义。氢氧化菌以二氧化碳为碳源,如果大规模发酵培养氢氧化菌,可有效缓解高碳排放带来的环境问题。同时,生产获得的单细胞蛋白可代替高蛋白食品和饲料等,弥补大规模种植、养殖对于有限土地资源的消耗,避免一部分养殖带来的环境问题。生产获得的phb是降解率高的环保型塑料原材料来源,有望解决“白色污染”问题。
附图说明
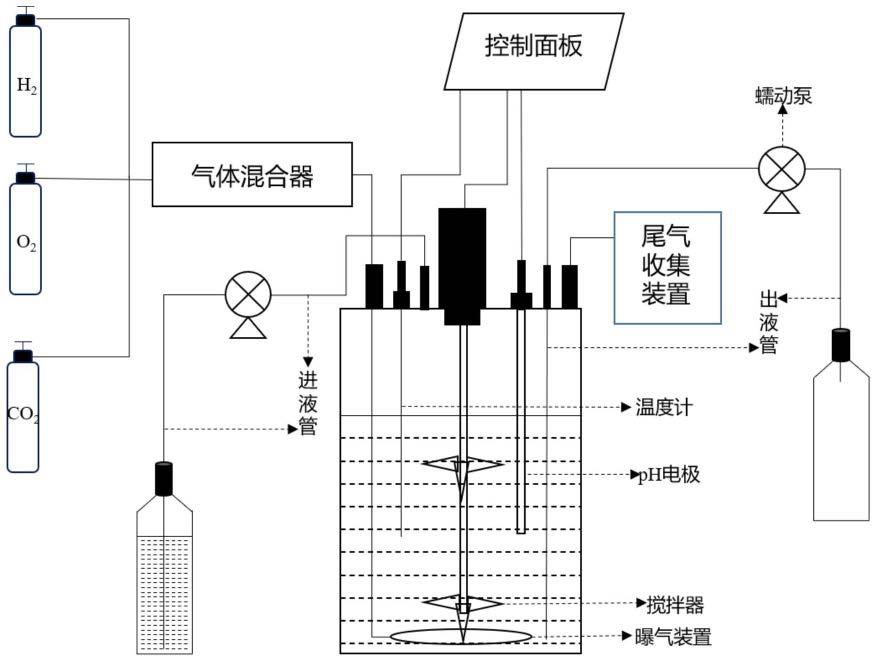
19.图1为发酵罐结构示意图;
20.图2为本发明实施例二的生物量变化图;
21.图3为本发明实施例二的氨氮利用变化图;
22.图4为本发明实施例二的蛋白含量变化图;
23.图5为本发明实施例二的菌群种类和丰度变化图;
24.图6为本发明实施例三的生物量变化图;
25.图7为本发明实施例三的氨氮利用变化图;
26.图8为本发明实施例三的蛋白含量变化图;
27.图9为本发明实施例三的菌群种类和丰度变化图;
28.图10为本发明实施例四的生物量变化图;
29.图11为本发明实施例四的生物量增长速率变化图;
30.图12为本发明实施例四的氨氮利用变化图;
31.图13为本发明实施例四的蛋白含量变化图;
32.图14为本发明实施例四的菌群种类和丰度变化图;
33.图15为本发明实施例五的生物量变化图;
34.图16为本发明实施例五的生物量增长速率变化图;
35.图17为本发明实施例五的氨氮利用变化图;
36.图18为本发明实施例五的蛋白含量变化图;
37.图19为本发明实施例五的菌群种类和丰度变化图。
具体实施方式
38.本发明提供了一种具有特定功能的氢氧化菌菌群。所述氢氧化菌菌群中的微生物包括:pandoraea、dyella、xanthobacter、chujaibacter、hydrogenophaga、starkeya、chryseobactetium、achromobacter、enterobacter、nubsella、filimonas中的任意两项及以上。
39.其中一种可高产phb的氢氧化菌菌群的可选方案为:所述氢氧化菌菌群中的微生物同时包括pandoraea、dyella、xanthobacter、chujaibacter;更优选的方案为:所述氢氧化菌菌群中的微生物中,各微生物活菌量占比关系为:25~27%pandoraea、20~22%dyella、21~23%xanthobacter、18~20%chujaibacter。
40.其中一种可高产单细胞蛋白的氢氧化菌菌群的可选方案为:所述氢氧化菌菌群中的微生物同时包括achromobacter、enterobacter、dyella、pandoraea、starkeya;更优选的方案为:所述氢氧化菌菌群中的微生物中,各微生物活菌量占比关系为:33~35%achromobacter、24~26%enterobacter、9~11%dyella、5~7%pandoraea、5~7%starkeya。
41.第二种可高产单细胞蛋白的氢氧化菌菌群的可选方案为:所述氢氧化菌菌群中的微生物同时包括hydrogenophaga、starkeya、chryseobactetium、xanthobacter;更优选的方案为:所述氢氧化菌菌群中的微生物中,各微生物活菌量占比关系为:90~92%hydrogenophaga、2~4%starkeya、1~3%chryseobactetium、0.5~1.5%xanthobacter。
42.其中一种可同时高产phb和单细胞蛋白的氢氧化菌菌群的可选方案为:所述氢氧化菌菌群中的微生物同时包括starkeya、hydrogenophaga、xanthobacter、nubsella、filimonas;更优选的方案为:所述氢氧化菌菌群中的微生物中,各微生物活菌量占比关系为:53~55%starkeya、16~18%hydrogenophaga、7~9%xanthobacter、4~6%nubsella、3~5%filimonas。
43.本发明还提供了可筛选上述各具有特定功能的氢氧化菌菌群的方法。所述氢氧化菌菌群均只用特定筛选培养基进行培养。所述筛选培养基组成为:na2hpo4·
12h2o 5.64g/l、nah2po4·
2h2o 5.34g/l、kcl 0.20g/l、mgso4·
7h2o 0.50g/l、cacl
2 0.05g/l、na2moo
4 2.5mg/l、feso4·
7h2o 15mg/l、1ml/l维生素溶液、1ml/l微量元素溶液。培养基初始氨氮浓度为500mg/l。
44.本发明涉及的维生素溶液和微量元素溶液的成分均如下:
45.所述维生素溶液成分为:2.0mg/l叶酸、5.0mg/l烟酸、2.0mg/l生物素、5.0mg/l泛酸钙、5.0mg/l硫辛酸、10.0mg/l维生素b6、6.0mg/l维生素b1、5.0mg/l维生素b2、0.1mg/l维生素b12、5.0mg/l对氨基苯甲酸。
46.所述微量元素溶液成分为:h3bo
3 0.6g/l、cocl2·
6h2o 0.4g/l、znso4·
7h2o 0.2g/l、mncl2·
4h2o 0.06g/l、namoo4·
2h2o 0.06g/l、nicl2·
6h2o 0.04g/l、cuso4·
5h2o 0.02g/l。
47.可以通过市购等方式,将上述各氢氧化菌菌群中的微生物按对应比例接种到所述筛选培养基中,在30℃、ph=7的环境中进行培养即可。
48.也可通过如下步骤进行筛选培养:
49.1、获得驯化微生物群。富集培养基为:5.64g/l nah2po4·
12h2o、5.34g/l na2hpo4·
2h2o、1g/l nh4cl、0.5g/l mgso4·
7h2o、0.5g/l nahco3、0.1g/l kcl、0.1g/l酵母粉、1ml/l微量元素溶液、1ml/l维生素溶液。发酵培养基为:5.64g/l nah2po4·
12h2o、5.34g/l na2hpo4·
2h2o、1g/lnh4cl、0.5g/l mgso4·
7h2o、0.1g/l kcl、1ml/l微量元素溶液、1ml/l维生素溶液。所述接种物中,微生物组成包括:按活菌量,37~39%chryseobacterium、22~24%bradyrhizobium、10~12%sphingobacterium、6~8%starkeya、3~5%xanthobacter、2~4%mesorhizobium、1~3%dysgonomonas、1~3%enterobacter、1~3%devosia、1~3%pleomorphomonas、0.5~1.5%mucilaginibacter。
50.可以按照本步骤的微生物组成,直接在所述发酵培养基中接种对应比例的微生物种子液,在30℃、ph=7中培养获得。可以使用活性污泥等通过驯化后获得。驯化方法包括如下步骤:(1)取活性污泥进行老化处理,即将所取活性污泥置于空气中24h以上,使活性污泥中的有机物适当降解。处理完成后,在厌氧环境中采用所述富集培养基提取污泥中的菌群。(2)将提取出的菌群进行传代培养,继续以新的所述富集培养基培养菌群,增强菌体活性。(3)在厌氧环境中,将传代所得菌群转入接种至所述发酵培养基中,并通入氢气、氧气和二氧化碳的混合气体,继续传代培养,获得驯化微生物群。
51.需要说明的是:发明人课题组选取了五个不同来源的活性污泥分别进行上述驯化实验,结果显示:通过上述驯化方法驯化不同来源的活性污泥,虽然获得的氢氧化菌菌群结构与上述微生物组成略有差异,但同样可以实现所述驯化微生物群的功能,可以实现本发明的发明目的。出于篇幅考虑,后文实施例中只展示其中一种活性污泥来源获得的菌群。
52.2、按10%(v/v)接种量在所述培养基中接种驯化微生物群。随后向培养基中同时通入h2、o2和co2。如需高产phb,则设置h2和o2的通入总量为2:1(v/v);如需高产单细胞蛋白,则设置h2和o2的通入总量为4:1(v/v)。co2通入量与h2、o2的关系为:co2占通入气体总体积的10~30%,h2和o2共占通入气体总体积的70~90%。在30℃、ph=7,培养10天及以上。需要说明的是:通入co2的目的是保证整个发酵过程中微生物生长所需碳源充足。
53.3、如需进一步提高单细胞蛋白产量,则执行本步骤3:在培养中,不断泵出混合培养液,同时以相同的速度不断泵入新鲜的所述培养基。培养基液体的流速为1.04ml/min~2.08ml/min,水力停留时间(hrt)为12~24h。
54.下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。所获得的数据均为进行至少3次重复后获得的平均值,且各重复获得的均为有效数据。
55.实施例一:获得驯化微生物群
56.提取来自成都市某市政污水处理厂的活性污泥,置于空气中48h进行老化。取老化后的活性污泥5g置于250ml厌氧瓶中,加入100ml富集培养基,置于摇床内,在200rpm、30℃下培养3天,获得培养液。收集培养液,按10%(v/v)的接种量接入新的富集培养基中进行传代培养,重复3次,获得富集的微生物菌群。
57.按10%(v/v)的接种量将富集的微生物菌群接种到含发酵培养基的厌氧瓶中进行驯化。具体为在厌氧瓶中加入90ml的发酵培养基,接种10ml的富集的微生物菌群,剩余顶空
部分充满按体积比为8:1:1的氢气、氧气和二氧化碳的混合气体并进行密封。密封后置于摇床上以200rpm、30℃条件培养3天。收集培养液,再按10%(v/v)接种量接入新的发酵培养基中进行传代培养,重复3次,获得可以以氢气作为能源、并可利用二氧化碳和无机氮化物的自养菌群,获得驯化微生物群。
58.获得的驯化微生物群中,微生物组成包括:按活菌量,38%chryseobacterium、23%bradyrhizobium、11%sphingobacterium、7%starkeya、4%xanthobacter、3%mesorhizobium、2%dysgonomonas、2%enterobacter、2%devosia、2%pleomorphomonas、1%mucilaginibacter。驯化微生物群中剩余部分的微生物非优势菌种,且不影响实际效果,未进行体现。
59.实施例二:一种筛选获得高产phb的氢氧化菌菌群的方法
60.本发明涉及的用于筛选具有特定功能的氢氧化菌菌群的反应装置为发酵罐,具体结构如图1所示。所述发酵罐为玻璃发酵罐,还包括:分别装有h2/co2/o2的气瓶、调节气体流量的气体混合装置、泵入和泵出培养基所需蠕动泵、曝气装置、控制运行条件的温度计、ph计、搅拌器以及尾气收集装置。包括本实施例在内的各实施例中,发酵罐有效容积均为3l。应当理解的是:本发明图1及此处提供的发酵罐结构为示例性的,实践中,本领域技术人员可以根据实际需要进行适应性调整。
61.在玻璃发酵罐中注入所述筛选培养基1.8l,所述筛选培养基的初始氨氮浓度为500mg/l。再按照10%(v/v)的接种量向玻璃发酵罐中注入实施例一获得的驯化微生物群混合物200ml。
62.打开各气瓶,利用稳流阀和气体流量计设置气体的流量,气体通过气体混合装置进行混匀,再通入玻璃发酵罐中。配置通入的气体总量h2:o2=2:1(通过控制流量实现)。控制h2、o2、co2的流量分别为37.88ml/min、18.94ml/min和12.63ml/min。同时设置运行条件,控制运行参数为:30℃、ph=7,搅拌器转速为700rpm,培养周期为10d。
63.每天定时取发酵罐中菌液测定细胞干重、氨氮量用量、蛋白质浓度。其中,细胞干重采用直接称重法,氨氮利用量采用纳什试剂光度法测定,蛋白质浓度采用凯氏定氮法测定。培养结束后(10d后),利用16s rdna提取试剂盒提取终产物混合液(含微生物菌群)的dna,通过测序并进行序列比对确定微生物菌群结构。
64.本实施例的生物量变化如图2所示,氨氮利用变化情况如图3所示,单细胞蛋白含量变化情况如图4所示,微生物菌群结构如图5所示。
65.10天后,测序并经序列比对显示,本实施例培养条件下获得的微生物菌群结构为:约26%的pandoraea、约22%的xanthobacter、约21%的dyella、约19%的chujaibacter。微生物群中剩余部分的微生物非优势菌种,且不影响实际效果,未进行体现。本实施例在相同条件下进行3次重复实验。同时按实施例一驯化微生物菌群结构组成,直接在所述发酵培养基中接种对应比例的微生物种子液(对应微生物市购获得),在30℃、ph=7中培养24h后获得驯化微生物,再按本实施例相同条件进行3次重复实验。各重复实验获得的微生物菌群结构均相同,以上各微生物在菌群结构中占比差异均在0.3%以内,且产phb和单细胞蛋白变化均不显著。
66.在10天的发酵周期结束时,生物量积累到1.59g/l,生物量增长速率0.131g/(l
·
d),氨氮利用速率18.9mg/(l
·
d),菌体蛋白质含量7%。整个发酵期间,生物量最快增长速
率为1.28g/(l
·
d),菌体单细胞蛋白含量最高达18%。取发酵结束时的菌体,测定其中的phb含量,占细胞百分比的60%(w/w)。结果显示:本实施例培养条件下获得的氢氧化菌菌群更倾向于合成phb,产单细胞蛋白的能力偏弱。
67.实施例三:一种筛选获得高产单细胞蛋白的氢氧化菌菌群的方法
68.本实施例所采用反应装置、筛选培养基等条件均与实施例二相同,差异在于:气体总量比,h2:o2=4:1。通过流量进行控制,h2、o2、co2的流量分别为45.44ml/min、11.36ml/min、12.63ml/min。
69.本实施例的生物量变化如图6所示,氨氮利用变化如图7所示,单细胞蛋白含量情况如图8所示,菌群群落结构如图9所示。
70.10天后,测序并经序列比对显示,本实施例培养条件下获得的微生物菌群结构为:约34%的achromobacter、约25%的enterobacter、约10%的dyella、约6%的pandoraea、约6%的starkeya。微生物群中剩余部分的微生物非优势菌种,且不影响实际效果,未进行体现。本实施例在相同条件下进行3次重复实验。同时按实施例一驯化微生物菌群结构组成,直接在所述发酵培养基中接种对应比例的微生物种子液(对应微生物市购获得),在30℃、ph=7中培养24h后获得驯化微生物,再按本实施例相同条件进行3次重复实验。各重复实验获得的微生物菌群结构均相同,以上各微生物在菌群结构中占比差异均在0.2%以内,且产phb和单细胞蛋白变化均不显著。
71.在10天的发酵周期结束时,生物量积累到3.03g/l,生物量增长速率0.284g/(l
·
d),氨氮利用速率34.2mg/(l
·
d),菌体蛋白质含量62%。整个发酵期间,生物量最快增长速率为0.98g/(l
·
d),菌体单细胞蛋白含量最高可达68%;取发酵结束时的菌体,测定其中的phb含量,占细胞百分比为6%。结果显示:氢氧比的增大使得筛选获得的氢氧化菌菌群的功能以合成单细胞蛋白为主。
72.实施例四:另一种筛选获得高产单细胞蛋白的氢氧化菌菌群的方法
73.本实施例所采用反应装置、筛选培养基、气体流量等条件均与实施例三相同,氢气与氧气的通入总量也为4:1。
74.本实施例在实施例三的基础上,增加如下操作:打开两个蠕动泵,通过进液口不停地泵入新鲜的所述筛选培养基,同时以相同的速度从出液口不停地泵出发酵罐中的混合培养液。本实施例中设置hrt为12h,进出发酵罐的筛选培养基液体的流速为125ml/h。
75.本实施例的生物量变化情况如图10所示,生物量增长速率如图11所示,氨氮利用变化情况如图12所示,单细胞蛋白质含量情况如图13所示,菌群群落结构如图14所示。
76.10天后,测序并经序列比对显示,本实施例培养条件下获得的微生物菌群结构为:约91%的hydrogenophaga、约3%的starkeya、约2%的chryseobactetium、约1%的xanthobacter。微生物群中剩余部分的微生物非优势菌种,且不影响实际效果,未进行体现。本实施例在相同条件下进行3次重复实验。同时按实施例一驯化微生物菌群结构组成,直接在所述发酵培养基中接种对应比例的微生物种子液(对应微生物市购获得),在30℃、ph=7中培养24h后获得驯化微生物,再按本实施例相同条件进行3次重复实验。各重复实验获得的微生物菌群结构均相同,以上各微生物在菌群结构中占比差异均在0.3%以内,且产phb和单细胞蛋白变化均不显著。
77.结果表明,连续培养水力停留时间为12h时,筛选的氢氧化菌菌群以嗜氢菌为主,
可高效合成单细胞蛋白。在10天的连续发酵周期结束时,生物量积累到5.20g/l,生物量增长速率0.512g/(l
·
d),氨氮利用速率132.95mg/(l
·
d),菌体蛋白质含量47%。整个发酵期间,生物量增长速率最高为0.6875g/(l
·
d),菌体单细胞蛋白含量最高可达到69%;取发酵结束时的菌体,测定其中的phb含量,占细胞百分比仅为2%。
78.实施例五:一种筛选获得可同时高产单细胞蛋白和phb的氢氧化菌菌群的方法
79.本实施例所采用反应装置、筛选培养基、气体流量等条件均与实施例三相同,氢气与氧气的通入总量也为4:1。
80.本实施例在实施例四的基础上,调整hrt为24h,进出发酵罐的筛选培养基液体的流速为62.5ml/h。
81.本实施例的生物量变化情况如图15所示,生物量增长速率如图16所示,氨氮利用变化情况如图17所示,单细胞蛋白质含量变化如18所示,菌群群落结构如图19所示。
82.10天后,测序并经序列比对显示本实施例培养条件下获得的微生物菌群结构为:约54%的starkeya、约17%的hydrogenophaga、约8%的xanthobacter、约5%的nubsella、约4%的filimonas。微生物群中剩余部分的微生物非优势菌种,且不影响实际效果,未进行体现。本实施例在相同条件下进行3次重复实验。同时按实施例一驯化微生物菌群结构组成,直接在所述发酵培养基中接种对应比例的微生物种子液(对应微生物市购获得),在30℃、ph=7中培养24h后获得驯化微生物,再按本实施例相同条件进行3次重复实验。各重复实验获得的微生物菌群结构均相同,以上各微生物在菌群结构中占比差异均在0.3%以内,且产phb和单细胞蛋白变化均不显著。
83.结果表明,连续培养水力停留时间为24h时,筛选获得的氢氧化菌菌群细菌种类丰富多样。在10天的连续发酵周期结束时,生物量积累到15.75g/l,生物量增长速率1.612g/(l
·
d),氨氮利用速率169.3mg/(l
·
d),菌体蛋白质含量19.2%。整个发酵期间,生物量增长速率最高为2.6g/(l
·
d),菌体单细胞蛋白含量最高可达到19.2%;取发酵结束时的菌体,测定其中的phb含量,占细胞百分比为30%。
84.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形、变型、修改、替换,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1