一种用于制备冠状病毒治疗药物的吲哚类化合物的制作方法
1.本发明属于化学医药领域,具体涉及一种用于制备冠状病毒治疗药物的吲哚类化合物。
背景技术:
2.新型冠状病毒肺炎(covid-19),简称“新冠肺炎”,是指2019新型冠状病毒 (sars-cov-2)感染导致的肺炎,现已证实为一种新型冠状病毒感染引起的急性呼吸道传染病。
3.冠状病毒超家族(冠状病毒科)包括几种具有巨大致病性的人类病原体rna基因组,例如流感和病毒性脑炎,它们被分为α、β、δ和γ冠状病毒家族,然后进一步分为谱系a、b、 c和d。sars-cov-2是一种有包膜的、非分段的、阳性的单链rna病毒,是一个异常大的 rna基因组,由一个核衣壳,以及从其表面伸出的棒状突起称为棘突蛋白组成。它属于b族β-冠状病毒类别,包括sars冠状病毒和mers病毒。这些病毒导致了两种疾病的不同严重程度的流行病呼吸和呼吸外临床表现、高度传染性和10-35%死亡率。
4.covid-19冠状病毒疾病和药物治疗谱,总结如下:潜在的治疗药物类别2019冠状病毒疾病包括抗体、抗病毒和抗炎治疗。早期的感染,疾病的严重程度相对较轻,治疗可侧重于病毒的预防进入细胞(抗体疗法)或抑制病毒复制(抗病毒疗法)。当患者肺部感染,在这种情况下,建议增加抗炎治疗,而轻度至中度非住院且为危重病的高风险者可接受抗病毒治疗。当出现肺部感染时,可发展为严重的急性呼吸道感染综合症(sars),在这种情况下需要补充氧气,包括机械通气或体外膜肺氧合(ecmo)。在这个后来的2019冠状病毒疾病阶段感染,一种压倒性的炎症反应是造成呼吸系统损害的主要原因导致急性呼吸窘迫综合征 (ards)的系统,需要使用抗炎药疗效数据有限,抗病毒药物疗效证据较少,也没有关于 sars抗体的有效性数据。
5.微管对细胞的形状、运输、运动和细胞分裂都很重要。微管是由α和β微管蛋白聚合而成的动态长极性纤维/长丝异二聚体亚单位,正端位于质膜,负端面向细胞膜微管组织中心 (mtoc)的细胞核。微管纤维从mtoc向外辐射从核区到细胞外围。微管是动态网络系统,也就是说,它们通过加入α和β微管蛋白亚基异二聚体进行快速聚合共同形成不断增长的聚合物链,并随后快速解聚(去除α和β微管蛋白亚基(异二聚体)解构和收缩聚合物链。这种“动态”正在增长微管的收缩能力满足了人类不断变化的运输需求单间牢房大分子,如病毒,与特殊的运动蛋白(驱动蛋白和蛋白质)结合动力蛋白)。驱动蛋白和动力蛋白附着、携带并在这些微管上下移动病毒货物轨道,就像火车车厢一样,需要经过很长的距离才能到达牢房内的不同隔间。病毒是专性的细胞内寄生虫,因此仅依赖于细胞内寄生虫用于膜运输、核进出口和基因表达的机器。传入病毒颗粒从细胞表面移动到病毒转录和复制的细胞内位点。在期间组装和排出,亚病毒核蛋白复合物和病毒粒子返回以排出血浆膜由于大分子在细胞质中的扩散受到严格限制,病毒使用atp水解宿主的分子马达,沿着微管推进,微管是细胞内高速公路。
6.基于微管的大分子细胞内转运是病毒复制的一个关键方面。对于病毒感染而言,
病毒蛋白的表达改变了这些微管网络的组织结构,从而满足他们复制和传播传染性病毒的需要。微管不仅促进感染,而且微管被病毒主动操纵。此外,细胞骨架干扰因子抑制病毒感染。不受理论限制,本发明部分基于微管蛋白与蛋白质相互作用的事实α冠状病毒和β冠状病毒sars 冠状病毒s蛋白的细胞质结构域。这个感染性病毒滴度的降低可通过使用引起微管的药物进行治疗解聚,主要是因为由于s受损,组装部位的s蛋白较少蛋白质微管运输和s蛋白自身并入病毒粒子的过程微管蛋白依赖。此外,微管运输的中断损害了细胞的出口这些组装不良的病毒粒子的细胞表面s蛋白较少,因此感染性较低。微管解聚剂可以通过破坏细胞膜来有效治疗冠状病毒感染微管运输对病毒复制周期至关重要。
7.控制细胞内运输的细胞和病毒解决方案是一个有组织的网络或细丝包括微管。细胞需要微管来维持长期的正常生理,以及病毒是专性细胞内寄生虫,完全依赖于宿主细胞的生理学。因此,毫不奇怪,大多数(如果不是全部的话)病毒生命周期都需要微管进行有效复制。微管上的病毒结合位点可能为抗病毒治疗提供新的靶点。veru公司其研发的新药sabizabulin,通过抑制微管蛋白,阻断新冠病毒沿微管的细胞内运输。
技术实现要素:
8.发明要解决的问题
9.为了解决现有技术存在的上述问题,本发明提供了一种取代的吲哚类化合物或其药学上可接受的盐,可通过抑制微管蛋白,破坏细胞骨架、使得冠状病毒无法被运输,从而来治疗病毒感染。
10.本发明还提供了一种药物组合物,其包括上述化合物或其药学上可接受的盐。
11.此外,本发明提供了上述化合物或其药学上可接受的盐的用途。
12.用于解决问题的方案
13.本发明首先提供了一种具有通式(i)的化合物或其药学上可接受的盐,
[0014][0015]
r1,r2和r3独立选自甲基或1-3个氘原子取代的甲基;且r1,r2和r3中至少一个是1-3 个氘原子取代的甲基。r4选自c1-c6直链、c1-c6支链、c3-c6环烷烃或1-3个氘原子取代的甲基。
[0016]
进一步地,r1,r2和r3中至少一个是3个氘原子取代的甲基。
[0017]
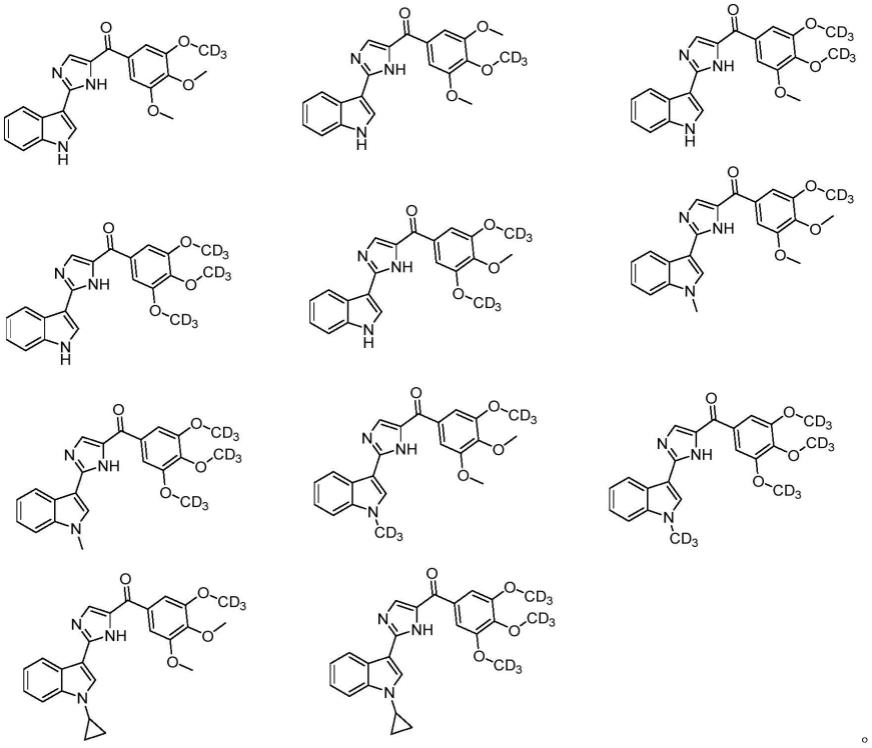
在本发明的一种实施方式中,上述化合物具体可选自:
[0018][0019]
在本发明的一种实施方式中,所述的药学上可接受的盐为无机盐或有机盐,无机盐包括盐酸盐、氢溴酸盐、氢碘酸盐、高氯酸盐、硫酸盐、硫酸氢盐、硝酸盐、磷酸盐、酸式磷酸盐;所述有机盐选自甲酸盐、乙酸盐、三氟乙酸盐、丙酸盐、丙酮酸盐、羟乙酸盐、乙二酸盐、丙二酸盐、丁二酸盐、戊二酸盐、富马酸盐、马来酸盐、乳酸盐、苹果酸盐、柠檬酸盐、酒石酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、水杨酸盐、对甲苯磺酸盐、抗坏血酸盐。更进一步地,所述药学上可接受的盐选自盐酸盐、硫酸盐、琥珀酸盐或甲磺酸盐。
[0020]
本发明还提供一种药物组合物,包括本发明所述化合物或其药学上可接受的盐以及药学上可接受载体、赋形剂或稀释剂。
[0021]
在本发明的一种实施方式中,所述药物组合物制成制剂时,可以系统地或顺序地给予,可以以任何有效的给药方式完成用于将化合物或药物组合物递送至病毒感染部位。所述给药方式包括但不限于口服化合物或组合物,通过以下方式局部、经皮、肠外、皮下、静脉、肌肉内、腹腔注射鼻内滴注,通过腔内或膀胱内滴注,眼内,动脉内,病变内或通过应用于粘膜,如鼻、喉和支气管粘膜管。
[0022]
本发明还提供上述化合物或其药学上可接受的盐在制备用于抑制微管蛋白的药物中的应用。
[0023]
本发明还提供上述化合物或其药学上可接受的盐在制备用于破坏细胞骨架的药物中的应用。
[0024]
本发明还提供上述化合物或其药学上可接受的盐在制备用于阻断病毒沿微管的细胞内运输的药物中的应用。
[0025]
本发明还提供上述化合物或其药学上可接受的盐在制备用于抗冠状病毒药物中的应用。
[0026]
在本发明的一种实施方式中,,所述冠状病毒包括:sars、mers-cov、2019冠状病毒sars-cov-2。
[0027]
本发明还提供一种抗新型冠状病毒sars-cov-2药物,其特征在于,包括上述化合物或其药学上可接受的盐,以及药用辅料。
[0028]
有益效果:
[0029]
本发明提供了一种取代的吲哚类化合物或其药学上可接受的盐,可通过抑制微管蛋白,破坏细胞骨架、使得冠状病毒无法被运输,实现有效治疗病毒感染的目的。本发明化合物对微管蛋白聚合的抑制作用较强,且稳定性较好,具有较长的代谢半衰期使得,能够降低医疗剂量和扩大给药时间间隔。
具体实施方式
[0030]
下列实施例用于说明而非限定通式(i)化合物的合成方法。温度均为摄氏度。如果没有另外说明,所有的蒸发均在减压下进行。如果没有另外说明,否则试剂是自商业供货商购得且未经进一步纯化即使用。终产物、中间体和原料的结构通过标准分析方法确认,例如元素分析、光谱特征分析,例如ms、nmr。使用的缩写是本领域常规缩写。
[0031]
实施例1:(2-(1h-吲哚-3-基)-1h-咪唑-4-基)(3,4-二甲氧基-5-(甲氧基-d3)苯基) 甲酮(化合物1)
[0032][0033]
1-(苯基磺酰基)-1h-吲哚-5-甲醛(1-2)的制备:
[0034]
在室温下,将吲哚-3-甲醛(1-1)(5g,34.5mmol)溶于乙醇(100ml)中,加入氢氧化钾(2.1g,37.9mmol),搅拌至澄清。减压浓缩去除乙醇,将残余物溶解在丙酮(100ml) 中,然后加入苯磺酰氯(6.7g,37.9mmol)。室温搅拌0.5小时。过滤,滤液浓缩得粗品,经甲醇重结晶,得到1-(苯基磺酰基)-ih-吲哚-5-甲醛(1-2)(4g,白色固体,收率:41%)。 ms-esi(m/z):286[m+l]
+
。
[0035]
3-(l h-咪唑-2-基)-1-(苯基磺酰基)-l h-吲哚(1-3)的制备:
[0036]
在0℃下,将1-(苯基磺酰基)-1h-吲哚-3-甲醛(1-2)(4g,14.0mmol)溶于乙醇(50 ml)中,加入40%乙二醛水溶液(2.2g,15.4mmol)和29%氢氧化铵水溶液(16.9g,140 mmol)。室温搅拌2天,加水100ml,二氯甲烷萃取。有机相经干燥,减压浓缩,粗品经柱层析分离得到3-(l h_咪唑-2-基)-1-(苯基磺酰基)-l h-吲哚(1-3)(1g,黄色固体,收率:22%)。ms-esi(m/z):324[m+l]
+
。
[0037]
1-(苯基磺酰基)-3-(1-(苯基磺酰基)-1h-咪唑-2-基)-l h-吲哚(1-4)的制备:
[0038]
冰浴下,将3-(1h-咪唑-2-基)-1-(苯基磺酰基)-l h-吲哚(1-3)(1g,3.1mmol)溶于无水dmf(15ml)中,分批加入氢化钠(149mg,3.7mmol),室温搅拌30分钟。冰浴下加入苯磺酰氯(653mg,3.7mmol),室温搅拌过夜。反应结束后,加入饱和氯化铵淬灭,经乙酸乙酯萃取。有机相经干燥,减压浓缩,粗品经柱层析分离得到1-(苯基磺酰基)-3-(1-(苯基磺酰基)-l h_咪唑-2-基)-l h-吲哚(1-4)(1g,白色固体,收率:71%)。ms-esi(m/z): 464[m+l]
+
。
[0039]
(1-(苯基磺酰基)-2-(1-(苯基磺酰基)-ih-吲哚-3-基)-1h-咪唑-4-基)(3,4-二甲氧基-5-(甲氧基-d3))甲酮(1-5)的制备:
[0040]
在-78℃下,将1-(苯基磺酰基)-3-(1-(苯基磺酰基)-1h-咪唑-2-基)-1h-吲哚(100 mg,0.2mmol)溶于无水thf(2ml)中,慢慢滴加叔丁基锂(0.18ml,0.24mmol,1.3m),滴加完后,搅拌20分钟。然后加入3,4-二甲氧基-5-(甲氧基-d3)苯甲酰氯(56mg,0.24mmol) 的thf(0.5ml)的溶液,室温搅拌过夜。反应结束后,加入饱和nahco3水溶液,并用乙酸乙酯萃取。有机相经干燥,减压浓缩,粗品经柱层析分离得到(1-(苯基磺酰基)-2-(1-(苯基磺酰基)-ih-吲哚-3-基)-1h-咪唑-4-基)(3,4-二甲氧基-5-(甲氧基-d3))甲酮(1-5)(90 mg,白色固体,收率:63%)。ms-esi(m/z):661[m+l]
+
。
[0041]
(2-(1h-吲哚-3-基)-1h-咪唑-4-基)(3,4-二甲氧基-5-(甲氧基-d3)苯基)甲酮(1) 的制备:
[0042]
将(1-(苯基磺酰基)-2-(1-(苯基磺酰基)-ih-吲哚-3-基)-1h-咪唑-4-基)(1-5)(90 mg,0.14mmol)溶于乙醇(10ml)和水(0.1ml)中,加入氢化钠(56mg,1.4mmol),加热至回流反应过夜。反应结束后,加入5ml水稀释,乙酸乙酯萃取。有机相经干燥,减压浓缩,粗品经制备分离得到(2-(1h-吲哚-3-基)-1h-咪唑-4-基)(3,4-二甲氧基-5-(甲氧基-d3) 苯基)甲酮(化合物1)(20mg,黄色固体,收率:39%)。ms-esi(m/z):381[m+l]
+
。
[0043]1h nmr(400mhz,cd3od)δ:8.31(d,j=6.5hz,1h),7.99(s,1h),7.90(s,1h),7.52-7.48 (m,3h),7.28-7.24(m,2h),4.00(s,3h),3.93(s,3h).
[0044]
按与实施例1基本操作相似的操作合成实施例2-5(参见表1),得到期望的产物。
[0045]
表1实施例2-5的结构和数据
[0046][0047][0048]
实施例6:(3,4-二甲氧基-5-(甲氧基-d3)苯基)(2-(1-甲基-1h-吲哚-3-基)-1h-咪唑-5-基)甲酮(化合物6)的制备
[0049][0050]
合成方法参考实施例1,得到(3,4-二甲氧基-5-(甲氧基-d3)苯基)(2-(1-甲基-1h
‑ꢀ
吲哚-3-基)-1h-咪唑-5-基)甲酮(6)(15mg,黄色固体)。ms-esi(m/z):395[m+l]
+
。
[0051]1h nmr(400mhz,cd3od)δ:8.20(s,1h),7.86(s,1h),7.81(s,1h),7.50-7.42(m,3h), 7.26-7.21(m,2h),4.01(s,3h),3.96(s,3h),3.92(s,3h).
[0052]
按与实施例6基本操作相似的操作合成实施例7-11(参见表2),得到期望的产物。
[0053]
表2实施例7-11的结构和数据
[0054][0055][0056]
实施例12:体外微管蛋白聚合试验
[0057]
牛脑微管蛋白(0.4mg,纯度》97%)与10μμ的试验化合物混合,并在100μl的溶液中培养ph值为6.9的普通微管蛋白缓冲液(80mm pipes、2.0mm mgcl2、0.5mm egta和 1mm gtp)。然后冷却到0℃,再加入gtp,将上述混合液转至比色皿中,用分光光度计测量od值,升
高温度至30℃,测量od值的变化,由此来反应测试样品对微管蛋白装配的影响。ic
50
为培育20分钟,聚合溶度被抑制50%时测试样品的浓度。
[0058]
表3体外微管蛋白抑制活性数据
[0059]
化合物微管蛋白聚合的抑制作用ic
50
+sd(μμ)sabizabulin2.23+0.15实施例11.45+0.07实施例21.07+0.09实施例31.32+0.10实施例41.11+0.13实施例51.55+0.17实施例62.15+0.09实施例72.10+0.13实施例82.21+0.15实施例92.15+0.08实施例102.03+0.10实施例111.95+0.12
[0060]
对该系列的化合物进行了微管蛋白装配实验。共进行了3次平行实验,实验结果取平均值。实验结果如表3所示,实施例1-5与对照sabizabulin相比均表现出较强的抑制活性,实施例6-11表现出与对照相当的抑制活性。
[0061]
实施例13:使用人体肝脏微粒体进行化合物稳定性的评价
[0062]
将实施例化合物的肝微粒体酶稳定性与sabizabulin进行比较。
[0063]
测定系统:本发明化合物的代谢稳定性利用由男女混合的肝脏微粒体用1mm nadph进行试验。样品使用质谱仪进行分析。将hrms用于确定峰面积响应比率(对应于试验化合物或对照物的峰面积除以分析内标的峰面积)而不运行标准曲线。为了检测到所有的可能代谢物,在适当的m/z范围内进行hrms扫描。
[0064]
测定条件:该测定用一次孵育(n=1)进行。将试验化合物在37℃下在含有0.5毫克/毫升肝脏微粒体蛋白的缓冲液中孵育。通过加入辅因子引发反应,并于0、15、30、60、90、120、 180、240、360分钟取样,平行孵育阳性对照物(5μm睾丸素)并于0、15、30、60、90、120、 180、240、360分钟取样。
[0065]
测定质量控制:平行进行对照化合物睾丸素以证实(肝脏)微粒体的酶活性。最终时间点后,利用荧光测定法来确认nadph添加到反应混合物中。对照物的t1/2满足可接受的内标。
[0066]
分析方法:
[0067]
液相色谱柱:thermo bds hypersil c18 30x2.0mm,3μm,具有保护柱m.p.,缓冲液: 25mm甲酸接缓冲液,ph 3.5;
[0068]
水相(a):90%水,10%缓冲液;
[0069]
有机相(b):90%乙腈,10%缓冲液;
[0070]
流速:300微升/分钟
[0071]
自动进样器:注射体积10微升
[0072]
梯度程序参见表4。
[0073]
表4梯度程序
[0074]
时间(分钟)%a%b0.010001.501002.001002.110003.51000
[0075]
通过使用人体肝微粒体,对实施例对代谢半衰期评价,结果见表5。
[0076]
表5各化合物代谢半衰期评价结果
[0077]
化合物t
1/2
(min)sabizabulin110实施例1162实施例2172实施例3183实施例4199实施例5191实施例6263实施例7275实施例8268实施例9269实施例10247实施例11236
[0078]
如本发明中所述,实施例1-11均表现为160-270分钟代谢半衰期,优于sabizabulin 110 分钟代谢半衰期,相对较长的代谢半衰期使得它们具有降低医疗剂量和扩大给药时间间隔的潜能。
[0079]
由实施例1-11的化合物具体微管蛋白聚和抑制ic
50
值及代谢半衰期数据可知,对于通式 (i)的化合物而言,连接基团和取代基团比如r1、r2、r3和r4基团对于化合物的药效学性能和代谢稳定性有着重要的影响。
[0080]
尽管本发明通过之前的特定实施例说明,但不应将其解释为受此限制;而是本发明涵盖之前公开的一般方面。可在不背离本发明的精神和范围下进行多种修饰并具有多种实施方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1