乳品致病菌的检测试剂和乳品致病菌的检测方法
1.本技术属于食品微生物安全检测技术领域,特别涉及一种乳品致病菌的检测试剂以及一种乳品致病菌的检测方法。
背景技术:
2.乳业是健康国家、强壮民族不可或缺的产业,是食品安全的代表性产业。2021年11月22日实施的《gb29921-2021食品安全国家标准预包装食品中致病菌限量》对乳制品、肉制品、水产制品等13类食品需要检测的包括单增李斯特菌、致泻大肠埃希氏菌等6种致病菌指标和限量做出了明确规定。生鲜乳品作为一种广泛食用且是无数食品加工业原料的动物源性食品种类,是人们理想的营养食品之一,但在实际生产中,乳品极易因遭受有害微生物污染而腐败变质。因此对乳品来说,致病菌的含量是评价乳品质量的一个重要指标。
3.大肠杆菌o157∶h7(escherichia coli o157∶h7)、单增李斯特菌(listeria monocytogenes)和蜡样芽孢杆菌(bacillus cereus)是乳品中最常见的3种致病菌。大肠杆菌o157∶h7是引起人类出血性腹泻和肠炎的重要致病菌;单增李斯特菌是一种人畜共患病的病原菌,感染后易出现败血症、脑膜炎和单核细胞增多;蜡样芽孢杆菌是引起人类呕吐和腹泻型食物中毒常见的病原菌,极易污染牛奶和奶制品。
4.目前对致病菌建立起来的检测方法主要包括:接种培养、生化鉴定等。传统检测乳制品中大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌的方法需要5-7天的检测周期,耗时长且检测灵敏度低,对巴士灭菌乳、酸奶等保质期短暂、即时性的乳品来说,难以在投放市场前进行快速地批量检测。另外,传统检测方法操作复杂,需要根据菌落性状判读结果,对技术人员的熟练度要求比较高;并且传统检测方法需要分别对样品中的大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌进行单独检测,难以进行大批量地同步检测。近年来发展起来的一些新方法,如聚合酶链式反应(pcr)、环介导恒温扩增技术(lamp)、基因芯片技术等,也均存在一定的不足。普通pcr能够做到对致病菌的快速检测,但灵敏度低且不能对致病菌进行定量分析;lamp技术具有反应体系小、灵敏度高、特异性好等优点,但扩增时引物间可能互补扩增出非特异性条带,造成假阳性;基因芯片技术虽然快速而全面,但稳定性差且操作过程和后期处理复杂;lamp、基因芯片虽然可以一次性同时检测几种致病菌,但无法对致病菌进行定量检测。
技术实现要素:
5.本技术为解决现有检测技术中存在的不足,提供一种乳品致病菌的检测试剂和一种乳品致病菌的检测方法,所述乳品致病菌的检测方法可以一次性同时检测大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌这3种致病菌,并可以进行定量检测,而且灵敏度高、便捷、高效。
6.为实现上述技术效果,本技术采用的技术方案如下:
7.第一方面,本技术提供了一种乳品致病菌的检测试剂,所述乳品致病菌的检测试
剂包括:tir基因的引物对和探针、mpl基因的引物对和探针、entfm基因的引物对和探针;
8.其中,所述tir基因的引物对和探针用于检测大肠杆菌o157∶h7,所述mpl基因的引物对和探针用于检测单增李斯特菌,所述entfm基因的引物对和探针用于检测蜡样芽孢杆菌。
9.第二方面,本技术提供一种乳品致病菌的检测方法,所述乳品致病菌的检测方法利用tir基因的引物对和探针、mpl基因的引物对和探针、以及entfm基因的引物对和探针,在一次实时荧光定量pcr反应中同时检测待测样品中的大肠杆菌o157∶h7、单增李斯特菌、蜡样芽孢杆菌;
10.其中,所述tir基因的引物对和探针用于检测所述大肠杆菌o157∶h7,所述mpl基因的引物对和探针用于检测所述单增李斯特菌,所述entfm基因的引物对和探针用于检测所述蜡样芽孢杆菌。
11.第三方面,本技术提供一种乳品致病菌的检测试剂盒,包括:容器,以及位于容器内的上述检测试剂。
12.本技术的有益效果包括但不限于:本技术提供的乳品致病菌的检测试剂包括用于检测大肠杆菌o157∶h7的引物对和探针,用于检测单增李斯特菌的引物对和探针,以及用于检测蜡样芽孢杆菌的引物对和探针。本技术提供的乳品致病菌的检测方法就是采用本技术的乳品致病菌的检测试剂,能够一次性同时检测待测样品中的大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌这3种致病菌,可以在24小时以内对待测样品完成检测,大大缩短检测周期,并通过ct值对待测样品中大肠杆菌o157∶h7、单增李斯特菌蜡样芽孢杆菌进行定量分析,并且检测的灵敏度可达到10-100cfu/ml,具有较高的检测灵敏度。因此,本技术所提供的乳品致病菌的检测方法可以一次性同时检测大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌这3种致病菌,并可以进行定量检测,而且灵敏度高、便捷、高效。
13.应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本技术。
附图说明
14.此处的附图被并入说明书中并构成本技术说明书的一部分,示出了符合本技术的实施例,并与说明书一起用于解释本技术的技术方案。下面描述中的附图是本技术的一些实施例,而不是全部实施例。对于本领域技术人员来讲,在不付出创造性劳动的前提下,可以根据这些附图获得其他的附图。
15.通过结合附图对本技术的实施方式进行详细说明,使本技术的各种目标,特征和优点变得更加显而易见。
16.图1为引物tir-f、tir-r和探针tir-p对大肠杆菌o157∶h7的荧光定量pcr对数扩增曲线图。
17.图2为引物mpl-f、mpl-r和探针mpl-p对单增李斯特菌荧光定量pcr对数扩增曲线图。
18.图3为引物entfm-f、entfm-r和探针entfm-p对蜡样芽孢杆菌荧光定量pcr对数扩增曲线图。
19.图4为引物tir-f、tir-r和探针tir-p对非目标菌(除目标菌大肠杆菌o157∶h7之外
的19种菌的混合菌)的荧光定量pcr扩增曲线图。
20.图5为引物mpl-f、mpl-r和探针mpl-p对非目标菌(除目标菌单增李斯特菌之外的19种菌的混合菌)的荧光定量pcr扩增曲线图。
21.图6为引物entfm-f、entfm-r和探针entfm-p对非目标菌(除目标菌蜡样芽孢杆菌之外的19种菌的混合菌)的荧光定量pcr扩增曲线图。
22.图7为引物tir-f、tir-r和探针tir-p对大肠杆菌o157∶h7的灵敏度检测结果图。
23.图8为引物tir-f、tir-r和探针tir-p对大肠杆菌o157∶h7的荧光定量pcr扩增对应的标准曲线图。
24.图9为引物mpl-f、mpl-r和探针mpl-p对单增李斯特菌的灵敏度检测结果图。
25.图10为引物mpl-f、mpl-r和探针mpl-p对单增李斯特菌的荧光定量pcr扩增对应的标准曲线图。
26.图11为引物entfm-f、entfm-r和探针entfm-p对蜡样芽孢杆菌的灵敏度检测结果图。
27.图12为引物entfm-f、entfm-r和探针entfm-p对蜡样芽孢杆菌的荧光定量pcr扩增对应的标准曲线图。
28.图13为针对单增李斯特菌和蜡样芽孢杆菌的二重荧光定量pcr对数扩增曲线图。
29.图14为针对大肠杆菌o157∶h7和单增李斯特菌的二重荧光定量pcr对数扩增曲线图。
30.图15为针对大肠杆菌o157∶h7和蜡样芽孢杆菌的二重荧光定量pcr对数扩增曲线图。
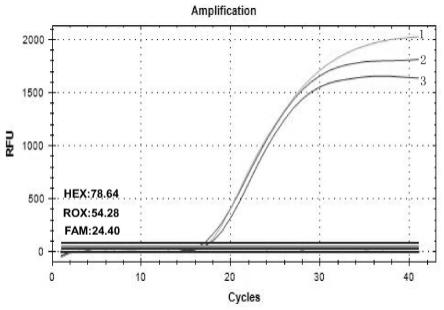
31.图16为针对大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌的三重荧光定量pcr对数扩增曲线图。
具体实施方式
32.为使本技术实施例的目的、技术方案和优点更加清楚,下面将结合本技术的实施例,对本技术的技术方案进行清楚、完整地描述,显然,所描述的实施例是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互任意组合。
33.本技术实施例提供了一种乳品致病菌的检测试剂、一种乳品致病菌的检测方法,以及一种乳品致病菌的检测试剂盒。
34.本技术的实施例提供的一种乳品致病菌的检测试剂,包括:tir基因的引物对和探针、mpl基因的引物对和探针、entfm基因的引物对和探针;
35.其中,tir基因的引物对和探针用于检测大肠杆菌o157∶h7,mpl基因的引物对和探针用于检测单增李斯特菌,entfm基因的引物对和探针用于检测蜡样芽孢杆菌。
36.本技术中,乳品致病菌的检测试剂包括用于检测大肠杆菌o157∶h7的引物对和探针,用于检测单增李斯特菌的引物对和探针,以及用于检测蜡样芽孢杆菌的引物对和探针,能够一次性同时检测乳品中的大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌等3种致病菌。而且,用于检测大肠杆菌o157∶h7的靶基因为tir基因,用于检测单增李斯特菌的靶基因
为mpl基因,用于检测蜡样芽孢杆菌的靶基因为entfm基因。
37.本技术选择位于细菌基因组上的毒力基因为靶基因。由于各种致病菌属间基因组的同源性很高,同属致病菌的非致病型基因在生化反应上无任何区别,但致病菌的致病性相关的毒力基因特异性高;因此,选择毒力基因为靶基因。作为原核生物的细菌,其遗传物质有基因组和质粒两类,很多毒力基因位于质粒上;但质粒不稳定,可以在细菌间转移,也容易在传代培养中丢失;由于基因组dna和质粒dna的大小相差很大,不能用同样方法提取,因此,选择位于细菌基因组上的毒力基因为靶基因。
38.大肠杆菌o157∶h7毒力基因tir的特异性高,单增李斯特菌毒力基因mpl的特异性高,蜡样芽孢杆菌肠毒素基因entfm的特异性高。为了提高检测的灵敏度,本技术的靶基因包括针对大肠杆菌o157∶h7的毒力基因tir、针对单增李斯特菌的毒力基因mpl、以及针对蜡样芽孢杆菌的肠毒素基因entfm。
39.在本技术所提供的实施例中,tir基因的引物对如seq id no:1-2所示,tir基因的探针如seq id no:3所示;mpl基因的引物对如seq id no:4-5所示,mpl基因的探针如seq id no:6所示;entfm基因的引物对如seq id no:7-8所示,entfm基因的探针如seq id no:9所示。
40.tir基因的引物对包括上游引物tir-f和下游引物tir-r,mpl基因的引物对包括上游引物mpl-f和下游引物mpl-r,entfm基因的引物对包括上游引物entfm-f和下游引物entfm-r;tir基因的探针为tir-p,mpl基因的探针为mpl-p,entfm基因的探针为entfm-p。
41.其中,靶基因(tir基因、mpl基因和entfm基因)的引物对和探针的信息(如,具体名称、序列、序号、产物长度、tm值)如表1所示,tm值为退火温度,即引物和模板链结合生成双链的温度。
42.表1靶基因的引物对和探针的信息
[0043][0044]
本技术中,tir基因qpcr产物长度为98bp;mpl基因qpcr产物长度为97bp;entfm基因qpcr产物长度为94bp。基于荧光定量pcr反应,本技术通过在靶基因特异序列的基础上设
计引物对来确定靶基因的产物长度,从而提高扩增效率(即耗时少产物多)。本技术中的tm值是根据引物长度及引物含有的四种碱基(g、c、a、t)的百分比含量来确定的,其中6种引物和3种探针的tm值比较相近,以便多种引物在同一个体系(及同一温度值)下都能结合模板链生成双链后进行扩增。
[0045]
在本技术所提供的实施例中,tir基因的探针上标记的荧光报告基团为rox,荧光淬灭基团为bhqⅱ;mpl基因的探针上标记的荧光报告基团为fam,荧光淬灭基团为bhqⅰ;entfm基因的探针上标记的荧光报告基团为hex,荧光淬灭基团为bhqⅰ。
[0046]
本技术中,探针的5
′
端标记有荧光报告基团,探针的3
′
端标记有荧光淬灭基团。当探针完整时,荧光报告基团所发射的荧光能量被淬灭基团吸收,无法检测到荧光信号。随着pcr反应的进行,taq酶在链延伸过程中遇到与模板结合的探针,会将探针切断,使荧光报告基团远离荧光淬灭基团,其能量不能被吸收,即产生荧光信号。每扩增一条dna链,就有一个荧光分子形成,实现了荧光信号的累积与pcr产物形成完全同步。
[0047]
本技术的实施例提供一种乳品致病菌的检测方法,检测方法利用tir基因的引物对和探针、mpl基因的引物对和探针、以及entfm基因的引物对和探针,在一次实时荧光定量pcr反应中同时检测待测样品中的大肠杆菌o157∶h7、单增李斯特菌、蜡样芽孢杆菌;
[0048]
其中,tir基因的引物对和探针用于检测大肠杆菌o157∶h7,mpl基因的引物对和探针用于检测单增李斯特菌,entfm基因的引物对和探针用于检测蜡样芽孢杆菌。
[0049]
本技术中,利用tir基因的引物对和探针、mpl基因的引物对和探针、以及entfm基因的引物对和探针,在一次实时荧光定量pcr反应中同时检测待测样品中的大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌,不仅特异性高,而且灵敏度好。
[0050]
在本技术所提供的实施例中,乳品致病菌的检测方法包括:
[0051]
步骤s100:设计tir基因的引物对和探针、mpl基因的引物对和探针、以及entfm基因的引物对和探针;
[0052]
步骤s200:提取待测样品的dna;
[0053]
步骤s300:以提取的待测样品dna为模板,加入tir基因的引物对和探针、mpl基因的引物对和探针、以及entfm基因的引物对和探针,在pcr反应液中进行pcr反应,同时收集荧光信号;
[0054]
步骤s400:根据荧光信号同时判断大肠杆菌o157∶h7、单增李斯特菌、蜡样芽孢杆菌的阴性或阳性。
[0055]
其中,步骤s100和步骤s200没有先后顺序,可以先进行步骤s100后进行步骤s200,也可以先进行步骤s200后进行步骤s100,也可以同时进行步骤s100和步骤s200。
[0056]
在本技术所提供的实施例中,检测方法还包括:在进行步骤s100之前,将通过blast、megalign和dnastar程序筛选出的大肠杆菌o157∶h7的肠细胞消失位点(lee岛)毒力基因tir(genbank:nc_004337.2),单增李斯特菌的毒力岛1(lipi-1)的毒力基因mpl(genbank:nc_003210.1)和蜡样芽孢杆菌的肠毒素fm基因entfm(genbank:nw_911826.1)做为特异性靶基因。
[0057]
步骤s100中,靶基因(tir基因、mpl基因和entfm基因)的引物对和探针的设计方法包括:根据大肠杆菌o157∶h7的毒力基因tir,单增李斯特菌的毒力基因mpl和蜡样芽孢杆菌的肠毒素fm基因entfm的基因序列,采用primer premier 5.0软件分别设计tir基因,mpl基
因和entfm基因的引物对,再进行pcr扩增、凝胶电泳、产物纯化回收、连接t载体、转化大肠杆菌dh5α、提取t质粒、测定目标序列,根据测序后的核苷酸序列采用primer premier 5.0分别设计tir基因,mpl基因和entfm基因的探针。
[0058]
步骤s200中,提取待测样品的dna包括:采用细菌基因组dna提取试剂盒,提取待测样品中细菌的dna。
[0059]
步骤s300中,pcr反应为三重荧光定量pcr反应,利用荧光收集器收集荧光信号。
[0060]
步骤s400中,根据荧光信号同时判断待测样品中的大肠杆菌o157∶h7、单增李斯特菌、蜡样芽孢杆菌的阴性或阳性。
[0061]
在本技术所提供的实施例中,检测方法还包括:步骤s400中,绘制pcr对数扩增曲线图,标记ct值,通过ct值对待测样品中的大肠杆菌o157∶h7、单增李斯特菌、蜡样芽孢杆菌进行定量分析。
[0062]
采用本技术的pcr反应检测待测样品中的大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌,不仅特异性高、灵敏度好,可一次性同时检测3个致病菌,而且检测周期短,还能进行定量分析。
[0063]
在本技术所提供的实施例中,tir基因的引物对如seq id no:1-2所示,tir基因的探针如seq id no:3所示;mpl基因的引物对如seq id no:4-5所示,mpl基因的探针如seq id no:6所示;entfm基因的引物对如seq id no:7-8所示,entfm基因的探针如seq id no:9所示。
[0064]
在本技术所提供的实施例中,在进行pcr反应时,pcr反应体系为20μl;
[0065]
tir基因的引物对包括上游引物tir-f和下游引物tir-r;mpl基因的引物对包括上游引物mpl-f和下游引物mpl-r、entfm基因的引物对包括上游引物entfm-f和下游引物entfm-r;
[0066]
pcr反应体系(20μl)包括:10μl的2
×
superreal-time pcr premix,0.4μl的上游引物tir-f,0.4μl的下游引物tir-r,0.4μl的上游引物mpl-f,0.4μl的下游引物mpl-r,0.4μl的上游引物entfm-f,0.4μl的下游引物entfm-r,0.8μl的tir基因的探针,0.8μl的mpl基因的探针,0.8μl的entfm基因的探针,1.0μl的待测样品dna模板,余量为超纯水。
[0067]
其中,靶基因(tir基因、mpl基因、和entfm基因)的引物对和探针的信息(如,具体名称、序列、序号、产物长度、tm值)如表1所示。
[0068]
在本技术所提供的实施例中,针对大肠杆菌o157∶h7的tir基因的引物对的浓度为8-12μmol/l,针对大肠杆菌o157∶h7的tir基因的探针的浓度为4-6μmol/l,针对单增李斯特菌的mpl基因的引物对的浓度为13-17μmol/l,针对单增李斯特菌的mpl基因的探针的浓度为4-6μmol/l,针对蜡样芽孢杆菌的entfm基因的引物对的浓度为13-17μmol/l,针对蜡样芽孢杆菌的entfm基因的探针的浓度为4-6μmol/l。
[0069]
在本技术所提供的实施例中,pcr反应的反应条件为:95℃13-18分钟
→
(95℃3-4秒,60℃26-34秒)
×
38-42个循环。
[0070]
本技术的实施例提供一种乳品致病菌的检测试剂盒,包括:容器,以及位于容器内的本技术的检测试剂。
[0071]
在本技术所提供的实施例中,检测试剂盒包括:容器,以及位于容器内的pcr反应体系,pcr反应体系为18-22μl;
[0072]
pcr反应体系(20μl)包括:10μl的2
×
superreal-time pcr premix,0.4μl的上游引物tir-f,0.4μl的下游引物tir-r,0.4μl的上游引物mpl-f,0.4μl的下游引物mpl-r,0.4μl的上游引物entfm-f,0.4μl的下游引物entfm-r,0.8μl的tir基因的探针,0.8μl的mpl基因的探针,0.8μl的entfm基因的探针,1.0μl的待测样品dna模板,余量为超纯水。
[0073]
为了更清楚的描述说明本技术的技术方案,下面列出本技术的部分具体实施例。
[0074]
在本技术实施例中,pcr反应在cfx-96荧光定量pcr仪中进行,各种工具酶类、生化试剂及试剂盒如下:细菌基因组dna提取试剂盒,dna回收试剂盒,ptopo-blunt连接及试剂盒(含载体,连接酶),质粒dna小量提取试剂盒,lb肉汤、生化管、李氏增菌液、离心管、玻璃试管、平皿、三角瓶;其他试剂均为分析纯常规试剂。
[0075]
lb固体培养基:在lb肉汤基础上加入比例为15g/l的琼脂粉,混匀煮沸融化灭菌。
[0076]
营养肉汤nb培养基(1l):牛肉膏3g,蛋白胨10g,nacl 5g,ph值7.4。
[0077]
大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌在内的20种实验菌株,如表2所示。
[0078]
表2 20种实验菌株及来源
[0079][0080][0081]
实施例1
[0082]
实施例1为针对大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌的检测,而设计
引物对和探针,并对设计的引物对和探针进行特异性和灵敏度检测的实验。
[0083]
1、引物对和探针的设计实验
[0084]
将通过blast、megalign和dnastar程序筛选出大肠杆菌o157∶h7的毒力基因tir(genbank:nc_004337.2),单增李斯特菌的毒力基因mpl(genbank:nc_003210.1)和蜡样芽孢杆菌的肠毒素fm基因entfm(genbank:nw_911826.1)做为特异性靶基因。
[0085]
根据tir基因、mpl基因、和entfm基因的基因序列,采用primer premier5.0软件分别设计tir基因、mpl基因和entfm基因引物对,再进行pcr扩增、凝胶电泳、产物纯化回收、连接t载体、转化大肠杆菌dh5α、提取t质粒、测定目标序列,根据测序后的核苷酸序列采用primer premier 5.0分别设计tir基因、mpl基因、和entfm基因的探针。其中,靶基因(tir基因、mpl基因、和entfm基因)的引物对和探针的信息(如,具体名称、序列、序号、产物长度、tm值)如表1所示。
[0086]
2、特异性检测分析
[0087]
分别量取表2中所示的20种细菌培养液(平板计数法测定菌含量107cfu/ml)2ml,采用细菌基因组dna提取试剂盒,提取基因组dna,用超纯水溶解成20μl,做为模板,-20℃保存备用。
[0088]
参照表3的荧光定量pcr反应体系,分别配制目标菌和非目标菌的pcr反应体系,在荧光定量pcr仪上进行pcr反应。
[0089]
表3荧光定量pcr反应体系
[0090][0091]
表3中,当目标菌为大肠杆菌o157∶h7时,非目标菌为表2中除大肠杆菌o157∶h7之外的其它19种菌的混合菌,上游引物为tir-f,下游引物为tir-r,探针为tir-p;当目标菌为单增李斯特菌时,非目标菌为表2中除单增李斯特菌之外的其它19种菌的混合菌,上游引物为mpl-f,下游引物为mpl-r,探针为mpl-p;当目标菌为蜡样芽孢杆菌时,非目标菌为表2中除蜡样芽孢杆菌之外的其它19种菌的混合菌,上游引物为entfm-f,下游引物为entfm-r,探针为entfm-p。
[0092]
经过组合优化,确定tir基因的引物对的浓度为10μmol/l,tir基因的探针的浓度为5μmol/l,mpl基因的引物对的浓度为15μmol/l,mpl基因的探针的浓度为5μmol/l,entfm基因的引物对的浓度为15μmol/l,entfm基因的探针的浓度为5μmol/l;目标菌为选用引物对和探针所对应能检测的致病菌。
[0093]
其中,目标菌的pcr反应体系(20μl)的反应条件为:95℃15分钟
→
(95℃3s
→
60℃
30s)
×
40个循环;非目标菌的pcr反应体系(50μl)优化的反应条件为:95℃18分钟
→
(95℃5s
→
60℃30s)
×
40个循环。
[0094]
分别对大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌进行单重荧光定量pcr反应得到图1、图2和图3所示的对数扩增曲线;图1为引物tir-f、tir-r和探针tir-p对大肠杆菌o157∶h7的荧光定量pcr对数扩增曲线图,图中对数曲线表示特异性扩增曲线;图2为引物mpl-f、mpl-r和探针mpl-p对单增李斯特菌荧光定量pcr对数扩增曲线图,图中对数曲线表示特异性扩增曲线;图3为引物entfm-f、entfm-r和探针entfm-p对蜡样芽孢杆菌荧光定量pcr对数扩增曲线图,图中对数曲线表示特异性扩增曲线。
[0095]
分别对3个批次非目标菌(除目标菌之外的19种菌的混合菌)进行荧光定量pcr反应得到图4、图5和图6所示的曲线图;图4为引物tir-f、tir-r和探针tir-p对非目标菌(除目标菌大肠杆菌o157∶h7之外的19种菌的混合菌)的荧光定量pcr扩增曲线图;图5为引物mpl-f、mpl-r和探针mpl-p对非目标菌(除目标菌单增李斯特菌之外的19种菌的混合菌)的荧光定量pcr扩增曲线图;图6为引物entfm-f、entfm-r和探针entfm-p对非目标菌(除目标菌蜡样芽孢杆菌之外的19种菌的混合菌)的荧光定量pcr扩增曲线图。
[0096]
图1、图2和图3均出现1条特异性对数扩增曲线,而图4、图5和图6均没有出现对数扩增曲线,表明本技术设计的引物tir-f、tir-r和探针tir-p对大肠杆菌o157∶h7具有良好的特异性,本技术设计的引物mpl-f、mpl-r和探针mpl-p对单增李斯特菌具有良好的特异性,本技术设计的引物entfm-f、entfm-r和探针entfm-p对蜡样芽孢杆菌具有良好的特异性。
[0097]
3、灵敏度检测分析
[0098]
分别以提取的大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌的基因组dna(1μl)为模板,用超纯水10倍梯度稀释,与各自相应的引物对和探针进行荧光定量pcr反应,得到相应的对数扩增曲线图以及相应的标准曲线图。其中,荧光定量pcr反应体系(20μl)与表3中目标菌的pcr反应体系相同,荧光定量pcr反应体系(20μl)的反应条件为:95℃15分钟
→
(95℃3s
→
60℃30s)
×
40个循环。扩增结束后观察对数扩增曲线结果,能够检测出菌液的最低浓度为荧光定量pcr检测的灵敏度。
[0099]
图7为引物tir-f、tir-r和探针tir-p对大肠杆菌o157:h7的灵敏度检测结果,对数扩增曲线1-6分别表示菌液浓度为106、105、104、103、102、101cfu/ml的曲线;图8为引物tir-f、tir-r和探针tir-p对大肠杆菌o157:h7的荧光定量pcr扩增对应的标准曲线图;图9为引物mpl-f、mpl-r和探针mpl-p对单增李斯特菌的灵敏度检测结果,对数扩增曲线1-5分别表示菌液浓度为105、104、103、102、101cfu/ml的曲线;图10为引物mpl-f、mpl-r和探针mpl-p对单增李斯特菌的荧光定量pcr扩增对应的标准曲线图;图11为引物entfm-f、entfm-r和探针entfm-p对蜡样芽孢杆菌的灵敏度检测结果,对数扩增曲线1-6分别表示菌液浓度为105、104、103、102、101cfu/ml的曲线;图12为引物entfm-f、entfm-r和探针entfm-p对蜡样芽孢杆菌的荧光定量pcr扩增对应的标准曲线图。
[0100]
参考图7至图12可知,引物tir-f、tir-r和探针tir-p引发的荧光定量pcr反应,可使大肠杆菌o157∶h7的检测灵敏度达到101cfu/ml;引物mpl-f、mpl-r和探针mpl-p引发的荧光定量pcr反应,可使单增李斯特菌的检测灵敏度达到101cfu/ml;引物entfm-f、entfm-r和探针entfm-p引发的荧光定量pcr反应,可使蜡样芽孢杆菌的检测灵敏度达到101cfu/ml。因
此本技术所设计的引物对和探针对大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌进行检测,具有很高的灵敏度。
[0101]
实施例2
[0102]
实施例2为三重荧光定量pcr检测方法的建立实验,为了保证检测方法的准确度和灵敏度,先进行二重荧光定量pcr反应进行条件优化,再进行三重荧光定量pcr反应,从而建立三重荧光定量pcr检测方法。
[0103]
1、二重荧光定量pcr反应
[0104]
对提取的大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌的基因组dna两两组合,作为模板,并采用与其相对应的引物对和探针(tir基因的引物对和探针、mpl基因的引物对和探针、entfm基因的引物对和探针),进行二重荧光定量pcr反应,得到图13、图14和图15所示的对数扩增曲线;其中,二重荧光定量pcr反应的反应体系如表4所示。
[0105]
表4二重荧光定量pcr反应体系
[0106]
成分体积(μl)2
×
superreal-time pcr premix10上游引物各0.4,(共0.8)下游引物各0.4,(共0.8)探针各0.8,(共1.6)dna模板各1,(共2)超纯水4.8总体积20
[0107]
其中,tir基因的引物对的浓度为10μmol/l,tir基因的探针的浓度为5μmol/l,mpl基因的引物对的浓度为15μmol/l,mpl基因的探针的浓度为5μmol/l,entfm基因的引物对的浓度为15μmol/l,entfm基因的探针的浓度为5μmol/l;目标菌为选用引物对和探针所对应能检测的致病菌。
[0108]
其中,二重荧光定量pcr反应体系的反应条件为:95℃15分钟
→
(95℃3s
→
60℃30s)
×
40个循环。
[0109]
图13为针对单增李斯特菌和蜡样芽孢杆菌的二重荧光定量pcr对数扩增曲线图,曲线1为单增李斯特菌毒力基因mpl对数扩增曲线,曲线2为蜡样芽孢杆菌毒力基因entfm对数扩增曲线;图14为针对大肠杆菌o157∶h7和单增李斯特菌的二重荧光定量pcr对数扩增曲线图,曲线1为大肠杆菌o157∶h7毒力基因tir对数扩增曲线,曲线2为单增李斯特菌毒力基因mpl对数扩增曲线;图15为针对大肠杆菌o157∶h7和蜡样芽孢杆菌的二重荧光定量pcr对数扩增曲线图,曲线1为大肠杆菌o157∶h7毒力基因tir对数扩增曲线,曲线2为蜡样芽孢杆菌毒力基因entfm对数扩增曲线。
[0110]
图13、图14、图15均具有相应特异性对数扩增曲线,且无非特异性对数扩增曲线,进一步说明:本技术设计的引物tir-f、tir-r和探针tir-p对大肠杆菌o157∶h7具有良好的特异性,本技术设计的引物mpl-f、mpl-r和探针mpl-p对单增李斯特菌具有良好的特异性,本技术设计的引物entfm-f、entfm-r和探针entfm-p对蜡样芽孢杆菌具有良好的特异性。
[0111]
2、三重荧光定量pcr反应
[0112]
以提取的大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌基因组dna为模板,并
采用tir的引物对和探针、mpl的引物对和探针、以及entfm的引物对和探针,进行三重荧光定量pcr反应,其中,三重荧光定量pcr反应的反应体系如表5所示。
[0113]
表5三重荧光定量pcr反应体系
[0114]
成分体积(μl)2
×
superreal-time pcr premix10上游引物各0.4,(共1.2)下游引物各0.4,(共1.2)探针各0.8,(共2.4)dna模板个1,(共3)超纯水2.2总体积20
[0115]
其中,tir基因的引物对的浓度为10μmol/l,tir基因的探针的浓度为5μmol/l,mpl基因的引物对的浓度为15μmol/l,mpl基因的探针的浓度为5μmol/l,entfm基因的引物对的浓度为15μmol/l,entfm基因的探针的浓度为5μmol/l;目标菌为选用引物对和探针所对应能检测的致病菌。
[0116]
其中,三重荧光定量pcr反应体系的反应条件为:95℃15分钟
→
(95℃3s
→
60℃30s)
×
40个循环。
[0117]
图16为针对大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌的三重荧光定量pcr对数扩增曲线图,曲线1为大肠杆菌o157:h7毒力基因tir对数扩增曲线,曲线2为单增李斯特菌毒力基因mpl对数扩增曲线,曲线3为蜡样芽孢杆菌毒力基因entfm对数扩增曲线。
[0118]
图16中出现了大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌3种菌各自的特异性对数扩增曲线,3条特异性对数扩增曲线非常清晰,无非特异性对数扩增曲线,表明本技术的三重荧光定量pcr反应可以一次性同时检测大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌,且检测结果稳定可靠,具有较大的应用价值。
[0119]
实施例3
[0120]
实施例3为在建立三重荧光定量pcr检测方法的基础上,采用该三重荧光定量pcr检测方法检测乳品致病菌的实验。
[0121]
采用三重荧光定量pcr检测方法,分别对20份被人工感染的乳品样品进行检测。其中,除dna模板为待测乳品样品中的细菌dna外,三重荧光定量pcr反应体系的其他参数参考表5;三重荧光定量pcr反应体系的反应条件为:95℃15分钟
→
(95℃3s
→
60℃30s)
×
40个循环。
[0122]
本技术为了说明实施例3所采用的三重荧光定量pcr检测方法灵敏度高、特异性好、简单快捷、检测周期短,还采用菌株分离培养法检测乳品中的致病菌,即为对比例1。
[0123]
对比例1
[0124]
参考《食品安全国家标准》中关于大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌的操作规程,采用菌株分离培养法对20份被人工接种感染的乳品样品(与实施例3中的20份被人工感染的乳品样品相同)进行检测。其中,被待检测乳品样品需要在37℃下恒温振荡培养24小时。
[0125]
其中,实施例3(采用三重荧光定量pcr检测方法)和对比例1(采用菌株分离培养
法)的检测结果如表6所示。
[0126]
表6实施例3和对比例1的检测结果
[0127][0128][0129]
表6中,e.c.表示大肠杆菌o157∶h7,l.m.表示单增李斯特菌,b.c.表示蜡样芽孢杆菌,阳性结果表示为“+”,阴性结果表示为
“‑”
。参考表6的检测数据可知,采用菌株分离培养法检测乳品样品的阳性检出率为100%,采用三重荧光定量pcr检测方法检测乳品样品的阳性检出率也为100%,两种方法的检测结果完全相符,符合率为100%。但与传统的菌株分离培养法相比,本技术的三重荧光定量pcr检测方法的操作简易、检测周期短(24h内)、可一次性同时检测大肠杆菌o157∶h7、单增李斯特菌和蜡样芽孢杆菌3致病菌,检测效率高、灵敏度高、特异性好、具有很高的应用价值。
[0130]
最后应说明的是:以上实施例仅用以说明本技术的技术方案,而非对其限制。尽管参照前述实施例对本技术进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本技术各实施例技术方案的精神和范围。
[0131]
[0132]
[0133]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1