抗β-淀粉样蛋白抗体及其用途的制作方法
no:1)。在第一方面的一些实施方案中,所述hcdr2序列包含氨基酸序列hiywdddkrynpslks (seq id no:2)。在第一方面的一些实施方案中,所述hcdr3序列包含氨基酸序列nrgyvnyasgfay (seq id no:3)。
10.在第一方面的一些实施方案中,特异性结合β-淀粉样蛋白的抗体或其抗原结合部分还包含轻链可变区,其中所述轻链可变区包含lcdr1、lcdr2和/或lcdr3序列。
11.在第一方面的一些实施方案中,所述lcdr1序列包含氨基酸序列rssqsivhsngntyle (seq id no:5)。在第一方面的一些实施方案中,所述lcdr2序列包含氨基酸序列kvsnrfs (seq id no:6)。在第一方面的一些实施方案中,所述lcdr3序列包含氨基酸序列fqgshvplt (seq id no:7)。
12.在第一方面的一些实施方案中,所述特异性结合β-淀粉样蛋白的抗体或其抗原结合部分的重链可变区包含seq id no: 4所示的氨基酸序列或者与上述序列具有至少80%同源性的氨基酸序列。
13.在第一方面的一些具体实施方案中,所述重链可变区的氨基酸序列如seq id no: 4所示。
14.在第一方面的一些实施方案中,所述特异性结合β-淀粉样蛋白的抗体或其抗原结合部分的轻链可变区包含seq id no: 8所示的氨基酸序列或者与上述序列具有至少80%同源性的氨基酸序列。
15.在第一方面的一些具体实施方案中,所述轻链可变区的氨基酸序列如seq id no: 8所示。
16.在第一方面的一些实施方案中,所述抗原结合部分选自:fab片段、fab’片段、f(ab’)2片段、fv片段、scfv片段、fd片段或单域抗体。
17.在第一方面的一些实施方案中,所述特异性结合β-淀粉样蛋白的抗体或其抗原结合部分特异性结合于灵长类动物β-淀粉样蛋白。在第一方面的一些具体实施方案中,所述特异性结合β-淀粉样蛋白的抗体或其抗原结合部分特异性结合于人β-淀粉样蛋白。
18.在第一方面的一些实施方案中,所述特异性结合β-淀粉样蛋白的抗体为鼠源化抗体。
19.在第一方面的一些实施方案中,所述特异性结合β-淀粉样蛋白的抗体为单克隆抗体。
20.在第一方面的一些具体实施方案中,所述特异性结合β-淀粉样蛋白的抗体的重链可变区氨基酸序列如seq id no:4所示,以及所述特异性结合β-淀粉样蛋白的抗体的轻链可变区氨基酸序列如seq id no: 8所示。
21.第二方面,本技术提供了核酸分子,其编码第一方面所述的特异性结合β-淀粉样蛋白的抗体或其抗原结合部分。
22.第三方面,本技术提供了第一方面所述的特异性结合β-淀粉样蛋白的抗体或其抗原结合部分、或第二方面所述的核酸分子在制备用于检测β-淀粉样蛋白和/或用于诊断阿尔兹海默症的产品中的用途。
附图说明
23.图1显示了抗β-淀粉样蛋白单克隆抗体7d10-1e6的ec
50
值测定曲线。
具体实施方式
24.人体内aβ最常见的亚型是aβ1~40和aβ1~42,在人脑脊液和血中,aβ1~40分别比aβ1~42的含量水平高10倍和1.5倍,aβ1~42具有更强的毒性,且更容易聚集,从而形成aβ沉淀的核心,引发神经毒性作用。在病理条件下,ad患者脑内aβ的产生是正常情况下的4~10倍,大量的aβ聚集形成的神经炎性斑(老年斑),老年斑的形成导致海马内大量细胞的死亡,这说明延长的两个氨基酸不仅增加了aβ的疏水性,使其更容易聚集,而且提高了聚集物的稳定性,早期即可选择性地在淀粉样斑块中沉积。
25.在ad患者中,在脑脊液(csf)中会出现aβ浓度的变化,其病理变化依次是脑aβ积聚、csf增加、海马和灰质体积减少、葡萄糖代谢减少、记忆障碍和痴呆。aβ可由多种细胞产生,循环于血液、脑脊液和脑间质液中,大多与伴侣蛋白分子结合,少数以游离状态存在。aβ不仅在脑细胞中表达,也能够在神经元、星形胶质细胞和小胶质细胞中表达,还会在外周器官和组织如肝、肾、胰腺、脾等脏器及各种血液和内皮细胞中表达。
26.aβ抗体可使体外聚集状的aβ解聚,从而降低其毒性作用,用aβ抗体治疗转基因ad小鼠,不但能减少模型鼠脑内的老年斑的数量,也可以改善其学习记忆能力,因此制备和应用针对aβ及其不同片段的抗体将会对于相关疾病的诊断、治疗以及研究都会有积极的影响。
27.本技术提供了特异性结合于β-淀粉样蛋白的新型抗β-淀粉样蛋白抗体或其抗原结合部分。在优选的实施方案中,本技术的抗体或其抗原结合部分具有pm级别的ec
50
值。本技术还提供了编码该抗体或其抗原结合片段的核酸分子、制备和纯化该抗体的方法以及所述抗体或其抗原结合片段的医学和生物学应用,例如用于检测β-淀粉样蛋白和/或用于诊断阿尔兹海默症。
28.为容易地理解本技术,首先定义本文中使用的某些术语。
29.如本文所用的,术语“抗体”是指包含四条多肽链,即通过双硫键互连的两条重链(h)及两条轻链(l)的免疫球蛋白分子,以及其多聚体(例如igm)。各重链包含重链可变区(缩写为vh)及重链恒定区(缩写为ch)。重链恒定区包含三个结构域,即ch1、ch2及ch3。各轻链包含轻链可变区(缩写为vl)及轻链恒定区(缩写为cl)。轻链恒定区包含一个域(cl1)。vh及vl区可进一步细分成称为互补决定区(cdr)的高变区,其中穿插有称为构架区(fr)的保守区。在一些实施方案中,从n-末端至c-末端,轻链与重链可变结构域均包含fr1、cdr1、fr2、cdr2、fr3、cdr3与fr4。
30.如本文所用的,术语抗体的“抗原结合部分”是指负责结合抗原的完整抗体分子的一部分或区段。抗原结合域可以包含重链可变区(vh)、轻链可变区(vl)或上述两者。抗体的抗原结合片段可使用任何适合的标准技术从完整抗体分子制备,所述标准技术包括蛋白水解消化或重组遗传工程化技术等。抗原结合部分的非限制性实例包括:fab片段、f(ab')2片段、fd片段、fv片段、单链fv (scfv)分子、单域抗体、dab片段及由模拟抗体高变区的氨基酸残基组成的最小识别单元(例如分离的cdr)。术语“抗原结合部分”也包括其它工程化的分子,如双抗体、三抗体、四抗体及微型抗体等。例如,本文中所述fd片段指由vh与ch1结构域组成的抗体片段;fv片段由抗体的单臂中vl与vh结构域组成;dab片段(ward et al., nature 1989; 341:544-546)由vh结构域组成。
31.本领域技术人员公知,互补决定区(cdr,通常有cdr1、cdr2及cdr3)是可变区中对
抗体的亲和力和特异性影响最大的区域。vh或vl的cdr序列有两种常见的定义方式,即kabat定义和chothia定义,例如参见kabat et al.,
ꢀ“
sequences of proteins of immunological interest”,national institutes of health, bethesda,md. (1991); al-lazikani et al.,j mol biol 273:927-948 (1997);以及martin et al.,proc. natl. acad. sci. usa 86:9268-9272 (1989)。对于给定抗体的可变区序列,可以根据kabat定义或者chothia定义来确定vh和vl序列中cdr区序列。在本技术的实施方案中,利用kabat定义cdr序列。在本文中,重链可变区的cdr1、cdr2及cdr3分别简称为hcdr1、hcdr2及hcdr3;轻链可变区的cdr1、cdr2及cdr3分别简称为lcdr1、lcdr2及lcdr3。
32.对于给定抗体的可变区序列,可以通过多种方式分析可变区序列中cdr区序列,例如可以利用在线软件abysis确定(http://www.abysis.org/)。
33.如本文所用的,术语“特异性结合”,是指两个分子之间的非随机结合反应,例如抗体至抗原表位的结合,例如抗体以比其对非特异性抗原的亲和性大至少两倍的亲和性结合于特异性抗原的能力。然而应了解,抗体能够特异性结合于两种或更多种与其序列相关的抗原。例如,本发明的抗体可特异性结合于人类与非人类(例如小鼠或非人类灵长动物)的β-淀粉样蛋白。
34.如本文所用的,术语“单克隆抗体”指由基本同质的抗体群体获得的抗体,即,除了可能在少量个体中存在自然发生的突变以外,组成群体的各个抗体是相同的。
35.如本文所用的,术语“鼠源化抗体”是指其中所有恒定结构域序列均为小鼠序列的任何抗体。此类抗体可通过杂交瘤产生。
36.可额外用于抗体方法中的合适的技术包括基于β-淀粉样蛋白的亲和纯化、非变性凝胶纯化、hplc或rp-hplc、分子排阻、在蛋白a柱上纯化、或这些技术的任何组合。可使用elisa测定法测定β-淀粉样蛋白抗体同种型,例如可使用鼠ig吸附的抗人ig鉴定人ig。
37.可通过本领域已知的多种标准的蛋白纯化或重组表达技术中的任何一种来产生适于产生抗体的β-淀粉样蛋白。适于产生免疫应答的β-淀粉样蛋白的形式包括β-淀粉样蛋白的亚型aβ1~40和aβ1~42。另外的β-淀粉样蛋白的形式包括β-淀粉样蛋白表达细胞、含有β-淀粉样蛋白的制品或细胞提取物或级分、部分纯化的β-淀粉样蛋白。
38.如本文所用的,术语“同源性”被定义为经过序列比对和引入空位后,氨基酸或核苷酸序列变体中相同的残基的百分比,如果需要,达到最大百分比的同源性。用于比对的方法和计算机程序在本领域内是公知的。本文所述的“至少80%同源性”是指同源性为80%至100%任一值,例如85%、90%、95%、99%等。
39.如本文所用的,术语“ec
50
值”是指半数最大效应浓度(concentration for 50% of maximal effect, ec
50
),指能引起50%最大效应的浓度。
40.第一方面,本技术提供了特异性结合β-淀粉样蛋白的抗体或其抗原结合部分,其包含重链可变区的hcdr1、hcdr2和/或hcdr3。
41.下表1中示例性列出了适用于本技术公开的抗体的cdr、重链可变区和轻链可变区氨基酸序列。在某些实施方案中,抗β-淀粉样蛋白抗体或其抗原结合部分包含hcdr1、hcdr2和/或hcdr3序列,其独立地选自表1中所示的hcdr1、hcdr2和/或hcdr3序列中任一者。在某些实施方案中,本技术的抗β-淀粉样蛋白抗体可进一步包含lcdr1、lcdr2和/或lcdr3,其独立地选自表1中所示的lcdr1、lcdr2和/或lcdr3序列中任一者。举例而言,本技术的抗β-淀
粉样蛋白抗体可包含表1中所示的重链可变区,任选地与表1中所示的轻链可变区组合或配对。
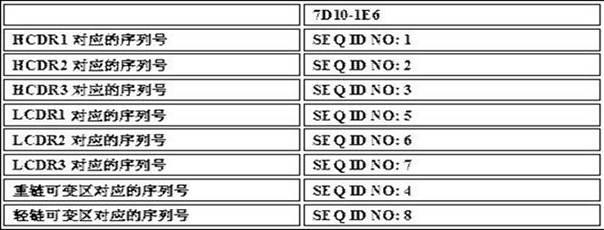
42.表1:示例性抗β-淀粉样蛋白抗体7d10-1e6的重链cdr、轻链cdr、重链可变区和轻链可变区的氨基酸序列的序列号
43.在第一方面的一些实施方案中,本文公开的抗体或其抗原结合部分的hcdr1的氨基酸序列如seq id no: 1所示。在第一方面的一些实施方案中,hcdr2的氨基酸序列如seq id no: 2所示。在第一方面的一些实施方案中,hcdr3的氨基酸序列如seq id no: 3所示。
44.本文公开的抗体或其抗原结合部分在包含重链可变区的基础上还可以进一步包含轻链可变区。
45.在第一方面的一些实施方案中,本文公开的抗体或其抗原结合部分的lcdr1的氨基酸序列如seq id no: 5所示。在第一方面的一些实施方案中,lcdr2的氨基酸序列如seq id no: 6所示。在第一方面的一些实施方案中,lcdr3的氨基酸序列如seq id no: 7所示。
46.在第一方面的一些具体的实施方案中,本文公开的抗体或其抗原结合部分的重链可变区与seq id no: 4所示的氨基酸序列具有至少80%同源性,例如90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的同源性。在第一方面的一些具体的实施方案中,所述抗体重链可变区的氨基酸序列如seq id no: 4所示。
47.在第一方面的一些具体的实施方案中,本文公开的抗体或其抗原结合部分的轻链可变区与seq id no:8所示的氨基酸序列具有至少80%同源性,例如具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的同源性。在第一方面的一些具体的实施方案中,所述抗体轻链可变区的氨基酸序列如seq id no:8所示。
48.在第一方面的一些实施方案中,本文公开的抗体的重链可变区或轻链可变区可以在上述所列举的各自对应的具体氨基酸序列的基础上取代、缺失或添加至少一个氨基酸,且得到的变体仍保持结合β-淀粉样蛋白的活性。
49.在某些实施方案中,上述氨基酸取代、缺失或添加的数目为1-30个或1-30个之间的任一数值,优选为1-20个,更优选为1-10个。在优选的实施方案中,序列变体与原氨基酸序列相差约1、2、3、4、5、6、7、8、9或10个氨基酸的取代、缺失和/或添加。在更优选的实施方案中,序列变体与原氨基酸序列相差约1、2、3、4或5个氨基酸的取代、缺失或添加。在具体的实施方案中,所述氨基酸取代为保守性取代。
50.在第一方面的一些实施方案中,本文公开的抗体或其抗原结合部分是鼠源化抗体。
51.在优选的实施方案中,本文公开的抗体为抗体7d10-1e6,其中抗体7d10-1e6的重链可变区氨基酸序列如seq id no: 4所示,轻链可变区氨基酸序列如seq id no: 8所示。
52.在第一方面的一些实施方案中,本文公开的抗原结合部分选自:fab片段、fab’片段、f(ab’)2片段、fv片段、scfv片段、fd片段或单域抗体。
53.本文公开的抗体或其抗原结合部分能够特异性结合β-淀粉样蛋白。在第一方面的一些实施方案中,所述抗体或其抗原结合部分特异性结合灵长类动物β-淀粉样蛋白,或者与灵长类动物β-淀粉样蛋白具有高度同源性的物种的β-淀粉样蛋白。在第一方面的一些具体的实施方案中,所述抗体或其抗原结合部分特异性结合人β-淀粉样蛋白,例如人β-淀粉样蛋白的aβ1~40亚型或aβ1~42亚型,优选为aβ1~42亚型。
54.在一些更具体的实施方案中,本文公开的抗体为抗人β-淀粉样蛋白单克隆抗体。β-淀粉样蛋白抗体类型与亚型可由本领域已知的任何方式确定。通常,抗体类型与亚型可使用特异于特定抗体类型与亚型的抗体确定。
55.第二方面,本技术提供了核酸分子,其编码第一方面所述的特异性结合β-淀粉样蛋白的抗体或其抗原结合部分。
56.如本文所用的,术语“核酸分子”意在包括dna分子及rna分子。核酸分子可为单链或双链,且可为cdna。
57.在第二方面的一些实施方案中,编码所述抗体重链可变区氨基酸序列的核酸分子包含seq id no: 9所示的核苷酸序列。在第二方面的一些实施方案中,编码所述抗体重链可变区氨基酸序列的核酸分子的核苷酸序列如seq id no: 9所示。在第二方面的一些具体实施方案中,seq id no: 9所示的核苷酸序列编码seq id no: 4所示的所述抗体的重链可变区氨基酸序列。
58.在第二方面的一些实施方案中,编码所述抗体轻链可变区氨基酸序列的核酸分子包含seq id no: 10所示的核苷酸序列。在第二方面的一些实施方案中,编码所述抗体轻链可变区氨基酸序列的核酸分子的核苷酸序列如seq id no: 10所示。在第二方面的一些具体实施方案中,seq id no: 10所示的核苷酸序列编码seq id no: 8所示的所述抗体的轻链可变区氨基酸序列。
59.第三方面,本技术还提供了第一方面所述的特异性结合β-淀粉样蛋白的抗体或其抗原结合部分、或第二方面所述的核酸分子在制备用于检测β-淀粉样蛋白和/或用于诊断阿尔兹海默症的产品中的用途。
60.在第三方面的一些实施方案中,所述产品可以为试剂盒、试纸条(例如胶体金免疫层析试纸条)、检测卡、微流控检测装置等。
61.在第三方面的一些实施方案中,所述产品还可以包含检测标记,如胶体金、化学发光标记、荧光标记、纳米颗粒标记等。
62.在第三方面的一些实施方案中,所述产品还可以包括用于检测的其它试剂,例如酶或胶体金标记抗原或抗体、底物、参考标准品、稀释液、洗涤液等。
63.在第三方面的一些实施方案中,所述产品还可以包括用于处理生物样品以进行检测的试剂,所述生物样品可以为脑脊液、脑间质液、组织液、尿液、血液或血清。
64.在第三方面的一些实施方案中,所述产品还可以包括产品使用说明书。
65.本技术还提供了制备和纯化特异性结合β-淀粉样蛋白的抗体或其抗原结合部分
的方法。
66.在一些实施方案中,向动物接种β-淀粉样蛋白抗原后,可自动物体内得到抗体和/或产生抗体的细胞。产生抗体的永生化细胞系可由经免疫的动物体中分离出的细胞制备。免疫接种后,杀死动物,取淋巴结和/或脾脏b细胞进行永生化处理,经过致癌性化合物及诱变化合物处理,与永生化细胞(例如骨髓瘤细胞)融合,去除肿瘤抑制基因的活性。若使用骨髓瘤细胞进行融合时,该骨髓瘤细胞最好不分泌免疫球蛋白多肽(非分泌性细胞系)。使用β-淀粉样蛋白、其部分或表达β-淀粉样蛋白的细胞筛选永生化细胞。在优选的实施方案中,初次筛选是利用酶联免疫分析法(elisa)进行。选取产生抗β-淀粉样蛋白抗体的细胞例如杂交瘤进行克隆,再进一步筛选所需的特性,包括生长良好、抗体产量高以及具有所需抗体特性等。杂交瘤的筛选、克隆及扩增方法是本领域普通技术人员熟知的。在一些实施方案中,经免疫接种的动物为非人类动物,其中脾脏b细胞与来自与该非人类动物相同物种的骨髓瘤细胞系融合。在一些实施方案中,该经免疫接种的动物为balb/c小鼠。
67.在一些实施方案中,可以利用亲和层析的方法对本文公开的抗β-淀粉样蛋白抗体进行分离纯化,根据所利用的亲和柱的特性,可以使用常规的方法例如高盐缓冲液、改变ph等方法洗脱结合在亲和柱上的抗β-淀粉样蛋白抗体。
68.在第三方面的一些具体实施方案中,可以采用protein g亲和层析柱进行抗体纯化。
69.本说明书和权利要求书中,词语“包括”、“包含”和“含有”意指“包括但不限于”,且并非意图排除其他部分、添加物、组分或步骤。
70.应该理解,在本技术的特定方面、实施方案或实施例中描述的特征、特性、组分或步骤,可适用于本文所描述的任何其他的方面、实施方案或实施例,除非与之矛盾。
71.上述公开内容从总体上描述了本技术,以下实施例是对本技术作进一步的说明,不应理解为对本技术的限制。本发明公开了特异性结合灵长类动物(人类等) β-淀粉样蛋白的抗体,且该抗体或抗体部分被用于检测和诊断等方面的应用,如在阿尔兹海默症诊断中的用途。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明的范围内。本领域技术人员能在不脱离本
技术实现要素:
、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明。
72.为了使本领域的技术人员更好地理解本发明的技术方案,下面结合实施例对本发明作进一步的详细说明。
实施例
73.实施例1. 材料与方法1.1试剂和仪器1.1.1细胞培养
74.1.1.2 elisa检测
75.1.2 动物
[0076] 实施例2. 单克隆抗体的制备2.1 动物免疫将β-淀粉样蛋白(aβ1~42亚型)免疫原与佐剂按1:1的体积比乳化后,在balb/c小鼠(10只)皮下进行多点免疫注射,其中免疫方案如表2所示:表2
[0077] 2.2 效价测定取10只免疫小鼠的腹水分别用生理盐水稀释成不同浓度,并通过酶联免疫吸附测定(elisa)法测定其效价,具体步骤如下:1. 包被:用包被缓冲液pbs将β-淀粉样蛋白(aβ1~42亚型)免疫原进行稀释并加入elisa酶联板中,0.1 μg/孔,4 ℃过夜;2. 封闭:生理盐水洗3遍,加入封闭液,200 μl/孔,37 ℃下孵育1.5 h;3. 向微孔板中加入100 μl待测样本,37 ℃下孵育45 min,洗板3次,扣干;4. 加入100 μl酶标抗体,用pbs稀释5000倍,37 ℃下孵育45 min,洗板3次,扣干;5. 加入tmb显色液100 μl,室温反应5 min,加入终止液,在酶标仪上进行读数;阴性对照为生理盐水。elisa效价检测结果如表3所示:表3
稀释比例#1#2#3#4#5#6#7#8#9#101:10002.5092.2161.9842.2262.262.511.5431.3321.6071.8431:20002.2421.6491.6181.9712.0192.1361.1180.8891.4531.3881:40001.9081.2371.0771.5931.5071.4570.880.7221.0541.0761:80001.3750.970.6821.241.251.2750.5530.4190.70.7931:160000.910.6060.4690.8730.7590.8850.3480.2560.470.5231:320000.5890.3730.3020.5260.5430.4980.2050.1680.2790.321:640000.3870.2470.2110.3850.3680.3630.1460.130.2270.222阴性对照0.0720.0680.0630.0690.0770.0720.0680.0620.0690.077
[0078]
2.3 细胞融合和筛选选出最佳免疫应答的#1 balb/c小鼠的脾细胞与sp2/0小鼠骨髓瘤细胞进行细胞融合,以β-淀粉样蛋白(aβ1~42亚型)作为检测抗原包板,经过多次筛选以及多次稳定性试验得到稳定分泌特异性抗体的阳性杂交瘤细胞株7d10-1e6。细胞株7d10-1e6由北京第一生物化学药业有限公司于2022年2月17日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc,中国北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编:100101),保藏号为cgmcc no. 45043,其分类命名为balb/c小鼠杂交瘤细胞。
[0079]
2.4 放大培养将阳性细胞株7d10-1e6采用t75培养瓶培养,冻存保种以及腹水制备;腹水制备流程如下所述:将小鼠用液体石蜡致敏,同时培养杂交瘤细胞,将培养好的杂交瘤细胞进行小鼠腹腔注射,观察小鼠腹水生长状态,及时收取腹水;
代次标记-有限稀释6孔培养默认为第一代,每传代一次增加一代将筛选的细胞扩入t75培养瓶中培养,冻存,在80%进行冻存,冻存代次3;冻存液:90% fbs+10% dmso。
[0080]
2.5 细胞冻存以及复苏2.5.1 细胞复苏培养基:10% fbs+1% ps+dmem(高糖型);1. 于安全柜中准备15 ml无菌离心管,加入9 ml基础培养基,备用;2. 于37 ℃水浴中将冻存细胞快速化冻;3. 于生物安全柜中,将解冻细胞用1 ml枪转移至15 ml离心管中,1000 r/min离心5 min;4. 弃上清,沉淀用完全培养基重悬,采用t75培养瓶进行培养。
[0081] 2.5.2 细胞冻存冻存液:6:3:1(60%fbs+30%基础培养基+10%dmso)或者90% fbs+10% dmso;1. 将t75培养瓶培养的细胞(状态圆润,透亮,细胞汇合度80%-90%)置于50 ml无菌离心管800 r/min-1000 r/min离心5 min;2. 弃上清,取3 ml冻存液快速悬浮,分装到2支冻存管中,放置梯度冻存盒中,在-80 ℃冰箱中进行保存;3. 第二天从-80 ℃冰箱转移至液氮中。
[0082]
2.6 抗体纯化将选定的免疫腹水经protein g亲和层析纯化得到抗体igg,标记为抗体7d10-1e6,其重链恒定区为igg1亚型,轻链恒定区为κ亚型。纯化前,利用腹水稀释进行初步试验,阴性对照为生理盐水。elisa检测结果如表4所示:表4
[0083] 2.7 纯化后抗体elisa检测1.用抗原(bs-0107p)包被酶联反应板,2 μg/ml,0.2 μg/孔;2.将纯化抗体按以下比例稀释:1:500、1:2000、1:8000、1:32000、1:128000、1:512000和1:2048000;3.二抗用辣根过氧化物酶标记的羊抗小鼠igg,1:5000稀释;4.显色剂用四甲基联苯胺;5.检测波长为:450nm,测得od值;
阴性对照为生理盐水。elisa检测结果如图1和表5所示:抗体7d10-1e6的ec
50
值为23.73 pm。
[0084]
表5
[0085]
可以理解,尽管本技术以上述具体形式描述了所涉及的发明,但这些发明并不局限于这些具体形式描述的特定内容。对本领域的技术人员显而易见的是,在不偏离本技术所描述的发明精神的前提下,还可对其中所涉及的发明包含的技术特征进行各种等同变化,这些变化都应该属于所述发明的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1