NK细胞治疗产品通用型临床前生物分布检测试剂盒的制作方法
nk细胞治疗产品通用型临床前生物分布检测试剂盒
1.nk细胞治疗产品通用型临床前生物分布检测试剂盒。
技术领域
2.本发明涉及生物分布分析、药代动力学、毒代动力学、细胞治疗药物安全性评价和临床前研究领域,尤其涉及一种nk细胞治疗产品通用型临床前生物分布检测试剂盒。
背景技术:
3.自然杀伤细胞(natural killer cell, nk细胞)来源于骨髓淋巴样干细胞,其分化、发育依赖于骨髓及胸腺微环境,主要分布在骨髓、外周血、肝、脾、肺和淋巴结。nk细胞不同于t细胞和b细胞,是一类无需预先致敏就能非特异性杀伤肿瘤细胞和病毒感染细胞的淋巴细胞。近年来,伴随着细胞基因治疗领域的不断发展,t细胞被生物医药领域研究人员开发成嵌合抗原受体t细胞免疫疗法( chimeric antigen receptor t-cell immunotherapy, car-t)治疗产品,nk细胞的治疗作用也备受关注。目前已经有各种各样的nk细胞改造型产品被用于医药研发,例如基于病毒载体转导的细胞构建car-nk,或基于胞外偶联方式构建car-nk的细胞治疗产品,双靶点或多靶点car-nk,基因编辑的nk细胞类产品。
4.细胞治疗的nk类产品离不开临床前的药代动力学和生物分布研究。对于病毒载体导入在nk细胞上表达的car可以基于转入基因即car部分的序列进行特异性检测。当前常用的技术手段是对每一个新的car-nk根据car序列分别基于qpcr技术检测特定的car,可是,基于转入基因的检测方式对于每一个转入基因针对不同的分子都需要构建独立的qpcr检测方法,这造成早期临床前研究的工作量巨大,也需要耗费较长的时间,对快速推进早期研究具有不利的时间成本。因此,建立通用的且特异性地直接区分人源nk细胞和实验动物如小鼠来源的基因组dna的方法体系,可以为临床前研究提供快捷和便利,具有重要的工业价值和经济效益。
5.另外,对于细胞外直接偶联car部分的car-nk或其它改造型的nk细胞治疗产品,并不适合基于car序列构建qpcr的方法。例如直接偶联的car,car本身就已经表达成蛋白性质的成品进行偶联,因此dna层面的仅基于car的检测方法则不再适用。为了表征nk本身的药代动力学和生物分布行为,必须基于nk细胞本身基因序列构建能特异性区分人源nk细胞的基因和动物基因的定量pcr方法。如何找到特异的dna序列进行上述区分是本领域经常碰到的难题。具体来说,虽然cd56分子是nk细胞表面的标志性分子,但实际上此分子的基因在小鼠和人nk细胞甚至其它细胞或组织均存在。找到怎样的基因特异性序列应用于nk细胞药代与分布,并成功构建对应的检测方法是本领域人员一直面对的重要挑战。
技术实现要素:
6.针对上述问题,本发明创新性地找到并提出特异性dna序列,可以特异性区分人源nk细胞来源的dna序列和非人源动物基因来源的dna序列,并基于该特异性dna序列构建区
分人源nk细胞基因和非人源动物基因的qpcr体系,为nk细胞及其衍生细胞治疗类产品提供引物对和探针组,并成功设计一种nk细胞治疗产品通用型临床前生物分布检测试剂盒,从而为nk细胞及其衍生细胞治疗类产品的临床前研究提供便利。具体地,本发明需要解决以下方面的技术问题:1. 特异性,尤其是在成千上万的人nk细胞的基因中找到与动物例如小鼠差异性表达的基因序列。nk细胞基因组和动物基因组都有成千上万的基因,寻找差异性表达基因不仅需要大量比对调研,还要进行严谨的试验验证,这样才能确定其是否能够区分差异存在的序列。qpcr技术仅是一种技术方式或技术载体,qpcr技术与特异的基因序列结合才能实现其完整应用和实际的应用价值。若能实现nk细胞的药代动力学分析与分布生物分析,必须先找到特异性序列,再基于特异性序列设计qpcr方法。
7.2. 方法学设计。怎样基于qpcr定量检测dna的技术,针对个性化的特异性差异表达基因序列进行方法学设计,包括引物、探针设计和目标序列选择。
8.3. 反应体系的设置。例如反应体系中各反应成分与比例的控制与优化。
9.4. 反应体系中关键性缓冲液(buffer)的应用。相较于基础科研,本发明立足于工业应用,成分变化可能对试剂盒的使用产生影响,所以本发明的反应体系并非像基础科研那样直接用水处理或稀释样品即可,而是需要精密和严谨的分析体系,强调各细节变化,保证方法和试剂盒满足实际的试验验证。
10.5. 反应条件的确定。反应条件包括预变性、变性、退火和延伸的温度以及时间的控制。
11.6. 优化各种条件,尤其是要提高方法学的灵敏度和扩增效率。例如,克服不同个体不同基质来源的模板(即基因组dna)提取液中的基质成分干扰。
12.第一方面,本发明提供seq id no.1 所示的基因序列在区分人源nk细胞和非人源动物基因中的特异性应用。
13.第二方面,本发明提供seq id no.1 所示的基因序列在制备nk细胞治疗产品通用型临床前生物分布检测试剂盒中的应用。
14.第三方面,本发明提供用于特异性区分人源nk细胞和非人源动物基因的引物对。所述引物对用于扩增seq id no.1所示的目标基因序列;所述引物对由primer-f正向引物和primer-r反向引物组成;所述primer-f正向引物为seq id no.2所示引物,或者将seq id no.2经过一个或几个核苷酸的取代和/或缺失和/或添加且与seq id no.2具有相同功能的dna分子;所述primer-r反向引物为seq id no.3 所示引物,或者将seq id no.3经过一个或几个核苷酸的取代和/或缺失和/或添加且与seq id no.3具有相同功能的dna分子。
15.较佳地,所述正向引物和反向引物的解链温度独立地为55
±
1℃。
16.较佳地,所述正向引物和反向引物的解链温度差值不超过2℃。如果正向引物和反向引物的解链温度差值过高,会导致退火不同步。
17.第四方面,本发明提供用于特异性区分人源nk细胞和非人源动物基因的引物对在制备nk细胞治疗产品通用型临床前生物分布检测试剂盒中的应用。
18.第五方面,本发明提供用于特异性区分人源nk细胞和非人源动物基因的引物探针组。所述引物探针组包括seq id no.4所示的基因序列在5
´
端偶联发光基团和3
´
端偶联淬灭基团的taqman探针以及上述任一项所述的引物对。
19.较佳地,探针的解链温度为65
±
1℃。
20.较佳地,探针的解链温度高于primer-f正向引物或者primer-r反向引物10
±
1℃。
21.第六方面,本发明提供上述任一项所述的用于特异性区分人源nk细胞和非人源动物基因的引物探针组在制备nk细胞治疗产品通用型临床前生物分布检测试剂盒中的应用。
22.第七方面,本发明提供nk细胞治疗产品通用型临床前生物分布检测试剂盒,包括上述任一项所述的用于特异性区分人源nk细胞和非人源动物基因的引物对。或者,本发明提供nk细胞治疗产品通用型临床前生物分布检测试剂盒,包括上述任一项所述的用于特异性区分人源nk细胞和非人源动物基因的引物探针组。
23.较佳地,nk细胞治疗产品通用型临床前生物分布检测试剂盒还包括标准质粒。
24.较佳地,使用标准质粒构建标准曲线,使用引物对或引物探针组构建qpcr检测体系,通过扩增反应得到特异性的seq id no.1 所示的目标基因序列,并识别人源nk细胞和非人源动物基因的差异。
25.较佳地,扩增反应条件为:94-96℃ / 3-4分钟;94-96℃ / 15-20秒;54-56℃ / 0.75-1分钟;循环次数:35-40次。一些技术方案中,扩增反应条件为:95℃ / 3分钟;95℃ / 15秒;55℃ / 1分钟;循环次数:40次。
附图说明
26.图1是homo2基因扩增后的电泳照片;m为分子标记(dna marker)。
27.图2是pcr扩增产物的琼脂糖凝胶电泳鉴定的示意图;m为分子标记(dna marker),n是空白对照,x1、x2、x3是三个空白小鼠的基因组dna,r是人源nk细胞的基因组dna。
28.图3是本发明试剂盒的扩增曲线图。
29.图4是本发明试剂盒的标准曲线图。
具体实施方式
30.除非另外说明,本发明中所公开的实验方法均采用本技术领域常规的分子生物学、生物化学、分析化学及相关领域的常规技术。
31.除非另行定义,本发明所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
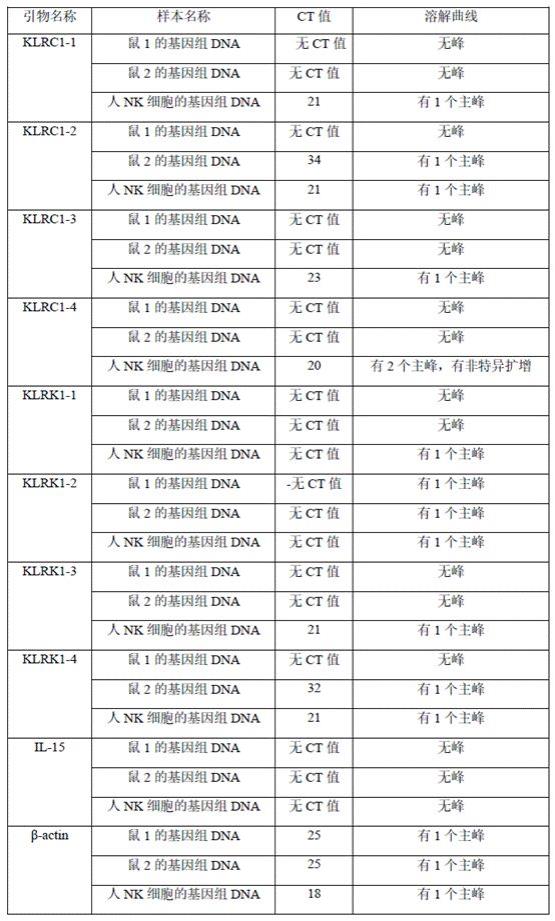
32.选择目标检测dna序列。本发明锐意提出采用seq id no.1所示的klrc1基因中一段特定序列作为目标检测dna序列。klrc1是一种43kdii型跨膜蛋白,主要表达在nk细胞膜上,属于nk类的受体家族(nkg2家族)。该基因编码的蛋白属于杀伤细胞凝集素样受体家族,是一组优先表达于nk细胞的跨膜蛋白。发明人在研发阶段尝试了多种基因序列如cd56基因、homo2基因、b-actin基因等,然而这些序列虽然在nk细胞上能够扩增但在鼠基因组中也能扩增到相应序列。现有技术中klrc1作为哮喘生物标志物被进行qpcr扩增用来探讨klrc1与哮喘的关联性,但是本发明首次提出将seq id no.1所示的klrc1基因序列用来区分人源nk细胞和其它种属动物的基因序列。
33.基于seq id no.1所示的klrc1基因序列,设计用于特异性区分人源nk细胞和动物基因的引物对和引物探针组。引物对和引物探针组的设计原则是根据解链温度(tm值)、gc
含量(在dna的四种碱基中鸟嘌呤和胞嘧啶所占的比率)、上游引物末端序列以及引物序列大小、引物末端碱基及探针两端碱基的特征选择和验证引物对和探针组合的可靠性。
34.所述引物对用于扩增seq id no.1所示的目标检测基因序列。引物对由primer-f正向引物和primer-r反向引物组成。所述primer-f正向引物为seq id no.2所示引物,或者将seq id no.2经过一个或几个核苷酸的取代和/或缺失和/或添加且与seq id no.2具有相同功能的dna分子;所述primer-r反向引物为seq id no.3 所示引物,或者将seq id no.3经过一个或几个核苷酸的取代和/或缺失和/或添加且与seq id no.3具有相同功能的dna分子。一些技术方案中,引物对的tm值控制在55℃左右。作为示例,反向引物的tm值设计为54.75℃,正向引物的tm值设计为55.81℃。
35.所述引物探针组由引物对及探针组成。具体地探针为seq id no.4所示的基因序列在5
´
端偶联发光基团和3
´
端偶联淬灭基团的taqman探针。一些实施方式中,发光基团为6-fam( 6-羧基荧光素),淬灭基团为tamra(羧基四甲基罗丹明)。基于taqman探针法设计了探针分子,taqman探针是单链dna,5
´
端偶联发光基团6
‑ꢀ
羧基荧光素,3
´
端偶联淬灭基团羧基四甲基罗丹明,游离的完整探针无荧光信号,发光基团发出的荧光会被淬灭基团吸收淬灭,当探针被水解,发光基团和淬灭基团远离就可以检测到荧光信号。一些技术方案中,探针的tm值为65℃左右,例如64.34℃。
36.作为优选,taqman探针的tm值比引物对高10℃。这样的tm值差异保证探针、引物依次结合到模板链上,从而确保正确的探针剪切。
37.接下来说明本发明所述nk细胞治疗产品通用型临床前生物分布检测试剂盒。该试剂盒是采用qpcr法对标准品、质控样本和/或待测样本中的目标dna进行扩增和检测。反应开始时,模板链经热变性解链形成单链,taqman探针优先跟模板链退火,引物随后退火到模板上,之后进行链的延伸,延伸过程中taq酶发挥5
´‑3´
外切酶活性,遇到探针会从5
´
端逐个碱基切除探针,发光基团会跟淬灭基团分开,因此荧光检测系统可以接收到荧光信号,每扩增一条dna链,就有一个荧光分子形成,荧光信号的累积和pcr产物形成是同步的。
38.nk细胞治疗产品通用型临床前生物分布检测试剂盒包括基于nk细胞中klrc1基因的引物对和taqman探针。作为示例,引物对的浓度是10μmol/l,探针的浓度是10μmol/l。可选地,所述试剂盒中还含有阳性对照。所述阳性对照为含有klrc1基因表达的核酸样本。当然,所述试剂盒中还可含有阴性对照。阴性对照为无klrc1基因表达的核酸样本。
39.可选地,所述试剂盒还包括dna 稀释液。
40.可选地,所述试剂盒还包括标准质粒。
41.可选地,所述试剂盒还包括预混溶液。预混溶液可以自行配置,也可以通过商业化的途径购买得到。作为示例,该预混溶液可以是qpcr taqman探针主混合物(qpcr taqman probe master mix)。
42.在试剂盒的使用过程中,使用者根据所测样品类型,可以补充提供对应基质来源的基因组dna。例如,样品是小鼠全血,则可以使用dna稀释液配制的小鼠全血提取的基因组dna配制标准曲线用样品和qc样品。在检测时外加水用于反应体系的体积的补充,添加入样本中提取的dna模板执行分析检测,快捷方便。
43.一些技术方案中,试剂盒的使用方法包括如下步骤:(1)加样。将样品基因组cdna、阳性对照或阴性对照分别加入装有pcr反应体系的pcr管中,获得对应的样品反应管、阳性
反应管或阴性反应管,所述pcr反应体系中含有前述klrc1基因检测引物。(2)pcr反应。反应管置于pcr仪上,设置温度、时间、循环数等反应条件参数,进行pcr反应。(3)pcr反应结束后,分析结果。
44.在该试剂盒中的构建过程中,基于taqman qpcr的方法设计实时定量扩增klrc1部分基因序列的方法,从而达到能够区分人源nk细胞和动物例如小鼠基因组的特异性要求,并基于此方法确立反应体系和反应条件,优化、验证并构建qpcr试剂盒,以期能够适用于nk细胞于早期临床前在小鼠甚至其它动物种属的药代动力学与生物分布研究。
45.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对 现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。以下通过节点性的实施例来说明本发明探索与改进的过程。
46.仪器设备1)abi荧光定量pcr仪(7500或等同的可替代版本);2)荧光定量pcr 8联管&盖(bbi,f602004-0001,或等同的可代品);3)离心机(上海生工生物,super mini dancer,或等同的可替代品);4)96孔pcr板(axygen,pcr-96-ab-c,或等同的可替代品)。
47.试剂1)标准质粒puc-gw-kan-nk(苏州金唯智生物科技有限公司,克隆id:za5917-1/a751715,lot#a751715-20211228或其它批次,≤-10℃);2)qpcr taqman探针主混合物(翌圣生物科技(上海)有限公司,cat#: 11205es08,lot#h8001170,≤-10℃);3)dna稀释液(cat#:b639270,上海生工生物工程公司)。
48.实施例1虽然nk细胞有表面标志物分子如cd16和cd56,但这类分子在人和非人种属如鼠体内均存在且差异不大,采用这些基因不能进行人nk细胞和非人种属动物的区分,也不能作为构建nk细胞药代分布的标志性基因序列。发明人还使用homo2基因区分人源nk细胞和非人种属的动物源基因,但是该homo2基因并非仅特异性地在人的nk细胞中实现扩增,在鼠的基因组中仍能明显扩增出序列。扩增后的电泳照片如图1所示。其中,m为marker;左边1、2、3、4道为4个不同小鼠的血液来源基因组dna中扩增结果;右边1、2、3、4道为4个人nk细胞基因组dna序列中扩增结果。从中可以看出,homo2引物序列并非可以特异地仅在人的基因组dna中扩增。
49.实施例2在确定本发明所选用的扩增目标序列之前,尝试设计了klrc1不同序列段设计多个引物对,也使用klrc1同家族的如klrk1基因序列或其它的基因如il-15、β-actin序列并基于这些基因序列设计了多对引物,确定选择扩增序列的特异性和适用性。本实施例使用引物对klrc1-1、klrc1-2、klrc1-3、klrc1-4、klrk1-1、klrk1-2、klrk1-3、klrk1-4、il-15、β-actin扩增对应基因上的序列,根据扩增效果进行目标序列和引物对的筛选。反应体系与
反应条件参照本发明的方法实施步骤和条件,反应体系唯一区别的是sybr
™ꢀ
green染料替代探针。因为目标序列和引物对还没有确定,sybr
™ꢀ
green染料可以先初步地根据溶解曲线确定引物对扩增的特异性。具体选用如下的引物对,同时采用人nk细胞基因组dna和鼠基因组dna做模板,通过sybr
™ꢀ
green染料法qpcr扩增的溶解曲线判断扩增的特异性。溶解曲线无峰或不呈现单一主峰的引物对不能被选用,相应其扩增出来的目的序列也不能被选用。溶解曲线若有多个主峰或无主峰,则说明该基因序列不适用于本发明。溶解曲线出现若出现单一主峰,则认为该基因序列可以作为构建特异的taqman qpcr方法的候选基因序列。随机从两只小鼠(分别编号为鼠1和鼠2)以及人的nk细胞提取基因组dna(gdna)后进行扩增,阈值循环数(ct)及溶解曲线结果见表1。
50.表1可以看出,选用扩增β-actin时,在鼠和人的基因组dna均有峰即有扩增,且此为持
家基因绝对没有人和鼠的特异性,故不可应用;il-15在人nk细胞和鼠的基因组dna中均无扩增,也不可以应用。klrc1,klrc3,klrk1,klrk3有一个主峰,初步显示特异性,具有潜在的可以作为区分人nk细胞和鼠的潜在应用价值。
51.实施例3实施例2筛选出的klrc1,klrc3,klrk1,klrk3这四种基因序列对应的4对引物可潜在应用于区分人源nk细胞和非人源动物基因,即、在人nk细胞上有特异性扩增而在鼠基因组dna无特异性扩增值。本实施例进一步将其扩增产物基于测序仪进行测序。测序结果如表2所示。
52.表2klrc1-1f的基因序列如seq id no.2所示。klrc1-1r的基因序列如seq id no.3所示。klrc1-3f 的基因序列如seq id no.5所示。klrc1-3r的基因序列如seq id no.6所示。klrk1-1f的基因序列如seq id no.7所示。klrk1-1r的基因序列如seq id no.8所示。klrk1-3f的基因序列如seq id no.9所示。klrk1-3r的基因序列如seq id no.10所示。
53.表2证明klrk1(人杀伤细胞凝集素样受体亚家族k, 成员i)的引物对均无法准确
比对到其同源人的nk细胞上的基因,故不可采用。基于klrc1(人杀伤细胞凝集素样受体亚家族c, 成员i,英文别名nkg2a)设计的两组引物对中,第一对引物(klrc1-1f,klrc1-1r)效果更佳,能被很好地测序并在基因库达到100%相似度地找到其human的nk细胞同源序列,说明本发明设计的klrc1的正反向引物(klrc1-1f,klrc1-1r)的序列是最佳的可以扩增nk细胞的序列。
54.实施例4本实施例基于实施例3确定了扩增的靶序列,且基于此基础上进一步设计和筛选特异性的探针序列以设计特异性的taqman qpcr定量方法。基于本发明的方法实施步骤和条件,添加含不同拷贝数梯度的相同目标序列即模板到反应体系中进行扩增(模板上样量采用1ul),区别是设计了不同序列的taqman探针。klrc1-探针1的序列如seq id no.11所示。klrc1-探针2采用如seq id no.4所示序列并在其5
´
端偶联发光基团和3
´
端偶联淬灭基团。探针扩增结果如表3所示。
55.表3同样的反应条件下经参数比较最终确定本发明保护的探针(klrc1-probe2)设计效果较佳。当目标序列拷贝数为108数量级时,本发明所保护的探针序列的ct值低于对比探针;当目标序列拷贝数为105数量级时,对比探针的ct值接近于总循环次数,本发明所保护的探针序列的ct值为33,与总循环次数相比还有窗口;当目标序列拷贝数为104数量级时,对比探针超越检测限,不可检测,而本发明所保护的探针序列检测限更低,104数量级拷贝
数时仍可检测。本发明所保护的探针序列更具应用潜力和价值,可以进一步被后续优化使用。以上说明,本发明基于klrc1设计了多对引物进行扩增和测序后筛选到一段可以被高保真检测到的目的序列,并确定相应引物。引物确定后设计多条探针对比选择了一条灵敏度好扩增效率优的探针作为本发明检测方法和试剂盒的重要组成部分。
56.实施例5基于本发明的引物特异性及所筛选基因的特异性鉴定(琼脂糖凝胶电泳鉴定)从图1可以看出,通过对本发明引物对及方法的pcr扩增产物的琼脂糖凝胶电泳鉴定,只在目标位置出现了与检测的目标dna大小相似的明亮条带,说明基于本发明的方法提供klrc1的引物对,可以很好地扩增得到特异性的目标dna片段,而且基于klrc1序列可以很好地区分人源nk细胞与鼠源样本的差异,因为只有人nk细胞扩增到目的条带,而鼠源dna样品中无扩增,可以基于筛选到的此基因作为鉴定人nk细胞在小鼠体内药代分布的一个标志性基因序列。
57.实施例6配制反应体系的反应混合物(master mix)。模板dna的加样量可以在1-5μl之间变化。在实际使用过程中,可以根据实际检测样品数量适当等比例调整反应混合物的各组分加样量。在本实施例中,反应混合物包括qpcr taqman probe master mix 10μl,klrc1-f 0.4μl,klrc1-r 0.4μl,探针-klrc1 0.2μl,rox 0.4μl,模板dna 2μl,超纯蒸馏水6.6μl。反应体系的总体积为20μl。rox的作用是用于校正与pcr无关的荧光波动,从而最大限度减少孔间差异。在实际应用中,模板dna的加样量变化,对超纯蒸馏水的体积作出相应变化即可。例如模板dna的加样量为1μl,则超纯蒸馏水的加样量可以调整为5.6μl。
58.标准质粒上插入扩增的目标dna序列以作为标准品,用来配制标准曲线。先将标准质粒稀释到1.900
×
10
9 拷贝/μl,然后用含空白未给药的小鼠血液或组织来源的基因组dna的dna稀释液10倍系列稀释以构成系列不同拷贝数浓度的标准品用于形成方法的标准曲线。标准曲线基于ct值与样品浓度(以拷贝数计)的log值呈线性关系,质控样品及待测样品可以根据以标准品回归拟合的标准曲线进行计算,通过样品的ct值得到未知样品浓度的log值,进而得到样品浓度。标准溶液配制如表4所示。质控样本配制如表5所示。
59.表4
表5以上标准溶液和质控样本配制的体积可以同比例调整。
60.每一个分析批的数据将用sequence detection software v1.5.1软件(abi7500)或以上版本进行采集,softmax 软件进行数据处理,以线性关系对标曲各浓度点扩增曲线ct值及理论浓度(以拷贝数计)的log值的关系进行回归从而确定标准曲线;质控样品和/或待测样品的浓度(以拷贝数计)可以由标准曲线计算得出,若qc和/或待测样品被稀释过,可以将测量浓度(以拷贝数计)乘以相应的稀释倍数得到最终的测量浓度(以拷贝数计)。测试结果如表6所示。
61.表6
在经过一系列条件优化比较后,确定依照本发明技术方案并考察此技术方案时,证明基于本发明的标准曲线设置条件及技术体系和反应条件执行试验显示扩增曲线表现佳。从图2和图3可以看出,标准曲线的r2值0.998,接近于1,各浓度梯度间ct间距能拉开且较均匀,斜率为-3.59,接近于-3.32,基于此扩增效率达到90%。故基于此进行此发明其它实施效果考察。
62.实施例7准确度和精密度方面的实施效果考察基于本发明的技术方案,执行准确度与精密度的运行考察配制出一条标准曲线和独配制的三套质控样品(qc),标准曲线(std)拟合的准确度和精密度非常好;质控样品的回收率及不同套间的同一水平质控样品检测结果非常一致。标准曲线的准确度和精密度如表7所示。质控样品的准确度和精密度如表8和表9所示。
63.表7表8
表9
在实施效果考察试验,配制了一条标准曲线和3套独立的质控样品,标准曲线的准确度和精密度佳,三套质控样品,每一套单独质控本身的准确度和精密度都很好,三套之间进行比较时,其批间的准确度和精密度也非常佳。
64.实施例8本发明对基质效应克服的实施效果用10只不同个体小鼠,分别提取其肝脏和血液基因组dna,在每一个小鼠个体的基因组dna提取液中添加一定copy(拷贝数)浓度(152000拷贝数)的含扩增目的基因dna片段的标准质粒,基于本发明的技术方案进行qpcr的扩增检测,考察每一个小鼠基因组dna中所添加的目的基因copy数的回收率以考察实施效果。测试结果如表10所示。
65.表10
结果显示,随机选取的10个小鼠中有9个提取的基因组dna中添加目的基因的copy数的回收率,均在80-100%之间,从而证明本方法无基质效应干扰,效果良好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1