一类具有抗肿瘤抗真菌活性的化合物及其应用
1.本发明属于医药技术领域,具体地说,涉及一类具有抗肿瘤抗真菌活性的化合物及其应用。
背景技术:
2.在过去的几十年中,侵袭性真菌感染(ifi)正在成为对免疫功能低下患者的威胁,尤其是hiv感染患者,或接受放疗、手术和化疗的患者。念珠菌属,尤其是白色念珠菌(c.albicans),是最常见的病原体之一,具有很高的发病率和死亡率。特别是侵袭性念珠菌病是抗癌化疗过程中常见且严重的并发症。晚期预防性治疗的实体瘤患者全身性念珠菌血症的死亡率接近35%。唑类抗真菌药物,主要是氟康唑(flc)的广泛使用甚至滥用,导致出现严重的耐药性。最近联合治疗,特别是抗真菌药物与非抗真菌药物的组合,在克服耐药性和提高抗菌效率方面引起了越来越多的兴趣。但是这种方法存在很多缺陷,比如需要确证药物配伍合理性、可能发生的药物-药物相互作用和复杂的药代动力学性质等。多靶点药物作用于肿瘤疾病网络中的多个关键环节或位点,发挥协同抗肿瘤的效果,其对肿瘤的治疗效果优于单一药物的疗效。此外,多靶点药物拥有相对简单的吸收、分布,代谢和排泄过程,减少药物-药物相互作用的发生(peters,ju.,polypharmacology
–
foe or friend,j med chem,2013,56(22):8955-8971),具有更低的副作用和更好的安全性,并使治疗方案大大简化,极大提高病人的依从性。多靶点药物研究已经成为现今抗肿瘤药物研发的一个热点领域。
3.抑制溴结构域和额外终端域蛋白(bromodomain and extra-terminal domain,bet),进而影响c-myc等基因的转录,迅速成为一种新策略。目前已有多个bet抑制剂相继开发并进入临床试验,主要用于治疗血液恶性肿瘤和实体瘤等疾病。组蛋白去乙酰化酶(histone deacetylases,hdacs)是当前抗肿瘤药物研究的热门靶点之一。组蛋白的乙酰化/去乙酰化是染色体结构改变和基因表达的重要调节方式,在细胞凋亡、能量代谢、转录和翻译等生命过程中发挥重要作用。hdacs水解组蛋白中赖氨酸侧链上n-端乙酰基,使得核小体变得更加紧密,从而抑制基因的转录。它能调控细胞的多种功能和过程,例如基因表达,染色体改造,细胞增殖、分化、凋亡等。
4.典型的hdac抑制剂包含一个帽子结构(cap group,cap),一个锌离子结合区(zinc binding group,zbg)和一个合适的连接基团(linker)。研究表明,hdac与p53、热休克蛋白(hsp90)、拓扑异构酶(topisomerase,top)和微管蛋白(tubulin)等多个抗肿瘤靶点表现出抗肿瘤的协同效应,针对hdac和协同靶点的多靶点药物研究已经成为克服肿瘤耐药性,增强抗肿瘤疗效的有效手段,目前已有数个hdac多靶点抑制剂进入临床或临床前研究。
5.bet溴结构域蛋白和hdac在调控组蛋白乙酰化的内稳态上起着关键作用。brd4识别组蛋白上乙酰化赖氨酸(kac),通过n-端与组蛋白结合募集rna聚合酶ii(polymerase ii,pol ii)和转录因子p-tefb,调节细胞内c-myc、caspase、bcl等相关基因的转录。hdac抑制剂通常在治疗实体瘤方面表现出有限的疗效,而bet抑制剂对三阴性乳腺癌的耐药性已
经出现。重要的是,乳腺癌患者容易感染念珠菌,念珠菌病也促进肿瘤的进展和转移,这在临床治疗中极具挑战性。hdac参与组蛋白上乙酰化赖氨酸去乙酰化过程,同样调控c-myc等相关基因的转录。联合使用brd4和hdac抑制剂可同时抑制两个靶标,通过阻断两条表观遗传信号通路发挥作用,使c-myc、bcl、cdk、caspase等表达下调,促使肿瘤细胞凋亡。
技术实现要素:
6.本发明的第一个目的是提供一类具有抗肿瘤抗真菌活性的化合物。
7.本发明的第二个目的是提供一种所述具有抗肿瘤抗真菌活性的化合物在制备bet/hdac双靶点抑制剂中的应用。
8.为了实现上述目的,本发明采用的技术方案如下:
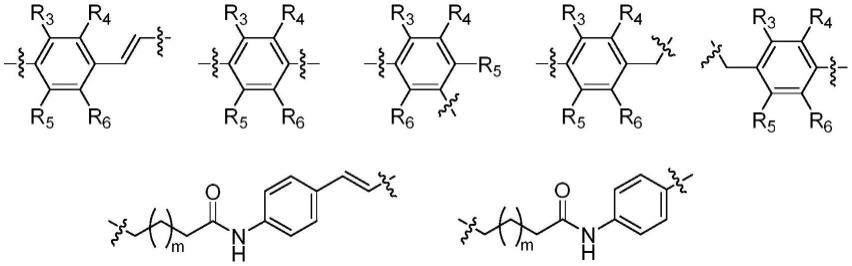
9.本发明的第一个方面提供了一类具有抗肿瘤抗真菌活性的化合物或其药用盐,结构通式如下:
[0010][0011]
其中:
[0012]
r1选自氢、c1~c10直链烷基、c1~c10支链烷基;
[0013]
r2选自-(ch2)n-、
[0014][0015]
n选自1至10的整数(如1、2、3、4、5、6、7、8、9、10);
[0016]
m选自1至10的整数(如1、2、3、4、5、6、7、8、9、10);
[0017]
r3、r4、r5、r6各自独立的选自氢、甲基、乙基、正丙基、异丙基。
[0018]
较优选的,所述具有抗肿瘤抗真菌活性的化合物中,
[0019]
r1选自氢、甲基、乙基、正丙基、异丙基、正丁基、叔丁基;
[0020]
r2选自-ch
2-、-(ch2)
2-、-(ch2)
3-、-(ch2)
4-、-(ch2)
5-、-(ch2)
6-、-(ch2)
7-、-(ch2)
8-、
[0021][0022]
所述药用盐为其有机酸盐或无机酸盐;所述无机酸为盐酸、硫酸、磷酸、二磷酸、氢溴酸或硝酸;所述有机酸为乙酸、马来酸、富马酸、酒石酸、琥珀酸、乳酸、对甲苯磺酸、水杨酸、草酸、鞣酸、枸橼酸、三氟醋酸、苹果酸或苯磺酸盐。
[0023]
最优选的,所述具有抗肿瘤抗真菌活性的化合物选自以下结构的一种:
[0024]
[0025][0026]
本发明的第二方面提供了一种所述具有抗肿瘤抗真菌活性的化合物或其药用盐在制备bet/hdac双靶点抑制剂中的应用。
[0027]
所述具有抗肿瘤抗真菌活性的化合物或其药用盐用于治疗恶性肿瘤、真菌感染或与分化增值相关的疾病。
[0028]
本发明的第三方面提供了一种所述具有抗肿瘤抗真菌活性的化合物或其药用盐在制备抗肿瘤的药物中的应用。
[0029]
所述肿瘤选自白血病、乳腺癌等。
[0030]
所述肿瘤的细胞选自人慢性髓系白血病细胞k562、人人早幼粒白血病细胞hl60、人红白细胞白血病细胞hel、人乳腺癌细胞mda-mb-231。
[0031]
本发明的第四方面提供了一种所述具有抗肿瘤抗真菌活性的化合物或其药用盐在制备抗真菌的药物中的应用。
[0032]
所述真菌选自新生隐球菌、白色念珠菌、耐药白色念珠菌。
[0033]
所述真菌的细胞选自新生隐球菌h99、耐药白色念珠菌0304103。
[0034]
由于采用上述技术方案,本发明具有以下优点和有益效果:
[0035]
本发明的化合物经酶抑制活性和体外抗肿瘤抗真菌活性试验发现,本发明的化合
物对bet和组蛋白去乙酰化酶均具有很强的抑制活性,而且具有较强的体外抗肿瘤抗真菌活性,部分化合物对hl60、k562、hel、mda-mb-231细胞具有较好的抑制活性,与氟康唑联用耐药白色念珠菌0304103,新生隐球菌h99的抑制活性表现出优于阳性药cf53和saha的抑制活性。
[0036]
本发明的化合物在体内抗肿瘤抗真菌试验中,发现了对肿瘤生长的抑制效果显著高于相同剂量下阳性药cf53和saha的先导化合物13c和17b,抑瘤率分别为64.9%、67.9%,相同剂量下的阳性对照组saha抑瘤率为22%,cf53为31.5%;同时可以显著降低肾脏荷菌量,优于两个阳性药与氟康唑联合用药组,具有显著性差异(p》0.05)。表明本发明中多靶点抗肿瘤抗真菌活性的bet/hdac双靶点抑制剂较单靶点抑制剂具有明显的优势,表现出高效低毒的特点,是一种优越的抗肿瘤抗真菌药物。
[0037]
本发明为深入研究和开发新结构类型抗肿瘤抗真菌药物开辟了新的途径,提供了新的策略。
[0038]
本发明的化合物,对bet和hdac均具有很强的抑制活性,而且具有较强的体外抗肿瘤和抗耐药真菌活性,优秀的体内抑瘤和抗深部真菌感染效果。
附图说明
[0039]
图1是人乳腺癌mda-mb-231裸鼠瘤体积变化示意图:(a)肿瘤体积折线图;(b)肿瘤重量图;(c)肿瘤解剖图;(d)深部真菌感染小鼠肾脏荷菌量。
具体实施方式
[0040]
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
[0041][0042]
α
reagents and conditions:(a)various amides,1-methylpyrrolidin-2-one(nmp),140℃,overnight;or pd2(dba)3,bis(diphenylphosphino)-1,1
′‑
binaphthyl,k3hpo4,toluene;(b)nh2oh,meoh,rt.
[0043]
实施例1
[0044]
6-((7-(3,5-二甲基异恶唑-4-基)-6-甲氧基-9h-嘧啶并[4,5-b]吲哚-4-基)氨基)-n-羟基己酰胺的制备
[0045]
(1)制备中间体12b:6-((7-(3,5-二甲基异恶唑-4-基)-6-甲氧基-9h-嘧啶并[4,5-b]吲哚-4-基)氨基)-n-羟基己酰胺
[0046]
将4-(4-氯-6-甲氧基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑(化合物11,5g,15mmol)溶于n-甲基吡咯烷酮溶液(10ml)中,加入6-(甲氨基)己酸甲酯盐酸盐(8g,45mmol)和n,n-二异丙基乙胺(1g,75mmol),140℃反应12小时。反应完后蒸干反应液,倒入冰水中(100ml),用乙酸乙酯(50ml)萃取三遍。合并有机相,蒸干有机相,残留物经硅胶柱层析(石油醚:乙酸乙酯=3:1)分离纯化,得到4g中间体12b,黄色固体,收率为83%。1h nmr(600mhz,cdcl3)δ=11.71(s,1h),8.29(s,1h),7.92(s,1h),7.30(s,1h),7.20(s,1h),3.88(s,3h),3.62(dd,j=10.08,6.52hz,2h),3.56(s,3h),2.32(t,j=6.85hz,2h),2.27(s,3h),2.08(s,3h),1.65
–
1.73(m,2h),1.57
–
1.62(m,2h),1.35
–
1.40(m,2h).
[0047]
(2)制备目标产物13b
[0048]
新鲜羟胺溶液的制备:将氢氧化钾(5.61g)溶于甲醇(14ml)中,将盐酸羟胺(4.67g)溶于甲醇(24ml)中,将前者滴加至后者中,室温反应30分钟,过滤,滤液为新鲜制备的羟胺溶液。
[0049]
将中间体12b(50mg,0.11mmol)溶于羟胺溶液(5ml)中,室温反应4小时。反应结束后蒸干溶剂,滴加1m盐酸溶液调节ph为7-8,出现沉淀,过滤,滤饼水洗,得到40mg化合物13b,黄色固体,收率83%。1h nmr(600mhz,dmso)δ=11.71(s,1h),10.32(s,1h),8.65(s,1h),8.30(s,1h),7.94(s,1h),7.30(t,j=5.52hz,1h),7.21(s,1h),3.89(s,3h),3.63(dd,j=7.87,5.90hz,2h),2.28(s,3h),2.09(s,3h),1.97(t,j=7.68hz,2h),1.63
–
1.70(m,2h),1.54
–
1.59(m,2h),1.32
–
1.37(m,2h).
13
c nmr(150mhz,dmso)δ=169.52,165.69,159.70,156.94,156.00,155.28,152.45,130.79,120.53,115.99,114.15,113.62,104.23,96.09,56.82,40.63,32.71,29.82,26.61,25.52,11.71,10.80.esi-hrms:calcd for c
22h26
n6o4:m/z:[m+h]
+
=439.2088;found[m+h]
+
=439.2123.
[0050]
实施例2
[0051]
将实施例1中的第一步6-(甲氨基)己酸甲酯盐酸盐替换成5-氨基戊酸甲酯,其他同实施例1,获得化合物13a。
[0052]
实施例3
[0053]
将实施例1中的第一步6-(甲氨基)己酸甲酯盐酸盐替换成7-氨基赓酸甲酯盐酸盐,其他同实施例1,获得化合物13c。
[0054]
实施例4
[0055]
将实施例1中的第一步6-(甲氨基)己酸甲酯盐酸盐替换成8-氨基辛酸甲酯盐酸盐,其他同实施例1,获得化合物13d。
[0056]
实施例5
[0057]
将实施例1中的第一步6-(甲氨基)己酸甲酯盐酸盐替换成(e)-3-(4-氨基苯基)丙烯酸乙酯,其他同实施例1,获得化合物13e。
[0058]
实施例6
[0059]
将实施例1中的第一步6-(甲氨基)己酸甲酯盐酸盐替换成4-氨基苯甲酸甲酯盐酸盐,其他同实施例1,获得化合物13f。
[0060][0061]
α
reagents and conditions:(a)various amides,1-methylpyrrolidin-2-one(nmp),140℃,overnight;or pd2(dba)3,bis(diphenylphosphino)-1,1
′‑
binaphthyl,k3hpo4,toluene;(b)nh2oh,meoh,rt.
[0062]
实施例7
[0063]
将实施例1中第一步的4-(4-氯-6-甲氧基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑替换为4-(4-氯-6-甲氧基-2-甲基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑,其他同实施例1,获得化合物17a。
[0064]
实施例8
[0065]
将实施例1中第一步的4-(4-氯-6-甲氧基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑替换为4-(4-氯-6-甲氧基-2-甲基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑,6-(甲氨基)己酸甲酯盐酸盐替换成7-氨基赓酸甲酯盐酸盐,其他同实施例1,获得化合物17b。
[0066]
实施例9
[0067]
将实施例1中第一步的4-(4-氯-6-甲氧基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑替换为4-(4-氯-6-甲氧基-2-甲基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑,6-(甲氨基)己酸甲酯盐酸盐替换成8-氨基辛酸甲酯盐酸盐,其他同实施例1,获得化合物17c。
[0068]
实施例10
[0069]
将实施例1中第一步的4-(4-氯-6-甲氧基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑替换为4-(4-氯-6-甲氧基-2-甲基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑,6-(甲氨基)己酸甲酯盐酸盐替换成(e)-3-(4-氨基苯基)丙烯酸乙酯,其他同实施例1,获得化合物17d。
[0070]
实施例11
[0071]
将实施例1中第一步的4-(4-氯-6-甲氧基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑替换为4-(4-氯-6-甲氧基-2-甲基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑,6-(甲氨基)己酸甲酯盐酸盐替换成4-氨基苯甲酸甲酯盐酸盐,其他同实施例1,获得化合物17e。
[0072]
实施例12
[0073]
将实施例1中第一步的4-(4-氯-6-甲氧基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑替换为4-(4-氯-6-甲氧基-2-甲基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑,6-(甲氨基)己酸甲酯盐酸盐替换成3-氨基苯甲酸甲酯盐酸盐,其他同实施例1,获得化合物17f。
[0074]
实施例13
[0075]
将实施例1中第一步的4-(4-氯-6-甲氧基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑替换为4-(4-氯-6-甲氧基-2-甲基-9h-嘧啶并[4,5-b]吲哚-7-基)-3,5-二甲基异恶唑,6-(甲氨基)己酸甲酯盐酸盐替换成3-(氨基甲基)苯甲酸甲酯,其他同实施例1,获得化合物17g。
[0076][0077]
(a)lioh,thf,h2o;(b)hatu,dipea,dmf;(c)nh2oh,meoh,rt
[0078]
实施例14
[0079]
4-(6-((7-(3,5-二甲基异恶唑-4-基)-6-甲氧基-2-甲基-9h-嘧啶并[4,5-b]吲哚-4-基)氨基)六氨基)-n-羟基苯甲酰胺的制备
[0080]
(1)制备中间体19c:甲基(e)-3-(4-(6-((7-(3,5-二甲基异恶唑-4-基)-6-甲氧基-2-甲基-9h-嘧啶并[4,5-b]indol-4)-基)氨基)六氨基)苯基)丙烯酸酯
[0081]
中间体16a(100mg,0.32mmol)溶于四氢呋喃:甲醇:水为3:2:1(10ml)的混合溶剂中,加入氢氧化锂(10mg,0.44mmol),室温下反应4小时。反应完后蒸干溶剂,饱和碳酸氢钠溶液滴加至残余物中,调节ph为7,析出沉淀,过滤,滤饼干燥得到中间体18b,黄色固体70mg。将中间体18b(70mg,0.16mmol)溶于dmf(5ml),再加入4-氨基苯甲酸酯(50mg,0.32mmol),hatu(120mg,0.32mmol)和dipea(41mg,0.32mmol)。反应液再室温下反应4小时,倒入冰水(100ml)中,用乙酸乙酯(50ml)萃取三遍。合并有机相,蒸干有机相,残留物经硅胶柱层析取(石油醚:乙酸乙酯=3:1)分离纯化,得到中间体19c,黄色固体60mg,收率为66%。1h nmr(600mhz,dmso)δ=11.45,(s,1h),10.19(s,1h),7.87(d,j=6.06hz,2h),7.86(s,1h),7.70(d,j=8.81hz,2h),7.14(s,1h),4.01(d,j=7.01hz,1h),3.84(s,3h),3.79(s,3h),3.61-3.64(m,2h),2.412(s,3h),2.36(t,j=7.10hz,2h),2.26(3h),2.06(s,3h),1.97(s,2h),1.651.72(m,4h),1.38
–
1.43(m,2h).esi-hrms:calcd for c
31h34
n6o5:m/z:[m-h]-=569.2518;found[m+h]-=569.2507.
[0082]
(2)制备目标产物20c
[0083]
中间体19c(50mg,0.08mmol)溶于新鲜制备的羟胺溶液(5ml)中,室温反应4小时。反应结束后蒸干溶剂,滴加1m盐酸溶液调节ph为7-8,出现沉淀,过滤,滤饼水洗,干燥得到
淡黄色固体40mg,收率88%。1h nmr(600mhz,dmso)δ=11.48(s,1h),10.07(s,1h),7.89(s,1h),7.69(d,j=8.18hz,2h),7.64(d,j=8.18hz,2h),7.18(s,1h),7.17(t,j=6.15hz,1h),3.88(s,3h),3.64
–
3.67(m,2h),2.45(s,3h),2.37(t,j=7.36hz,2h),2.29(s,3h),2.09(s,3h),1.68
–
1.75(m,4h),1.41
–
1.46(m,2h).
13
c nmr(150mhz,dmso)δ=172.05,165.90,163.87,159.70,157.07,156.91,152.32,142.25,141.70,130.77,128.05,127.47,120.77,118.69,115.32,114.21,113.44,104.07,93.85,56.79,36.91,29.84,26.66,26.61,25.33,11.71,10.80.esi-hrms:calcd for c
30h33
n7o5:m/z:[m+h]
+
=572.2616;found[m+h]
+
=572.26226.
[0084]
实施例15
[0085]
将实施例14中的第一步中化合物16a替换成12b(按照实施例1第一步制备),4-氨基苯甲酸酯替换成(e)-3-(4-氨基苯基)丙烯酸乙酯,其他同实施例14,获得化合物20a。
[0086]
实施例16
[0087]
将实施例14中的第一步4-氨基苯甲酸酯替换成(e)-3-(4-氨基苯基)丙烯酸乙酯,其他同实施例14,获得化合物20b。
[0088]
表1.本发明化合物的结构式和核磁质谱数据
[0089]
[0090]
[0091]
[0092]
[0093]
[0094]
[0095][0096]
实施例17
[0097]
目标化合物酶抑制活性和体外抗肿瘤抗真菌活性的测试
[0098]
1.目标化合物bet活性研究测试
[0099]
采用时间分辨荧光分析(tr-fret)测试法进行实验:
[0100]
1.配制1
×
tr-fret assay buffer(item no.600503)。用buffer 3倍稀释待测化合物(100μm),依次得到10个不同浓度(化合物的浓度依次为100μm,30μm,10μm,3μm,1μm,0.3μm,0.1μm,0.03μm,0.01μm,0.003μm)的待测样品,并使每个待测孔dmso终浓度为1%,每个浓度做三复孔,重复两次。
[0101]
2.向96孔板的每个测试孔中依次加入10μl用1
×
buffer稀释后的brd蛋白,5μl brd蛋白配体,5μl待测浓度(化合物的浓度依次为100μm,30μm,10μm,3μm,1μm,0.3μm,0.1μm,0.03μm,0.01μm,0.003μm)样品,充分混匀。每块测试板设置阴性对照和阳性对照组,阴性对照不加化合物样品,阳性对照组使用cf53。
[0102]
3.将96孔板置于20℃避光振摇孵育60分钟后,340nm激发光照射670nm发射光读数。
[0103]
4.根据测得的读值,在graphpad 5.0软件中进行拟合,求得化合物的ic
50
值。
[0104]
2.目标化合物hdac1酶抑制测试
[0105]
1.1实验材料:
[0106]
hdac1酶,缓冲液(137mm氯化钠,2.7mm氯化钾,1mm氯化镁,0.1mg/ml bsa,ph=8的tris-hcl 25mm),hdac substrate 3,胰蛋白酶,96孔黑色板。
[0107]
1.2实验方法:
[0108]
(1)96孔黑色板平衡至室温;
[0109]
(2)用含有10%的dmso的缓冲液稀释待测化合物,化合物的浓度依次为100μm,30μm,10μm,3μm,1μm,0.3μm,0.1μm,0.03μm,0.01μm,0.003μm;
[0110]
(3)将11μl的hdac1加入到400μl的缓冲液中,摇匀;
[0111]
(4)向96孔板上第2-11孔加入35μl刚刚配好的含有hdac1酶的缓冲液,并依次加入5μl稀释好的不同浓度的化合物到对应的反应孔中,对于阴性对照(第一个孔)和空白对照孔(第十一个孔),分别加入40μl和5μl assay buffer;
[0112]
(5)向所有反应孔中加入100μm的hdac substrate 5μl和0.5mg/ml的胰蛋白酶5μ
l,37℃孵化30分钟后读数。
[0113]
(6)依据公式计算抑制率:抑制率=(100%活性孔-样品孔)/100%活性孔*100,在graphpad软件中将酶活性对化合物浓度的曲线进行拟合,求出化合物的ic
50
值;
[0114]
实验结果表明,本发明的大部分化合物都表现出良好的hdac1抑制活性,均在纳摩尔级(ic
50
范围:28
–
974nm),构效关系研究表明,化合物对hdac1的抑制活性随着烷烃链的延长而提高(13c》13d》13b》13a),其中含六个亚甲基的两个化合物13c(ic
50
=10nm)和17b(ic
50
=19nm),优于阳性对照药saha(ic
50
=40nm)。另一方面,brd4活性测试结果显示,化合物13c和17b在1μm浓度下的抑制率最高(分别为93.7%和97.5%),进一步构效关系研究显示,化合物的brd4抑制活性随着烷烃链的延长而增加(13c》13d》13b》13a,17b》17a》17c),与hdac1的构效关系一致。其中化合物13c和17b的ic50测试活性为35nm和63nm。以上结果表明化合物13c和17b对bet和hdac的抑制活性强效而平衡。
[0115]
表2.目标化合物brd4和hdac1抑制活性
[0116][0117][0118]
3.目标化合物体外抗肿瘤活性测试
[0119]
3.1样品配制
[0120]
用dmso(merck)溶解化合物后,加入pbs(-)配成1000μm的溶液或均匀的混悬液,然后用含dmso的pbs(-)稀释。样品终浓度100、33、10、0.33、0.1、0.033μm。
[0121]
3.2细胞株
[0122]
k562(人慢性髓系白血病细胞)、hl60(人人早幼粒白血病细胞)、hel(人红白细胞白血病细胞)、mda-mb-231(人乳腺癌细胞),均由本实验室冻存和传代。
[0123]
3.3培养液
[0124]
dmem或prmi1640+10%fbs+双抗
[0125]
3.4试验方法
[0126]
cck-8法:96孔板每孔加入浓度为6-10
×
104个/ml的细胞悬液100μl,置37℃,5%co2培养箱内。24小时后,加入样品液,10ml/孔,设三复孔,37℃,5%co2作用48小时。每孔加入10mlcck-8溶液,然后37℃下避光孵育1-4小时后,用全波长多功能酶标仪测450nm od值。
[0127]
实验结果显示,本发明的化合物具有广谱抗肿瘤活性,其ic
50
值在0.5-50μm之间,其中化合物13c,17b对mda
–
mb-231细胞均表现出优于阳性药saha、cf53的抑制活性。
[0128]
表3.目标化合物体外抗肿瘤活性结果(μm)
[0129]
[0130][0131]
4.目标化合物体外抗真菌活性
[0132]
4.1样品配制
[0133]
用dmso(merck)溶解化合物后,加入pbs(-)配成2mg/ml的溶液或均匀的混悬液,然后用含dmso的pbs(-)稀释。样品终浓度64、32、16、8、4、2、1、0.5、0.25μg/ml。
[0134]
4.2细胞株
[0135]
h99(新生隐球菌)、0304103(耐药白色念珠菌),均由本实验室冻存和传代。
[0136]
4.3培养液
[0137]
prmi1640
[0138]
4.4试验方法
[0139]
微量稀释法:96孔板每孔加入浓度为6-10
×
103个/ml的细胞悬液100μl,置37℃,5%co2培养箱内。24小时后,加入样品液(浓度分别为64、32、16、8、4、2、1、0.5、0.25μg/ml),10ml/孔,设三复孔,37℃,5%co2作用48小时。用全波长多功能酶标仪测630nm od值。
[0140]
测量协同指数(fici)方法:用rpmi 1640培养基稀释真菌悬浮液的初始浓度为103cfu/ml,最终浓度范围为氟康唑0.125μg/ml到64μg/ml,目标化合物浓度为1μg/ml到32μ
g/ml,加入至96孔板。使用含有真菌和无真菌培养基的无药培养基分别作为空白对照和阴性对照。将加药后的96孔板在35℃孵育48h,随后在630nm处测量od值,并从各孔的od值减去背景od值。fici值≤0.5为协同作用,》4为拮抗作用,两者之间为不相关。
[0141]
实验结果显示,化合物或氟康唑在单独使用时对耐药白念菌无抑制活性(mic
80
》64μg/ml),但是与氟康唑联用后,化合物的抗菌活性显著提升(mic
80
范围:0.5
–
8μg/ml),同时氟康唑的活性也显著提升(mic
80
范围:0.5
–
32μg/ml)。其中化合物13c-13d,17a-17e,17g和20b-20c的协同作用(fici范围:0.047
–
0.16)优于阳性药saha和cf53(fici分别为0.25和1.2)。
[0142]
表4.目标化合物体外抗真菌活性(mic
50
,μg/ml)
[0143]
[0144][0145]
实施例18
[0146]
优选化合物的体内抗肿瘤抗真菌活性
[0147]
根据体外抗肿瘤抗真菌实验结果及化合物的结构特点,选择人乳腺癌mda-mb-231作为裸鼠移植瘤模型,以化合物13c和17b作为研究对象,saha和cf53及两者联合用药作为阳性对照药。balb/c裸鼠从中国科学院上海实验动物中心获得(证书scxk-2007-0005,重18~20g)。将mda-mb-231细胞悬液皮下植入小鼠的右腋下区域。当植入的肿瘤长出并体积达到约100-300mm3时开始给药。将小鼠随机分组(每组5只)。将化合物13c和17b悬浮于0.5%羧甲基纤维素中并以10mg/kg的给药剂量,连续腹腔注射给药21天。对照小鼠接受0.5%羧甲基纤维素给药。通过卡尺测量长度和宽度来监测肿瘤体积,并使用以下公式计算tv=1/2
×a×
b2。其中a是肿瘤长度,b是宽度。在给药过程每2天监测肿瘤体积和体重。植入细胞后第30天至第33天处死小鼠,取出肿瘤并记录分析。
[0148]
给药剂量设置化合物13c和17b为10mg/kg,口服一天一次;阳性药saha和cf53剂量为10mg/kg,一天一次;以及联合给药组(saha+cf53)剂量为10mg/kg+10mg/kg;连续口服给药(p.o)给药21天(图1a)。结果显示(图1a-b),化合物13c和17b抑瘤率分别为64.9%、67.9%,显著优于相同剂量下的阳性对照组(saha抑瘤率为22%,cf53为31.5%),且具有统计学意义(p《0.001)。在给药期间化合物13c和17b给药组未发现小鼠体重明显变化,而cf53给药组死亡一只小鼠(图1c),表明化合物13c和17b的毒性较小。
[0149]
构建了深部真菌感染小鼠模型,将4至6周且体重为20至25g的雌性icr小鼠饲养并喂食。用0.2ml耐药白色念珠菌0304103悬浮液通过尾静脉感染小鼠(每只小鼠接种量为15
×
104cfu)。在感染后每天腹膜内单独或联合注射氟康唑(剂量为1mg/kg)和化合物。对照组注射由用0.5%羧甲基纤维素组成的安慰剂。化合物13c和17b给药剂量设置为20mg/kg和10mg/kg,腹腔注射给药,一天一次。阳性药saha和cf53的给药剂量为20mg/kg,腹腔注射给药,一天一次。给药7天后处死小鼠,取出肾脏,将每只小鼠的肾脏放入组织研磨专用ep管中并加入1ml的生理盐水,研磨匀浆。匀浆液稀释不同的比例并分别取20μl涂布于事先准备好
的sda平板上。然后将sda平板放入培养箱于30℃静置培养,待板上长出菌落后计数菌落数目。各组数据之间显著性差异通过one-way anova方法进行分析。结果显示(图1d),与氟康唑联用组显著降低小鼠的肾脏荷菌量,优于两个阳性药与氟康唑联合用药组,具有显著性差异(p》0.05)。
[0150]
图1是人乳腺癌mda-mb-231裸鼠瘤体积变化示意图:(a)肿瘤体积折线图;(b)给药结束后肿瘤重量图;(c)肿瘤组织解剖图;(d)深部真菌感染模型小鼠肾脏荷菌量分析。图1a显示给药期间肿瘤组织的体积变化,可以明显看出化合物13c和17b给药组的体积增长最为缓慢;图1b显示给药21天后取出肿瘤的重量,可以看出13c和17b给药物的肿瘤组织重量最小,抑制肿瘤生长效果最佳;图1c时肿瘤组织的照片,可以直观看出13c和17b给药组更小,且cf53给药组出现肿瘤组织数量缺少一个,表明其毒性较大;图1d为深部真菌感染小鼠的肾脏荷菌量,可以看出13c和17b与氟康唑给药组荷菌量最少,治疗深部真菌感染效果最佳。
[0151]
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专利的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1