一种绵羊胚胎来源成肌细胞的传代纯化方法
1.本发明涉及生物技术领域,尤其涉及一种绵羊胚胎来源成肌细胞的传代纯化方法。
背景技术:
2.绵羊是重要的家畜,骨骼肌生长发育直接影响绵羊的生产性能。成肌细胞是骨骼肌的前体细胞,来源于中胚层,具有自我更新和肌纤维再生能力,存在于胚胎发育期和成熟期。骨骼肌成肌细胞在经历增殖、分化及迁移等生长发育过程后相互融合形成肌纤维,进一步形成肌肉组织。肌肉受mrf家族转录因子的调控,主要包括成肌细胞决定因子(myogenic differentiation, myod)和生肌因子5(myofactor 5, myf5),肌生成素(myogenin, myog)是myod的下游因子以激活成肌细胞分化程序,配对盒转录因子7(paired box 7, pax7)是骨骼肌发育、生长和再生的关键调控因子,结蛋白(desmin)与上述4个调控因子都是骨骼肌成肌细胞重要的标志物。
3.成肌细胞染色体核型分析是以进入分裂中期的细胞染色体为研究对象,根据染色体的长度、着丝点位置、长短臂比例、随体的有无等特征,对染色体进行分析、比较、排序和编号,根据染色体结构和数目的变异情况进行细胞鉴定。染色体核型分析可为成肌细胞的遗传分类、物种间的亲缘关系以及染色体数目和结构变异的研究提供重要依据。
4.目前,绵羊肌肉生长发育分子机制还不明晰,由于缺乏必要的绵羊成肌细胞系,相关研究受到很大的局限性。
技术实现要素:
5.本发明的目的是提供多次传代后,高纯度并具有较高基因保留量且染色体形态正常的成肌细胞。
6.第一方面,本发明提供一种绵羊成肌细胞的传代纯化方法,在传代过程中,在传代过程中,每4-6代进行一次纯化,每次纯化的时间为20-24h;更具体地,本发明提供的传代纯化方法,每5代进行一次纯化,每次纯化的时间为24h。
7.即本发明提供的传代纯化方法中,每5代进行一次差速贴壁纯化。
8.成肌细胞具有自我更新能力和增殖潜力,可利用原代和传代细胞培养技术进行体外分离培养以获得稳定、可持续传代的绵羊成肌细胞。
9.现有技术的原代和传代细胞培养技术只能在有限传代次数内维持体外连续培养。本发明首次研发了一种可以多次传代的绵羊原代骨骼肌成肌细胞,利用改良纯化方法持续获得高纯度的具有较高基因保留量且染色体形态正常的成肌细胞,适用于开展分子机制等研究,具有较大的社会经济价值与科研价值。
10.现有技术进行成肌细胞培养时,由于成肌细胞与成纤维细胞不能完全分离,不可避免的会发生将成肌细胞与成纤维细胞同时进行培养的情况。特别是,本发明为了获得分化潜力强的成肌细胞,选择的是胚胎来源的成肌细胞,虽然胚胎来源的成肌细胞具备更好
的分化潜力,但在绵羊胚胎骨骼肌采集时,非常困难,会采集到一定比例的成纤维细胞。
11.因此,在成肌细胞传代的过程中,如何去除成纤维细胞,减少成纤维细胞对成肌细胞生长的抑制作用,成为了决定成肌细胞培养纯度、传代频率的关键步骤。
12.本发明采用的差速贴壁法是原代培养过程中常用的纯化方法,但在传代过程中较为少见。同时差速贴壁法更换培养皿前的纯化时间和传代间隔是该方法成功的关键,纯化时间过短或传代间隔过长均不能有效去除已贴壁的成纤维细胞,纯化时间过长或传代间隔过短则会损失成肌细胞。传统差速贴壁纯化方法多采用培养时间2-4h。本发明采用每5代1次纯化,每次纯化培养24h的改良方法能够尽可能获得较为纯净,细胞量较多的成肌细胞。
13.第二方面,本发明提供一种绵羊成肌细胞的培养方法,所述绵羊成肌细胞连续培养10代后,自行分化产生肌管结构,所述培养方法包括:采用绵羊胚胎成肌细胞进行原代培养,当贴壁细胞比例达75-80%,进行消化传代,在传代过程中每5代进行一次差速贴壁纯化,每次纯化的时间为24h。
14.作为本发明的一个具体实施方式,本发明提供的培养方法,包括:(1)绵羊胚胎骨骼肌组织消毒,浸于含双抗的pbs缓冲液中,去除肌膜、纤维组织,然后将肌肉组织剪碎;(2)向步骤(1)剪碎的肌肉组织中,加入i型胶原酶进行消化,离心弃掉上清液,加入dmem/f12全培养基重悬沉淀,获得混合液;(3)将步骤(2)获得的混合液用细胞筛研磨过滤,静置后弃去上层单细胞悬液,保留下层沉淀,重复加入全培养基重悬,静置以最大程度除去单细胞悬液和杂质,将最终获得的沉淀用含有胎牛血清的dmem/f12培养基重悬,轻轻吹打均匀,获得沉淀悬液;(4)将步骤(3)中混匀后的沉淀悬液接种至细胞培养皿后置于培养箱中培养5 d-7 d;(5)当贴壁细胞比例达75-80%,进行消化传代,在传代过程中每5代使用差速贴壁法进行纯化去除成纤维细胞,纯化时间为24h,纯化后,将上清转移至新的培养皿中培养。
15.在本发明提供的培养方法中,步骤(1)中所述绵羊胚胎骨骼肌组织来源于湖羊72日龄胚胎。
16.在本发明提供的培养方法中,步骤(2)中,所用i型胶原酶浓度为0.1%。
17.在本发明提供的培养方法中,步骤(3)中,胎牛血清为10%的胎牛血清。
18.现有技术进行成肌细胞体外培养时,所培养的细胞在连续培养过程中,会自发形成无限细胞系;或所培养的细胞受到化学或病毒诱导而形成了具有癌性的无限细胞系。因此,现有技术中对绵羊成肌细胞进行培养,无法达到传代30次依然具有正常细胞状态。然而,本发明所培养的细胞传代30次后细胞形态、增殖水平稳定,具有很好的基因保留量,可正常传代。
19.现有技术通常采用马血清诱导肌管分化,低浓度的马血清具有较强的诱导分化作用。本发明中不存在马血清诱导分化,采用本发明提供的传代培养方法,连续培养至10代后,由于所获得的成肌细胞纯度极高,自行分化出现大量肌管。
20.根据本领域技术人员的理解,采用本发明提供的传代纯化方法或培养方法,能够提高成肌细胞特异性基因mrna的表达量。
21.具体地,在本发明所提供的应用中,成肌细胞特异性基因为pax7基因、myf5基因、
myod基因、myog基因和desmin基因。
22.第三方面,本发明实验过程中发现,myf5表达量上调与肌管形成有关,且myf5表达量与其他4个基因表达量在成肌细胞不同生长发育阶段有较大差异。此前的研究认为肌管以肌球蛋白重链 (myosin heavy chain, myhc) 的表达为特征,然而,本发明的实验结果表明myf5基因的表达或可成为新的肌管特有的特征标志物。
23.因此,本发明还请求保护myf5基因的表达量或其编码蛋白在判断成肌细胞体外培养形成肌管中的应用。
24.本发明的有益效果在于:(1)本发明通过优化传代纯化方法,采用每5代1次纯化,每次纯化培养24h的改良方法能够尽可能获得较为纯净,细胞量较多的成肌细胞。
25.(2)本发明中不存在诱导分化步骤,采用本发明提供的传代培养方法,由于获得的成肌细胞纯度极高,连续培养至10代后,自行分化出现大量肌管结构。
26.(3)采用本发明所提供的传代纯化方法获得的成肌细胞在传代30次后细胞形态、增殖水平稳定,具有很好的基因保留量,可正常传代。培养时间的延长为后续在细胞水平开展机制研究提供了更长的实验周期,同时为实验提供了更丰富的细胞群体。是在获得绵羊永生化细胞系前,部分实验的重要实验材料和研究平台。
27.(4)本发明提供的绵羊成肌细胞培养方法能够获得高纯度、具有较高基因保留量且染色体形态正常的成肌细胞,适用于开展分子机制等研究,具有较大的社会经济价值与科研价值。
附图说明
28.图1为连续传代绵羊成肌细胞计数结果,其中横坐标“x”为传代次数。
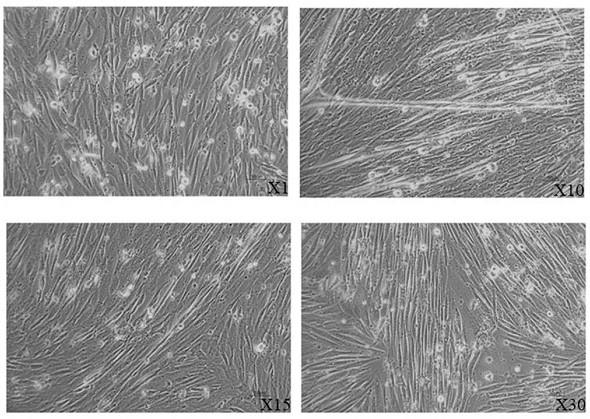
29.图2为不同代次绵羊成肌细胞镜下观察结果,其中“x1”为第1代成肌细胞,“x10”为第10代成肌细胞,“x15”为第15代成肌细胞,“x30”为第30代成肌细胞。
30.图3为绵羊成肌细胞不同代次及c2c12小鼠成肌细胞系成肌细胞特异性基因的mrna表达水平,图中不同a, b, c, d字母表示差异显著(p《0.05), 相同字母表示差异不显著(p》0.05)。
31.图4为不同代次绵羊成肌细胞染色体核型分析结果,其中“x1”为第1代成肌细胞,“x15”为第15代成肌细胞。
32.图5为常规纯化方法,湖羊胚胎来源骨骼肌成肌细胞培养24 h后相差显微镜镜下观察结果图。
33.图6为纯化后湖羊胚胎来源骨骼肌成肌细胞培养24 h后相差显微镜镜下观察结果图。
34.图7为常规纯化方法,湖羊胚胎来源骨骼肌成肌细胞培养72 h后相差显微镜镜下观察结果图。
35.图8为纯化湖羊胚胎来源骨骼肌成肌细胞培养72 h后相差显微镜镜下观察结果图。
具体实施方式
36.以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的保护范围。
37.若未特别指明,本发实施例中所用的实验材料、试剂、仪器等均可市售获得;若未具体指明,本发明实施例中所有的技术手段均为本领域技术人员所熟知的常规手段。
38.实施例1
ꢀꢀ
湖羊72日龄胚胎成肌细胞连续培养本实施例提供一种湖羊72日龄胚胎成肌细胞连续培养的方法,具体步骤如下:1. 将采集的绵羊胚胎骨骼肌肌肉组织消毒,浸于含双抗的pbs缓冲液中,去除肌膜、纤维组织,然后将肌肉组织剪碎并漂洗;2. 加入浓度为0.1%的i型胶原酶进行消化,消化完成后将含有肌肉组织的ⅰ型胶原酶混合液离心弃掉上清液,加入dmem/f12全培养基重悬;3. 将重悬后的混合液用40目细胞筛研磨过滤,静置后弃去上层单细胞悬液,保留下层沉淀,重复加入全培养基重悬,静置以最大程度除去单细胞悬液和杂质,将最终获得的沉淀用含有10%胎牛血清的dmem/f12培养基重悬,轻轻吹打均匀;4. 将混匀后的沉淀悬液接种至细胞培养皿后置于培养箱中培养5 d
ꢀ‑ꢀ
7 d;5. 当贴壁细胞比例达80%即可进行消化传代,在传代过程中每5代使用差速贴壁法进行纯化去除成纤维细胞,即将传代后的细胞在培养箱中培养24h后,将上清转移至新的培养皿中培养。
39.本发明采用湖羊72日龄胚胎成肌细胞进行连续培养,胚胎成肌细胞作为一种多能干细胞,具有增殖分化潜能大、易于培养等优点。本发明中绵羊成肌细胞可在有限代次内连续培养至30代,在整个传代过程中早期收获细胞量最高可达2
×
107个/ml,随着传代次数的增加呈缓慢下降的趋势,传代30次后细胞量仍可达传代阈值(图1)。
40.传代早期细胞形态清晰且呈典型纤维状,成片后细胞排列整齐,汇合率达90%以上。连续培养至10代后出现大量肌管且细胞折光性增强,至30代细胞形态仍保持纤维状排列(图2)。以上结果表明,本发明所培养得到的成肌细胞,可连续培养至30代以上且后期细胞形态正常、细胞量可达传代阈值,在有限代次内可正常培养用于后续分子机制探索。
41.推测本发明中连续培养至10代后,自行分化出现大量肌管的原因是:在成肌细胞纯度极高的前提下,由于培养基中胎牛血清的浓度随培养时间的增加而逐渐降低,较低浓度的胎牛血清可能有一定的诱导分化作用。因此,自行分化出现大量肌管,也证实了本发明所用的传代纯化方法,能够获得纯度极高的成肌细胞。
42.实施例2
ꢀꢀ
成肌细胞的特异性基因的mrna表达水平本实施例对实施例1得到的成肌细胞的特异性基因的mrna表达水平进行检测。
43.myf5、myod、myog 3个转录因子属于成肌调节因子家族(mrf),被认为是成肌决定因子,引导祖细胞建立骨骼肌并激活成肌细胞分化程序。desmin作为中间丝蛋白的一种,参与构成肌肉组织细胞骨架。pax7调控因子在胚胎期参与调控成肌细胞增殖和生长。不同代次成肌细胞特异性基因的mrna表达量存在显著性差异(p 《 0.05)。其中pax7、myod、myog及desmin基因表达量随传代次数的增加而显著降低,x10成肌细胞myf5基因表达量显著高于x1、x15及x30,且5个特异性基因在x1、x10、x15及x30成肌细胞中的表达量均高于c2c12小鼠
成肌细胞系(图3)。表明在连续传代过程中成肌细胞数量比例和增殖分化能力逐步下降,但培养至30代成肌细胞仍有很好的基因保留量。基因保留量虽低于前期细胞,但仍略高于c2c12小鼠成肌细胞系。证实原代培养获得细胞确为成肌细胞,在30代内细胞具有成肌特性且可正常增殖传代用于后续机制研究实验。
44.实施例3
ꢀꢀ
多次传代的成肌细胞形态学特征肌管是成肌细胞高度分化形成的特殊结构,肌管又称多核肌纤维,由多个成肌细胞接触和融合形成。镜下观察结果和形态学特征可知x10成肌细胞与其他代次不同具有明显的肌管结构(图2),结合荧光定量结果分析,x10成肌细胞的myf5基因表达量显著高于包括x1在内的其他代次(图3)。表明myf5基因表达量与肌管形成密切相关。在成肌细胞增殖分化过程中,成肌细胞标记基因表达量随代次增加而下调,而一旦形成肌管则myf5基因表达量会显著上调不受代次增加的影响。此外,上述5个基因都与骨骼肌增殖分化密切相关,但myod、myog、desmin与pax7基因表达量在第10代下调,这可能是因为成肌细胞分化终末期会抑制其他特异性基因表达,以防止不必要的基因过度表达影响肌管形成。
45.综上,myf5表达量上调与肌管形成有关,且myf5表达量与其他4个基因表达量在成肌细胞不同生长发育阶段有较大差异。此前研究认为肌管以肌球蛋白重链 (myosin heavy chain, myhc) 的表达为特征,本发明的实验结果表明myf5或可成为新的肌管特有的特征标志物。
46.实施例4
ꢀꢀ
多次传代的成肌细胞染色体核型分析通过g显带染色体核型分析检测第1代及第15代绵羊成肌细胞均为二倍体核型(图4),其染色体数目为2n=54,且无其他核型,染色体形态、结构与数目正常,符合绵羊染色体生物学特征,未发生染色体突变。两代细胞染色体形态、结构和数目保持一致,表明所培养绵羊成肌细胞遗传学特征稳定,可用于后续基因功能验证与分子机制研究。
47.培养时间的延长为后续在细胞水平开展机制研究提供了更长的实验周期,同时为实验提供了更丰富的细胞群体。是在获得绵羊永生化细胞系前,部分实验的重要实验材料和研究平台。综上本发明所培养细胞在30代内均可作为实验材料应用于科研及其它领域。
48.对比例1
ꢀꢀ
不同纯化时间与间隔培养至第10代的镜下观察结果本对比例提供一种常规纯化方法,与实施例1相同,区别在于,本对比例中常规纯化方法,所用的纯化时间为无间隔,每代均纯化,纯化时间为2-3 h。这种纯化方法为现有技术中惯用的方法,其原理为通过多次短时间的纯化获得纯度较高的成肌细胞,而本发明的原理为少次长时间的纯化更易获得高纯度成肌细胞。
49.当纯化时间为2-3 h,每代均纯化时,由于纯化时间过短,成纤维细胞不能被有效去除。虽然增加了纯化次数,依然不能获得较高纯度的成肌细胞。培养至24 h时,可观察到常规纯化方法中贴壁细胞较多,但培养至72 h时,细胞不能自行分化形成肌管。说明尚有较多的成纤维细胞掺杂其中,虽细胞量较多,但纯度较低。
50.当纯化时间为24h,每5代进行纯化时,纯化时间长,可有效去除成纤维细胞,因此细胞量在培养至24 h时,细胞量较少,但培养至72 h可观察到明显的肌管结构,表明其纯度较高,且纯化间隔较长,可有效降低纯化对成肌细胞造成的细胞量与细胞活性的损失。
51.本对比例提供的常规纯化方法纯化湖羊胚胎来源骨骼肌成肌细胞培养24 h后相差显微镜镜下观察结果,见图5。本发明实施例1所提供纯化方法,纯化后湖羊胚胎来源骨骼
肌成肌细胞培养24 h后相差显微镜镜下观察结果,见图6。
52.本对比例提供的常规纯化方法纯化湖羊胚胎来源骨骼肌成肌细胞培养72 h后相差显微镜镜下观察结果,见图7。本对比例还提供,本发明实施例1所提供纯化方法,纯化湖羊胚胎来源骨骼肌成肌细胞培养72 h自行分化后相差显微镜镜下观察结果,见图8。
53.本对比例的结果表明:常规纯化方法纯化后的细胞在初期增殖速度较快,但后期不能自行分化形成肌管。本发明纯化方法纯化细胞虽前期贴壁细胞数量较少,但成肌细胞纯度较高,后期可自行形成肌管。
54.成肌细胞是骨骼肌的前体细胞,同时是来源于中胚层的肌源干细胞,具有自我更新和肌纤维再生能力,成肌细胞主要存在于胚胎和成熟肌肉组织中,在胚胎中成肌细胞经增殖、分化后融合形成多核肌纤维即肌管,肌管细胞融合形成的中空管状结构,细胞核移至肌管边缘且不易被观察。具有细胞极性,呈不规律分布,无方向性。
55.本对比例的结果表明:常规纯化方法纯化的细胞中成肌细胞比例较低,难以自行分化形成成肌细胞特异性肌管结构;本发明纯化方法纯化的细胞中成肌细胞比例较高,易于分化形成成肌细胞特异性肌管结构。
56.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1