一种158位突变的醛酮还原酶突变体及其应用
1.本发明涉及醛酮还原酶突变体(scecpr
s158a
)的构建和表达,以及该酶的性质和制备研究,属于基因工程和酶学研究技术领域。
背景技术:
2.d-泛酸(d-pantothenic acid,pa)又称维生素b5,存在于植物以及部分微生物中,具有多种生理功能。首先,泛酸作为能量物质参与代谢,不仅是大脑神经所必需的物质,还可以保持血液、皮肤和头发的健康。其次,泛酸作为辅酶a的合成前体,辅助脂肪酸和脂质的生物合成反应,d-泛酸缺乏时会抑制辅酶a的生产,导致自由基清除效率和磷脂的合成效率下降,最终影响神经系统以及代谢功能的运转。
3.d-泛解酸内酯(d-pantolactone,d-pl)是合成d-泛酸的重要前体物质,也可以用于合成异戊二烯、软体毒剂cyanoide a大分子内酯化合物和d-(-)-noviose等物质。d-pl的合成方法包括化学法、酶法和化学酶法。d-pl的化学合成法是以甲醛和异丁醛为起始原料,经醛缩合、腈化及内酯化等反应生成d/l-pl,再经选择性拆分得到d-pl,整个过程工艺成熟,但总体反应步数较多,反应条件严苛,且酸碱用量大和能耗较高。生物技术的发展为生物酶法合成d-pl提供了重要的可行性。目前工业化合成d-pl采用的是化学法与水解酶拆分法相结合的技术路线。即d/l-pl在d-泛解酸内酯水解酶作用下,选择性水解生成d-泛解酸,d-泛解酸再经内酯化生成d-pl,而留下的l-pl再经化学消旋化为d/l-pl重新进行循环拆分。
4.氧化还原法催化不对称还原酮泛解酸内酯(ketopantolactone,kpl)也可以用于制备d-pl,具体的过程是d/l-pl在l-泛解酸内酯脱氢酶的作用下,将l-pl氧化成kpl,再利用酮泛解酸内酯还原酶将其不对称还原成d-pl。整个过程简单绿色,不需要化学法再消旋化。
5.早在1974年,king hl等人已经发现了一种来源于酿酒酵母(saccharomyces cerevisiae)的nadp(h)依赖型的酮泛解酸还原酶能够将kpl还原为d-pl。1989年,hata h等人从s.cerevisiae nrrl y-2034中发现了酮泛解酸内酯还原酶,并对其酶学性质进行了研究,发现其对醛酮类化合物靛红(istain)及其衍生物具有非常高的亲和力,其中对kpl也具有较好的亲和力,km值为0.017mm。nadph依赖性的酮泛解酸内酯还原酶属于醛酮还原酶(aldo-keto reductases,akr)超家族。目前研究较多的cpr主要是源于candida parapsilosis ifo 0708的cpr-c1和cpr-2,以及s.cerevisiae中的scecpr。2014年,qin hm等人对cpr-c2的蛋白结构进行了解析,其结构由13个α螺旋和8个β折叠组成,并具有典型的磷酸丙糖异构酶结构口袋,属于典型akr家族蛋白。qin hm等人进一步又提出了cpr-c2的分子作用机制,揭示了其四个关键的催化位点asp58、tyr63、lys88和his125,其中tyr63与his125作为质子供体,tyr63与lys88形成的带电氢键促进了tyr63的质子转移;lys88与asp58之间形成盐桥实现整个催化过程,此外,还揭示了cpr-c2辅酶结合位点(gly26、thr27、ser161、ser215、leu217、arg222、thr260、thr261)。
6.2017年,zhao m等人通过构建“一菌双酶”辅酶循环再生体系生产d-pl,为抑制底物kpl的自发性水解,将底物以酸性条件流加入反应中,最终产物浓度达到475mm,得率在95%左右,e.e.≧99.9%,产物的时空得率为243.45g
·
l-1
d-1
。2020年,pei x等人,利用二氯甲烷抑制kpl的自发性水解,开发了一种双相反应体系进行全细胞生物转化生产d-pl。在分批补料双相反应中,d-pl的产物浓度为0.77mol/l,其e.e.≧99%,时空产率为343.2g
·
l-1
d-1
。
7.但是由于泛酸及其相关产品的重要性,在工业上仍需要进一步提高d-pl生产效率,降低其合成成本,还需要进一步提升scecpr的催化活性。
技术实现要素:
8.本发明的目的是通过分子对接和定向进化技术,提供一种与野生型相比,比酶活更高的醛酮还原酶的定向改造酶。
9.本发明是通过以下技术方案实现的:
10.第一方面,本发明提供一种醛酮还原酶突变体,所述突变体是将seq id no:2所示氨基酸序列的第298位进行单突变或第158位、第298位进行双突变获得的。
11.具体地,所述突变体是将seq id no:2所示氨基酸序列进行如下之一的突变获得:(1)第298位的酪氨酸突变成组氨酸,其氨基酸序列如seq id no:6所示;(2)第158位丝氨酸、第298位酪氨酸分别突变为丙氨酸、组氨酸,其氨基酸序列如seq id no:8所示。
12.第二方面,本发明提供一种上述醛酮还原酶突变体的编码基因。所述编码基因的核苷酸序列分别如seq id no:5、seq id no:7所示。
13.第三方面,本发明提供一种含上述编码基因的重组表达质粒。
14.优选地,所述的重组表达质粒的载体为peasy-blunt e1。所述重组表达质粒是将所述编码基因插入peasy-blunt e1质粒的多克隆位点(multiple cloning sites,mcs)得到。
15.进一步所述重组表达质粒按如下方法构建:
16.(1)以含有质粒pacycduet1-scecpr/esgdh的e.coli dh5α菌株为模板,以下列引物进行pcr扩增,对pcr产物进行纯化回收,得到目的基因:
17.scecpr-f tcatcatcatatgggctcatttcatcagcag
18.scecpr-r gttatgctagtcacactttctgggccgc
19.所述质粒pacycduet1-scecpr/esgdh是将genbank登录号为ega59421.1的基因、genbank登录号为km817194.1的基因分别插入同一质粒pacycduet-1的酶切位点nco i与hind iii之间、nde i与xho i之间得到的;
20.(2)以peasy-blunt e1质粒为模板,以下列引物进行pcr扩增,对pcr产物进行纯化回收,得到线性化载体:
21.peasy-blunt e1-f gaaagtgtgactagcataaccccttggggc
22.peasy-blunt e1-r atgagcccatatgatgatgatgatgatgagaaccc
23.(3)通过一步克隆试剂盒将步骤(1)所述的目的基因和步骤(2)所述的线性化载体进行连接,所得连接产物转入感受态细胞中,在含(100μg/ml)氨苄青霉素的培养基上进行筛选,挑取单克隆测序验证,提取质粒,得到所述野生型表达质粒;
24.(4)以步骤(3)所述的野生型表达质粒为模板,以以下引物进行全质粒定点突变pcr,所得pcr产物纯化后转入e.coli dh5α感受态细胞,在含(100μg/ml)氨苄青霉素的培养基上进行筛选,挑取单克隆测序验证,提取质粒,得到重组表达质粒a:
25.y298h-f
26.cgcctgcattggaacaaactgtatggcaaatataattatgcg
27.y298h-r gttccaatgcaggcgcagtggttcatgttctaagccca
28.(5)以步骤(3)所述的野生型表达质粒为模板,以以下两对引物依次进行两轮全质粒定点突变pcr,所得pcr产物纯化后转入e.coli dh5α感受态细胞,在含氨苄青霉素的培养基上进行筛选,挑取单克隆测序验证,提取质粒,得到重组表达质粒b:
29.s158a-f ggcgtggcaaattttgcggtggaagatttgcag
30.s158a-r aaaatttgccacgccaatatttttggctttacctgactt
31.y298h-f
32.cgcctgcattggaacaaactgtatggcaaatataattatgcg
33.y298h-r gttccaatgcaggcgcagtggttcatgttctaagccca。
34.重组质粒a和重组质粒b的不同在于目的基因上的突变位点不同。重组质粒a:第298位的酪氨酸突变成组氨酸,其氨基酸序列如seq id no:6所示;重组质粒b:第158位丝氨酸、第298位酪氨酸分别突变为丙氨酸、组氨酸,其氨基酸序列如seq id no:8所示。
35.所述重组表达质粒可以直接送到公司合成,也可以采用本领域人员所知的任何常规手段将目的基因插入表达载体获得的可以表达本发明的三种醛酮还原酶突变体的重组表达质粒都在本发明的保护范围内,本发明在此只是提供发明人实际操作的一种方法。
36.第四方面,本发明提供一种上述重组表达质粒构建的重组基因工程菌。
37.本发明的一个实施例中,所述重组基因工程菌的宿主细胞是e.coli bl21(de3)。
38.具体地,所述重组基因工程菌按如下方法构建:利用热激法将所述重组表达质粒转入e.coli bl21(de3)感受态细胞,转化产物均匀涂布在含有100μg/ml氨苄青霉素的lb固体培养基上,经37℃过夜培养,挑取单克隆测序验证,获得所述重组基因工程菌。
39.第五方面,本发明提供一种上述醛酮还原酶突变体在催化不对称还原酮泛解酸内酯制备d-泛解酸内酯中的应用。
40.具体地,所述应用为:以表达所述醛酮还原酶突变体的重组基因工程菌经诱导表达、蛋白纯化获得的纯酶为催化剂,以酮泛解酸内酯为底物,以nadph为辅酶构建反应体系,在ph 6.0、35℃下进行不对称还原;所述反应体系中,所述纯酶的终浓度为0.5μg/ml,所述酮泛解酸内酯的终浓度为50mm,所述nadph的终浓度为60μm。
41.第六方面,本发明提供一种醛酮还原酶突变体,所述突变体是将seq id no:2所示氨基酸序列的第158位进行单突变获得的。
42.具体地,所述突变体是将seq id no:2所示氨基酸序列进行如下突变获得:第158位丝氨酸突变为丙氨酸,其氨基酸序列如seq id no:4所示。
43.第七方面,本发明提供一种上述醛酮还原酶突变体的编码基因,所述编码基因的核苷酸序列如seq id no:3所示。
44.第八方面,本发明提供一种含上述编码基因的重组表达质粒。
45.优选地,所述的重组表达质粒的载体为peasy-blunt e1。所述重组表达质粒是将
所述编码基因插入peasy-blunt e1质粒的多克隆位点(multiple cloning sites,mcs)得到。
46.进一步所述重组表达质粒按如下方法构建:
47.(1)以含有质粒pacycduet1-scecpr/esgdh的e.coli dh5α菌株为模板,以下列引物进行pcr扩增,对pcr产物进行纯化回收,得到目的基因:
48.scecpr-f tcatcatcatatgggctcatttcatcagcag
49.scecpr-r gttatgctagtcacactttctgggccgc
50.所述质粒pacycduet1-scecpr/esgdh是将genbank登录号为ega59421.1的基因、genbank登录号为km817194.1的基因分别插入同一质粒pacycduet-1的酶切位点nco i与hind iii之间、nde i与xho i之间得到的;
51.(2)以peasy-blunt e1质粒为模板,以下列引物进行pcr扩增,对pcr产物进行纯化回收,得到线性化载体:
52.peasy-blunt e1-f gaaagtgtgactagcataaccccttggggc
53.peasy-blunt e1-r atgagcccatatgatgatgatgatgatgagaaccc
54.(3)通过一步克隆试剂盒将步骤(1)所述的目的基因和步骤(2)所述的线性化载体进行连接,所得连接产物转入感受态细胞中,在含氨苄青霉素的培养基上进行筛选,挑取单克隆测序验证,提取质粒,得到所述野生型表达质粒;
55.(4)以步骤(3)所述的野生型表达质粒为模板,以以下引物进行全质粒定点突变pcr,所得pcr产物纯化后转入e.coli dh5α感受态细胞,在含氨苄青霉素的培养基上进行筛选,挑取单克隆测序验证,提取质粒,得到所述重组表达质粒c:
56.s158-f ggcgtggcaaattttgcggtggaagatttgcag
57.s158-r aaaatttgccacgccaatatttttggctttacctgactt。
58.重组质粒a、b和c的不同在于目的基因上的突变位点不同。重组质粒a:第298位的酪氨酸突变成组氨酸,其氨基酸序列如seq id no:6所示;重组质粒b:第158位丝氨酸、第298位酪氨酸分别突变为丙氨酸、组氨酸,其氨基酸序列如seq id no:8所示;重组质粒c:第158位丝氨酸突变为丙氨酸,其氨基酸序列如seq id no:4所示。
59.所述重组表达质粒可以直接送到公司合成,也可以采用本领域人员所知的任何常规手段将目的基因插入表达载体获得的可以表达本发明的三种醛酮还原酶突变体的重组表达质粒都在本发明的保护范围内,本发明在此只是提供发明人实际操作的一种方法。
60.第九方面,本发明提供一种上述重组表达质粒构建的重组基因工程菌。
61.本发明的一个实施例中,所述重组基因工程菌的宿主细胞是e.coli bl21(de3)。
62.具体地,所述重组基因工程菌按如下方法构建:利用热激法将所述重组表达质粒转入e.coli bl21(de3)感受态细胞,转化产物均匀涂布在含有(100μg/ml)氨苄青霉素的lb固体培养基上,经37℃过夜培养,挑取单克隆测序验证,获得所述重组基因工程菌。
63.第十方面,本发明提供一种上述醛酮还原酶突变体在催化不对称还原酮泛解酸内酯制备d-泛解酸内酯中的应用。
64.具体地,所述应用为:以表达所述醛酮还原酶突变体的重组基因工程菌经诱导表达、蛋白纯化获得的纯酶为催化剂,以酮泛解酸内酯为底物,以nadph为辅酶构建反应体系,在ph 6.0、35℃下进行不对称还原;所述反应体系中,所述纯酶的终浓度为0.5μg/ml,所述
酮泛解酸内酯的终浓度为50mm,所述nadph的终浓度为60μm。
65.综上,本发明提供了醛酮还原酶scecpr的定向突变体,所述醛酮还原酶scecpr突变体是将seq id no:2所示氨基酸序列的第158位,第298位分别进行单位点和双位点突变获得。
66.进一步,所述醛酮还原酶scecpr突变体进行了以下一个或两个位点的突变:(1)将seq id no:2所示氨基酸序列第158位丝氨酸突变成丙氨酸,即scecpr
s158a
;(2)将seq id no:2所示氨基酸序列第298位酪氨酸突变成组氨酸,即scecpr
y298h
;(3)将seq id no:2所示氨基酸序列第158位丝氨酸和第298位酪氨酸分别同时变成丙氨酸和组氨酸,即scecpr
s158a/y298h
。
67.在本发明提供的醛酮还原酶的高比酶活定向改造酶scecpr
s158a
,其编码的核苷酸序列如seq id no:3所示;其编码的氨基酸序列如seq id no:4所示。
68.在本发明提供的醛酮还原酶的高比酶活定向改造酶scecpr
y298h
,其编码的核苷酸序列如seq id no:5所示;其编码的氨基酸序列如seq id no:6所示。
69.在本发明提供的醛酮还原酶的高比酶活定向改造酶scecpr
s158a/y298h
,其编码的核苷酸序列如seq id no:7所示;其编码的氨基酸序列如seq id no:8所示。
70.第二方面,本发明还提供一种上述醛酮还原酶突变体的编码基因、重组表达质粒以及突变体蛋白酶活及酶学表征。
71.进一步,所述醛酮还原酶突变体的编码基因的核苷酸序列如seq id no:3、seq id no:5或seq id no:7所示。
72.优选地,所述的重组表达质粒的载体为peasy-blunt e1。所述的宿主细胞包括但不限于本领域的各种常规宿主细胞,本发明优选e.coli bl21(de3)。
73.进一步,所述醛酮还原酶突变体的重组表达质粒是将seq id no:1所示核苷酸序列插入peasy-blunt e1质粒的多克隆位点(multiple cloning sites,mcs)得到。
74.特别优选地,所述醛酮还原酶突变体的重组表达质粒采用如下方法获得:
75.(1)利用一步克隆试剂盒(clonexpress ii one step cloning kit)将scecpr基因和线性化peasy-blunt e1质粒连接,获得插入scecpr基因的重组质粒,质粒图谱如图1所示;
76.(2)以步骤(1)所述的插入scecpr基因的重组质粒为模板,进行全质粒定点突变,所得pcr产物经后处理,获得所述醛酮还原酶突变体的重组表达质粒;
77.进一步,所述后处理为:将所述pcr产物用内切酶dpn i 37℃消化1h,去除模板dna,然后用纯化试剂盒纯化,即得所述醛酮还原酶突变体的重组表达质粒片段。
78.与现有技术相比,本发明取得的有益效果是:本发明利用同源建模和序列同源性分析对醛酮还原酶进行理性改造,构建了能表达高活性的醛酮还原酶突变体的工程菌。与野生型相比,突变体比酶活显著提高,提高了1226.55%。本发明还公开了突变体工程菌的构建以及表达和纯化方法,制备的突变体具有更高的比酶活,具有较大的工业应用潜力。
附图说明
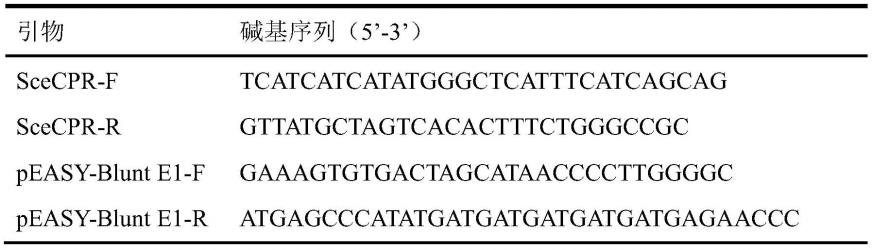
79.图1重组质粒peasy-blunt e1-scecpr示意图;
80.图2scecpr分子对接结构示意图;
81.图3酮泛解酸内酯还原酶及其突变体sds-page注:m为:蛋白marker;泳道1为:scecpr粗酶液;泳道2为:scecpr
s158a
纯酶酶液;泳道3为:scecpr
y298h
纯酶酶液;泳道4为:scecpr
s158a/y298h
纯酶酶液;
82.图4不同温度(℃)对scecpr及突变体的影响;
83.图5不同ph对scecpr及突变体的影响;
84.图6scecpr及突变体比酶活结果。
具体实施方式
85.实施例中所使用的材料、试剂,如无特殊说明,均可从常规销售途径获得;
86.实施列中所使用的实验方法,如无特殊说明,均为常规方法;
87.下面通过具体的实施方案来阐述本发明。实施方案为说明性的,而非限制本发明的范围,本发明的范围仅由权力说明书所限定。
88.lb培养基组成为:胰蛋白胨10g/l,酵母提取物5g/l,氯化钠10g/l,溶剂为去离子水,ph值自然;
89.lb固体培养基组成:胰蛋白胨10g/l,酵母提取物5g/l,氯化钠10g/l,琼脂粉2%,溶剂为去离子水,ph值自然。
90.50mm tris-hcl(ph 8.0)缓冲液:tris 6.05g溶于超纯水中,用hcl调节ph至8.0后,通过容量瓶定容至1l。
91.缓冲液a:50mm tris-hcl,300mm nacl,ph 8.0。
92.缓冲液b:50mm tris-hcl,300mm nacl,500mm咪唑,ph 8.0。
93.20mm pbs缓冲液:20mm na2hpo4,20mm nah2po4,加入0.9%的nacl,ph 6.0。
94.氨基酸序列的物种来源:saccharomyces cerevisiae,scecpr;exiguobacterium sibiricum,esgdh。
95.实施例1:醛酮还原酶突变体构建方法
96.(1)scecpr基因分子进化关系分析及建立模型
97.以scecpr的氨基酸序列(ncbi id:np_010159.1)为模板,在ncbi数据库中检索序列相似度较高的氨基酸序列,选择与scecpr的氨基酸序列相似度较高的近平滑假丝酵母c.parapsilosis ifo 0708来源的共轭醛酮还原酶(cpr-c2)进行建模。以cpr-c2(pdb id:3vxg)的三维结构为模板,利用swiss-model在线服务器进行同源建模。运用在线分析网站(https://services.mbi.ucal.edu/saves)对同源建模的结构模型进行评估和优化,获得精准度较高的模型,如图2所示。
98.(2)分子对接预测scecpr与底物之间的结合模式
99.利用autodock分子对接软件将scecpr与底物kpl进行分子对接处理,得到酶与底物相互作用的关键位点以及可能影响酶催化效率的氨基酸位点。以scecpr与kpl的复合体为模型,确定了以kpl为中心以内的氨基酸,如图2所示。利用funclib(http://funclib.weizmann.ac.il)在线分析工具确定scecpr结构中同源位点突变的可选择性。
100.结合上述分析软件给出的结果,确定了158位丝氨酸、298位酪氨酸的关键作用。将158位丝氨酸突变为丙氨酸、298位酪氨酸突变为组氨酸。
101.实施例2:醛酮还原酶突变体菌株的构建。
102.(1)醛酮还原酶重组工程菌株的构建
103.所述醛酮还原酶突变体的重组表达质粒是将seq id no:1所示核苷酸序列插入peasy-blunt e1质粒的mcs得到。
104.利用一步克隆试剂盒将scecpr基因和线性化peasy-blunt e1质粒连接,获得插入scecpr基因的重组质粒;
105.以实验室保存的e.coli dh5α(pacycduet1-scecpr/esgdh)菌株(zhao m,gao l,zhang l,et al.asymmetric reduction of ketopantolactone using a strictly(r)-stereoselective carbonyl reductase through efficient nadph regeneration and the substrate constant-feeding strategy.biotechnology letters.2017,39(11):1741-1746.doi:10.1007/s10529-017-2415-1)为模板,利用pcr扩增目的基因scecpr片段(该基因已进行密码子优化,核苷酸序列如seq id no:1所示),该基因编码的目的蛋白的氨基酸序列如seq id no:2所示。
106.根据ncbi数据库中查找到的酿酒酵母醛酮还原酶基因的核苷酸序列,设计两对扩增引物:
107.表1重组质粒构建相关引物
[0108][0109]
目的基因(scecpr)pcr扩增体系:1μl浓度100ng/ul的pacycduet1-scecpr/esgdh质粒为模板,浓度10μm的引物f和引物r各1μl,2
×
primestar hsdna polymerase高保真dna聚合酶25μl,超纯水22μl。
[0110]
pcr反应条件为:预变性98℃,5min,然后进入温度循环98℃,10sec;57℃,15sec;72℃,1min;共30个循环,终止温度为4℃。
[0111]
peasy-blunt e1质粒片段线性化pcr扩增体系:1μl浓度120ng/μl的peasy-blunt e1质粒为模板,浓度10μm的引物f和引物r各1μl,2
×
primestar hsdna polymerase高保真dna聚合酶25μl,超纯水22μl。
[0112]
pcr反应条件为:预变性98℃,5min,然后进入温度循环98℃,10sec;58℃,15sec;72℃,1min;共30个循环,终止温度为4℃。
[0113]
对pcr产物进行纯化回收,将纯化回收得到的片段与线性化的peasy-blunt e1质粒片段利用一步克隆试剂盒(vazyme,clonexperss ii one step cloning kit c112)连接获得重组质粒peasy-blunt e1-scecpr,如图1所示。将连接产物转化到e.coli dh5α感受态中。在含有100μg/ml amp的lb培养基中,37℃过夜培养12h,挑菌并鉴定阳性转化子。根据测序结果,选择核苷酸序列正确的菌株进行甘油保菌,并于-80℃超低温冰箱中保藏。提取peasy-blunt e1-scecpr质粒转入表达菌株e.coli bl21(de3)感受态中,在含有100μg/ml amp的lb培养基中,37℃培养12h,挑菌并鉴定阳性转化子。将阳性转化子培养送测。
[0114]
(2)醛酮还原酶突变体重组工程菌株的构建
[0115]
设计定点突变引物(表2),以peasy-blunt e1-scecpr质粒为模板进行全质粒pcr。pcr扩增体系:1μl浓度1ng/μl的peasy-blunt e1-scecpr质粒为模板,浓度10μm的引物f和引物r各1μl,2
×
primestar hsdna polymerase高保真dna聚合酶25μl,超纯水22μl。
[0116]
表2定点突变相关引物
[0117][0118]
注:加粗字体表示突变碱基,突变碱基为大肠杆菌的优化碱基。
[0119]
pcr反应条件为:预变性98℃,5min,然后进入温度循环98℃,10sec;57℃,15sec;72℃,1min;共30个循环,终止温度为4℃。
[0120]
全质粒定点突变pcr产物经内切酶dpn i 37℃消化2h后,通过纯化试剂盒获得的纯化产物转入到e.coli dh5α感受态中,菌液均匀涂布在含100μg/ml amp的lb固体培养基上,37℃过夜培养,得到定点突变文库。挑取单转化子,通过菌落pcr鉴定阳性转化子。其中,scecpr
s158a/y298h
突变体经两轮全质粒定点突变后获得。
[0121]
根据测序结果,选择核苷酸序列正确的菌株进行甘油保菌,并于-80℃超低温冰箱中保藏。提取重组突变质粒,通过热激法转入表达菌株e.coli bl21(de3)感受态中,在含有100μg/ml amp的lb培养基中,37℃培养12h,挑菌并鉴定阳性转化子。
[0122]
实施例3:醛酮还原酶突变体蛋白的表达与纯化
[0123]
(1)醛酮还原酶突变基因的诱导表达
[0124]
将含有醛酮还原酶突变基因(scecpr
s158a
、scecpr
y298h
、scecpr
s158a/y298h
)的工程菌株接种于含有100μg/ml amp的lb培养基中,37℃,180rpm摇床震荡12h,获得种子液。
[0125]
将种子液以2%(v/v)接种量转接于含有100μg/ml amp的lb培养基中,在37℃,180rpm摇床震荡2h左右直至od600在0.6-0.8,加入终浓度为0.2mm异丙基硫代半乳糖苷(iptg),在24℃,180rpm条件下诱导表达培养12h。
[0126]
(2)醛酮还原酶突变体的纯化
[0127]
通过高速冷冻离心机8000rpm,4℃下离心10min,弃上清保留菌体,再用超纯水重悬洗涤菌体,8000rpm,4℃离心10min,去上清收集菌体并称重。称取0.5g湿菌体,以1:20(m/v,g/ml)比例添加50mm tris-hcl(ph 8.0)缓冲液重悬菌体。利用超声破碎仪破碎重悬菌体,释放目的蛋白,整个过程需要冰浴。超声破碎程序:工作2s,暂停4s,持续10min,功率维持在35%。破碎液利用高速冷冻离心机,4℃,12000rpm离心15min,去除细胞碎片获得粗酶液。粗酶液进行sds-page验证。粗酶液经过膜处理后可用于蛋白纯化。
[0128]
通过ni柱亲和层析进行纯化,ni柱使用缓冲液a平衡后上样,使用缓冲液a与缓冲液b以体积比9:1的比例去除非特异性结合蛋白,使用缓冲液b洗脱目的蛋白,收集该洗脱液即为纯化的目的蛋白。
[0129]
纯化的目的蛋白通过透析的方式进行脱盐处理。进行透析处理前,需对透析袋(3.5kda)进行检漏操作,确保透析袋的密封性良好。将纯化得到的目的蛋白放置于透析袋中,透析袋置于20mm pbs缓冲液中,每隔6个小时进行换液,透析12小时,全程确保低温(冰浴0℃)处理。
[0130]
(3)醛酮还原酶突变体纯化验证
[0131]
透析后所获得酶液进行sds-page分析,验证酶液的纯化效果。结果如图3所示:条带单一,大小与理论值相符,可用于后续实验研究。m为marker,标准蛋白大小依次为(235kda、170kda、130kda、93kda、70kda、53kda、41kda、30kda、22kda、18kda、14kda、9kda);泳道1:peasy-blunt e1-scecpr诱前菌液;泳道2:peasy-blunt e1-scecpr诱导表达后纯酶;泳道3:peasy-blunt e1-scecpr
s158a
诱导表达后纯酶;泳道4:peasy-blunt e1-scecpr
y298h
诱导表达后纯酶;泳道5:peasy-blunt e1-scecpr
s158a/y298h
诱导表达后纯酶。
[0132]
实施例4:醛酮还原酶突变体酶活测量及酶学表征
[0133]
(1)醛酮还原酶突变体比酶活测量方法
[0134]
酶活测定采用分光光度计测量340nm处nadph吸光值的变化来计算酶活,总反应体系1ml。酶活力单位(u)定义:在35义下,每分钟氧化1μmol nadph所需的酶量。
[0135]
将装有1ml磷酸盐缓冲液(ph 6.0)的离心管在金属浴中35℃恒温孵育10min,然后加入scecpr酶液(0.5μg)和kpl(终浓度50mm),共同孵育30s后,立即转移至1ml容量的比色皿中,同时加入辅酶nadph(终浓度60μm),监测1min内340nm处nadph吸光值的变化来计算酶活。酮泛解酸内酯还原酶的体积酶活以及比酶活计算公式如下:
[0136][0137][0138]
δa为吸光值的变化;v1为反应液总体积;v2为反应液中添加的酶液体积,ml;6220为nadph在340nm下的摩尔消光系数,l*mol-1
*cm-1
;l为光程距离,cm;t为反应时间,min。
[0139]
(2)醛酮还原酶突变体最适温度测量
[0140]
将装有1ml磷酸盐缓冲液(ph 6.0)的离心管在金属浴中25、30、35、40、45、50、55℃恒温孵育10min,然后加入scecpr纯酶液(0.5μl,1mg/ml)和终浓度为50mm的kpl,共同孵育30s后,立即转移至1ml容量的比色皿中,同时加入辅酶nadph(60μm),监测1min内340nm处nadph吸光值的变化来计算酶活,定义最高酶活为100%。测得的结果如图4所示,最适反应温度为35℃。
[0141]
(3)醛酮还原酶突变体最适ph测量
[0142]
将装有1ml 0.2m磷酸盐缓冲液(ph 5.5、6.0、6.5、7.0、8.0)、0.1m柠檬酸-柠檬酸钠缓冲液(ph 4.0、5.0、5.5、6.0)的离心管在金属浴中35℃恒温孵育10min,然后加入scecpr纯酶液(0.5μl,1mg/ml)和50mm kpl,共同孵育30s后,立即转移至1ml容量的比色皿中,同时加入辅酶nadph(60μm),监测1min内340nm处nadph吸光值的变化来计算酶活,定义最高酶活为100%。测得的结果如图5所示,最适反应ph为6.0。
[0143]
在最适条件下测量scecpr、scecpr
s158a
、scecpr
y298h
、scecprs
158a/y298h
的比酶活,结果如图6所示,scecpr、scecpr
s158a
、scecpr
y298h
、scecprs
158a/y298h
的比酶活分别为32.62u/mg、
119.4u/mg、216.6u/mg、400.1u/mg,scecpr
s158a
、scecpr
y298h
、scecpr
s158a/y298h
的比酶活相较于scecpr分别提高了3.66、6.64、12.26倍。以上为本发明一种详细的实施方法和具体的操作流程,是以本发明技术方案为前提下实施的,但本发明的保护范围不限于上述的实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1