一种提高贵州木霉NJAU4742在逆境下分解农作物秸秆的基因片段及其应用
一种提高贵州木霉njau 4742在逆境下分解农作物秸秆的基因片段及其应用
技术领域
1.本发明属于基因工程领域,涉及一种提高贵州木霉njau 4742在逆境下分解农作物秸秆的基因片段及其应用。
背景技术:
2.过量施用化肥、农药等化学品使我国土壤微生物区系受到极大破坏,土壤养分生物转化能力越来越弱,作物产量对化肥供应养分的依赖性越来越强,经济作物的土传病害更严重,严重影响了我国农业的可持续发展。近年来,贵州木霉菌njau 4742(trichoderma guizhouense njau4742,以下简称njau 4742)因其具有显著的促进植物生长或防控土传病害的能力以及环境友好、安全无毒的特点,在农业生产上得到越来越广泛的应用。njau 4742定殖于植物根部后能与植物形成共生体,显著促进根际养分的转化并通过分泌次级代谢产物和植物生长调节剂来促进植物的生长,有效地施用njau 4742菌株及其相关的生物有机肥产品,也是减少我国农用化学品投入的重要途径之一。
3.与其他异养真菌类似,njau 4742通常依赖于特定的宿主生物或基质来获取营养。在不同的栖息地(包括土壤和植物根系)的定殖过程中,njau 4742总是以有效降解真菌尸体或不同的植物碎屑而获得足够的能源。因此,njau 4742有效的木质纤维素酶的降解对维持其营养生长及土壤定殖过程十分重要。然而,由于全球变暖和其他极端气候的影响,预计本世纪内全球土壤表面温度将上升1.4-5.81℃,导致我国大部分农田,尤其是大棚的夏季土壤表层温度高于 37℃。土壤表层温度的波动通常会对土壤微生物的生长代谢造成巨大影响。然而,土壤温度的升高造成的温度胁迫是否会抑制功能菌njau 4742利用农作物秸秆中的木质纤维素,限制其获取碳源,进而导致其在植物根际的定殖能力减弱、促生和防病效果不稳定等一系列问题仍有待深入研究。因此,研究逆境下njau 4742分解农作物秸秆的差异及其调控机制,对提高njau4742菌株及其相关的生物有机肥产品的田间施用效果具有重要的理论意义,这不仅是本领域的重要技术问题,也是本专利所要阐明和揭示的科学问题。
技术实现要素:
4.本发明的目的是针对现有技术的上述不足,提供一种提高njau 4742在逆境条件下分解农作物秸秆的方法及应用。
5.本发明的另一目的是提供含有adp核糖焦磷酸酶基因tradp的过表达片段。
6.本发明的又一目的是提供该基因和过表达片段的应用。
7.本发明的目的可通过以下技术方案实现:
8.seq id no.1所示的adp-核糖焦磷酸酶基因tradp在提高贵州木霉njau 4742在热胁迫下分解农作物秸秆能力中的应用。adp-核糖焦磷酸酶基因tradp的cds序列如seq id no.2 所示。
9.本发明所述方法中贵州木霉njau4742保藏编号为cgmcc no.12166,保藏于中国普通微生物菌种保藏管理中心。
10.本发明所述的adp核糖焦磷酸酶基因tradp的过表达片段。
11.作为本发明的一种优选,所述的过表达片段的核苷酸序列如seq id no.3所示。
12.一种贵州木霉njau 4742基因工程菌,其能够过表达所述的adp核糖焦磷酸酶基因 tradp。
13.作为本发明的一种优选,所述的贵州木霉njau 4742基因工程菌是用权利要求2或3所述的adp核糖焦磷酸酶基因tradp的过表达片段转化贵州木霉njau4742所得。
14.作为本发明的一种优选,所述的转化方法为原生质体转化。
15.一种提高贵州木霉njau 4742在热胁迫下分解农作物秸秆能力的方法,将所述的过表达片段转染到贵州木霉njau 4742中获得基因工程菌,再利用该基因工程菌分解农作物秸秆。
16.有益效果:
17.以往的研究表明,贵州木霉njau 4742降解秸秆的最适温度为28℃左右,当温度升高到 32℃时,贵州木霉njau 4742农作物秸秆利用能力显著下降,严重影响了其微生物功能。
18.本发明通过基因同源重组方法获得njau 4742两个基因的过表达突变子,发现对于njau4742逆境下农作物秸秆的利用具有调控能力,adp核糖焦磷酸酶基因tradp的过表达突变子就是其中之一;在逆境条件下(热胁迫)相比于njau 4742野生型菌株(wt),adp核糖焦磷酸酶基因tradp过表达(oe-tradp)显著提高了其生物量及农作物秸秆酶的分泌能力进而有利于农作物秸秆的分解。
附图说明
19.图1:oe-tradp突变株的rt-pcr验证;
20.图2:菌株oe-tradp与wt平板生长情况比较;
21.图3:逆境下固体发酵过程中菌株oe-tradp与wt生物量的测定;
22.图4:逆境下固体发酵过程中菌株oe-tradp与wt农作物秸秆酶活力的测定;
23.图5:逆境下固体发酵过程中菌株oe-tradp与wt木质纤维素酶关键基因的定量;
24.图6:逆境下固体发酵过程中菌株oe-tradp与wt木质纤维素酶相关调控因子的定量。
具体实施方式:
25.下面结合实施例对本发明做进一步说明,下列实施例中未注明具体条件的实验方法,通常按照本领域的公知手段。
26.实施例1菌株活化与制备
27.1、菌株的观察:贵州木霉njau 4742(trichoderma guizhouense njau 4742),具有以下特征:丝状真菌,菌丝有隔丛枝状,分生孢子梗光滑,绿色,顶端膨大呈球形,上面有生小梗产生孢子,分生孢子光滑球形,绿色。
28.2、菌株的培养:将njau 4742接种到固体培养基pda玻璃培养皿中,培养条件为:28
℃、7天,将培养皿上的绿色孢子用5ml的无菌水洗刮下来,用无菌纱布过滤到灭完菌的玻璃瓶中制备成了孢子悬液备用。
29.实施例2njau4742中adp核糖焦磷酸酶基因tradp过表达突变子的构建
30.1、菌体培养:将njau4742孢子液接种到固体培养基pda玻璃培养皿中,培养条件为:28℃、7天,将培养皿上的绿色孢子用5ml的无菌8%nacl洗刮下来,用无菌纱布过滤到灭完菌的离心管中待用。
31.2、tradp基因过表达:基于同源重组原理,构建目的基因过表达片段。从njau4742基因组克隆tradp基因上游片段约1200bp,tradp基因orf及下游1000bp左右的序列及强启动子p9.17片段(约1700bp);委托安徽通用生物系统有限公司合成seqidno.4所示的约2300bp的潮霉素b抗性表达片段。具体步骤如下:
32.单片段克隆pcr体系设置如下:
[0033][0034][0035]
其中,克隆tradp基因上游片段的上游引物为tradp-uf,下游引物为tradp-ur;克隆tradp基因orf及下游1000bp左右的序列的上游引物为tradp-f,下游引物为tradp-r克隆强启动子p9.17片段的上游引物为promoter-f,下游引物为promoter-r;引物序列详见表1。
[0036]
反应条件:
[0037][0038]
用dna切胶回收试剂盒(omega)回收pcr产物,保证dna片段浓度大于200ng/μl。将四个片段采用融合pcr技术连接。pcr技术分两步融合,具体如下:
[0039]
第一步:
[0040]2×
cloneamphifipcrpremix10μl
[0041]
基因上游片段(250ng/μl)1μl
[0042]
强启动子片段(250ng/μl)1μl
[0043]
hygb片段(250ng/μl)1μl
[0044]
orf及下游1000bp左右的序列(250ng/μl)1μl
[0045]
ddh2o6μl
[0046]
不加引物,pcr体系20μl。
[0047]
第一步pcr反应条件设置如下:
[0048][0049][0050]
第二步:
[0051]2×
cloneamphifipcrpremix25μl
[0052]
基因上游片段的上游引物(tradp-uf)(10μm)2μl
[0053]
基因及下游片段的下游引物(tradp-dr)(10μm)2μl
[0054]
第一步pcr产物4μl
[0055]
加超纯水17μl。
[0056]
第二步pcr反应条件设置如下:
[0057][0058]
将pcr产物进行凝胶电泳验证,将正确的融合片段切胶回收用于后续实验验证。
[0059]
3、njau4742原生质体制备:
[0060]
按要求配制200ml溶液a(含1.2m山梨醇和0.1mkh2po4,ph5.6)、100ml溶液b(含1m山梨醇、50mmcacl2和10mmtris-hcl,ph7.5)和100mlpeg溶液(含25%peg6000、50mmcacl2和10mmtris-hcl,ph7.5)。njau4742原生质体制作分如下5步完成:
[0061]
1)将50μlnjau4742新鲜孢子悬液均匀涂布于覆盖有玻璃纸cellophane的pda培养基上,每个菌株准备5份,于28℃黑暗培养约16h;
[0062]
2)将带有刚萌发菌丝的玻璃纸小心撕下,浸泡于含4ml无菌的细胞壁酶裂解液(由20ml溶液a和0.15g贵州木霉细胞壁裂解酶配制)的90mm平皿中,继续加入3-4张玻璃纸,每隔一张玻璃纸加4ml酶裂解液,将平皿置于28℃、100rpm条件下孵育约2h(可在孵育1h后用镊子将团聚在一起的菌丝小心拨开);
[0063]
3)取出平皿,弃去玻璃纸,用移液枪反复吸打细胞酶解液以助菌丝分开;
[0064]
4)吸取细胞酶解液,用带有玻璃丝的无菌滤头滤去菌丝,可用少量溶液a冲洗菌丝,收集约30ml滤液于50ml无菌离心管中(冰上操作);
[0065]
5)在4℃、2000rpm条件下离心10min,弃去上清液,用0.5-1ml溶液b复溶细胞沉淀,即获得木霉原生质体,置于冰上待用。
[0066]
4、过表达融合片段转化
[0067]
tradp过表达融合片段转化主要分为以下五个步骤进行:
[0068]
1)吸取njau4742原生质体悬液200μl于2ml离心管中,离心管置于冰上;向其中加入20μltradp基因过表达融合片段,50μlpeg溶液,小心混匀至peg完全溶解,冰上静置20min;
[0069]
2)室温下加入2mlpeg溶液,轻轻混匀,静置5min后加入3ml溶液b,轻轻混匀,室温下静置待用;
[0070]
3)吸取200-500μl上述混合液至含1m蔗糖的pda平皿(90mm)中,涂布均匀,于28℃黑暗培养12-16h;
[0071]
4)次日,在该pda(含1m蔗糖)培养基上小心倒入一层厚度约2-3mm的含200μg/ml潮霉素b的pda(不含1m蔗糖)培养基,在28℃黑暗条件下继续培养24-48h,直至含潮霉素b的pda平皿上长出小的木霉突变子菌落。
[0072]
5、tradp基因过表达菌株筛选验证
[0073]
1)用无菌枪头挑取各个转化子菌丝若干,分别置于含20μldilutionbuffer(phireplantdirectpcrmastermix试剂盒,thermoscientific)的pcr管中,用枪头稍微压打菌丝,破壁释放gdna;
[0074]
2)在tradp基因上游1250bp处设计验证上游引物e-tradp,在hygb基因3’端下游500bp处设计下游引物为e-hygb;
[0075]
3)pcr跑胶验证;pcr体系设置如下:
[0076]2×
phireplantdirectpcrmastermix——10μl
[0077]
引物e-tradp——1μl
[0078]
引物e-hygb——1μl
[0079]
上述含dna的dilutionbuffer——0.5μl
[0080]
加超纯水至20μl。
[0081]
pcr反应设置如下:
[0082][0083]
所用引物见表1:筛选过表达转化子用引物对e-tradp/e-hygb,目的片段长度分别≈1.6kb;将菌落pcr验证为阳性的转化子置于28℃光照条件下继续培养,直至产孢;收集各阳性转化子孢子,稀释涂布于含200μg/ml潮霉素b的pda平皿(90mm)中培养16-24h,孢子萌发后进行单胞分离,纯化菌株至新的pda平皿(60mm)中培养,每个转化子分离5-6个单株;在
含有潮霉素的抗性平板上培养转化子后收集菌体,提取转化子菌丝总rna并反转录成 cdna,利用荧光定量pcr技术定量目的基因的在不同处理中的表达量,筛选出基因表达量显著上调的菌株为目标转化子。荧光定量pcr使用sybr premix ex taq ii(rr820a,takara, dalian,china)和cfx connecttm real-time system(bio-rad,hercμles,usa)进行。目标基因的转录水平通过2-δct
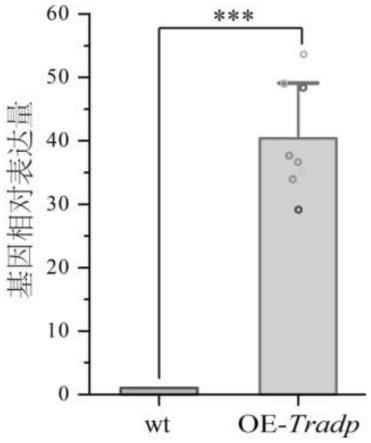
方法进行标准化,njau 4742中的翻译延伸因子1α基因(elongation factor 1 alpha,tef)被用作靶基因定量的内参基因。将通过同源重组和基因表达定量验证的阳性突变子备份保存至-80℃。tradp基因过表达所用引物(q-adp-f/q-adp-r)与内参基因所用引物 (tef-f/tef-r)在表1中列出,过表达突变株基因tradp的定量rt-pcr验证结果如图1所示,结果表明:与野生株相比,实验选择的oe-adprase菌株的adprase基因的转录水平显著提高。
[0084]
表1 tradp基因过表达及验证所用引物
[0085][0086][0087]
实施例3逆境下njau 4742野生株和突变株分解农作物秸秆能力验证
[0088]
njau 4742野生株和突变株菌丝的制备:将储存在-80℃冰箱中的njau 4742野生型wt 及tradp基因过表达菌株oe-tradp孢子液,吸取2.5μl接种于pda固体平板,28℃光照培养 3天后,在萌发的菌落边缘用打孔器获取同样大小的菌块备用;
[0089]
njau 4742野生株和突变株孢子液的制备:将野生型wt及oe-tradp孢子液接种于pda 培养基,28℃光照培养4-5天,直至产孢。在培养基上加入5ml无菌水冲洗,用4层无菌纱布过滤到无菌离心管中,通过血球计数板稀释至108孢子/ml浓度备用;
[0090]
按照以下要求配制三种培养基备用:无机盐培养基:1.4g(nh4)2so4,2.0g kh2po4,0.3 cacl2,0.3g mgso4,5mg feso4·
7h2o,20mg cocl2,1.6mg mnso4和1.4mg znso4,定容至1 l。稻草粉固体平板培养基:将1.5%秸秆粉末、1.5%的琼脂粉加入无机盐培养基中充分
混匀,灭菌。稻草粉固体发酵培养基:将25%的秸秆粉末、1%的秸秆小段(1-2cm)加入无机盐培养基中充分搅拌混匀,灭菌。
[0091]
对于逆境(热胁迫)下野生型wt和突变株利用农作物秸秆能力的表型鉴定,利用打孔器均匀地收集wt及突变株的菌块并接种于稻草粉固体平板培养基上,37℃条件下稻草粉固体平板培养基上避光培养48h后观察表型,用佳能eos 600d相机拍照记录。如图2所示,在pda 平板上培养3天后,过表达突变株与wt之间无论生长速度还是菌丝形态并未出现明显差异。然而,在逆境37℃下,以稻草为唯一碳源培养48h后,过表达突变株表现出较wt更好的生长状态和更大的生物量。
[0092]
将制备好的wt及oe-tradp孢子液稀释到107孢子/ml,取1ml接种于稻草粉固体发酵培养基中,在37℃培养箱中分别培养4天。发酵结束后向发酵产物中加入20ml去离子水,在28℃,170rpm条件下充分摇晃2h。收集通过去离子水稀释的发酵产物,以12000rpm离心10min,取发酵液上清作为粗酶液,待测。
[0093]
滤纸酶活力(fpa)测定:取50μl粗酶液,分别加入500μl 50mm的醋酸缓冲液和450 μl去离子水,并将两个滤纸小圆片(whatman no.1滤纸,用打孔器获取滤纸小圆片,两片约 10mg)加入2ml离心管中,50℃水浴反应20min后加入1ml的dns试剂,沸水浴10min 后冷却,在od 520nm波长处测定吸光度值。以灭活的粗酶液做空白对照。将每1min产生1 μmol的还原糖定义为1个酶活单位(u)。
[0094]
内切葡聚糖酶活力(eg)测定:取480μl 0.5%羧甲基纤维素溶液(cmcna)加入2ml 离心管中,再加入500μl 50mm的醋酸缓冲液,最后加入20μl粗酶液,混合后,保证50℃水浴反应10min,然后将1ml的dns试剂加入,沸水浴10min后冷却,在od 520nm处测定吸光度值。以灭活的粗酶液做空白对照。将每1min产生1μmol还原糖定义为1个酶活力单位(u)。
[0095]
外切葡聚糖酶活力(cbh)测定:取10μl 5mm的pnpc加入到96孔板中,加入40μl 粗酶液和50μl 50mm的醋酸缓冲液,同时使用灭活的粗酶液进行空白对照,将96孔板在50℃水浴中反应10min,并通过添加100μl的1m的na2co3溶液终止反应。在402nm下测定吸光度值。根据标线计算出对硝基酚的含量。以每分钟酶解pnpc以获得1μmol对硝基酚所需的酶量为一个单位酶活力。
[0096]
木聚糖酶活力(xyl)测定:取0.2ml粗酶液加入到1ml木聚糖,再加0.8ml醋酸缓冲液,同时以灭活的粗酶液做空白对照,50℃条件下水浴30min。取出后加入0.5ml 0.3mol/lhcl终止反应,再用0.1ml 2.5mol/l的k2co3中和,再加入2ml dns水浴10min后定容到 25ml。最后用酶标仪读取520nm处的吸光值。根据标线计算还原糖的含量。以每分钟分解木聚糖以获得得到1μmol还原糖所需的酶量为1个酶活力。
[0097]
以在100℃水浴灭活5min的粗酶液为对照溶液,其余步骤相同。
[0098]
葡萄糖标准曲线的绘制:将不同体积的葡萄糖标准溶液、去离子水和dns试剂加入各离心管中混匀,将各离心管同时置于沸水浴中反应10min,冷却后在od 520nm下测定吸光度值,以葡萄糖含量为横坐标,od值为纵坐标,绘出葡萄糖的标准曲线。
[0099]
对硝基酚标准曲线的绘制:将不同体积的对硝基酚的标准溶液(1mg/ml)、去离子水和 na2co3溶液分别加入96孔板中,混匀后在402nm下测吸光度值,使用对硝基酚含量和od 值分别为横坐标和纵坐标,绘制对硝基酚的标准曲线。
[0100]
野生型wt及过表达突变株的秸秆降解相关的木质纤维素酶活力结果如图4所示。
与wt 相比,突变株oe-tradp中的fpa、eg、cbh和xyl活性相应提高了1.94倍、1.76倍、1.18 倍和1.39倍。这充分说明tradp过表达后能显著提高njau 4742逆境下固体发酵过程中木质纤维素酶的分泌,进而能够更高效地对农作物秸秆进行降解利用。
[0101]
如上所述,稻草粉底物中加入njau 4742野生型及突变子孢子液固体发酵4天后,收集发酵样品充分混合均匀,用土壤dna试剂盒(mobio)提取样品的dna。用njau 4742基因组dna片段的荧光定量的拷贝数作为衡量其生物量的标准,具体操作如下:
[0102]
先将来自njau 4742基因组的300bp的特异性片段克隆到pmd19-t载体(takara)上作为标准质粒,调整质粒模板的浓度并根据基因片段荧光定量的结果绘制标准曲线。njau4742基因片段拷贝数采用sybr premix ex taq ii(rr820a,takara,大连,中国)测定,在 cfx connect real-time system(bio-rad,hercules,美国)上运行。基因拷贝数由标准曲线根据每个样品的ct值计算得到,结果以每克发酵底物拷贝数的对数值表示(log
10
拷贝
·
g-1
底物)。结果表示为三个重复的平均值
±
标准偏差,用于构建特异性片段及量化的基因引物在表1 中列出(4742-f/4742-r)。野生型及过表达突变株基因拷贝数结果如图3所示。根据rt-pcr 分析,固体发酵第四天过表达突变株基因拷贝数达到1
×
10
7.66
,显著高于野生型1
×
10
5.95
,说明tradp基因过表达后显著提高了njau 4742逆境下固体发酵过程中的生物量。以上实验至少三个重复,数据分析利用误差
±
sds表示,*p《0.05,**p《0.01,***p《0.001。
[0103]
实施例4逆境下基因tradp在njau 4742农作物秸秆利用过程中的调控
[0104]
接种njau 4742菌株野生型孢子悬液和突变株孢子悬液至pda培养基上28℃静置培养三天。用打孔器均匀地收集野生型及突变株的菌块并接种于稻草粉固体培养基上,注意提前在固体培养基表面覆盖一层灭菌的玻璃纸(cellophane),在37℃下培养三天后从玻璃纸上小心的刮下木霉菌丝体。收集的菌体液氮冷冻后用rneasy plant mini kit提取总rna,使用 revertaid
tm first strand cdna kit合成第一链cdna作定量分析(qtower,jena analytics)。采用sybr premix ex taq ii(rr820a,takara,大连,中国)测定,在cfx connect real-timesystem(bio-rad,hercules,美国)上运行。基因的转录水平通过2-δct
方法标准化,基因翻译延伸因子1α(translation elongation factor 1alpha,tef)被用作内参基因。实验至少三个重复,数据分析利用误差
±
sds表示,*p《0.05,**p《0.01,***p《0.001。
[0105]
为了剖析逆境下njau 47472中基因tradp调控木质纤维素酶分泌的分子机制。我们检测了一些代表性的木质纤维素酶基因(基于蛋白组学分析)及木质纤维素酶分泌密切相关的调节因子(cre1、ace1、xyr1和ire)的表达水平。代表性的木质纤维素酶基因包括r-egl(内切-1,4-β
‑ꢀ
葡聚糖酶,opb37031)、r-cbh(纤维二糖水解酶,opb45635)、r-bgl(β-葡萄糖苷酶,kkp01743) 和r-xyl(内切-1,4-β-木聚糖酶,opb45659)。用于量化的基因引物在表2中列出。如图5,6 所示,关键的木质纤维素酶基因和调节因子(cre1、ace1和xyr1)的表达水平在突变株oe-tradp 和野生型wt之间没有显著差异。相比之下,与野生型wt相比,突变株oe-tradp中ire的表达水平增加了3.12倍(p《0.001)。一般来说,热应激可引起严重的内质网应激,而ire是缓解内质网应激的关键调控因子。因此,我们猜测基因tradp可能通过调节ire的转录水平增强热应激下内质网的折叠能力从而调节木质纤维素酶的分泌。
[0106]
表2木质纤维素酶基因及其调控因子定量引物
[0107][0108]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1