水稻直链淀粉含量基因ACF1等位基因的分子标记及其检测的引物和方法
水稻直链淀粉含量基因acf1等位基因的分子标记及其检测的引物和方法
技术领域
1.本发明涉遗传学和植物育种领域,具体为一种筛选低直链淀粉含量基因acf1等位基因型水稻的分子标记、扩增或检测分子标记的引物以及检测方法,用于辅助常规育种快速、简便、准确选育低直链淀粉含量水稻。
背景技术:
2.水稻是最重要的粮食作物之一,提高产量和品质一直是水稻遗传育种的两个关键目标。过去几十年,由于杂交稻的推广以及水稻栽培和管理技术水平的提高,水稻产量已得到极大提升,而稻米品质改良却远远落后(zeng et al.,2017,plant molecular biology,65:501-509; zhao et al.,2017,indian journal of genetics and plant breeding,77,221)。同时,随着人们生活水平的提高,人们对稻米品质的要求也越来越高。因此提高稻米品质成为育种家和消费者首要考虑的因素。稻米品质主要包括碾米品质、外观品质、营养品质和食味品质,其中食味品质是稻米品质的核心(tian et al.,2009,proceedings of the national academyof sciences of the united states of america,106(51):21760-21765)。
3.淀粉是稻米的主要成分,约占精米干重的90%左右,由直链淀粉和支链淀粉组成。直链淀粉与总淀粉的比值,也称为直链淀粉含量 (amylose content,ac),是决定稻米食味品质的最重要因素(tianet al.,2009,proceedings of the national academy of sciences of theunited states of america,106(51):21760-21765)。由于较低直链淀粉含量的软米食味品质好,甜润爽口,冷热饭均蓬松,质软,冷后不回生。软米的价格普遍高于非软米香水稻品种。随着人们生活水平的提高,目前市场对软米香米的需求量日益增加。这些都极大地促进了人们对水稻软米香型特性的遗传研究,同时也加快了软米香稻新品种的选育进程。
4.水稻gbss i是稻米直链淀粉合成的关键酶,由6号染色体上的 wx基因编码。在自然界中,wx至少存在10种不同等位基因型,包括wxa、wxb、wx
mq
、wx
hp
、wx
mp
、wx
op
、wx
in
、wx
lv
、wx
mw
和wx,具有不同基因型的稻米直链淀粉含量不同(zhang et al;2019, molecular plants 12,1157-1166;zhang et al;2020,journal of integrativeplant biology.63:889-901)。其中wx
mq
基因型水稻直链淀粉较低,已被广泛用于优质软米水稻培育。然而目前用于优质水稻培育的直链淀粉含量相关基因只有wx基因被报道。本研究组前期从优质软米水稻“银香38”品种中克隆了一个新的控制直链淀粉含量的基因acf1,其编码一个新的c2h2锌指蛋白(cn113637688a,公开日)。
5.软米水稻的产量通常较低,需要与其他水稻杂交获得产量更高的品种。一般都选择产量较高的非软米水稻与软米水稻进行杂交,然后再将杂交f1植株与高产的非软米水稻回交几代。过去在较低直链淀粉含量软米传统育种过程中,育种者主要通过直链淀粉含量测定来区分软米水稻和非软米水稻。但该方法费时且检测费用非常昂贵。随着各种分子标
记的发展,许多重要农艺性状和品质性状的分子标记被开发用于水稻育种。
6.因此,需要提供一种分子标记、相应的引物和检测方法来辅助培育和筛选粳米水稻中的软米水稻和非软米水稻。
技术实现要素:
7.本发明提供了一种筛选水稻直链淀粉含量基因acf1等位基因型的分子标记dcaps(maeii)以及检测该分子标记的引物及方法,能够快速并准确地鉴定acf1基因不同等位基因型。可用来辅助培育筛选软米水稻。
8.经过基因序列分析发现,相比于“日本晴”水稻,“银香38”软米水稻acf1在编码区655bp处存在一个g-a的突变,该突变导致“银香 38”大米具有低直链淀粉含量的特性,即acf1编码区655bp处g-a 变异与低直链淀粉含量呈对应关系。即acf1
655a
等位基因型粳稻稻米直链淀粉含量较低,为软米水稻,而acf1
655g
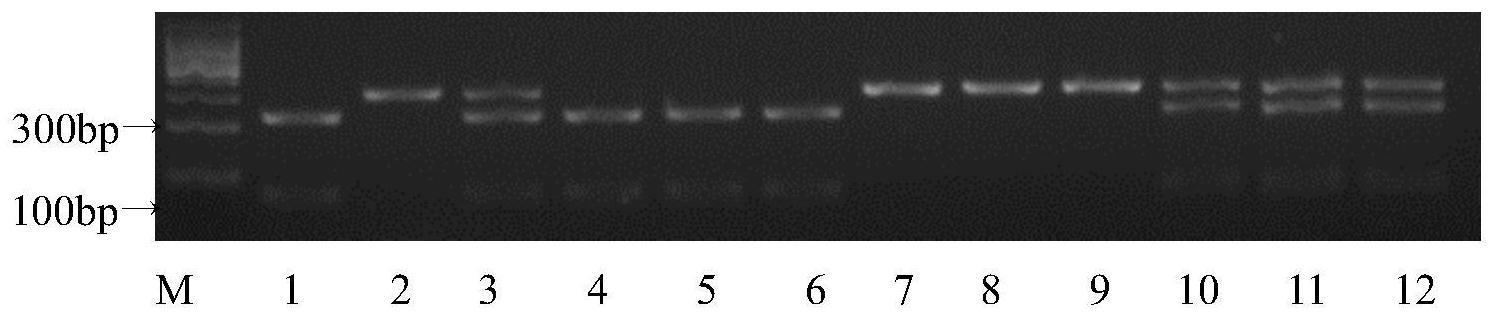
等位基因型水稻直链淀粉含量相对较高,为非软米水稻。
9.本发明的技术方案:
10.一种水稻低直链淀粉含量基因acf1的分子标记(以下简称 dcaps(maeii)),在软米水稻中,其acf1基因编码区655bp-658bp 处为acgt;非软米水稻中,acf1基因编码区655bp-658bp处为 gcgt。
11.分子标记dcaps(maeii)位于直链淀粉含量基因acf1编码区 655bp-658bp处。在低直链淀粉含量的软米水稻中,该位点的4个核苷酸序列“acgt”能够被限制性核酸内切酶maeii识别并剪切,而中直链淀粉含量普通粳稻c2h2锌指蛋白基因acf1
655g
编码区655bp
‑ꢀ
655bp处的核苷酸序列为“gcgt”,不能被限制性核酸内切酶maeii识别并剪切,由此可以快速和准确地区分软米粳稻和非软米粳稻品种中的acf1
655a
基因型和acf1
655g
基因型。
12.用于扩增和检测上述新的分子标记dcaps(maeii)或者扩增和检测水稻直链淀粉含量基因acf1等位基因的引物,其核苷酸序列包括 seq id no.1和seq id no.2。更优选的,其核苷酸序列如seq id no.1和seq id no.2所示。
13.seq id no.1:5
’‑
gaatctcgacgggttcaagt-3’14.seq id no.2:5
’‑
tcttattgtctgctctgacatgg-3’15.检测水稻直链淀粉含量基因acf1等位基因的方法包括如下步骤:
16.(1)提取水稻基因组dna作为模板(可采用ctab法),加入上述2种引物进行pcr扩增;
17.(2)pcr产物用maeii进行酶切反应。
18.(3)取酶切产物用凝胶电泳检测。
19.优选的,步骤(1)中,pcr扩增程序为:93~95℃预变性4~7min;93~95℃变性42~50s、51~54℃退火42~50s、70~73℃延伸25~35s,共30~35个循环;最后70~73℃延伸9~12min。更优选的,pcr扩增程序为:94℃预变性5min;94℃变性45s、52℃退火45s、72℃延伸30s,共32个循环;最后72℃延伸10min。
20.优选的,步骤(3)中,在2.5~3.5%的琼脂糖凝胶中进行电泳检测;更优选用3%的琼脂糖凝胶进行电泳检测。
21.检测结果显示,含有acf1
655a
软米等位基因型水稻均含有分子量分别约为231bp和
82bp的两条带,而含有acf1
655g
非软米等位基因型水稻都含有分子量约为333bp的条带。上述方法可用于筛选鉴定分别含有acf1
655a
软米等位基因型水稻与含有acf1
655g
非软米等位基因型水稻杂交后代,以及分别含有acf1
655a
软米等位基因型水稻与含有acf1
655g
非软米等位基因型水稻自交后代,或者分别含有 acf1
655a
软米等位基因型水稻与含有acf1
655g
非软米等位基因型水稻回交的后代。所检测的水稻为含有acf1
655a
软米等位基因型水稻、含有acf1
655g
非软米等位基因型水稻、含有acf1
655a
软米等位基因型水稻与含有acf1
655g
非软米等位基因型水稻的杂交后代及其再自交或回交后代。
22.如模板总dna由纯合acf1
655a
软米等位基因型水稻提取,酶切后的产物均含有分子量分别约为231bp和82bp的两种条带。如模板总dna由acf1
655g
非软米等位基因型水稻提取,酶切后的产物均含有分子量约为313bp的条带。
23.如模板总dna由acf1
655a
软米等位基因型水稻与acf1
655g
非软米等位基因型水稻杂交后代的杂合子水稻提取,酶切后的产物均含有分子量约为313bp、231bp和82bp的三种条带。
24.如模板总dna由acf1
655a
软米等位基因型水稻与acf1
655g
非软米等位基因型水稻杂交f1植株再自交的后代水稻提取,不同植株酶切后的产物应该有三种类型的带型:对于纯合型acf1
655a
软米水稻含有分子量约为231bp和82bp两种条带;对于杂合子含有分子量约为4313bp、231bp和82bp三种条带;对于纯合型acf1
655g
非软米型水稻含有分子量约为313bp一种条带。
25.如模板总dna由acf1
655a
软米等位基因型水稻与acf1
655g
非软米等位基因型水稻杂交f1植株再与非软米等位基因型水稻回交的后代水稻提取,不同植株酶切后的产物应该有两种类型的带型:纯合 acf1
655g
非软米等位基因型水稻含有分子量约为313bp一种条带;杂合子含有分子量约为4313bp、231bp和82bp三种条带。
26.通过上述方法可用于鉴别软米水稻、非软米水稻以及软米水稻与非软米水稻的杂交品种。
27.所述的软米水稻包括银香38及其与非软米水稻的杂交品种;
28.优选的,软米水稻与非软米水稻的杂交品种,其亲本非软米水稻为纯合acf1
655g
非软米等位基因型水稻,即采样上述方法检测后只显示一条313bp条带的非软米水稻。所述的非软米水稻包括但不限于:“日本晴”、“嘉花1号”、“秀水134”、“秀水123”、“秀水114”、“嘉禾218”、“中植抗2号”、“光明粳3号”、“武香粳14”、“武运2645”、“9522”、“上师大5号”、“中花11”、“保农34”、“繁14”和“繁26”。
29.本发明提供了一种针对直链淀粉含量基因acf1 655bp处g/a 变异的选择性分子标记,对选育含有acf1
655a
等位基因的软米水稻非常有实用价值。
30.采用本发明的方案,通过鉴定acf1
655a
软米等位基因型的分子标记,从而检测acf1等位基因,对回交后代进行检测,选取含有 acf1
655a
软米等位基因的杂合植株继续与非软米水稻回交。因此,对于作为鉴定软米基因的分子标记位点,应该能够区别出作为亲本的软米水稻和软米水稻分别具有的acf1
655a
软米等位基因和acf1
655g
非软米等位基因。
31.对于非软米水稻锌指蛋白基因acf1编码区655bp位点是否是腺嘌呤脱氧核苷酸(a)的鉴定,可确定在使用本发明的软米基因 acf1分子标记dcaps(maeii)进行新的软米水稻新品种培育的辅助筛选时,有哪些非软米水稻品种适合被选作非软米亲本。
32.本发明的有益效果在于,所提供dcaps(maeii)分子标记及其检测引物和检测方法操作简便,结果容易判断。采用本发明方案对 acf1
655a
等位基因和acf1
655g
等位基因进行检测,只需要使用3%左右琼脂糖凝胶就能很容易分辨,不但可以快速、方便地鉴定软米水稻。与非软米水稻,还可以快速鉴定杂交、回交、自交子代中的acf1
655a
基因型和acf1
655g
基因型,对软米水稻的培育和筛选有重要的应用价值。
附图说明
33.图1为实施例1中1种acf1
655a
软米等位基因型水稻、1种 acf1
655g
非软米等位基因型水稻、以及它们杂交的f1植株和f1自交产生的f2植株acf1基因型的鉴定图。其中m1为100bp类型的标准分子量dna;第1泳道为软米水稻“银香38”植株pcr扩增后的酶切产物,含有分子量约231bp和82bp两种条带;第2泳道为非软米水稻“嘉花1号”植株pcr扩增后的酶切产物,含有分子量约313bp 一条带;第3泳道为“银香38”与“嘉花1号”杂交f1植株pcr扩增后的酶切产物,含有分子量分别约为313bp、231bp和82bp三条带;第 4-6泳道为f2群体中含有纯合acf1
655a
软米等位基因型水稻,含有分子量约231bp和82bp两种条带;第7-9泳道为f2群体中含有纯合 acf1
655g
非软米等位基因型水稻,含有分子量约313bp一条带;第10
‑ꢀ
12泳道为f2群体中含有acf1
655a
acf1
655g
杂合基因型水稻,含有分子量分别约为313bp、231bp和82bp三条带。
34.图2为实施例2中,acf1
655a
软米等位基因型水稻“银香38”和 14种acf1
655g
非软米等位基因型水稻的acf1基因鉴定图。m1为 250bp类型标准分子量dna;第1泳道为“银香38”,含有分子量约 231bp和82bp两种条带;第2泳道到第15泳道分别为14种acf1
655g
非软米等位基因型水稻品种:“秀水134”、“秀水123”、“秀水114”、“嘉禾218”、“中植抗2号”、“光明粳3号”、“武香粳14”、“武运 2645”、“9522”、“上师大5号”、“中花11”、“保农34”、“繁14”和“繁26”植株pcr扩增后的酶切产物,均含有分子量约为313bp的一条带。
具体实施方式
35.实施例1能够鉴定直链淀粉含量基因acf1等位基因型分子标记的建立及检测方法
36.具有低直链淀粉含量的水稻“银香38”为软米水稻品种,具有中等直链淀粉含量的水稻“嘉花1号”为普通粳稻品种。
37.提取了2种水稻基因组dna,克隆了这2种水稻与稻米直链淀粉含量相关的锌指蛋白基因acf1序列,并进行了测序分析,同时查看了已公布在genbank中非软米水稻“日本晴”的acf1基因序列 (loc_os06g48530),相对于“日本晴”和“嘉花1号”的acf1序列,“银香38”acf1编码区655bp处发生g-a的突变。软米水稻“银香 38”acf1基因编码区655bp-658bp处为acgt,能够作为限制性核酸内切酶maeii酶识别和剪切的序列。而非软米水稻“日本晴”和“嘉花1 号”acf1基因编码区655bp-658bp处为gcgt,不能作为限制性核酸内切酶maeii酶识别的位点。由此建立一个能够鉴定acf1基因不同等位基因型的分子标记:dcaps(maeii)。
38.在水稻锌指蛋白acf1基因编码区655bp-658bp序列的两端分别设计一对上、下游引物,核苷酸序列分别为seq id no.1和seq idno.2所示。
39.seq id no.1:5
’–
gaatctcgacgggttcaagt-3’;
40.seq id no.2:5
’–
tcttattgtctgctctgacatgg-3’。
41.以具有低直链淀粉含量的水稻“银香38”为软米水稻品种,以具有中等直链淀粉含量的水稻“嘉花1号”为普通粳稻品种,以及软米水稻“银香38”与非软米水稻“嘉花1号”杂交的f1植株为材料,提取水稻基因组总dna为模板,采样上述引物进行扩增检测。方法如下:
42.(1)提取水稻基因组dna作为模板(可采用ctab法),加入上述2种引物进行pcr扩增;
43.pcr扩增程序为:94℃预变性5min;94℃变性45s、52℃退火 45s、72℃延伸30s,共32个循环;最后72℃延伸10min;
44.(2)pcr产物用maeii进行酶切反应;
45.反应体系为:10快酶反应缓冲液(购自fermentas公司)2ul, pcr产物14ul(≤0.2g),maeii快酶(购自fermentas公司)1ul(10 个酶活单位),灭菌水13ul。反应条件为:65℃水浴4小时;
46.(3)取酶切产物,在3%的琼脂糖凝胶中进行电泳检测。
47.再将具有acf1
655a
基因型的软米水稻“银香38”与具有acf1
655g
基因型的非软米水稻“嘉花1号”杂交的f1植株自交,得到自交f2植株,提取总dna,用同样的方法进行pcr扩增、酶切和电泳检测。
48.结果如图1所示,其中m1为100bp类型的标准分子量dna;第1泳道为软米水稻“银香38”植株pcr扩增后的酶切产物,含有分子量约231bp和82bp两种条带;第2泳道为非软米水稻“嘉花1号”植株pcr扩增后的酶切产物,含有分子量约313bp一条带;第3泳道为“银香38”与“嘉花1号”杂交f1植株pcr扩增后的酶切产物,含有分子量分别约为313bp、231bp和82bp三条带;第4-6泳道为f2 群体中含有纯合acf1
655a
软米等位基因型水稻,含有分子量约231bp 和82bp两种条带;第7-9泳道为f2群体中含有纯合acf1
655g
非软米等位基因型水稻,含有分子量约313bp一条带;第10-12泳道为f2 群体中含有acf1
655a
acf1
655g
杂合基因型水稻,含有分子量分别约为 313bp、231bp和82bp三条带。
49.结果显示,具有acf1
655a
基因型的软米水稻“银香38”含有分子量分别约为231bp和82bp的条带,具有acf1
655g
基因型的非软米水稻“嘉花1号”含有分子量约313bp的条带,杂交的f1植株都含有分子量分别约为313bp、231bp和82bp的条带。
50.具有acf1
655a
基因型的软米水稻“银香38”与具有acf1
655g
基因型的非软米水稻“嘉花1号”杂交的f1植株自交,得到自交f2植株。从检测结果显示两种组合的自交后代都有三种不同基因型的植株,其中dna分子量只有约231bp和82bp两条带对应于自交后代acf1
655a
基因型纯合植株pcr产物,具有约313bp、231bp和82bp三条带对应于自交后代软米基因acf1杂合植株pcr产物,只有313bp一条带对应于自交后代acf1
655g
基因型纯合非软米植株pcr产物(如图 1)。
51.我们还使用了0.2%ki溶液对f2植株的种子胚乳进行染色。直链淀粉含量为15-20%的普通粳稻种子胚乳染色结果深蓝色,而直链淀粉含量约9%的软米水稻种子胚乳染色结果淡红棕色。而取每一颗 f2植株收的f3种子24粒,用锋利刀片把胚乳切开,加入0.2%ki溶液,室温下染色2-3min,然后逐一观察胚乳染色情况。由于低直链淀粉含量软米性状属于隐性性状,对于出现313bp条带的纯合非软米植株24粒种子胚乳染色结果都为深蓝色,对于同时出现313bp、231bp 和82bp三条带的杂合植株24粒种子胚乳染色结果为3/4种子胚乳为深蓝色,1/4种子胚乳为淡红棕色,只有出现231bp和82bp两条带的植株24粒种子胚乳染
色结果全部为淡红棕色。也就是说,得到的 acf1
655a
纯合子子代全部为软米水稻。
52.使用dcaps(maeii)分子标记和0.2%ki溶液两种方法的检测结果,与遗传分离规律中的一对基因自交预期结果完全一致。由此表明,使用本发明建立的dcaps(maeii)分子标记及检测方法,能够有效区别软米水稻acf1
655a
和非软米水稻acf1
655g
两种基因型。
53.实施例2具有acf1
655g
基因型的非软米水稻dcaps(maeii)分子标记的鉴定
54.由于大多软米水稻的产量都较低,因此在利用分子标记辅助选育新的软米水稻中,一般都选择产量较高的非软米水稻与软米水稻进行杂交,然后再将杂交f1植株与高产的非软米水稻回交几代,在每次回交前,需要使用鉴定acf1
655a
软米等位基因型的分子标记对回交后代进行检测,选取含有acf1
655a
软米等位基因的杂合植株继续与非软米水稻回交。因此,对于作为鉴定软米基因的分子标记位点,应该能够区别出作为亲本的软米水稻和软米水稻分别具有的acf1
655a
软米等位基因和acf1
655g
非软米等位基因。
55.对于非软米水稻锌指蛋白基因acf1编码区655bp位点是否是腺嘌呤脱氧核苷酸(a)的鉴定,可确定在使用本发明的软米基因acf1分子标记dcaps(maeii)进行新的软米水稻新品种培育的辅助筛选时,有哪些非软米水稻品种适合被选作非软米亲本。
56.在实施例1中,我们选用的“嘉花1号”为非软米水稻,使用本发明的dcaps(maeii)分子标记及检测方法,对它们的基因组dna进行鉴定,结果它们都显示一条313bp的条带,表明“嘉花1号”非软米水稻的锌指蛋白基因acf1的pcr产物都不能被maeii剪切,说明它们在锌指蛋白基因acf1编码区655bp位点不是腺嘌呤脱氧核苷酸(a),从而也表明利用本发明设计的dcaps(maeii)分子标记,能够用于鉴定这“嘉花1号”非软米水稻与具有acf1
655a
基因型的软米水稻杂交培育新的软米水稻新品种,也就是说“嘉花1号”非软米水稻品种适合被作为非软米亲本进行新的软米型水稻新品种的选育。为了探索是否有更多的非软米水稻在培育新的软米水稻新品种时,也适合使用本发明的dcaps(maeii)分子标记进行检测。
57.我们又另外选取了目前大多在上海市等周边地区主栽的14种重要的非软米粳稻:“秀水134”、“秀水123”、“秀水114”、“嘉禾218”、“中植抗2号”、“光明粳3号”、“武香粳14”、“武运2645”、“9522”、“上师大5号”、“中花11”、“保农34”、“繁14”和“繁26”,使用dcaps (maeii)分子标记对这14种非软米水稻进行鉴定。
58.结果如图2所示,m1为250bp类型标准分子量dna;第1泳道为“银香38”,含有分子量约231bp和82bp两种条带;第2泳道到第15泳道分别为14种acf1
655g
非软米等位基因型水稻品种:“秀水 134”、“秀水123”、“秀水114”、“嘉禾218”、“中植抗2号”、“光明粳3号”、“武香粳14”、“武运2645”、“9522”、“上师大5号”、“中花 11”、“保农34”、“繁14”和“繁26”植株pcr扩增后的酶切产物,均含有分子量约为313bp的一条带。
59.上述结果显示,这些非软米水稻与在实施例1中的“嘉花1号”非软米水稻一样,也都含有313bp条带。也就是说,上述非软米水稻的 acf1编码区第655位核苷酸为g,为acf1
655g
基因型,使用上述 dcaps(maeii)分子标记对使用这些非软米水稻进行鉴定也是合适的,同时将上述水稻品种作为非软米亲本进行新的软米水稻新品种选育也是适合的。也就是说,本发明的dcaps(maeii)分子标记、引物及检测acf1等位基因的方法,对使用这些非软米水稻作为非软米亲本进行新的软米水稻新品种选育也是适合的。
60.因此,我们建议育种家在使用本发明dcaps(maeii)分子标记辅助选育新的软米水稻育种前,最好能够提前使用本发明简便的操作方法对用作亲本的非软米水稻进行鉴定,
如鉴定结果只显示一条313bp 条带的,即表明是适合被选为非软米亲本使用范围的水稻品种。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1