长链烷基酯胺类化合物及其制备方法和在核酸递送方面的应用与流程
1.本发明属于医药技术领域,具体地说,本发明涉及长链烷基酯胺类化合物及其制备方法和在核酸递送方面的应用。
背景技术:
2.通过体外转录技术合成的核酸,借助酯质纳米颗粒递送系统运送到组织细胞内,由自身细胞非翻译系统翻译出目标蛋白,这些蛋白或是作为抗原激发免疫反应,或是补充细胞内缺少的蛋白以行驶功能,最终达到治疗的目的。基于核酸的治疗技术具有制备快速、成本低、安全等优点让它在众多的治疗方法中脱颖而出,被广泛应用于癌症、感染性疾病和罕见病治疗领域。然而,由于核酸本身不稳定,容易在体内被降解,稳定的递送系统的选择是该类药物研发的关键。
3.随着纳米脂质体技术的蓬勃发展,研究人员致力于开发新型的合成脂质以及提高脂质体的载药能力,于是阳离子脂质应运而生,用于有效转载带负电的药物,尤其是对于核酸类药物的递送备受关注。阳离子脂质一般有带正电的头部基团通过连接键(酰胺、酯、醚键)与疏水尾片段(胆固醇或脂肪链)相连组成,其结构是决定核酸类药物药效的重要因素。近年来,脂质分子得到了长足的发展,从永久的带电的阳离子脂质分子,如dotap、dogs(结构式如下所示)等,到可电离的阳离子脂质dlin-dma。在dlin-dma的基础上,修改链长度和取代位置得到了mc3(结构式如下所示)。全球首个sirna药物onpattro于2018年获批上市用于治疗甲状腺素蛋白淀粉样变性引起的神经损伤,这款药物中使用的关键脂质分子就是mc3。moderna biotech在mc3的基础上,优化获得氮原子上连接羟乙基的脂质分子sm-102(结构式如下所示),并将该化合物应用于covid-19的疫苗研发中,该疫苗于2020年12月8日获得fda授权。
[0004][0005]
阳离子递送分子
[0006]
虽然现在已经有部分阳离子递送分子用于疾病治疗或预防剂的递送,但是在递送核酸方面依然存在一些问题,例如稳定性和选择性不理想等,由此可见,发明新的递送分子尤为重要。
技术实现要素:
[0007]
本发明的目的之一是提供一系列长链烷基酯胺类化合物。
[0008]
本发明的又一目的是提供长链烷基酯胺类化合物的制备方法。
[0009]
本发明的又一目的是提供一种含有长链烷基酯胺类化合物的组合物。
[0010]
本发明的又一目的是提供长链烷基酯胺类化合物作为脂质分子在核酸递送方面的应用。
[0011]
术语定义
[0012]
在本文中用于本发明描述中的术语仅是为了描述具体实施方案而不作为对本发明的限制。本文所用命名和在本文所述的有机化学、药物化学、生物学中的实验室操作是本领域熟知的和常用的。除非另外提及,本文所用的全部技术和科学术语与本领域所属技术领域的一般技术人员通常所理解的具有相同的含义。
[0013]
如在本发明实施方案和所附权利要求的描述中所用,单数形式的“一”、“一种”、“该”“其
””
用于是指该冠词的单数和复数,除非上下文另外明确提及。例如,一种化合物包括一种或多于一种化合物。
[0014]
如本文所用,“和/或”是指和包括一或多个相关的所列项目的任意和所有可能的组合。
[0015]
如本文所用,术语“疾病”或“病患”是指身体状态或一些器官的任意改变,中断或干扰其功能的实施和/或引起症状。
[0016]
如本文所用,术语“治疗”目的是减轻或消除所针对的疾病状态或病症。如果受试者按照本文所述方法接受了治疗量的生物大分子或化学小分子,该受试者一种或多种指征和症状表现出可观察到的和/或可检测出的降低或改善,则受试者被成功地“治疗”了。还应当理解,所述的疾病状态或病症的治疗的不仅包括完全地治疗,还包括未达到完全地治疗,但实现了一些生物学或医学相关的结果。
[0017]
技术主题一
[0018]
本发明提供了具有如式i所示结构的长链烷基酯胺类化合物:
[0019][0020]
其中,x为c5-c12的直链烷烃。
[0021]
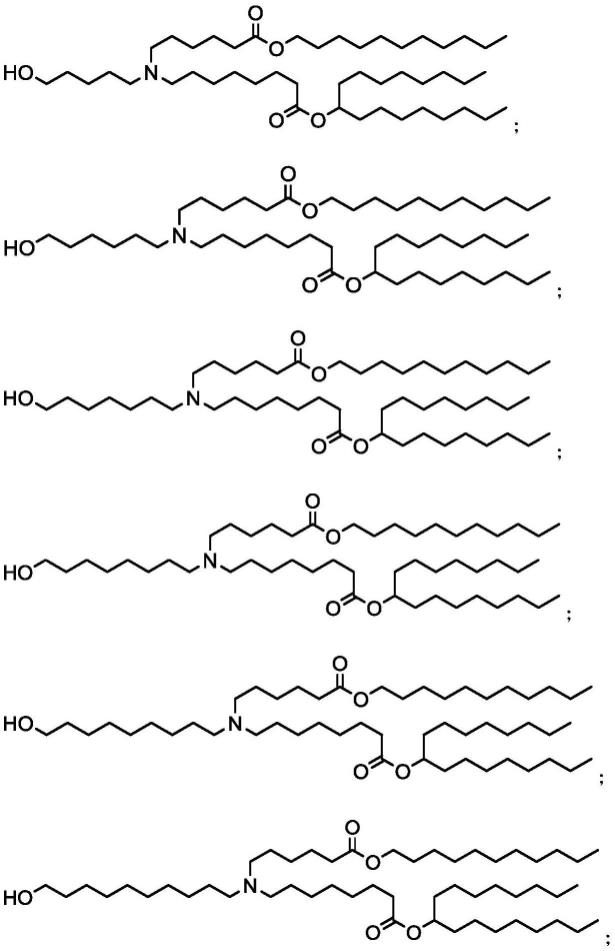
在本发明的一些优选实施方案中,所述化合物包括如下结构:
[0022][0023][0024]
技术主题二
[0025]
本发明还提供了式i所示化合物的合成方法,包括以下步骤:
[0026][0027]
步骤1:向化合物a的质子性溶剂的溶液中,加入oh-x-nh2和diea,加热反应12~36小时,加水稀释,乙酸乙酯萃取,纯化得到化合物b;
[0028]
步骤2:向化合物c的非质子性溶剂的溶液中,加入化合物b,碳酸钾和碘化钾,加热反应24~48小时,加水稀释,乙酸乙酯萃取,纯化得到式i化合物。
[0029]
进一步地,所述步骤1的溶剂为乙醇或丙醇。
[0030]
进一步地,所述步骤2的溶剂为2-甲基四氢呋喃和乙腈的混合溶剂,或者环戊基甲醚和乙腈的混合溶剂,2-甲基四氢呋喃或者环戊基甲醚与乙腈的比例为1:1到3:1。
[0031]
进一步地,所述纯化为经硅胶柱层析纯化。
[0032]
技术主题三
[0033]
本发明提供一种组合物,包括治疗或预防剂和用于递送所述治疗或预防剂的载体,所述载体包括技术主题一所述的长链烷基酯胺类化合物。
[0034]
进一步地,所述治疗或预防剂包括核酸分子、蛋白质、多肽或小分子化合物中的一种或多种。
[0035]
进一步地,所述核酸包括任何形式的核酸分子,包括但不限于单链dna、双链dna、短异构体、agomir、antagomir、反义分子、小干扰rna(sirna)、不对称干扰rna(airna)、microrna(mirna)、dicer-substrate rna(dsrna)、小发夹rna(shrna)、转移rna(trna)、信使rna(mrna)和本领域已知的其他形式的rna分子,或锁核酸(lna)、肽核酸(pna)和吗啉环寡聚核苷酸等核酸模拟物。
[0036]
进一步地,所述核酸选自至少一种编码抗原的mrna或其片段或表位。
[0037]
进一步地,所述治疗或预防剂为疫苗。
[0038]
进一步地,所述小分子化合物可选自抗肿瘤药、抗感染药、抗抑郁药、抗惊厥药、抗生素/抗菌剂、抗真菌药、抗寄生虫药、免疫调节药或麻醉药。
[0039]
进一步地,“药物组合物”还可以包含其他赋形剂,例如:稀释剂、填充剂、粘合剂、崩解剂、润滑剂、助流剂、粒化剂、包衣剂、润湿剂、溶剂、共溶剂、助悬剂、乳化剂、增甜剂、调味剂、掩味剂、着色剂、防结块剂、保湿剂、螯合剂、增塑剂、增粘剂、抗氧化剂、防腐剂、稳定剂、表面活性剂和缓冲剂。
[0040]
本发明化合物可以制成普通制剂、也制成是缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。
[0041]
技术主题四
[0042]
本发明还提供了式i所示化合物在制备核酸药物、疫苗、蛋白质或多肽药物、小分子药物中的应用。
[0043]
进一步地,所述应用为在制备核酸递送药物中的应用。
[0044]
进一步地,所述应用为在制备mrna药物中的应用。
[0045]
进一步地,所述应用为在制备mrna疫苗中的应用。
[0046]
本发明的有益效果如下:
[0047]
本发明提供了一类新的长链烷基酯胺类化合物,通过大量研究以及实验验证,发现该类长链烷基酯胺类化合物具备包封率高,递送效果好、肝毒性低以及相对选择分布的特点,为疾病治疗或预防剂的递送提供了更多的选择基础。
附图说明
[0048]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍。
[0049]
图1为递送的mrna在体内的分布。
具体实施方式
[0050]
以下结合具体实施例阐述本发明,这些实施例不旨在限制本发明的范围,而是为本领域技术人员制备和使用本发明化合物、组合物提供指导。本技术中描述的化合物的化学名称通常从chemdraw ultra(chambridgesoft)和生成/或通常遵循iupac命名法的原理。
[0051]
本实施例部分的化合物的合成路线如下:
[0052][0053]
实施例1
[0054][0055]
向化合物a(200mg,0.43mmol)的乙醇(5ml)溶液中加入5-氨基-1-戊醇(88mg,0.86mmol)和diea(213μl,1.29mmol),加热回流20小时,tlc监测反应,反应完全后冷却至室温。向反应液中加入等体积的水稀释,乙酸乙酯萃取(10ml
×
3),浓缩,硅胶柱层析(二氯甲烷:甲醇=10:1)得到化合物b-1,x=(ch2)5(172mg,收率82.69%)。
[0056]
向化合物b-1(260mg,0.54mmol)的乙腈和环戊基甲醚的混合溶剂(环戊基甲醚:乙腈=2:1,3ml)中,加入5倍当量的化合物c(936mg,2.69mmol),k2co3(224mg,1.62mmol)和ki(90mg,0.54mmol),90℃加热反应24小时,tlc监测反应,反应完全后,冷却至室温。向反应液中加入水稀释,乙酸乙酯萃取(10ml
×
3),浓缩,硅胶柱层析(二氯甲烷:甲醇=20:1)得油状化合物1(140mg,收率34.5%),1h nmr(500mhz,cdcl3)δ4.88
–
4.83(m,1h),4.05(t,j=6.7hz,2h),3.63(t,j=6.3hz,2h),2.85
–
2.58(brs,6h),2.32
–
2.23(m,4h),1.73-1.57(m,
13h),1.52
–
1.41(m,5h),1.38
–
1.25(m,50h),0.87(t,j=6.8hz,9h);
13
c nmr(126mhz,cdcl3)δ173.77,173.60,74.23,64.61,62.13,53.26,53.11,34.64,34.17,34.11,32.07,31.94,31.90,31.88,29.63,29.56,29.37,29.29,29.27,29.19,29.08,29.02,28.69,27.08,26.75,25.97,25.36,25.02,24.81,24.61,23.53,22.72,22.70,14.14;ms-esi(m/z):752(m+h)
+
。
[0057]
实施例2
[0058][0059]
制备方法同化合物1,使用6-氨基-1-己醇为原料可制得油状化合物2,1h nmr(500mhz,cdcl3)δ4.86
–
4.81(m,1h),4.04(t,j=6.8hz,2h),3.63(t,j=6.4hz,2h),2.99
–
2.94(brs,6h),2.29(dt,j=23.7,4h),1.87
–
1.75(m,7h),1.69
–
1.55(m,8h),1.51
–
1.24(m,55h),0.86(t,j=6.8hz,9h);
13
c nmr(151mhz,cdcl3)δ173.58,173.44,74.37,64.80,62.41,52.57,52.49,52.47,34.61,34.23,33.92,32.29,32.01,31.97,29.70,29.63,29.61,29.43,29.37,29.35,29.00,28.83,28.74,26.79,26.55,26.45,26.03,25.43,25.17,24.96,24.32,23.25,23.19,22.78,14.22;ms-esi(m/z):766(m+h)
+
.
[0060]
实施例3
[0061][0062]
制备方法同化合物1,使用7-氨基-1-庚醇为原料可制得油状化合物3,1h nmr(500mhz,cdcl3)δ4.83
–
4.81(m,1h),4.02(t,j=6.8hz,2h),3.59(t,j=6.6hz,2h),2.57(brs,6h),2.28
–
2.22(m,4h),1.81(brs,1h),1.62
–
1.47(m,15h),1.30
–
1.22(m,56h),0.84(t,j=6.8hz,9h);ms-esi(m/z):780(m+h)
+
.
[0063]
实施例4
[0064][0065]
制备方法同化合物1,使用8-氨基-1-辛醇为原料可制得油状化合物4,1h nmr(500mhz,cdcl3)δ4.85
–
4.80(m,1h),4.02(t,j=6.8hz,2h),3.59(t,j=6.6hz,2h),2.58(brs,6h),2.28
–
2.22(m,4h),1.81(brs,1h),1.64
–
1.46(m,15h),1.29
–
1.22(m,58h),0.84(t,j=6.8hz,9h);
13
c nmr(126mhz,cdcl3)δ173.71,173.63,74.21,64.58,62.84,53.53,34.69,34.20,32.79,31.96,31.92,29.66,29.64,29.59,29.56,29.38,29.31,29.16,28.72,27.27,26.94,25.99,25.72,25.37,25.09,24.77,22.74,22.72,14.15;ms-esi(m/z):794(m+h)
+
.
[0066]
实施例5
[0067][0068]
制备方法同化合物1,使用9-氨基-1-壬醇为原料可制得油状化合物5,1h nmr(500mhz,cdcl3)δ4.85
–
4.81(m,1h),4.02(t,j=6.8hz,2h),3.59(t,j=6.6hz,2h),2.56(brs,6h),2.28
–
2.21(m,4h),1.81(brs,1h),1.62
–
1.47(m,15h),1.31
–
1.20(m,60h),0.84(t,j=6.8hz,9h);ms-esi(m/z):808(m+h)
+
.
[0069]
实施例6
[0070][0071]
制备方法同化合物1,使用10-氨基-1-正癸醇为原料可制得油状化合物6,1h nmr(500mhz,cdcl3)δ4.86
–
4.81(m,1h),4.03(t,j=6.8hz,2h),3.60(q,j=6.2hz,2h),2.39(s,6h),2.29
–
2.23(m,4h),1.72
–
1.69(m,1h),1.64
–
1.56(m,6h),1.55
–
1.52(m,1h),1.51
–
1.40(m,7h),1.34
–
1.23(m,63h),0.85(t,j=6.8hz,9h);
13
c nmr(126mhz,cdcl3)δ173.89,173.69,74.17,64.51,62.95,54.14,53.96,34.78,34.41,34.23,32.91,31.98,31.94,29.68,29.66,29.63,29.61,29.58,29.51,29.41,29.36,29.34,29.31,29.29,28.74,27.65,27.55,27.23,26.01,25.86,25.39,25.20,25.03,22.75,22.73,14.17;ms-esi(m/z):822(m+h)
+
.
[0072]
实施例7
[0073][0074]
制备方法同化合物1,使用12-氨基-1-十二醇为原料可制得油状化合物7,1h nmr(500mhz,cdcl3)δ4.85
–
4.80(m,1h),4.02(t,j=6.8hz,2h),3.59(t,j=6.6hz,2h),2.51(brs,6h),2.28
–
2.23(m,4h),1.63
–
1.57(m,5h),1.54
–
1.45(m,9h),1.33
–
1.22(m,68h),0.85(t,j=6.7hz,9h);
13
c nmr(151mhz,cdcl3)δ173.77,173.66,74.19,64.56,62.97,53.74,34.71,34.28,34.21,32.89,31.97,31.93,29.66,29.64,29.59,29.57,29.49,29.39,29.32,29.30,29.22,29.20,28.72,27.48,27.36,27.03,26.00,25.84,25.38,25.12,24.85,22.74,22.73,14.17;ms-esi(m/z):850(m+h)
+
.
[0075]
实施例8报告基因荧光素酶mrna的制备
[0076]
1.1质粒线性化
[0077]
报告基因质粒puc57-luc包含t7启动子、5’utr、荧光素酶序列、3’utr以及polya
尾,在polya尾最后一个a后面有一个sapⅰ酶切位点。供试质粒10μg、限制性内切酶sap i(10000u/ml)1μl、10xcutsmart buffer 5μl,用ddh2o补足50μl。限制性内切酶sap i和10xcutsmart buffer为配套产品,neb,产品目录号为r0569l。反应条件为37℃,3h。反应完成后,取2μl酶切产物,进行1%琼脂糖凝胶电泳,检测质粒的线性化情况。确认酶切完成后,利用快速dna产物纯化试剂盒(康维世纪,cw2301m)回收纯化线性化质粒。
[0078]
1.2体外转录
[0079]
以线性化质粒并作为体外转录的模板,利用高产量t7 rna转录试剂盒进行体外转录。高产量t7 rna转录试剂盒,产品名称为high yield t7 rna synthesis kit,上海兆维科技发展有限公司,产品目录号为on-040;5
×
reaction buffer、100mm atp solution、100mm ctp solution、100mm gtp solution、enzyme mix、dnase i、ammonium acetate stop solution、lithium chloride(licl)precipitation solution均为高产量t7 rna转录试剂盒中的组件。100mmψutp solution,全称为n1-me-putp,100mm,上海兆维科技发展有限公司,产品目录号为r5-027。
[0080]
体外转录的具体步骤:首先,制备反应体系,混匀后37℃反应3h;然后,加入1μl dnase i(含量为1u),37℃反应15min;然后加入15μl ammonium acetate stop solution。
[0081]
反应体系:5
×
reaction buffer 4μl、100mm atp solution 2μl、100mmψutp solution 1μl、100mm ctp solution 2μl、100mm gtp solution 2μl、enzyme mix 2μl、线性化质粒(dna含量为500ng-1μg),nuclease-free h2o补齐至20μl。
[0082]
表2体外转录体系
[0083]
1.3rna纯化
[0084]
向体外转录反应体系中加入1/3体积的7.5m licl(使其终浓度为2.5m),-20℃放置30min。12000g离心15min,rna沉淀在底部,弃掉上清。加入1ml70%乙醇清洗rna,12000g离心5min,弃掉上清。晾干后加入50μl无rna酶的水溶解沉淀,并使用紫外分光光度计进行mrna定量,得到加帽的体外转录mrna。
[0085]
实施例9mrna-lnp包载
[0086]
将mrna原液分散于20mm醋酸溶液(ph 5.0)中,使终浓度为200μg/ml(水相)。按照实施例化合物:胆固醇:dspc:dmg-peg2000=50:38.5:10:1.5的摩尔比进行混合成混脂(油相)。控制水相和油相流速通过t混流的方式,使mrna与脂质混合物按3:1的体积比进行混合,得到lnp包载的mrna。用缓冲液将包载好的lnp稀释10倍,然后通过超滤进行浓缩,并置换稀释液,最终将lnp浓缩到mrna到200ug/ml,同时lnp的ph调节到7-8左右。最后用ribogreen试剂盒和10%otg作为破乳剂检测lnp中mrna总含量和游离含量,并计算lnp的包封率。在用稀释液将lnp最终产品稀释10倍,加入到粒径池中1ml,放到马尔文zetasizer仪器上,检测lnp的粒径,结果见表1。
[0087]
表1:实施例化合物的lnp的表征数据
[0088]
编号粒径pdi包封率实施例172.680.089296实施例272.020.086296实施例371.550.083594实施例470.420.081693
实施例570.670.086591实施例670.880.099294实施例772.730.098792sm10292.160.129695
[0089]
结果显示实施例化合物所形成的lnp的粒径比sm102的更小,均一性优于sm102,部分化合物的包封率更优,说明本发明化合物具有更为理想的递送能力、更好的产品均一性以及特定需求的药物递送。
[0090]
实施例10小鼠体内报告基因表达检测
[0091]
取制备的lnp包载的mrna溶液,用pbs缓冲液稀释,得到注射用液。20g左右的balb/c雌性小鼠,用胰岛素注射器在小鼠股四头肌部位注射注射用液,每只小鼠注射50μl。设计两种剂量:一种剂量为“每50微升注射用液含5μg mrna”,另一种剂量为“每50微升注射用液含14μg mrna”。20g左右的balb/c雌性小鼠,用胰岛素注射器在小鼠股四头肌部位注射pbs缓冲液,每只小鼠注射50μl。
[0092]
小鼠注射24h后,用perkinelmer的ivis检测luciferase的体内表达情况。底物为d-luciferin sodium salt(goldbio,lucna-1g),用生理盐水配成15mg/ml的浓度,用0.22μm滤膜过滤除菌,分装避光保存于-20℃。成像前每只20g左右的小鼠腹腔注射200μl底物溶液,作用10-20分钟,然后使用异氟烷气体麻醉后将小鼠趴在成像板上检测动物活体的荧光。
[0093]
结果显示脂质实施例1和2的lnp转染的荧光素酶在体内的表达高于sm102的表达(见表2)。
[0094]
表2:阳离子脂lnp递送荧光素酶mrna小鼠体内表达水平
[0095][0096]
上述结果证明实施例化合物1和2可以在体内高效递送mrna,保证蛋白表达水平,且表达效率高于sm102。
[0097]
实施例11脂质急性毒性分析
[0098]
为了考察实施例化合物的生物安全性,我们分析了化合物1、2和7的急性毒性。试
验入组balb/c雌性小鼠,每组10只,每组分别设置高低浓度组分别为50ug/只和150ug lnp/只。以sm102为对照。小鼠注射24h后,通过眼眶采血,将大约100ul的血液采集到含有edta的采血管中,取样后上下轻轻颠倒几次使血液与抗凝剂充分混匀。4℃保存,不可与冰袋直接接触,不可猛烈撞击,试验结果见表3和表4。
[0099]
表3:阳离子脂lnp急性毒性分析(低剂量组)
[0100][0101]
表4:阳离子脂lnp急性毒性分析(高剂量组)
[0102][0103]
结果显示,与对照组相比,各组的肌酐、总胆红素、天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、碱性磷酸酶和γ-谷氨酰转肽酶六个主要毒理指标均无显著性变化,初步说明本产品的安全性。与sm102组相比,天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、碱性磷酸酶和γ-谷氨酰转肽酶数值均下降10-30%,说明本产品的肝肾毒性进一步降低,表明其更高的生物安全性。
[0104]
实施例12体内表达分布分析
[0105]
为了考察脂质递送mrna在体内的分布特点,我们分析了实施例化合物1、2和7包载报告基因荧光素酶mrna的单次肌肉注射给予c57bl/6j小鼠的分布特征。试验入组c57bl/6j小鼠10只,雌雄各半,每只给药50μg,以sm102为对照。
[0106]
阴性对照组动物于给药后2h和336h,供试品组分别于给药后2h、6h、24h、48h、72h、120h、168h、336h收集全血、骨髓、肝、脾、心、肾、腹股沟淋巴结、肠系膜淋巴结、脾、脑、胃、小肠、非注射部位肌肉、注射部位肌肉组织等。采用rt-pcr法检测各时间点样本中的rna含量,方法的定量下限为40copies/反应,以反映在c57bl/6j小鼠体内的分布特征。
[0107]
结果显示在sm102注射的动物中,在组织脏器中暴露量由高到低依次为:腹股沟淋巴结、注射部位肌肉、全血、非注射部位肌肉、脾、骨髓、心、肠系膜淋巴结、肝、肾、小肠、和脑;在脂质实施例1、2、7注射的动物中,在组织脏器中暴露量由高到低依次为:注射部位肌肉、腹股沟淋巴结、全血、脾、非注射部位肌肉、骨髓、心、肝、肠系膜淋巴结、肾、小肠和脑(见图1)。研究结果表明实施例1和2递送的mrna在循环、免疫系统及肌肉中的分布要高于sm102,但在肝脏、心脏和肾脏中低于sm102。此外,实施例7化合物递送的mrna在胃的分布较
高。这一结果提示,与sm102相比,该类脂质实施例1和实施例2得到的脂质更适于作为递送载体更为适合应用于疫苗类等产品,同时降低在肝脏、心脏和肾脏的聚集,降低其潜在毒性。实施例7得到的脂质在胃部递送具有一定的优势。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1