一种含氧杂环化合物的晶型、其制备方法及应用与流程
1.本发明属于医药领域,具体涉及一种含氧杂环化合物的晶型、其制备方法及应用。
背景技术:
2.ras(rat sarcoma viral oncogene,鼠类肉瘤病毒癌基因),最早在大鼠肉瘤中发现。哺乳动物的ras基因家族有三个成员,分别是h-ras,k-ras,n-ras,其中k-ras的第四个外显子有a,b两种变异体。ras基因广泛存在于各种真核生物如哺乳类,果蝇,真菌,线虫及酵母中,在不同组织中表达程度不一,其中h-ras主要在皮肤和骨骼肌中表达,k-ras主要在结肠和胸腺中表达,n-ras则在睾丸中表达程度高。ras蛋白作为细胞信号转导过程中分子开关,通过与gtp/gdp结合切换来调控信号传导,进而调节细胞增殖、分化、衰老和凋亡等生命过程。
3.ras突变与肿瘤的发生和发展密切相关。ras基因在30%以上的人类肿瘤中发生突变,被认为是最有力的癌症驱动因素之一。ras原癌基因突变主要是通过点突变的方式进行。已经发现有150多种不同的ras点突变,其中以12和13位甘氨酸以及61位谷氨酰胺的突变最为常见。
4.几十年来,人们一直致力于靶向ras的小分子抑制剂研发,然而相关药物研发进展缓慢。科学家一直希望能够研发出直接作用于ras蛋白的gtp竞争性抑制剂,但是因为gtp与ras之间具有极强的亲和力(pmol/l级),而细胞中gtp浓度很高(0.5mm),以及ras蛋白结构中缺乏有利于小分子结合的口袋等原因没有成功。近年来,人们利用k-ras g12c突变体的变构位点进行药物研发取得了一定的进展。2013年,有研究小组报道了k-ras g12c小分子抑制剂的发现(nature,2013,503,548-551)。他们从k-ras g12c突变体中鉴定出一个位于分子开关ii区域下方的新型结合口袋,这些抑制剂结合于该变构口袋,并与附近的cys12形成共价结合,从而选择性抑制k-ras g12c的活化。另一些研究人员报道了具有细胞活性的kras抑制剂(science,2016,351,604-608)。amgen公司的化合物sotorasib(amg 510)通过丙烯酰胺michael加成受体结构与kras-g12c突变型的12号半胱氨酸巯基相连,将g12c突变kras蛋白锁定在一种非激活gdp结合状态来特异性地和不可逆地抑制其促增殖活性。sotorasib于2021年5月获得fda批准上市,成为全球首个用于治疗携带kras g12c突变的局部晚期或转移性非小细胞肺癌(nsclc)患者的靶向疗法。
5.本领域技术人员公知,化学药物因其内部质点的周期性排列方式不同而存在多晶型现象,包括无定形态和晶体形式在内的同一药物的不同固体形式可展现出迥异的物理、化学和光谱学性质,例如在熔点、引湿性、溶解速率、溶解度、加工性能以及稳定性方面存在差异,进而导致药物产品在安全性和有效性等方面同样表现出差异。因此,开展对药物多晶型现象的详尽研究及评估药物的不同固体形式的理化性质,选择合适的固体形式用于药物开发具有许多实际益处。
6.一种含氧杂环化合物,其结构如式(i)所示(以下简称如式(i)所示的化合物),可用于治疗和/或预防由ras介导的多种疾病。该化合物为本发明人自主设计并合成,经oj柱(20*250mm,10μm;品牌daicel)手性拆分制备得到固体形式,经xrpd确定该化合物的固体形式为无定形态。研究发现,当如式(i)所示的化合物以无定形态固体形式存在时具有下列缺陷:具有较高的引湿性;稳定性较差,特别是在高温和光照下化合物纯度明显下降。
7.鉴于发现的如式(i)所示的化合物以无定形态固体形式存在时开发为药物的潜能较差,开发具有更多优势性能的如式(i)所示的化合物的新的晶体形式具有十分重要的现实意义。
技术实现要素:
8.本发明所要解决的技术问题是现有技术中含氧杂环化合物的固体形式单一、引湿性较高、稳定性较差的缺陷,提供了一种含氧杂环化合物的晶型、其制备方法及应用。这些晶型制备方法简单,适合工业化生产,且不易吸湿,具有较好的稳定性,有利于制剂的制备和药物的长期储存。
9.本发明是通过下述技术方案来解决上述技术问题的。
10.本发明一方面提供了一种如式(i)所示的化合物的晶型a,其以2θ角表示的x-射线粉末衍射图,在4.8
±
0.2
°
、12.4
±
0.2
°
、15.6
±
0.2
°
和23.3
±
0.2
°
处具有特征峰,所述x-射线粉末衍射图使用cu靶的kα谱线测得;
[0011][0012]
在一些实施方案中,所述如式(i)所示的化合物的晶型a,其以2θ角表示的x-射线粉末衍射图,可在4.8
±
0.2
°
、9.1
±
0.2
°
、9.7
±
0.2
°
、12.4
±
0.2
°
、15.6
±
0.2
°
、19.8
±
0.2
°
、20.4
±
0.2
°
、21.1
±
0.2
°
、23.3
±
0.2
°
、24.7
±
0.2
°
和26.3
±
0.2
°
处具有特征峰。
[0013]
在一些实施方案中,所述如式(i)所示的化合物的晶型a,其以2θ角表示的x-射线粉末衍射图,在4.8
±
0.2
°
、9.1
±
0.2
°
、9.7
±
0.2
°
、12.4
±
0.2
°
、14.5
±
0.2
°
、15.6
±
0.2
°
、16.5
±
0.2
°
、17.2
±
0.2
°
、17.5
±
0.2
°
、19.8
±
0.2
°
、20.4
±
0.2
°
、21.1
±
0.2
°
、21.4
±
0.2
°
、
22.1
±
0.2
°
、22.4
±
0.2
°
、23.3
±
0.2
°
、24.7
±
0.2
°
、26.3
±
0.2
°
、27.6
±
0.2
°
和27.9
±
0.2
°
处具有特征峰。
[0014]
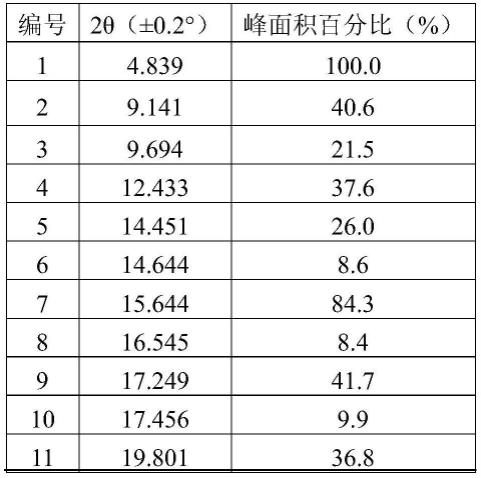
在一些实施方案中,所述如式(i)所示的化合物的晶型a,其以2θ角表示的x-射线粉末衍射图,其衍射峰和峰面积百分比还可如下所示:
[0015]
编号2θ(
±
0.2
°
)峰面积百分比(%)14.839100.029.14140.639.69421.5412.43337.6514.45126.0614.6448.6715.64484.3816.5458.4917.24941.71017.4569.91119.80136.81220.40624.21321.09848.21421.3998.91522.13414.71622.4074.21723.30242.31824.68554.91926.25730.22027.55215.82127.94817.62228.5202.32329.7422.22430.7465.3。
[0016]
在一些实施方案中,所述如式(i)所示的化合物的晶型a以2θ角表示的x-射线粉末衍射图还可基本上如图3所示。
[0017]
在一些实施方案中,所述如式(i)所示的化合物的晶型a的差示扫描量热图(dsc)中还可在167.7-171.0℃处具有吸热峰。
[0018]
在一些实施方案中,所述如式(i)所示的化合物的晶型a的差示扫描量热图(dsc)还可基本上如图4所示。
[0019]
在一些实施方案中,所述如式(i)所示的化合物的晶型a的热重分析图(tga)还可基本上如图5所示。在tga图中,所述晶型a在加热至分解温度之前基本上无重量损失,其显示所述晶型a是无水物。
[0020]
在一些实施方案中,所述如式(i)所示的化合物的晶型a的动态水分吸附图(dvs)中,所述晶型a增加的重量相比于初始的重量,还可在0%-95%相对湿度范围内增重了约0.30%。显示所述晶型a基本上不吸湿。
[0021]
在一些实施方案中,所述如式(i)所示的化合物的晶型a的动态水分吸附图(dvs)还可基本上如图6所示。
[0022]
在一些实施方案中,所述如式(i)所示的化合物的晶型a基本上是纯的。例如所述晶型a重量含量至少达到99%,至少95%,或更低至90%。又或者,所述晶型a重量含量至少达到80%,或至少70%,或更低至60%。或更进一步,所述晶型a重量含量至少达到50%。
[0023]
本发明另一方面提供了所述如式(i)所示的化合物的晶型a的制备方法,其为方法1、方法2或方法3:
[0024]
方法1:40℃~80℃下,将如式(i)所示的化合物与溶剂中形成的热饱和溶液降温至室温,析晶,即可;其中,所述溶剂选自乙醇、乙酸乙酯、甲基异丁基酮、乙腈和甲基叔丁基醚中的一种或多种;
[0025]
方法2:40℃~80℃下,将如式(i)所示的化合物与溶剂a形成的溶液与溶剂b混合,析晶,即可;其中,所述溶剂a为乙醇、异丙醇、丙酮、乙酸乙酯、乙腈、四氢呋喃、2-甲基四氢呋喃和1,4-二氧六环中的一种或多种,所述溶剂b选自甲基叔丁基醚、正庚烷和水中的一种或多种;
[0026]
方法3:将过量的如式(i)所示的化合物置于溶剂中形成混悬液,混悬平衡后,固液相分离,干燥,即可;其中,所述溶剂选自乙醇、甲基异丁基酮、甲基叔丁基醚、乙腈、四氢呋喃、2-甲基四氢呋喃、1,4-二氧六环中的一种或多种。
[0027]
在一些实施方案中,所述方法1、方法2或方法3中,所述如式(i)所示的化合物可为任意固体形式的如式(i)所示的化合物,例如,为无定形态固体形式的如式(i)所示的化合物。
[0028]
其中,
[0029]
方法1中,
[0030]
所述的溶剂用量可为本领域进行此类操作的常规用量,只要形成饱和溶液即可,在一些实施方案中,所述的溶剂与如式(i)所示的化合物的体积质量比为10.0~30.0ml/g,例如,16.7ml/g。
[0031]
所述的析晶可通过5-30℃/小时的速率进行降温冷却的方式。
[0032]
在一些实施方案中,所述方法1中,在进行所述的析晶前,所述热饱和溶液经过滤处理。所述过滤处理的方式可为本领域此类操作常规的过滤方式,较佳地为热过滤。
[0033]
所述的析晶后还可包括固液分离和干燥的操作。
[0034]
所述的固液分离可为过滤。
[0035]
所述的干燥可为减压干燥,例如,40℃下减压干燥。
[0036]
方法2中,
[0037]
所述的溶剂a与如式(i)所示的化合物的体积质量比为8.0~11.0ml/g,例如,9.5ml/g。
[0038]
所述的40℃~80℃可为70-75℃或45-50℃。
[0039]
所述的溶剂a与溶剂b的体积比为(0.2-5):1,例如,(0.38-1.9):1。
[0040]
所述的混合的时机不作特别限定,可将如式(i)所示的化合物与溶剂a形成的溶液与溶剂b混合,也可将如式(i)所示的化合物与溶剂a形成的溶液冷却至有固体析出后再与溶剂b混合。
[0041]
所述的混合的方式可为滴加的方式,例如,将溶剂b滴加到如式(i)所示的化合物与溶剂a形成的溶液中。
[0042]
在一些实施方案中,所述方法2中,较佳地,当溶剂b为正庚烷时,溶剂a为乙醇和/或乙酸乙酯;当溶剂b为甲基叔丁基醚,溶剂a选自乙醇、异丙醇和2-甲基四氢呋喃中的一种或多种。
[0043]
在一些实施方案中,所述方法3中,所述溶剂选自乙醇和/或甲基异丁基酮,例如,甲基异丁基酮。
[0044]
方法3中,所述溶剂的用量无须进行限定,可为本领域常规,只要其与如式(i)所示的化合物形成混悬液即可,例如,当所述的溶剂为甲基异丁基酮时,其与如式(i)所示的化合物的体积质量比为0.2g/ml。
[0045]
所述混悬平衡的温度可为常规,只要不高于溶剂体系的沸点即可,可为30℃~60℃,例如,50℃。
[0046]
在一些实施方案中,所述方法3中,所述混悬平衡的时间可视反应规模而定,一般在2小时-14天;例如,在实验室小试时,在室温条件下,2-24小时左右即可完成;放大后反应时间延长,例如24小时-14天,优选7天-14天,例如7天、14天。
[0047]
本发明一方面提供了一种如式(i)所示的化合物的晶型b,其以2θ角表示的x-射线粉末衍射图,在5.0
±
0.2
°
、9.8
±
0.2
°
、14.7
±
0.2
°
、19.6
±
0.2
°
、24.6
±
0.2
°
和31.0
±
0.2
°
处具有特征峰,所述x-射线粉末衍射图使用cu靶的kα谱线测得;
[0048][0049]
在一些实施方案中,所述如式(i)所示的化合物的晶型b,其以2θ角表示的x-射线粉末衍射图,其衍射峰和峰面积百分比还可如下所示:
[0050]
编号2θ(
±
0.2
°
)峰面积百分比(%)14.958100.029.83819.8314.7181.1419.6314.6524.5822.9631.0471.1。
[0051]
在一些实施方案中,所述如式(i)所示的化合物的晶型b以2θ角表示的x-射线粉末衍射图还可基本上如图7所示。
[0052]
在一些实施方案中,所述如式(i)所示的化合物的晶型b的差示扫描量热图(dsc)中还可在132.0-142.5℃处具有吸热峰。
[0053]
在一些实施方案中,所述如式(i)所示的化合物的晶型b的差示扫描量热图(dsc)还可基本上如图8所示。
[0054]
在一些实施方案中,所述如式(i)所示的化合物的晶型b的热重分析图(tga)还可基本上如图9所示。在tga图中,所述晶型b在加热至分解温度之前基本上无重量损失,其显示所述晶型b是无水物。
[0055]
在一些实施方案中,所述如式(i)所示的化合物的晶型b的动态水分吸附图(dvs)中,所述晶型b增加的重量相比于初始的重量,还可在0%-95%相对湿度范围内增重了约0.95%。显示所述晶型b基本上不吸湿。
[0056]
在一些实施方案中,所述如式(i)所示的化合物的晶型a的动态水分吸附图(dvs)还可基本上如图10所示。
[0057]
在一些实施方案中,所述如式(i)所示的化合物的晶型b基本上是纯的。例如所述晶型b重量含量至少达到99%,至少95%,或更低至90%。又或者,所述晶型b重量含量至少达到80%,或至少70%,或更低至60%。或更进一步,所述晶型b重量含量至少达到50%。
[0058]
本发明另一方面提供了所述如式(i)所示的化合物的晶型b的制备方法,其为方法a或方法b:
[0059]
方法a:50~70℃下,将如式(i)所示的化合物与甲醇形成热饱和溶液,在室温下挥发溶剂析晶,即可;
[0060]
方法b:将如式(i)所示的化合物与溶剂形成混悬液,混悬平衡后,固液相分离,干燥,即可;所述溶剂为甲醇或“甲醇和水的混合液”。
[0061]
在一些实施方案中,所述方法a或方法b中,所述如式(i)所示的化合物可为任意固体形式的如式(i)所示的化合物,例如,为无定形态固体形式的如式(i)所示的化合物。
[0062]
在一些实施方案中,所述方法a中,在所述挥发溶剂析晶前,所述热饱和溶液经过滤处理。所述过滤处理的方式可为本领域此类操作常规的过滤方式,较佳地为热过滤。
[0063]
在一些实施方案中,所述方法a中,所述析晶之后还可包括进行干燥的操作。所述的干燥为减压干燥。
[0064]
在一些实施方案中,所述方法b中,当所述溶剂为甲醇和水的混合液时,甲醇和水的体积比可为(5-95):5,例如5:5或95:5。
[0065]
所述混悬平衡的温度可为常规,只要不高于溶剂体系的沸点即可,可为10℃~40℃,例如,室温。
[0066]
在一些实施方案中,所述方法b中,所述混悬平衡的时间可视反应规模而定,一般在2天-14天;例如,在实验室小试时,在室温条件下,2天左右即可完成;放大后反应时间延长,例如2天-14天,优选7天-14天,例如7天、14天。
[0067]
在一些实施方案中,所述方法b中,所述混悬的同时可以进行加热,加热温度应不高于溶剂体系的沸点,例如约40℃、约50℃。所述加热可以促进混悬液中固体转变成如式(i)所示的化合物的晶型b。
[0068]
本发明另一方面还提供了一种如式(i)所示的化合物溶剂合物的晶型c,所述晶型c的结构如下所示:
[0069][0070]
其属三斜晶系,空间群为p1,晶胞参数为:α=95.12(3)
°
,β=93.82(3)
°
,γ=90.43(3)
°
;晶胞体积晶胞内不对称单位数z=1。
[0071]
在一个实施方案中,所述晶型c采用x-射线单晶衍射采集的晶体结构数据如下表4所示:
[0072]
表4
[0073]
[0074][0075]
本发明另一方面还提供了一种药物组合物,其包括上述如式(i)所示的化合物的晶型a、上述如式(i)所示的化合物的晶型b和上述如式(i)所示化合物溶剂合物的晶型c中的一种或多种,以及药学上可接受的辅料。
[0076]
本发明中,上述如式(i)所示的化合物的晶型a、上述如式(i)所示的化合物的晶型b和上述如式(i)所示化合物溶剂合物的晶型c中的一种或多种也可以与一种或多种其他活性成分组合使用;当组合使用时,活性成分可以是分开的组合物,用于在治疗中通过相同或不同的施用途径同时施用或者在不同时间分别施用,或者它们也可以在同一药物组合物中一起施用。
[0077]
本发明中,所述药物组合物的给药方法没有特殊限制,可根据病人年龄、性别和其它条件及症状,选择各种剂型的制剂给药;例如,片剂、丸剂、溶液、悬浮液、乳液、颗粒剂或胶囊口服给药;针剂可以单独给药,或者和注射用输送液(如葡萄糖溶液及氨基酸溶液)混合进行静脉注射;栓剂为给药到直肠。
[0078]
本发明另一方面还提供了如式(i)所示的化合物或上述药物组合物在制备药物中的应用,所述药物用于治疗和/或预防ras介导的疾病。
[0079]
在一些实施方案中,所述如式(i)所示的化合物为上述如式(i)所示的化合物的晶型a、上述如式(i)所示的化合物的晶型b或上述如式(i)所示化合物溶剂合物的晶型c。
[0080]
在一些实施方案中,所述ras例如为k-ras、h-ras和n-ras中的一种或多种的g12c突变,再例如k-ras的g12c突变。
[0081]
在一些实施方案中,所述ras介导的疾病例如癌症。所述的癌症例如结肠癌、阑尾癌、胰腺癌、myh相关的息肉病、血液癌、乳腺癌、子宫内膜癌、胆囊癌、胆管癌、前列腺癌、肺
癌、脑癌、卵巢癌、子宫颈癌、睾丸癌、肾癌、头或颈癌、骨癌、皮肤癌、直肠癌、肝癌、食道癌、胃癌、甲状腺癌、膀胱癌、淋巴瘤、白血病和黑色素瘤中的一种或多种。
[0082]
本发明另一方面还提供了上述如式(i)所示的化合物或上述药物组合物在制备ras抑制剂中的应用。
[0083]
在一些实施方案中,所述如式(i)所示的化合物为上述如式(i)所示的化合物的晶型a、上述如式(i)所示的化合物的晶型b或上述如式(i)所示化合物溶剂合物的晶型c。
[0084]
在一些实施方案中,所述ras例如为k-ras、h-ras和n-ras中的一种或多种的g12c突变,再例如k-ras的g12c突变。
[0085]
在一些实施方案中,所述的ras抑制剂可用于哺乳动物生物体内;也可用于生物体外,主要作为实验用途,例如:作为标准样或对照样提供比对,或按照本领域常规方法制成试剂盒,为ras抑制效果提供快速检测。
[0086]
本发明另一方面还提供了上述如式(i)所示的化合物或上述药物组合物在制备药物中的应用,所述药物用于治疗和/或预防癌症。
[0087]
在一些实施方案中,所述如式(i)所示的化合物为上述如式(i)所示的化合物的晶型a、上述如式(i)所示的化合物的晶型b或上述如式(i)所示化合物溶剂合物的晶型c。
[0088]
在一些实施方案中,所述的癌症例如结肠癌、阑尾癌、胰腺癌、myh相关的息肉病、血液癌、乳腺癌、子宫内膜癌、胆囊癌、胆管癌、前列腺癌、肺癌、脑癌、卵巢癌、子宫颈癌、睾丸癌、肾癌、头或颈癌、骨癌、皮肤癌、直肠癌、肝癌、食道癌、胃癌、甲状腺癌、膀胱癌、淋巴瘤、白血病和黑色素瘤中的一种或多种。
[0089]
如无特别说明,本发明所用术语具有如下含义:
[0090]
本发明中所使用的“如式(i)所示的化合物”是指具有如下式(i)所示化学结构的化合物:
[0091][0092]
本发明中所使用的“无定形”或“无定形态”指如式(i)所示的化合物的固体形式为非晶体形式。
[0093]
本发明中所使用的“晶型”、“晶体形式”和“多晶型物”在本发明中可以互换使用,具体指上述如式(i)所示的化合物的晶型a、上述如式(i)所示的化合物的晶型b或上述如式(i)所示化合物溶剂合物的晶型c。
[0094]
本发明的晶型可以通过一种或几种固态分析方法进行鉴定。如x-射线粉末衍射、单晶x-射线衍射、红外吸光光谱、差示扫描量热、热重曲线等。本领域技术人员知道,x-射线粉末衍射的峰强度和/或峰情况可能会因为实验条件不同而不同。同时由于仪器不同的精确度,测得的2θ值会有约
±
0.2
°
的误差。而峰的相对强度值比峰的位置更依赖于所测定样品的某些性质,如晶体的尺寸大小,纯度高低,因此测得的峰强度可能出现约
±
20%的偏
差。尽管存在试验误差、仪器误差和取向优先等,本领域技术人员还是可以从本专利提供的x-射线粉末衍射数据获得足够的鉴别各个晶型的信息。在红外光谱测定中,由于各种型号的仪器性能不同、供试品制备时研磨程度的差异或吸水程度不同等原因,对光谱的形状及吸收峰的位置均会有一定程度的影响。而在dsc测量中,根据加热速率、晶体形状和纯度和其它测量参数,实测获得的吸热峰的初始温度、最高温度和熔化热数据均具有一定程度的可变性。
[0095]
本发明中所使用的“无水物”是指样品经tga测定含有不多于1.0%(重量百分数)或不多于0.5%(重量百分数)的水。
[0096]
本发明中所使用的“约”用于某个参数,比如数量、角度、温度、时间等,是指偏离具体给定的数值至多
±
10%,较佳地为在
±
5%以内,最佳地为在
±
2%以内;但在差示扫描量热(dsc)图中测量热事件的起始温度和峰值温度时,无论起始温度或峰值温度的绝对值是多少,术语“约”表示起始温度或峰值温度通常可以相差
±
3℃以内。正如本领域技术人员所理解的,一个数字用于非关键参数仅出于说明目的,而非限制。
[0097]
本发明中所使用的“基本上是纯的”用于描述如式(i)所示的化合物的多晶型物时,表示该化合物的固体形式包含这种多晶型物且基本上不包含所述化合物的其它多晶型物。典型的基本上是纯的多晶型物中含有其它多晶型物的含量以重量计小于50%,优选小于40%,优选小于30%,优选小于20%,优选小于10%,优选小于5%,优选小于1%。
[0098]
本发明中所使用的“基本上不吸湿”用于描述如式(i)所示的化合物的多晶型物时,表示在使用动态水分吸附(dvs)技术测定如式(i)所示的化合物的多晶型物增加的质量相比于初始的质量,在0-95%相对湿度范围内的增重小于2%,优选小于1%。
[0099]
本发明中,所使用的“热饱和液”是指通过加热将溶质在一种或几种溶剂中形成过饱和溶液,其中溶质是过量的。所述加热的温度通常为溶剂沸点或低于溶剂沸点以下约5-30℃,例如加热的温度可为40℃、50℃、60℃、70℃、75℃、80℃。
[0100]
本发明中,所使用的“热过滤”是指将热饱和液通过针孔式过滤器过滤,其中滤膜材质较佳地为聚偏二氟乙烯(pvdf)或尼龙,滤膜孔径较佳地为0.45微米。
[0101]
本发明中,所使用的“热澄清液”是指通过加热将溶质完全溶解于一种或几种溶剂中,其中溶剂是过量的。所述加热的温度通常为溶剂沸点或低于溶剂沸点以下约5-30℃,例如加热的温度可为40℃、50℃、60℃、70℃、75℃、80℃。
[0102]
本发明中,所使用的“混悬液”是指将溶质在一种或几种溶剂中形成过饱和溶液,其中溶质是显著过量的,例如混悬平衡实验中制备的混悬液。
[0103]
本发明中,所使用的“混悬平衡”可采用本领域的常规方法完成,例如可通过将制备得到的混悬液小瓶以360
°
旋转的方式,或者将制备得到的混悬液以搅拌的方式进行。所述混悬平衡的温度如无特别说明,通常是指室温。
[0104]
本发明中,所述“室温”是指10-30℃。
[0105]
本发明中,所述“固液相分离”的操作可以采用本领域的常规方法完成,例如过滤、离心。当采用过滤操作完成“固液相分离”时,所述过滤,如无特别说明,是指减压抽滤。所述离心的具体操作为:将预分离的样品置于离心机中,离心速率通常为3000-15000转/分钟,较优地为6000-12000转/分钟。经所述“分离”得到的固体可以进一步洗涤,洗涤所用的溶剂优选与晶体制备方法中所用的溶剂相同,洗涤溶剂的用量一般为晶体制备方法中所用的溶
剂体积的0.1-1倍。
[0106]
本发明中,所述“干燥”可采用本领域的常规方法完成,干燥方式例如常压干燥、减压干燥,较优地为减压干燥。非限制性地,所述减压干燥的真空度可为-0.09mpa;所述减压干燥的温度可为30-80℃,较优地为40-70℃,例如40℃、50℃。干燥时长通常为1小时至过夜,即1-24小时,例如2小时、16小时。
[0107]
本发明中,所述“搅拌”可采用本领域的常规方法完成,搅拌方式例如磁力搅拌、机械搅拌,搅拌速度为50-1200转/分钟,较优地为200-500转/分钟。
[0108]
本发明中,所使用的“挥发”是指将盛有经滤膜过滤后的溶液的小瓶瓶口用铝箔覆盖并扎一个小孔,静置于实验室环境下缓慢地挥发溶剂,例如将盛有经滤膜过滤后的溶液的小瓶瓶口用铝箔覆盖并扎一个小孔,静置于通风橱内缓慢地挥发溶剂。
[0109]
本发明中,“治疗”指改善疾病或障碍(即阻止疾病或减少表现、其临床症状的程度或严重性);或者,改善至少一种身体参数,其可能不被受试者察觉;或者减缓疾病进展。
[0110]
本发明中,“预防”是指获得或发生疾病或障碍的风险降低(即导致可能暴露于导致疾病试剂或疾病发作前易感疾病的受试者中未发生疾病的临床症状的至少一种)。
[0111]
术语“药学上可接受的辅料”是指生产药品和调配处方时使用的赋形剂和附加剂,是除活性成分以外,包含在药物制剂中的所有物质。可参见中华人民共和国药典(2020年版)四部、或、handbook of pharmaceutical excipients(raymond c rowe,2009 sixth edition)。
[0112]
在不违背合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0113]
本发明所用试剂和原料均市售可得。
[0114]
本发明的积极进步效果在于:
[0115]
本发明提供的如式(i)所示的化合物的晶型具有一种或多种改进的特性,尤其是表现在具备良好的纯度、提高对高温和光照的稳定性、改善高湿度条件下的引湿性,不易发生转晶,能够更好地对抗药物在生产、储存、运输等过程中由环境温度、湿度、光照等因素引起的活性成分的纯度降低、杂质增长等问题,降低由此带来的疗效下降风险和安全风险;以及能够更好地对抗药物制剂在长期储存期间由于活性成分的固体形式发生转变导致药物的生物利用度发生变化的风险,适合作为活性成分用于药物的制剂开发。本发明提供的制备方法简单易操作,适合工业化生产。
附图说明
[0116]
图1为如式(i)所示的化合物的无定形态的x-射线粉末衍射(xrpd)图谱。
[0117]
图2为如式(i)所示化合物溶剂合物的晶型c的单分子立体结构椭球图。
[0118]
图3为如式(i)所示的化合物的晶型a的xrpd图谱。
[0119]
图4为如式(i)所示的化合物的晶型a的差示扫描量热(dsc)图。
[0120]
图5为如式(i)所示的化合物的晶型a的热重分析(tga)图。
[0121]
图6为如式(i)所示的化合物的晶型a的动态水分吸附(dvs)图;其中1为吸湿曲线,2为去湿曲线。
[0122]
图7为如式(i)所示的化合物的晶型b的xrpd图谱。
[0123]
图8为如式(i)所示的化合物的晶型b的dsc图。
[0124]
图9为如式(i)所示的化合物的晶型b的tga图。
[0125]
图10为如式(i)所示的化合物的晶型b的dvs图;其中1为吸湿曲线,2为去湿曲线。
[0126]
图11为如式(i)所示的化合物的无定形态的dvs图;其中1为吸湿曲线,2为去湿曲线。
[0127]
图12为肺癌细胞nci-h358皮下异种移植瘤模型中小鼠体重变化图。
[0128]
图13为肺癌细胞nci-h358皮下异种移植瘤模型中小鼠瘤体积变化图。
[0129]
图14为胰腺癌细胞mia paca-2皮下异种移植瘤模型中小鼠体重变化图。
[0130]
图15为胰腺癌细胞mia paca-2皮下异种移植瘤模型中小鼠瘤体积变化图。
[0131]
图16为人源结肠癌细胞sw837皮下异种移植瘤模型中小鼠体重变化图。
[0132]
图17为人源结肠癌细胞sw837皮下异种移植瘤模型中小鼠瘤体积变化图。
具体实施方式
[0133]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0134]
下列实施例采用无定形态固体形式的如式(i)所示的化合物作为原料。
[0135]
下列实施例中涉及的溶剂均为分析纯或色谱纯,当所述溶剂为混合溶剂时,除非另有说明,均为体积比。
[0136]
本发明中实验所用的测试仪器及测试条件:
[0137]
(1)x-射线粉末衍射(x-ray powder diffraction,xrpd)
[0138]
采用布鲁克公司的d8 advance型x-射线粉末衍射仪检测,采用cu靶的kα谱线射线粉末衍射仪检测,采用cu靶的kα谱线电压为40千伏,电流为40毫安,发散狭缝1.0mm,索拉狭缝0.4
°
,扫描模式为连续扫描,扫描角度范围3
°‑
45
°
,步长为0.02
°
,扫描速度为8
°
/min,探测器:lynxeye。
[0139]
(2)差示扫描量热(differential scanning calorimeter,dsc)
[0140]
采用ta仪器公司的dsc25型差示扫描量热仪检测,气氛为氮气,升温速率为10℃/分钟,升温范围为25-300℃。
[0141]
(3)热重分析(thermo gravimetric analysis,tga)
[0142]
采用ta仪器公司的q500型热重分析仪检测,气氛为氮气,以10℃/分钟的升温速率加热至350℃。
[0143]
(4)动态水分吸附(dynamic vapor sorption,dvs)
[0144]
采用sms公司的advantage 1.0型动态水分吸附仪检测,温度为25℃,相对湿度范围是0%-95%,湿度变化步长为相对湿度5%,当质量变化率dm/dt的值小于0.002%时视为天平平衡,当5分钟内质量变化率小于0.01%/分钟为检测过程中的平衡标准,最长平衡时间为2小时。
[0145]
制备例1如式(i)所示的化合物的合成
[0146]
(1)化合物1的合成
[0147]
化合物1的合成路线:
[0148][0149][0150]
化合物1-j的合成
[0151]
将化合物1-溴-8-氯萘(500mg,2.07mmol)溶解在thf(20ml)中,冷却到-78℃,在氮气保护下,滴加n-buli(2.5m,1.66ml,4.14mmol)。滴加结束后,混合物在-78℃下搅拌10分钟,然后在-78℃下滴加dmf(800μl,10.35mmol)。加毕,反应混合物在-78℃下搅拌30分钟后,升到室温搅拌2小时,用50ml的饱和氯化铵溶液淬灭反应,乙酸乙酯(50ml*2)萃取。有机相用饱和食盐水(50ml*2)洗涤,无水硫酸钠处理、过滤、浓缩,得到粗品。粗品通过快速分离柱分离纯化(ea/pe=1/10),得到化合物1-j(330mg,84%收率)为白色固体。lc-ms(esi):m/z=191.0[m+h]
+
;1h nmr(400mhz,cdcl3):δ11.31(s,1h),8.03(dd,1h,j1=1.2hz,j2=8.4hz),7.92(dd,1h,j1=1.2hz,j2=7.2hz),7.86(1h,j=8.4hz),7.70(dd,1h,j1=1.2hz,j2=7.6hz),7.59(t,1h,j=7.6hz),7.47(t,1h,j=8hz).
[0152]
化合物1-i的合成
[0153]
在室温条件下,将nah(60%,242mg,6.05mmol)加到6ml的thf中。然后在室温氮气条件下加入乙酰乙酸甲酯(543μl,5.04mmol),混合物在室温氮气条件下搅拌30分钟后,在-15℃~-10℃条件下滴加n-buli(2.5m,2.4ml,6.05mmol)。加毕,混合物保持在这个温度30分钟,然后滴加化合物1-j(320mg,1.68mmol)的thf(10ml)溶液。加毕,混合物在低温(-10℃-0℃)条件下搅拌2小时后,用饱和氯化铵溶液(50ml)淬灭反应,然后用乙酸乙酯(50ml*2)萃取。有机相用饱和食盐水(50ml*2)洗涤,无水硫酸钠处理、过滤、浓缩得到粗品,粗品通
过快速分离柱分离纯化(ea/dcm=1/10),得到化合物1-i(510mg,99%收率)为白色固体。lc-ms(esi):m/z=329.1[m+na]
+
;1h nmr(400mhz,cdcl3):δ8.06(d,1h,j=6.4hz),7.79(d,2h,j=8hz),7.58(dd,1h,j1=7.6hz,j2=1.6hz),7.53(t,1h,j=7.6hz),7.34(t,1h,j=7.6hz),6.91(dd,1h,j1=9.2hz,j2=2.4hz),3.74(s,3h),3.54(s,2h),3.36(dd,1h,j1=18hz,j2=1.6hz),3.24(d,1h,j=3.6hz),2.85-2.75(m,1h).
[0154]
化合物1-h的合成
[0155]
在室温条件下,将化合物1-i(510mg,1.66mmol)溶解在dcm(18ml)中,然后在室温氮气条件下加入dmf-dma(245μl,1.83mmol)。在室温条件下,反应液搅拌45分钟后,加入bf3·
et2o(232μl,1.83mmol)。加毕,混合物室温搅拌1小时后,用100ml的乙酸乙酯稀释。有机相依次用饱和nahco3溶液(100ml)、饱和食盐水(100ml*2)洗涤,用无水硫酸钠处理、过滤、浓缩得到粗品化合物1-h(520mg)。粗品无需纯化,直接用于下一步反应。lc-ms(esi):m/z=317.1[m+1]
+
.
[0156]
化合物1-g的合成
[0157]
在室温条件下,将化合物1-h(520mg,1.64mmol)溶解在thf(20ml)中,然后在-78℃氮气条件下,滴加三仲丁基硼氢化锂(1m,1.64ml,1.64mmol)。加毕,混合物在-78℃下搅拌1小时后,用饱和氯化铵溶液(50ml)淬灭反应,用乙酸乙酯(50ml*2)萃取,有机用饱和食盐水(50ml*2)洗涤,无水硫酸钠处理、过滤、浓缩得到粗品,粗品通过快速分离柱分离纯化(pe/ea=4/1),得到化合物1-g(338mg,65%收率)为黄色油状物。lc-ms(esi):m/z=319.0[m+1]
+
.
[0158]
化合物1-f的合成
[0159]
在室温条件下,将化合物1-g(338mg,1.06mmol)溶解在甲醇(20ml)中,然后在0℃氮气条件下,依次加入甲醇钠(286mg,5.3mmol),化合物2-甲基-2-巯基硫酸脲(265mg,0.954mmol)。加毕,混合物升到室温并搅拌20小时。反应液用1n的稀盐酸调ph到5,固体析出,过滤,滤饼用水(5ml*2)洗涤,收集固体,真空干燥,得到粗品1-f(313mg)为白色固体。lc-ms(esi):m/z=359.1[m+1]
+
.
[0160]
化合物1-e的合成
[0161]
在室温条件下,将化合物1-f(313mg,0.87mmol)溶解在dcm(10ml)中,然后在冰水浴氮气条件下,依次加入dipea(431μl,2.61mmol),三氟甲磺酸酐(219μl,1.31mmol)。加毕,反应混合物在冰水浴条件下搅拌2小时后,用饱和碳酸氢钠溶液(50ml)淬灭,用dcm(50ml*2)萃取,有机相用无水硫酸钠处理、过滤、浓缩,得到粗品,粗品通过快速分离柱分离纯化(ea/pe=1/10),得到化合物1-e(83mg,2步16%收率)为白色固体。lc-ms(esi):m/z=491.0[m+1]
+
.
[0162]
化合物1-d的合成
[0163]
在室温条件下将化合物1-e(83mg,0.169mmol)溶解在dmf(10ml)中,然后依次加入dipea(84μl,0.507mmol),(s)-2-氰基甲基哌嗪-1-甲酸苄酯盐酸盐(59.9mg,0.203mmol)。加毕,混合物在100℃氮气保护下搅拌1小时后,冷却到室温,用饱和食盐水(50ml)淬灭反应,用乙酸乙酯(50ml*2)萃取。有机相用饱和食盐水(50ml*3)洗涤,然后用无水硫酸钠处理、过滤、浓缩,得到粗品,粗品通过快速分离柱分离纯化(ea/pe=1/1),得到化合物1-d(101mg,99%收率)为白色固体。lc-ms(esi):m/z=600.2[m+1]
+
.
[0164]
化合物1-c的合成
[0165]
在室温条件下,将化合物1-d(101mg,0.168mmol)溶解在乙酸乙酯(10ml)中,然后室温下加入mcpba(85%,88.4mg,0.437mmol)。加毕,混合物在室温搅拌2小时后,用饱和碳酸氢钠溶液(20ml)淬灭,用乙酸乙酯(25ml*2)萃取,有机相用无水硫酸钠处理、过滤、浓缩,得到粗品,粗品通过快速分离柱分离纯化(ea/pe=1/4),得到化合物1-c(88mg,82%收率)为白色固体。lc-ms(esi):m/z=632.1[m+1]
+
.
[0166]
化合物1-b的合成
[0167]
在室温条件下,将化合物1-c(88mg,0.139mmol)溶解在甲苯(10ml)中,然后反应液冷却到0℃,依次加入n-甲基脯氨醇(29μl,0.243mmol),t-buona(27mg,0.278mmol)。加毕,反应混合物在冰水浴氮气下搅拌0.5小时后,用水(20ml)淬灭,乙酸乙酯(30ml*2)萃取。有机相用无水硫酸钠处理、过滤、浓缩,得到粗品,粗品通过快速分离柱分离纯化(meoh/dcm=1/10),得到化合物1-b(78mg,84%收率)为白色固体。lc-ms(esi):m/z=667.3[m+1]
+
.
[0168]
化合物1-a的合成
[0169]
在室温条件下,将化合物1-b(72mg,0.108mmol)溶解在甲醇(50ml)中,然后将反应液冷却到-78℃,氮气置换2次,然后加入pd/c(150mg),znbr2(24.3mg,0.108mmol),氢气置换3次,反应液升到室温,在氢气条件下搅拌5小时。将反应液过滤、浓缩,得到粗品,粗品通过快速分离柱分离纯化(meoh/dcm=1:4),得到化合物1-a(20mg,35%收率)为白色固体。lc-ms(esi):m/z=533.0[m+1]
+
.
[0170]
化合物1的合成
[0171]
在室温条件下,将化合物2-氟丙烯酸(5.1mg,0.0563mmol)溶解在dmf(2ml)中,然后0℃条件下,然后依次加入hatu(25.6mg,0.0675mmol),dipea(18.6μl,0.113mmol),加毕,反应混合物在0℃氮气下搅拌20分钟后,将化合物1-a(20mg,0.0375mmol)的dmf(3ml)溶液加入上述反应液中,升到室温,继续搅拌5小时。用饱和食盐水(20ml)淬灭,乙酸乙酯(25ml*2)萃取,有机相用饱和食盐水(50ml*3)洗涤,无水硫酸钠处理、过滤、浓缩,得到粗品,粗品通过prep-tlc分离纯化(meoh/dcm=1/10),得到化合物1(6mg,26%收率)为白色固体。lc-ms(esi):m/z=605.2[m+1]
+
;1h nmr(400mhz,cdcl3):δ7.99-7.93(m,1h),7.83(t,2h,j=8.8hz),7.62-7.49(m,2h),7.36(t,1h,j=7.6hz),6.55-6.44(m,1h),5.51-5.31(m,1h),5.25(d,1h,j=16.8hz),5.02-4.93(m,1h),4.82(dd,1h,j1=2.4hz,j2=13.6hz),4.48-4.38(m,1h),4.32-4.19(m,1h),4.17-4.04(m,1h),4.00(d,1h,j=14hz),3.87-3.70(m,1h),3.66-3.36(m,2h),3.31-3.16(m,2h),3.14-2.98(m,1h),2.96-2.69(m,4h),2.59(d,3h,j=18hz),2.52-2.34(m,1h),2.15-2.06(m,1h),1.87-1.74(m,2h),0.93-0.76(m,2h).
[0172]
(2)化合物1的拆分
[0173]
化合物1-1和1-2的合成
[0174][0175]
化合物1的手性拆分获得如式(i)所示的化合物是难点所在。尽管尝试了多种条件,化合物1的两个异构体在薄层层析板上分不开,无法通过薄层层析手段实现分离;即使在hplc中,化合物1的两个异构体分离度也很差,无法通过制备hplc实现分离;最后不得不求助于手性拆分,尝试了多个条件(如下表1),最后找到了手性拆分条件9,实现了对如式(i)所示的化合物与其非对映异构体的分离。
[0176]
表1
[0177]
[0178]
[0179][0180]
将重新制备的化合物1(260mg,0.43mmol)按下表2所示的条件进行手性拆分。得到化合物1-1(76mg,29%收率)为白色固体;得到化合物1-2(67mg,26%收率)为白色固体。其中,根据如下所示的如式(i)所示的化合物的单晶结构解析可以确定化合物1-2即如式(i)所示的化合物。
[0181]
表2
[0182][0183]
1-1:lc-ms(esi):m/z=605.3[m+1]
+
;1h nmr(400mhz,cdcl3)δ7.96(d,1h,j=7.2hz),7.83(t,2h,j=8.4hz),7.65-7.50(m,2h),7.36(t,1h,j=8.0hz),6.47(dd,1h,j1=10.8hz,j2=3.2hz),5.42(d,1h,j=49.2hz),5.26(dd,1h,j1=3.6hz,j2=16.8hz),5.05-4.76(m,1h),4.97(d,1h,j=13.6hz),4.84(d,1h,j=13.6hz),4.36(dd,1h,j1=4.8hz,j2=10.4hz),4.17(dd,1h,j1=6.8hz,j2=10.8hz),4.06-3.87(m,1h),3.77(d,1h,j=10hz),3.59(dd,1h,j1=2.4hz,j2=17.6hz),3.50-3.15(m,3h),3.14-2.99(m,2h),2.96-2.82(m,2h),2.72-2.59(m,1h),2.47(s,3h),2.32-2.21(m,1h),2.10-1.98(m,1h),1.89-1.67(m,4h).
[0184]
1-2:lc-ms(esi):m/z=605.2[m+1]
+
;1h nmr(400mhz,cdcl3)δ7.97(d,1h,j=7.2hz),7.83(t,2h,j=9.2hz),7.63-7.51(m,2h),7.36(t,1h,j=7.6hz),6.52(dd,1h,j1=3.2hz,j2=10.8hz),5.42(d,1h,j=47.2hz),5.25(dd,1h,j1=3.6hz,j2=16.4hz),4.99(d,1h,j=14.0hz),4.82(d,1h,j=13.6hz),5.05-4.72(m,1h),4.38(dd,1h,j1=4.8hz,j2=10.4hz),4.15(dd,1h,j1=6.8hz,j2=10.8hz),3.98(d,1h,j=14hz),3.87-3.73(m,1h),3.60(dd,1h,j1=2.4hz,j2=18.4hz),3.66-3.54(m,1h),3.54-3.41(m,1h),3.16-2.98(m,2h),2.95-2.71(m,3h),2.71-2.61(m,1h),2.46(s,3h),2.33-2.19(m,1h),2.10-1.98(m,1h),1.90-1.66(m,4h).
[0185]
经xrpd确定由上述方法制得的化合物1-2(如式(i)所示的化合物)的固体形式为无定形态,其xrpd图谱如图1所示。
[0186]
实施例1如式(i)所示的化合物溶剂合物的晶型c的制备
[0187]
本项工作的又一难点是如式(i)所示的化合物的结构鉴定。如式(i)所示的化合物与其非对映异构体在体外细胞活性上存在明显差异,通过化学、一般光谱等方法很难实现对手性结构的确证。最后求助于x-射线衍射技术,为此,尝试了多个条件进行单晶的培养,都没有成功。最后,幸运的是,通过溶剂挥发法,在溶剂甲醇-水(20:1)条件下(下表3中编号7对应的条件),获得了满足单晶x-射线衍射实验要求的无色透明片状晶体。通过解析,确定化合物1-2为如式(i)所示的化合物,而化合物1-1为其非对映异构体。
[0188]
单晶培养过程:采用下表3所示的方法及溶剂条件,在室温下进行单晶培养实验。
[0189]
表3
[0190][0191]
单晶测试条件:照《中国药典》2020年版四部通则0451第一法测定,采用布鲁克公司的d8 venture型单晶x-射线衍射仪,mokα辐射,ω扫描。单晶衍射实验收集总衍射点数为18322个,独立衍射点数10763个,可观察点数(|f|2≥2σ|f|2)为7231个。
[0192]
单晶结构解析:采用直接法(shelxs97)解析晶体结构,所述如式(i)所示的化合物溶剂合物的晶型c的晶体结构数据如表4所示,晶体结构数据证实所述的晶型c为所述的如
式(i)所示的化合物的一种溶剂合物固体形式,并且该溶剂合物中如式(i)所示的化合物结合了1分子甲醇和1分子水,具体结构如下所示:
[0193][0194]
所述晶型c的单分子立体结构椭球图如图2所示。
[0195]
表4
[0196]
[0197][0198]
实施例2如式(ⅰ)所示的化合物的晶型a的制备
[0199]
在约60℃加热下将1.2g如式(i)所示的化合物溶解于20ml乙醇中得到热饱和液,热过滤,滤液以5℃/小时的速率降温至室温,搅拌过夜;将析出的固体滤出,40℃减压干燥16小时,得白色粉末0.89g,hplc纯度99.6%,收率:74.2%。
[0200]
所得粉末样品为如式(i)所示的化合物的晶型a,其x-射线粉末衍射图谱如图3所示,其在以2θ角、d间距、峰高百分比和峰面积百分比表示的x-射线粉末衍射图谱中,主要衍射峰的2θ角、d间距、峰高百分比和峰面积百分比如下表5所示,其中特征峰(2θ
±
0.2
°
)为4.839
°
、9.141
°
、9.694
°
、12.433
°
、14.451
°
、15.644
°
、16.545
°
、17.249
°
、17.456
°
、19.801
°
、20.406
°
、21.098
°
、21.399
°
、22.134
°
、22.407
°
、23.302
°
、24.685
°
、26.257
°
、27.552
°
和27.948
°
。
[0201]
表5
[0202]
[0203][0204]
其差示扫描量热图如图4所示。dsc测试显示晶型a在167.73-170.96℃具有吸热峰。
[0205]
其热重分析图如图5所示。由图5可知,晶型a在加热至220℃损失重量0.122%。
[0206]
其动态水分吸附图如图6所示。dvs测试显示在从0%-95%相对湿度变化时,晶型a的吸湿增重质量百分数为0.3048%。
[0207]
实施例3如式(i)所示的化合物的晶型a的制备
[0208]
在70-75℃加热下将2.0g如式(i)所示的化合物溶解于19ml乙醇中得到热澄清液,搅拌10分钟后缓慢降温至45-55℃,有固体析出,保温搅拌1小时后滴加正庚烷10ml,滴加完后搅拌1小时,然后缓慢降温至室温,搅拌2小时,将析出的固体滤出;50℃减压干燥16小时,得白色粉末1.80g,收率90.0%。此方法所得样品经比对x-射线粉末衍射图谱,确定为如式(i)所示的化合物的晶型a。
[0209]
实施例4如式(i)所示的化合物的晶型a的制备
[0210]
在70-75℃加热下将2.0g如式(i)所示的化合物溶解于19ml乙醇中得到热澄清液,搅拌10分钟后缓慢降温至45-50℃,有固体析出,保温搅拌1小时后滴加甲基叔丁基醚50ml,滴加完后搅拌1小时,然后缓慢降温至室温,搅拌2小时,将析出的固体滤出;50℃减压干燥16小时,得白色粉末1.54g,收率77.0%。此方法所得样品经比对x-射线粉末衍射图谱,确定为如式(i)所示的化合物的晶型a。
[0211]
实施例5如式(i)所示的化合物的晶型a的制备
[0212]
将2.0g如式(i)所示的化合物分散于10ml甲基异丁基酮中,加盖密闭后于约50℃下混悬平衡2天。将固体滤出,40℃减压干燥16小时,得白色粉末1.87g,收率:93.5%。此方法所得样品经比对x-射线粉末衍射图谱,确定为如式(i)所示的化合物的晶型a。
[0213]
实施例6如式(i)所示的化合物的晶型b的制备
[0214]
在约60℃加热下将0.93g如式(i)所示的化合物溶解于80ml甲醇中得到热饱和液,热过滤,滤液转移至250ml圆底烧瓶中,瓶口用铝箔覆盖并扎一个小孔,置于室温下缓慢挥发溶剂。将溶剂完全挥发后的固体于40℃减压干燥16小时,得白色粉末0.82g,收率88.2%。
[0215]
所得粉末样品为如式(i)所示的化合物的晶型b,其x-射线粉末衍射图谱如图7所示,其在以2θ角、d间距、峰高百分比和峰面积百分比表示的x-射线粉末衍射图谱中,主要衍射峰的2θ角、d间距、峰高百分比和峰面积百分比如下表6所示,其中特征峰(2θ
±
0.2
°
)为4.958
°
、9.838
°
、14.718
°
、19.631
°
、24.582
°
和31.047
°
。
[0216]
表6
[0217][0218]
其差示扫描量热图如图8所示。dsc测试显示晶型b在131.98-142.51℃具有吸热峰。
[0219]
其热重分析图如图9所示。由图9可知,晶型b在加热至220℃损失重量0.207%。
[0220]
其动态水分吸附图如图10所示。dvs测试显示在从0%-95%相对湿度变化时,晶型b的吸湿增重质量百分数为0.9504%。
[0221]
实施例7如式(i)所示的化合物的晶型b的制备
[0222]
将0.5g如式(i)所示的化合物混悬于2ml甲醇中,加盖密闭后室温下混悬平衡2天。将固体滤出,40℃真空干燥16小时,得白色粉末0.37g,收率74.0%。此方法所得样品经比对x-射线粉末衍射图谱,确定为如式(i)所示的化合物的晶型b。
[0223]
效果实施例1稳定性
[0224]
1.1如式(i)所示的化合物的晶型a在溶液中的稳定性
[0225]
分别取适量的如式(i)所示的化合物的晶型a样品到小瓶中,分别往小瓶中加入1ml的单一溶剂或混合溶剂,超声分散制成混悬液。将混悬液加盖密闭后于室温下混悬平衡14天。离心,弃去上清液,将固体于40℃减压干燥后测定xrpd。
[0226]
结果显示,各种溶剂中,晶型都没有发生变化,仍为晶型a。所述单一溶剂包括乙醇、正丙醇、异丙醇、正丁醇、丙酮、2-丁酮、甲基异丁基酮、乙酸乙酯、乙酸异丙酯、异丙醚、甲基叔丁基醚、乙腈、2-甲基四氢呋喃、四氢呋喃、二氯甲烷、甲苯、1,4-二氧六环、水、正庚烷、正己烷、环己烷及环戊烷;所述混合溶剂包括体积比分别为15:85、65:35和95:5的乙醇与水,体积比分别为35:65、80:20和95:5的异丙醇与水。
[0227]
1.2如式(i)所示的化合物的晶型b在溶液中的稳定性
[0228]
分别取适量的如式(i)所示的化合物的晶型b样品到小瓶中,分别往小瓶中加入1ml的单一溶剂或混合溶剂,超声分散制成混悬液。将混悬液加盖密闭后于室温下混悬平衡14天。离心,弃去上清液,将固体于40℃减压干燥后测定xrpd。
[0229]
结果显示,各种溶剂中,晶型都没有发生变化,仍为晶型b,所述单一溶剂或混合溶剂包括甲醇、体积比分别为50:50、75:25或95:5的甲醇与水、体积比均为50:50的甲醇与乙腈、甲醇与丙酮、甲醇与乙酸乙酯、甲醇与乙酸异丙酯、甲醇与异丙醚、甲醇与甲基叔丁基醚、甲醇与二氯甲烷。
[0230]
效果实施例2竞争实验
[0231]
分别取等重量的如式(i)所示的化合物的晶型a、晶型b样品到同一小瓶中,往小瓶中加入1ml的溶剂,超声分散制成混悬液,所述溶剂包括乙醇、丙酮、乙酸乙酯和乙腈。将混悬液加盖密闭后于室温下混悬平衡7天。离心,弃去上清液,将固体于40℃减压干燥后测定
xrpd。
[0232]
结果显示,最终的固体形式都是如式(i)所示的化合物的晶型a,可见所述晶型a是如式(i)所示的化合物的热力学更稳定的多晶型物。
[0233]
效果实施例3如式(i)所示的化合物的晶型a、晶型b和无定形态在高温、高湿、光照条件下的稳定性
[0234]
将适量的如式(i)所示的化合物的晶型a或晶型b或无定形态的供试品置于玻璃小瓶中,分别于高温(60℃)、高湿(rh92.5%,25℃)和光照(4500
±
500lux,25℃)条件下敞开放置。于2周后取样,采用x-射线粉末衍射和高效液相色谱(hplc)对供试品进行分析。
[0235]
x-射线粉末衍射分析的方法同前所述。
[0236]
采用agilent zorbax sb-phenyl柱(3.5μm,4.6
×
150mm)实施反相hplc分析,流动相组分为(a)含0.1%高氯酸的水和(b)乙腈。洗脱梯度为流动相b于12分钟内自25%增加至95%,并于95%下保持3分钟,然后于25%下平衡系统5分钟。流速为1.0ml/分钟,进样体积为2μl,柱温为25℃,检测波长为228nm。将供试品用甲醇制备至最终浓度为0.5mg/ml。采用面积归一化法计算供试品中总杂质含量和如式(i)所示的化合物的纯度,供试品色谱图中峰面积小于0.05%的色谱峰忽略不计。考察结果见下表7-9。
[0237]
表7晶型a的影响因素试验结果
[0238][0239]
表8晶型b的影响因素试验结果
[0240][0241]
表9无定形的影响因素试验结果
[0242][0243][0244]
由上述表7-9数据表明,晶型a可将如式(i)所示的化合物的纯度提高至约99.6%,晶型a相对于无定形态和晶型b有效成分含量更高。
[0245]
与影响因素试验处理前相比,在高温条件下分别放置2周,所述晶型a和晶型b的化
学纯度和晶型均没有发生改变,总杂质未见增长,而xrpd测定显示所述无定形态已经发生转变,其化学纯度则下降2.7%。
[0246]
在高湿条件分别放置2周,所述晶型a、晶型b和无定形态的晶型均没有发生改变;晶型a和晶型b的化学纯度未发生变化,无定形态的化学纯度略有下降。
[0247]
在光照条件下分别放置2周,所述晶型a、晶型b和无定形态的晶型均未发生改变,晶型a和晶型b的化学纯度均仅下降0.4%-0.5%;所述无定形态的化学纯度下降3.4%,总杂质增长3.34%。
[0248]
可见,相比于无定形态固体形式,本发明的晶型a和晶型b显著提高了如式(i)所示的化合物对高温和光照的稳定性。
[0249]
效果实施例4引湿性
[0250]
采用与实施例2中如式(i)所示的化合物的晶型a、实施例6中如式(i)所示的化合物的晶型b相同的dvs测定方法,对如式(i)所示的化合物的无定形态样品进行dvs测定,其动态水分吸附图如图11所示。将晶型a、晶型b以及无定形态的dvs引湿性结果汇总于表10。
[0251]
表10晶型a、晶型b和无定形态的dvs引湿性结果
[0252][0253]
由表10可知,从0%-95%相对湿度变化时,所述晶型a、晶型b和无定形态的吸湿增重质量百分数依次为0.3048%、0.9504%和4.376%,无定形态吸湿的增重质量百分数分别为所述晶型a和晶型b的14.4倍和4.6倍,可见本发明的晶型a和晶型b在高湿度条件下具有更低的引湿性。
[0254]
可见,相比于无定形态固体形式,本发明的晶型a和晶型b显著改善了如式(i)所示的化合物的引湿性能,更有利药物的储存。
[0255]
效果实施例5如式(i)所示的化合物及其非对映异构体的体外细胞活性
[0256]
ctg法检测化合物对nci-h358、mia paca-2、a549和a375细胞系的增殖抑制实验。
[0257]
nci-h358为具有kras g12c突变的人非小细胞肺癌细胞,mia paca-2为具有kras g12c突变的人胰腺癌细胞,a549为具有kras g12v突变的人非小细胞肺癌细胞,a375为野生型的恶性黑色素瘤细胞。通过检测化合物对四种细胞系的增殖抑制活性来评价化合物对不同突变的抑制作用。
[0258]
分别向384孔板中(外围孔除外)加入40μl待测细胞悬液(板1:nci-h358细胞悬液,板2:mia paca-2细胞悬液,板3:a549细胞悬液,板4:a375细胞悬液)。将培养板放置于二氧化碳培养箱中过夜。往各孔中加入配制好的化合物(通过3倍稀释,得到10个浓度梯度的化合物)。细胞板在二氧化碳培养箱中孵育120小时。向384孔板中加入25μl的celltiter glo试剂,避光震荡10分钟,孵育10分钟。将培养板放入envision读板,利用xlfit绘制药效抑制率曲线并计算ic
50
值。
[0259]
如式(i)所示的化合物与其非对映异构体(化合物1-1)的体外细胞活性数据如下表11所示。
[0260]
表11如式(i)所示的化合物与非对映异构体对h358细胞、mia paca-2细胞、a549细
胞和a375细胞的增殖抑制活性
[0261][0262]
结果显示,如式(i)所示的化合物在h358细胞上的增殖抑制活性是其非对映异构体(化合物1-1)的614倍,在mia paca-2细胞上的增殖抑制活性是其非对映异构体(化合物1-1)的326倍。
[0263]
结果表明,如式(i)所示的化合物对于kras g12c突变细胞的抑制活性远远优于其非对映异构体(化合物1-1)。
[0264]
效果实施例6如式(i)所示的化合物在肺癌细胞nci-h358皮下异种移植瘤模型中的药效学研究
[0265]
实验指标是考察肿瘤生长是否可以被抑制、延缓或治愈。每周两次用游标卡尺测量肿瘤直径。
[0266]
肿瘤体积的计算公式为:v=0.5
×a×
b2,a和b分别表示肿瘤的长径和短径。
[0267]
受试物的抑瘤疗效用t/c(%)评价。t/c%=t
rtv
/c
rtv
×
100%(t
rtv
:治疗组rtv;c
rtv
:溶剂对照组rtv)。
[0268]
相对肿瘤体积rtv的计算公式为rtv=v
t
/v1。其中v1为分笼给药时(即day 1)测量所得肿瘤体积,v
t
为第t天测量时的肿瘤体积。
[0269]
t/c(%)的百分比值反映疗效,根据药审中心抗肿瘤药物的指导原则t/c%≤40%,认为受试物有效。肿瘤体积疗效用tgiv(%)评价,tgiv(%)=(1-(tv
t-dn-tv
t-d1
)/(tv
c-dn-tv
c-d1
))
×
100%,tvc:溶剂对照组瘤体积,tv
t
:治疗组瘤体积。
[0270]
实验使用balb/c nude小鼠。实验中往如式(i)所示的化合物的晶型a样品中加入0.5%mc水溶液,涡旋使其充分混匀,获得浓度分别为2.5、5.0、10.0mg/ml的混悬液,分别用于25mg/kg组,50mg/kg组和100mg/kg组的给药。通过灌胃方式给药。
[0271]
实验分为溶剂对照组,如式(i)所示的化合物25mg/kg组,50mg/kg组和100mg/kg组,口服灌胃给药21天,一天一次。给药期间,各组小鼠均表现出良好的耐受性,未出现明显异常。小鼠体重变化图见图12。
[0272]
小鼠瘤体积变化图见图13。对各治疗组与溶剂对照组肿瘤体积进行统计学分析,如式(i)所示的化合物50mg/kg组和100mg/kg组自开始给药第5天至给药结束显示有极显著性差异。
[0273]
受试物开始给药第22天时,与溶剂对照组相比,如式(i)所示的化合物25mg/kg组,50mg/kg组和100mg/kg组t/c值分别为66.58%(tgi%:42.39%),36.10%(tgi%:81.00%)和13.36%(tgi%:109.91%)。
[0274]
实验表明,如式(i)所示的化合物50mg/kg组和100mg/kg组在肺癌细胞nci-h358皮下异种移植肿瘤模型中具备显著的抑瘤效果。
[0275]
效果实施例7如式(i)所示的化合物在胰腺癌细胞mia paca-2皮下异种移植瘤模型中的药效学研究
[0276]
实验使用balb/c nude小鼠。实验中往如式(i)所示的化合物的晶型a样品中加入0.5%mc水溶液,涡旋使其充分混匀,获得浓度分别为1.5、3.0、10.0mg/ml的混悬液,分别用于15mg/kg组,30mg/kg组和100mg/kg组的给药。通过灌胃方式给药。
[0277]
实验分为溶剂对照组,如式(i)所示的化合物15mg/kg组,30mg/kg组和100mg/kg组,口服灌胃给药21天,一天一次。给药期间,各组小鼠均表现出良好的耐受性,未出现明显异常。小鼠体重变化图见图14。
[0278]
小鼠瘤体积变化图见图15。对各治疗组与溶剂对照组肿瘤体积进行统计学分析,如式(i)所示的化合物15mg/kg组,30mg/kg组和100mg/kg组,自给药开始第5天至给药结束显示有极显著性差异。
[0279]
化合物开始给药第22天时,与溶剂对照组相比,如式(i)所示的化合物15mg/kg组,30mg/kg组和100mg/kg组t/c值分别为36.91%(tgi%:75.39%),13.55%(tgi%:103.21%)和0.56%(tgi%:118.78%)。如式(i)所示的化合物15mg/kg组,30mg/kg组和100mg/kg组显示出了很好的抗癌活性。
[0280]
实验表明,如式(i)所示的化合物15mg/kg组,30mg/kg组和100mg/kg组在胰腺癌细胞mia paca-2皮下异种移植肿瘤模型中均显示了显著的抑瘤效果。
[0281]
效果实施例8如式(i)所示的化合物在人源结肠癌sw837皮下异种移植瘤模型中的药效学研究
[0282]
实验使用nod scid小鼠。实验中往如式(i)所示的化合物的晶型a样品中加入0.5%mc水溶液,涡旋使其充分混匀,获得浓度分别为10.0mg/ml的混悬液。通过灌胃方式给药。
[0283]
实验分为溶剂对照组,如式(i)所示的化合物100mg/kg组,口服灌胃给药28天,一天一次。给药期间,各组小鼠均表现出良好的耐受性,未出现明显异常。小鼠体重变化图见图16。
[0284]
小鼠瘤体积变化图见图17。对治疗组与溶剂对照组肿瘤体积进行统计学分析,如式(i)所示的化合物100mg/kg组,自给药开始第4天至给药结束显示有极显著性差异。
[0285]
化合物开始给药第28天时,与溶剂对照组相比,如式(i)所示的化合物100mg/kg组t/c值和tgi%值分别为6.48%和106.4%。如式(i)所示的化合物100mg/kg组显示出了很好的抗癌活性。
[0286]
实验表明,如式(i)所示的化合物100mg/kg组在人源结肠癌sw837皮下异种移植肿瘤模型中显示了显著的抑瘤效果。
[0287]
应当理解,本文所述的实施例仅用于说明目的,通过实施例将有助于进一步理解本发明,但不用于限制本发明的内容。对于本领域技术人员而言,对于材料和方法两者的许多改变可在不脱离本发明范围的情况下实施,这些改变或改进包括在本技术的主旨和范围以及所附权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1