转录抑制因子121121的应用及提高里氏木霉纤维素酶表达量和酶活的方法
1.本发明涉及农业生物技术领域,具体涉及转录抑制因子121121的应用及提高里氏木霉纤维素酶表达量和酶活的方法。
背景技术:
2.丝状真菌里氏木霉具有强大的分泌纤维素酶的能力,其混合发酵液中,纤维二糖水解酶的表达占胞外总分泌蛋白的50%以上。然而,纤维素酶的高成本仍然是纤维素生物炼制的主要瓶颈之一,因此需要继续开发新的方法,以提高纤维素酶的表达,降低应用成本。
3.在里氏木霉中,纤维素酶的表达受多个调控途径的影响。其中,调控主要发生在转录水平,包括主要激活因子xyr1、ace2、ace3、vib1和hap2/3/5,抑制因子cre1、ace1、rce1和rce2等多个转录因子的协同调控。目前,已经有几篇关于对转录抑制因子敲除提高纤维素酶表达的研究。例如,转录因子cre1是里氏木霉的碳代谢阻遏转录抑制因子,科研学者通过同源重组的方法敲除了里氏木霉eu7-22的转录抑制因子cre1,在诱导或者抑制性碳源培养条件下,内切纤维素酶活性分别提高了1.15倍和7.50倍;在里氏木霉alko2221菌株,转录抑制因子ace1的缺失明显提高了纤维素酶的表达,而在里氏木霉c30oexyr1菌株中删除ace1并没有带来任何改善;在里氏木霉tu6-rp菌株敲除rce1,纤维酶的表达略有提高(50%左右);在野生型菌株qm6a敲除rce2,内切纤维素酶活性提高了约30%。里氏木霉有500多个转录因子,然而,近几十年只发现了几个抑制纤维素酶表达的转录因子。因此,继续挖掘里氏木霉的新型转录因子并对其进行基因工程改造提高纤维素酶的表达,显的尤为重要。
技术实现要素:
4.本发明的目的是提供里氏木霉纤维的转录抑制因子121121的应用。
5.本发明的再一目的是提供一种提高里氏木霉纤维素酶的表达量和酶活的方法。
6.根据本发明的提高里氏木霉纤维素酶表达的转录抑制因子121121编码氨基酸序列如seq id no:1所示的蛋白质。
7.根据本发明的提高里氏木霉纤维素酶表达的转录抑制因子121121的核苷酸序列如seq id no:2所示。
8.根据本发明的提高里氏木霉纤维素酶的表达量和酶活的方法,包括敲除里氏木霉转录抑制因子121121的步骤。
9.根据本发明的提高里氏木霉纤维素酶的表达量和酶活的方法,其中,通过构建里氏木霉转录抑制因子121121的敲除质粒并将其导入里氏木霉中,实现敲除里氏木霉转录抑制因子121121。
10.根据本发明的提高里氏木霉纤维素酶的表达量和酶活的方法,其中,里氏木霉转录抑制因子121121的敲除质粒为所述转录抑制因子121121的donor质粒和所述转录抑制因子121121的sgrna质粒。
11.根据本发明的具体实施方式,其中,121121的donor质粒包括121121上游同源臂、pcre/loxp-hph(潮霉素表达盒)和121121下游同源臂;p121121sgrna质粒包括pdc1p-121121sgrna-pdc1t、tel序列、pdc1p-cas9-pdc1和大肠杆菌基本元件(氨苄编码基因和大肠杆菌复制起始点)。
12.根据本发明的具体实施方式,将121121上游同源臂、pcre/loxp-hph(潮霉素表达盒)、下游同源臂通过无缝拼接方式串联拼接,得到质粒p121121 donor。
13.根据本发明的具体实施方式,将pdc1p-121121sgrna-pdc1t、tel基因、pdc1p-cas9-pdc1t和大肠杆菌基本元件通过无缝拼接方式串联拼接,得到质粒p121121sgrna。
14.根据本发明的具体实施方式,敲除该转录抑制因子121121的里氏木霉的方法包括以下步骤:(1)敲除121121的p121121donor dna和p121121sgrna分别用pac1和i-ceu1酶切(2)用步骤(1)得到的质粒载体转化宿主细胞,得到敲除121121的里氏木霉菌株。
15.根据本发明的具体实施方式,上述敲除质粒载体可以提高里氏木霉的纤维素酶酶活表达。
16.本发明的纤维素酶表达相关的转录抑制因子121121对于纤维素酶活性表达具有调节作用,通过构建该基因的敲除质粒,并用其转化宿主菌,在宿主菌中敲除转录抑制因子121121的表达可提高宿主菌的蛋白表达量和纤维素酶酶活。本发明丰富了里氏木霉纤维素酶的转录调控网络,为提高纤维素酶产量,降低纤维素酶成本,实现纤维素有效利用提高了新途径。
附图说明
17.图1 提高纤维素酶表达的转录抑制因子的p121121donor质粒图谱。
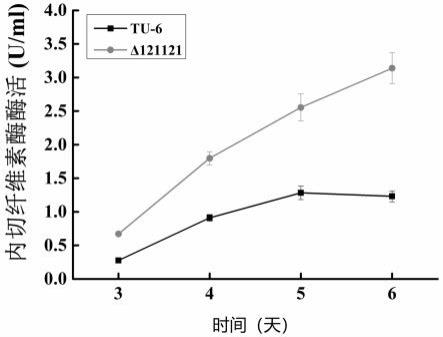
18.图2为提高纤维素酶表达的转录抑制因子的p121121sgrna质粒图谱。
19.图3显示转录抑制因子121121在里氏木霉基因组敲除的pcr鉴定结果。
20.图4显示敲除转录抑制因子121121的里氏木霉菌株蛋白表达的比较。
21.图5显示敲除转录抑制因子121121的里氏木霉菌株纤维素酶的表达比较。
具体实施方式
22.下列实施例中未注明具体条件的实验方法,通常按照常规条件进行。本发明所使用的里氏木霉tu-6菌株是尿嘧啶缺陷型突变体,编号atcc (mya-256)。
23.实施例1 转录抑制因子的p121121 donor和p121121sgrna质粒的构建(1)构建转录抑制因子p121121 donor质粒p121121donor质粒包含121121上游同源臂、pcre/loxp-hph(潮霉素表达盒和大肠杆菌基本复制元件)和121121下游同源臂。以pcre/loxp-hph质粒为模板,引物loxp-hphf1/loxp-hphr1扩增pcre/loxp-hph部分;以里氏木霉tu-6基因组为模板,引物121121upf1/121121upr1扩增1.5 kb长度的121121上游同源臂;引物121121downf1/121121downr1扩增1.5 kb长度的121121下游同源臂。
24.pcr反应体系包括:2 ng模板、1
ꢀµ
l正向引物、1
ꢀµ
l反向引物、25
ꢀµ
l的2xpcr mix,双蒸水补足至50
ꢀµ
l。
mm-glucose培养基中,28℃,160 rpm培养2 天。以10%的接种量转接至50 ml mm+2% avicel培养基中以诱导纤维素酶的表达。从第3天开始,每隔24 h取样,连续取样至6天。
33.(2)敲除转录抑制因子121121的转化子的蛋白浓度、纤维素酶的测定蛋白定量用考马斯亮蓝法,加入250
ꢀµ
l 1
ꢀ×ꢀ
dye reagent染液和10
ꢀµ
l蛋白标品后,室温下反应10分钟后,测定595 nm的吸光值, 结果见图4。在发酵第5天,里氏木霉tu-6的蛋白浓度是0.027 mg/ml, δ121121菌株(转化子)的蛋白浓度是0.059 mg/ml,提高了1.2倍。
34.纤维素酶的测定采用羧甲基纤维素钠(1.5 % cmc-na)作为底物进行测定。用柠檬酸-磷酸氢二钠缓冲液(0.05 m、ph 5.0)配制。取适当稀释的酶液100
ꢀµ
l,加入到900
ꢀµ
l cmc-na底物中,振荡混合均匀,50 ℃水浴保温30 min,反应终止时,向各试管中加入1.5 ml dns试剂,在沸水中煮5 min,迅速冷却,测定540 nm的吸光度。1 ml液体酶,在50 ℃、ph 5.0的条件下,每小时水解羧甲基纤维素钠,产生1 μmol还原糖(以葡萄糖计)所需要的酶量定义为一个酶活力单位(u),结果见图5在发酵第5天,里氏木霉tu-6的内切纤维素酶酶活为1.42 u/ml, δ121121菌株(转化子)的内切纤维素酶酶活为2.57 u/ml,提高了0.8倍。
35.应理解,本技术的实施例仅用于说明本发明而不用于限制本发明的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1