一株控制辣椒细菌性软腐病的香肠乳杆菌及其应用
1.本发明属于微生物技术领域,涉及一株香肠乳杆菌及其应用。
背景技术:
2.辣椒(capsicum spp.)是一种蔬菜,更是一种调味品,因营养价值丰富、口感独特受到消费者的喜爱和欢迎。我国辣椒年播种面积占全国蔬菜总播种面积的8%~ 10%,产值32500亿元,播种面积和产值均居蔬菜首位。但是,辣椒在采收后由于机械损伤、物流运输等原因很容易被病原菌侵染,对辣椒的品质及产量造成严重影响。常见的辣椒细菌性病害有果腐病、炭疽病、软腐病、黑斑病、疫病、灰霉病等。近些年辣椒细菌性软腐病的发生十分普遍,其中由果胶杆菌属(pectobacterium)的胡萝卜软腐果胶杆菌(pectobacteriumcarotovorum)引起的软腐病较为严重。
3.目前采用化学杀菌剂控制蔬菜细菌性软腐病的方法并不具有持久性且存在副作用大、成本高以及细菌菌群可产生耐药性等问题,这使得人们不断地探索新型杀菌剂。相关研究表明,乳酸菌“一般被认为是安全的”(gras),它们产生大量的有机酸和其他抑菌物质如细菌素,可以抑制食物腐败微生物和致病微生物。
技术实现要素:
4.有鉴于此,本发明的目的之一在于提供一株乳酸菌,其菌体及代谢产物对胡萝卜软腐果胶杆菌有较强的抑制活性;目的之二在于提供该乳酸菌及其代谢产物在制备防治辣椒细菌性软腐病的产品中的应用。
5.经研究,本发明提供以下技术方案:
6.1、香肠乳杆菌(lactobacillus farciminis)ljlab1,保藏编号为cgmcc no.24672。
7.本发明的香肠乳杆菌ljlab1是从四川省眉山市一个泡菜加工厂仓库中的辣椒上分离得到的,于2022年4月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称 cgmcc,地址:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no.24672,分类命名为香肠乳杆菌(lactobacillus farciminis)。
8.2、香肠乳杆菌ljlab1代谢产生的无菌发酵液(cfs)。
9.3、所述无菌发酵液的制备方法,包括以下步骤:将香肠乳杆菌ljlab1种子菌接种于 mrs液体培养基中,37℃振荡培养,离心,收集上清液,用孔径为0.22μm的微孔滤膜过滤,即得无菌发酵液。
10.进一步,所述无菌发酵液的制备方法包括以下步骤:将香肠乳杆菌ljlab1种子菌以0.1wt%接种于mrs液体培养基中,37℃振荡培养48h,12000rmp、4℃离心15min,收集上清液,用孔径为0.22μm的微孔滤膜过滤,即得无菌发酵液。
11.4、香肠乳杆菌ljlab1代谢产生的蛋白提取物。
12.5、所述蛋白提取物的制备方法,包括以下步骤:将香肠乳杆菌ljlab1种子菌接种
于 mrs液体培养基中,37℃振荡培养,离心,收集上清液,加入硫酸铵至80%饱和度,4℃过夜沉淀后,离心,收集沉淀,即得蛋白提取物。
13.进一步,所述蛋白提取物的制备方法包括以下步骤:将香肠乳杆菌ljlab1种子菌以 0.1wt%接种于mrs液体培养基中,37℃振荡培养48h,8000rpm、4℃离心10min,收集上清液,加入硫酸铵至80%饱和度,4℃过夜沉淀后,12000rpm、4℃离心15min,收集沉淀,即得蛋白提取物。
14.6、香肠乳杆菌ljlab1或其菌悬液或其含菌发酵液在制备防治辣椒细菌性软腐病的产品中的应用。
15.进一步,所述辣椒细菌性软腐病由胡萝卜软腐果胶杆菌所引起。
16.7、所述无菌发酵液在制备防治辣椒细菌性软腐病的产品中的应用。
17.进一步,所述辣椒细菌性软腐病由胡萝卜软腐果胶杆菌所引起。
18.8、所述蛋白提取物在制备防治辣椒细菌性软腐病的产品中的应用。
19.进一步,所述辣椒细菌性软腐病由胡萝卜软腐果胶杆菌所引起。
20.本发明的有益效果在于:本发明公开了保藏编号为cgmcc no.24672的香肠乳杆菌 (lactobacillus farciminis)ljlab1,其菌体及代谢产生的无菌发酵液、蛋白提取物对导致辣椒细菌性软腐病的胡萝卜软腐果胶杆菌展现出较强的抑制能力,可用于制备防治辣椒细菌性软腐病的产品,有效降低辣椒果实的软腐病发病率、病斑直径以及果实表面的病原菌数量,维持辣椒表皮结构,保持辣椒品质,减少辣椒在贮运期间的腐烂损失。本发明在辣椒细菌性软腐病的生物防治方面具有良好的应用潜力,同时也为研发微生物防腐剂提供了优良的基础菌株。
附图说明
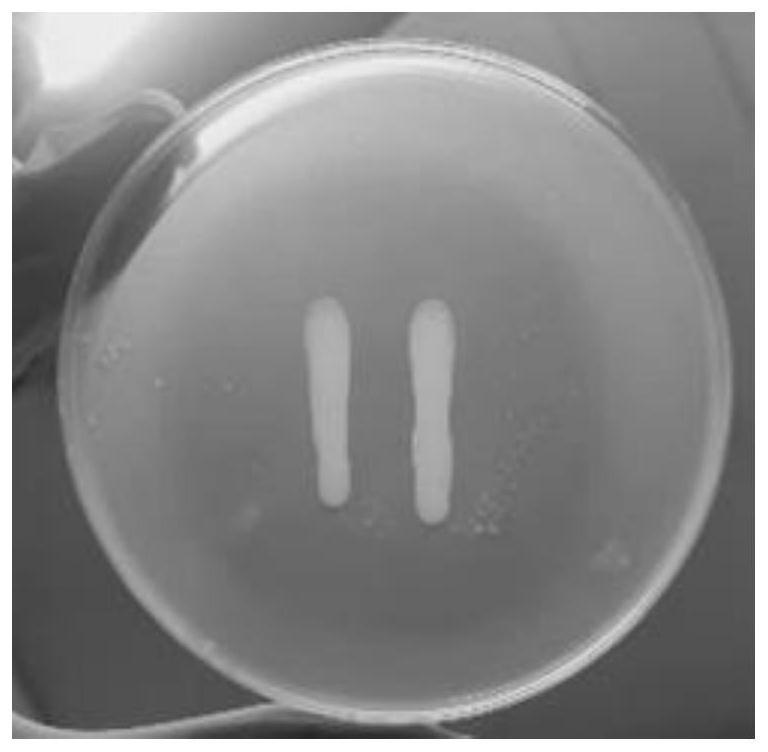
21.图1为本发明实施例1中拮抗菌筛选双层划线平板图。
22.图2为本发明实施例2所得无菌发酵液对胡萝卜软腐果胶杆菌体外抑菌平板图。
23.图3为本发明实施例2所得无菌发酵液对胡萝卜软腐果胶杆菌体内控病效果图。
24.图4为本发明实施例2中各处理组辣椒表面扫描电镜图。
25.图5为本发明实施例3中绿色荧光蛋白标记的胡萝卜软腐果胶杆菌平板图。
26.图6为本发明实施例3中各处理组辣椒表面胡萝卜软腐果胶杆菌生长图。
27.图7为本发明实施例4所得蛋白提取物对胡萝卜软腐果胶杆菌体外抑菌平板图。
28.图8为本发明实施例4所得蛋白提取物对胡萝卜软腐果胶杆菌体内控病效果图。
具体实施方式
29.为了使本方明的目的、技术方案和优点更加清楚,下面将结合附图对本发明的优选实施例进行详细的描述。
30.实施例1:拮抗乳酸菌的筛选与鉴定
31.1、微生物的分离
32.将辣椒(取自四川省眉山市一个泡菜加工厂仓库)进行研磨,用灭菌生理盐水以10倍的稀释梯度进行稀释。分别取100μl各稀释度(10-3
、10-4
、10-5
、10-6
)的辣椒水稀释液涂布至 mrs固体培养基上,37℃恒温培养48h。挑取乳酸菌单菌落,进一步采用划线分离法对特
征菌落进行反复地分离纯化,记录各菌落的形态特征。
33.ljlab1菌株菌落形态特征:在mrs琼脂平板上菌落形状为圆形、边缘整齐,呈半透明状,表面湿润易挑起。
34.2、抗菌乳酸菌的筛选
35.使用双层划线法进行抗菌乳酸菌的筛选:将乳酸菌接种到mrs液体培养基中培养至 od
600nm
=0.8,用接种环将菌悬液划线到mrs琼脂平板上(2条平行线,长度约2cm),37℃恒温培养12h。将10ml含有106cfu/ml胡萝卜软腐果胶杆菌的lb琼脂培养基(0.7wt%琼脂)倾注到上述mrs琼脂平板表面,37℃恒温培养24h,观察抑菌圈大小。
36.结果如图1所示,ljlab1菌株对胡萝卜软腐果胶杆菌展现出强抑菌圈,具有较好的抑菌活性。
37.3、微生物菌株的鉴定
38.将ljlab1菌株接种于mrs液体培养基中,37℃培养12h。采用genomic dnamini kit(invitrogen,usa)试剂盒提取乳酸菌基因组dna。以乳酸菌基因组dna为模板,使用27f(5'-agagagtttgatcmtggctcag-3',seq id no.2)和1495r(5'-ggttaccttgttacgactt-3',seqid no.3)为引物进行16s rdna扩增,并对pcr扩增产物进行测序分析。
39.获得的ljlab1菌株的16s rdna序列如seq id no.1所示,在ncbi数据库中进行 blast比对分析,结果显示,ljlab1菌株与香肠乳杆菌(lactobacillus farciminis)的identity =99%(》97%)。因此,ljlab1菌株为香肠乳杆菌(lactobacillus farciminis),将其命名为 ljlab1,于2022年4月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号),保藏号为cgmcc no.24672。
40.实施例2:香肠乳杆菌ljlab1的无菌发酵液对胡萝卜软腐果胶杆菌的生物拮抗活性
41.1、无菌发酵液的制备
42.将香肠乳杆菌ljlab1种子菌以0.1wt%的接种量接种至mrs液体培养基,37℃摇瓶培养48h,12000rpm、4℃离心15min,收集上清液,用孔径为0.22μm的微孔滤膜过滤,即得无菌发酵液。
43.2、无菌发酵液对胡萝卜软腐果胶杆菌的体外抑制活性
44.牛津杯法测定:将5ml 2wt%无菌琼脂溶液倒入无菌平皿中使其覆盖平皿底部,待凝固后,将3个灭菌牛津杯用镶子等距离放到琼脂平板上;将培养至对数期的胡萝卜软腐果胶杆菌用新鲜的lb液体培养基调节菌体浓度至108cfu/ml,取1ml菌悬液加入到冷却至45℃左右的100ml含0.7wt%琼脂的lb培养基中,混合均匀后,取20ml倒入琼脂平板中(不要倒入到牛津杯的孔里),待完全凝固后,小心地用无菌镶子夹出牛津杯,在琼脂平板上的3 个小孔中分别加入待测样品(香肠乳杆菌ljlab1的无菌发酵液)100μl,然后将平板先置4℃下2h使测试样品充分扩散,再37℃培养12h,观察抑菌现象并测量抑菌圈直径。
45.结果如图2所示,香肠乳杆菌ljlab1的无菌发酵液对胡萝卜软腐果胶杆菌有较好的体外抑制活性,抑菌圈明显可见。
46.3、无菌发酵液对胡萝卜软腐果胶杆菌的体内抑制活性
47.从本地农贸市场购买新鲜青椒,使用无菌打孔器在青椒表面打孔(直径0.3cm,深
度0.3 cm),每个小孔中加入15μl胡萝卜软腐果胶杆菌菌悬液(104cfu/ml),温室下放置,待菌悬液被完全吸收后,每个小孔中继续加入30μl待测样品(香肠乳杆菌ljlab1的无菌发酵液),以等体积的无菌水作为对照,处理后的青椒用果袋包裹严实后于室温下放置,观察发病情况。
48.(1)对辣椒细菌性软腐病的控制效果
49.结果如图3所示,随着贮藏时间的延长,对照组辣椒腐烂程度逐渐加重,到第4天全部辣椒已经完全腐烂、皱缩,颜色变为黄褐色,流出褐色的脓水;而无菌发酵液组的辣椒在第 4天仍然保持着完整、质硬、色绿的状态,只有少部分组织出现浸润现象。由此可见,无菌发酵液对辣椒细菌性软腐病有较强的控制效果。
50.(2)对辣椒表面细胞结构的影响
51.取上述处理后放置2d的对照组与无菌发酵液组的青椒,剪下伤口附近的植物组织(取样面积为5mm
×
5mm),用适量电镜固定液浸泡,4℃放置过夜,次日依次用20%、30%、40%、 50%、70%、90%的乙醇进行脱水,再用100%的乙醇脱水2遍,每次脱水时间为20min,最后50℃真空干燥2~3h,以5000
×
的倍数进行观察。
52.结果如图4所示,接种了胡萝卜软腐果胶杆菌的辣椒表面出现很多褶皱,说明细胞壁受到了破坏,并且可以清晰看到菌体的形态;而用香肠乳杆菌ljlab1的无菌发酵液处理后的辣椒表皮与正常辣椒的细胞表皮形态无明显差别,说明用香肠乳杆菌ljlab1的无菌发酵液处理后的辣椒并未出现明显的软腐病症。
53.实施例3:香肠乳杆菌ljlab1的无菌发酵液对辣椒表面胡萝卜软腐果胶杆菌的抑菌效果
54.1、绿色荧光蛋白标记的胡萝卜软腐果胶杆菌菌株的构建
55.将携带重组质粒pcr2.1 gfp的大肠杆菌j53进行活化,过夜培养16h,次日采用质粒提取试剂盒(diaspin plasmid mini-preps kit,上海生物工程股份有限公司)进行质粒提取,并测定其浓度。
56.挑取胡萝卜软腐果胶杆菌单菌落至5ml lb液体培养基中,37℃摇瓶培养过夜,取0.5ml 培养物,加至50ml lb液体培养基中,37℃摇瓶培养至od
600nm
=0.4,取1ml菌液于离心管中,3000rmp、4℃离心3min,弃上清,加入1ml无菌超纯水重悬,冰浴30min,3000rmp、 4℃离心3min,收集细胞,加入1ml 20%甘油重悬,3000rmp、4℃离心3min,收集细胞,再加入1ml 20%甘油重悬,冰上放置几分钟,得到胡萝卜软腐果胶杆菌感受态细胞。
57.取10μl提取的质粒与100μl胡萝卜软腐果胶杆菌感受态细胞混合,立即放入0.2cm电转杯中,冰浴5min电击转化(电压1.8kv,延迟时间6.0ms),电击后立刻加入500μl预热 lb培养液,37℃摇床复苏50min,然后取100μl涂布于含有卡那霉素的lb平板,37℃培养箱培养16h~24h。次日使用荧光显微镜观察,挑出呈现绿色荧光的菌落进行扩大培养。
58.图5为绿色荧光蛋白标记的胡萝卜软腐果胶杆菌平板图,可以清晰看到胡萝卜果胶杆菌在紫外条件下呈现绿色荧光,说明绿色荧光蛋白标记的胡萝卜果胶杆菌菌株构建成功。
59.2、微生物计数
60.从本地农贸市场购买新鲜青椒,使用无菌打孔器在青椒表面打孔(直径0.3cm,深度0.3 cm),每个小孔中加入15μl绿色荧光蛋白标记的胡萝卜软腐果胶杆菌菌悬液
(104cfu/ml),温室下放置,待菌悬液被完全吸收后,每个小孔中继续加入30μl待测样品(香肠乳杆菌 ljlab1的无菌发酵液),以等体积的无菌水作为对照,处理后的青椒用果袋包裹严实后于室温下放置;于处理后0d、1d、2d、3d,分别取对照组与无菌发酵液组的青椒,将伤口处植物组织剪下,加无菌生理盐水用研钵进行研磨,再用无菌生理盐水进行一系列稀释,直至稀释至10-8
;取不同稀释度的菌悬液各100μl,涂布于含有卡那霉素的lb琼脂平板,37℃培养箱培养24h,进行微生物计数。
61.结果如图6所示,用香肠乳杆菌ljlab1的无菌发酵液处理辣椒,可以明显降低辣椒表面胡萝卜软腐果胶杆菌的数量,之后随着贮藏时间的延长,胡萝卜软腐果胶杆菌在辣椒表面迅速增长,但无菌发酵液组辣椒表面的胡萝卜软腐果胶杆菌的数量始终显著低于对照组。
62.实施例4:香肠乳杆菌ljlab1的蛋白提取物对胡萝卜软腐果胶杆菌的生物拮抗活性
63.1、蛋白提取物的制备
64.将香肠乳杆菌ljlab1种子菌以0.1wt%接种于mrs液体培养基中,37℃振荡培养48h, 8000rpm、4℃离心10min,收集上清液,加入硫酸铵至80%饱和度,4℃过夜沉淀后,12000 rpm、4℃离心15min,收集沉淀,即得蛋白提取物。
65.2、蛋白提取物对胡萝卜软腐果胶杆菌的体外抑制活性
66.将100ml发酵液所得蛋白提取物溶解于1ml无菌水中,作为待测样品。牛津杯法测定其对胡萝卜软腐果胶杆菌的体外抑制活性,具体步骤同实施例2中所述。
67.结果如图7所示,香肠乳杆菌ljlab1的蛋白提取物对胡萝卜软腐果胶杆菌有较好的体外抑制活性,抑菌圈明显可见。
68.3、蛋白提取物对胡萝卜软腐果胶杆菌的体内抑制活性
69.将100ml发酵液所得蛋白提取物溶解于1ml无菌水中,作为待测样品。从本地农贸市场购买新鲜青椒,使用无菌打孔器在青椒表面打孔(直径0.3cm,深度0.3cm),每个小孔中加入15μl胡萝卜软腐果胶杆菌菌悬液(104cfu/ml),温室下放置,待菌悬液被完全吸收后,每个小孔中继续加入30μl待测样品(香肠乳杆菌ljlab1的蛋白提取物),以等体积的无菌水作为对照,处理后的青椒用果袋包裹严实后于室温下放置,观察发病情况。
70.结果如图8所示,随着贮藏时间的延长,对照组的辣椒在第3天几乎完全腐烂,散发出臭味;和对照组相比,蛋白提取物组的辣椒腐烂面积更小,腐烂味更轻,对辣椒细菌性软腐病有一定的控制效果。
71.最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管通过参照本发明的优选实施例已经对本发明进行了描述,但本领域的普通技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离所附权利要求书所限定的本发明的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1