乳癌HER2丰度PIK3CA突变检测探针组和试剂盒的制作方法
乳癌her2丰度pik3ca突变检测探针组和试剂盒
技术领域
1.本发明涉及一种乳癌her2丰度pik3ca突变检测探针组和试剂盒,属于分子杂交领域。
背景技术:
2.目前,在中国,乳腺癌是女性最常见的癌症,每年新发数量占全世界的 12.2%,每年死亡数量占全世界的9.6%,且这两项数据仍在逐步增加。乳腺癌继肺癌、胃癌、肝癌、食管癌、结直肠癌之后,成为中国女性第六大癌症死亡原因。仅2020年,中国新发乳腺癌41.6万,死亡11.7万,因此增强对乳腺癌诊疗技术的开发成为临床迫切需解决的重要问题。her2为乳腺癌治疗的主要靶点,也是其预后的重要检测指标, 其准确检测的重要性已经得到了临床和病理医师的广泛认同。早在2007年,继美国临床肿瘤协会/美国病理学家学院2007年发布her2检测指南之后, 我国也于2009年12月发布了her2检测指南。指南中均以免疫组化和原位杂交作为主要技术方案。但这些技术操作繁琐并且要求具有良好的技术专业性,无法进行大批量临床标本的检测。
3.pi3k通路是调控细胞代谢、生长、生存及迁移的重要信号通路,它在癌症发展中也起到重要的作用。在her2+晚期乳腺癌中,pi3k通路的改变是肿瘤恶化、疾病进展和产生治疗耐药性的最常见原因。研究发现pik3ca突变,如h1047r(3140 a》g)、e542k(1624 g》a)及e545k(1633 g》a)发生在大约20%-40%的早期乳腺癌及40%以上的her2+晚期乳腺癌患者中,且其与良好的预后相关。pik3a突变能够激活 pi3k/akt 信号通路,促进 her2介导的肿瘤细胞上皮转化,改变 her2过表达肿瘤的内在表型,导致抗 her2靶向治疗耐药。因此日渐成为临床乳腺癌治疗中的重要检测目标。fda于2019年5月24日批准诺华公司(novartis)的pi3k抑制剂alpelisib (piqray)上市,可与内分泌疗法氟维司群联用,alpelisib是首款应用于实体瘤的pi3k抑制剂。2019年7月2日,乳腺癌nccn指南2019 v2版新增了pik3ca基因突变检测以及针对pik3ca基因突变的治疗方案——氟维司群联合特异性pik3抑制剂alpelisib。而这些疗法的选择关键在于pi3kca基因突变的准确检测。
4.传统的her2及pi3kca检测均依赖于组织样本进行,包括通过免疫组化及原位杂交确定her2表达水平;通过基因测序或荧光定量pcr法确定pi3kca的突变情况,并被视为金标准方法。但病理组织切片会造成病人痛苦,检测方法操作复杂,对检验人员技术要求较高,且无法进行大批量临床样本的检测。随着血液中肿瘤游离dna(ctdna)的发现,其逐渐成为肿瘤液体活检的重要对象,但外周血中ctdna浓度极低(<1 ng/μl),常规的荧光定量pcr技术无法准确检测其丰度,且相对定量的检测方法高度依赖内参基因的选择,不同的内参对检测结果的判读影响较大,不同研究之间的检测结果差异较大,致使该诊断策略不能在临床得到应用。基因测序灵敏度及准确性均较高,但其检测成本和周期较长,限制了其临床应用推广。
5.因此,建立灵敏、快速、准确的临床诊断方法仍是未来临床技术发展的必须。
技术实现要素:
6.为了克服现有技术的不足,本发明提供一种乳癌her2丰度pik3ca突变检测探针组和试剂盒,能够用于安全、快速、准确地通过血液ctdna检测乳腺癌。
7.本发明解决其技术问题所采用的技术方案是:第一方面,本发明提供一组乳癌her2丰度pik3ca突变检测探针组,包括以下探针引物:e542k-f:5
’‑
gggaaaatgacaaagaacagctcaa-3’,如seq id no:1所示;e542k-r:5
’‑
ctgtgactccatagaaaatctttctcct-3’,如seq id no:2所示;wild type-e542k-probe:5
’‑
cctctctctgaaatca-3’,如seq id no:3所示;mutation type-e542k probe:5
’‑
cctctctctaaaatca-3’,如seq id no:4所示;e545k-f:5
’‑
tcaaagcaatttctacacgagatcct-3’,如seq id no:5所示;e545k-r:5
’‑
ctgtgactccatagaaaatctttctc-3’,如seq id no:6所示;wild type-e545k-probe:5
’‑
ctctctgaaatcactgagcag-3’,如seq id no:7所示;mutation type-e545k probe:5
’‑
ctctgaaatcactaagcag-3’,如seq id no:8所示;h1047r-f:5
’‑
tgagcaagaggctttggagt-3’,如seq id no:9所示;h1047r-r:5
’‑
tcagttcaatgcatgctgttt-3’,如seq id no:10所示;wild type-h1047r-probe:5
’‑
aatgatgcacatcatggtggct-3’,如seq id no:11所示;mutation type-h1047r-probe:5
’‑
aatgatgcacgtcatggtggct-3’,如seq id no:12所示;其中,所述探针引物带有修饰标记。
8.本技术提供的乳癌her2丰度pik3ca突变检测探针组灵敏度高、特异性强。
9.在一些可能的实施方式中,所述修饰标记为荧光素修饰。
10.在一些可能的实施方式中,所述探针引物mutation type-e542k probe、mutation type-e545k probe、mutation type-h1047r-probe的荧光基团修饰与所述探针引物wild type-e542k-probe、wild type-e545k-probe、wild type-h1047r-probe的荧光基团修饰不同。
11.在一些可能的实施方式中,所述探针引物mutation type-e542k probe、mutation type-e545k probe、mutation type-h1047r-probe的荧光基团修饰是fam。
12.在一些可能的实施方式中,所述探针引物wild type-e542k-probe、wild type-e545k-probe、wild type-h1047r-probe的荧光基团修饰为vic。
13.在一些可能的实施方式中,各所述探针引物的使用浓度为100 nmol/l
ꢀ‑
400 nmol/l。
14.在一些可能的实施方式中,各所述探针引物的使用浓度为200 nmol/l。
15.进一步地,所述的乳癌her2丰度pik3ca突变检测探针组用于bio-rad微滴数字pcr体系。
16.第二方面,本发明提供一种乳癌her2丰度pik3ca突变检测试剂盒,包括一组乳癌her2丰度pik3ca突变检测探针组,所述探针组包括以下探针引物:
e542k-f:5
’‑
gggaaaatgacaaagaacagctcaa-3’,如seq id no:1所示;e542k-r:5
’‑
ctgtgactccatagaaaatctttctcct-3’,如seq id no:2所示;wild type-e542k-probe:5
’‑
cctctctctgaaatca-3’,如seq id no:3所示;mutation type-e542k probe:5
’‑
cctctctctaaaatca-3’,如seq id no:4所示;e545k-f:5
’‑
tcaaagcaatttctacacgagatcct-3’,如seq id no:5所示;e545k-r:5
’‑
ctgtgactccatagaaaatctttctc-3’,如seq id no:6所示;wild type-e545k-probe:5
’‑
ctctctgaaatcactgagcag-3’,如seq id no:7所示;mutation type-e545k probe:5
’‑
ctctgaaatcactaagcag-3’,如seq id no:8所示;h1047r-f:5
’‑
tgagcaagaggctttggagt-3’,如seq id no:9所示;h1047r-r:5
’‑
tcagttcaatgcatgctgttt-3’,如seq id no:10所示;wild type-h1047r-probe:5
’‑
aatgatgcacatcatggtggct-3’,如seq id no:11所示;mutation type-h1047r-probe:5
’‑
aatgatgcacgtcatggtggct-3’,如seq id no:12所示;其中,所述探针引物带有修饰标记。
17.进一步地,所述的乳癌her2丰度pik3ca突变检测试剂盒,适用于bio-rad微滴数字pcr体系。
18.本发明的有益效果是:本发明提供的乳癌her2丰度pik3ca突变检测探针组灵敏度高,灵敏度可高达0.001%,且适于复杂背景下的靶标序列检测,是珍贵样本或样本核酸存在降解时的最佳选择,在穿刺样本、胸腹水、外周血中即可完成靶标序列的检测,特异性强,有利于快速、灵敏地通过血液ctdna测出乳腺癌。
19.本技术的其他特征和优点将在随后的说明书阐述,并且,部分地从说明书中变得显而易见,或者通过实施本技术了解。本技术的目的和其他优点可通过在所写的说明书、以及附图中所特别指出的结构来实现和获得。
附图说明
20.图1是特异性验证实验中第一个排管的bio-rad微滴数字pcr检测结果图。
21.图2是特异性验证实验中第二个排管的bio-rad微滴数字pcr检测结果图。
22.图3是特异性验证实验中第三个排管的bio-rad微滴数字pcr检测结果图。
23.图4是特异性验证实验中第四个排管的bio-rad微滴数字pcr检测结果图。
具体实施方式
24.本发明提供乳腺癌her2(erbb2,一种人类表皮生长因子受体)丰度pik3ca突变检测探针组和试剂盒,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
25.下面通过具体实施方式结合附图对本发明作进一步详细说明。
26.本发明提供的乳癌her2丰度pik3ca突变检测探针组和乳癌her2丰度pik3ca突变
检测试剂盒包含了e542k的突变型探针与野生型探针共4种、e545k的突变型探针与野生型探针共4种、h1047r的突变型探针与野生型探针共4种。所有探针引物共12种,具体序列见表1。
27.表1探针引物名称引物序号序列(5
’‑
》3’)e542k-f1gggaaaatgacaaagaacagctcaae542k-r2ctgtgactccatagaaaatctttctcctwildtype-e542k-probe3cctctctctgaaatcamutationtype-e542kprobe4cctctctctaaaatcae545k-f5tcaaagcaatttctacacgagatccte545k-r6ctgtgactccatagaaaatctttctcwildtype-e545k-probe7ctctctgaaatcactgagcagmutationtype-e545kprobe8ctctgaaatcactaagcagh1047r-f9tgagcaagaggctttggagth1047r-r10tcagttcaatgcatgctgtttwildtype-h1047r-probe11aatgatgcacatcatggtggctmutationtype-h1047r-probe12aatgatgcacgtcatggtggct探针引物为优化设计并经过测试,证明不同靶点检测互不干扰,且具有相同的扩增条件,从而可方便、快速地实现多个位点的共同检测。
28.本发明用于检测血液ctdna(循环肿瘤细胞dna,是指在血液中可能存在少部分肿瘤细胞坏死分泌的dna片段),适用于bio-rad微滴数字pcr体系,各探针引物的使用浓度为100 nmol/l
ꢀ‑
400 nmol/l,最优选为200 nmol/l。
29.其中,探针引物带有修饰标记。具体地,修饰标记为荧光素修饰。探针引物mutation type-e542k probe、mutation type-e545k probe、mutation type-h1047r-probe的荧光基团修饰与探针引物wild type-e542k-probe、wild type-e545k-probe、wild type-h1047r-probe的荧光基团修饰不同。e542k\e545k\h1047r的突变型与野生型探针分别使用fam与vic标记。
30.探针引物mutation type-e542k probe、mutation type-e545k probe、mutation type-h1047r-probe的荧光基团修饰是fam。
31.探针引物wild type-e542k-probe、wild type-e545k-probe、wild type-h1047r-probe的荧光基团修饰为vic。
32.e542k-f、e542k-r、e545k-f、e545k-r、h1047r-f、h1047r-r的作用是把血液样品中特定的dna片段大量复制出来。复制出来后,wild type-e542k-probe、mutation type-e542k probe、wild type-e545k-probe、mutation type-e545k probe、wild type-h1047r-probe、mutation type-h1047r-probe会与复制片段配对结合,而突变探针和野生型探针上有标记,存在突变的片段与突变型探针结合,在fam通道有信号;不存在突变的片段与野生型探针结合,在vic通道有信号。
33.本发明实施例具有以下优点:灵敏度高:通过把样本稀释成许多部分,并在一个反应中对其进行计数,灵敏度高
达0.001%,显著高于arms法(0.1%)和sanger法测序(10%)。
34.特异性强:适于复杂背景下的靶标序列检测,是珍贵样本或样本核酸存在降解时的最佳选择,在穿刺样本、胸腹水、外周血中即可完成靶标序列的检测。
35.样本量少:200 μl血浆或1 ml全血/纳克级活检组织即可满足检测需求;分析便捷:可实现真正意义上的绝对定量,每个微滴的检测结果以阴性、阳性判读。
36.成本更低:理想状态下,dpcr不需要进行文库构建等操作,其单人份样本检测成本显著低于二代测序技术。
37.特异性验证实验使用ddpcr
tm supermix for probes(bio-rad)进行实验,分别加入上述不同靶点的引物探针,乳腺癌患者的ctdna样品,预混液(2x)和h2o配制成20
ꢀµ
l反应体系,每个样本做三个技术重复。使用bio-rad芯片、20
ꢀµ
l的反应体系以及适量探针法液滴生成油(bio-rad)进行微滴生成。然后将微滴转移到96孔pcr板(eppendorf)中并在eppendorf master cycler nexus(eppendorf)上进行扩增,热循环条件参考dpcr supermix for probes(bio-rad)说明书。扩增后,使用bio-rad qx200检测仪对微滴荧光信号进行检测。
38.在同一个8孔排管中同时检测下列表1中的8个目标,即将e542k突变型探针(seq id no:4)、e542k-f(seq id no:1)、e542k-r(seq id no:2)加入排管的第1个孔,将e542k野生型探针(seq id no:3)、e542k-f(seq id no:1)、e542k-r(seq id no:2)加入排管的第2个孔,将e545k突变型探针(seq id no:8)、e545k-f(seq id no:5)、e545k-r(seq id no:6)加入排管的第3个孔,将e545k野生型探针(seq id no:7)、e545k-f(seq id no:5)、e545k-r(seq id no:6)加入排管的第4个孔,将h1047r突变型探针(seq id no:12)、h1047r-f(seq id no:9)、h1047r-r(seq id no:10)加入排管的第5个孔,将h1047r野生型探针(seq id no:11)、h1047r-f(seq id no:9)、h1047r-r(seq id no:10)加入排管的第6个孔,将her 2探针(5
’‑
tgtgcgaggcacccagctct-3’,seq id no:15)、her2-f(5
’‑
ctcatcgctcacaaccaagt-3’, seq id no:13)、her2-r(5
’‑
cagggcatagttgtcctcaa-3’, seq id no:14)加入排管的第7个孔,将内源性对照品β-actin的基因加入排管的8个孔。且e542k突变型探针、e542k野生型探针、e545k突变型探针、e545k野生型探针、h1047r突变型探针、h1047r野生型探针、her2探针、内源性对照品的基因均用fam标记。
39.这样的排管共准备四个,第一个排管的8个孔都加入e542k突变基因;第二个排管的8个孔都加入e545k突变基因;第三个排管的8个孔都加入h1047r突变基因;第四个排管的8个孔都加入her2阳性基因。
40.表2
12345678e542k突变型e542k野生型e545k突变型e545k野生型h1047r突变型h1047r野生型her2β-actin
反应体系配制如下:ddpcrtm supermix for probes(2x)
ꢀꢀꢀ
10
µ
l;primer-f (20
µ
m)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.6
µ
l;primer-r (20
µ
m)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.6
µ
l;probes
ꢀꢀꢀ
(20
µ
m)
ꢀꢀꢀꢀꢀꢀꢀ
0.4
µ
l;
模板
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ2µ
l;ddh2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6.4
µ
l。
41.扩增条件如下表3。
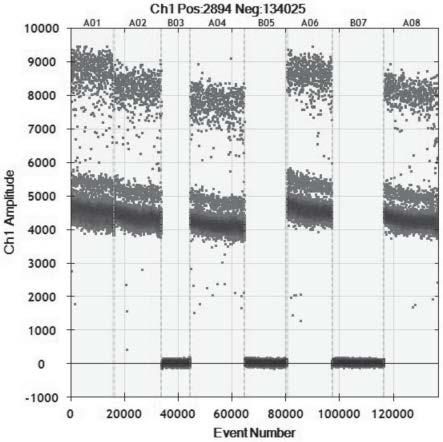
42.表3第一个排管的实验结果如图1所示。图1为fam通道扩增效果,图中每个点表示微滴扩增情况,横坐标event number表示总反应数,纵坐标ch1amplitude表示fam荧光通道扩增效果, ch1pos:2894 neg:134025代表fam荧光通道中突变型总反应数为2894,无信号总反应数为134025。a01对应第一个排管的第1个孔,a02对应第一个排管的第2个孔,b03对应第一个排管的第3个孔,a04对应第一个排管的第4个孔,b05对应第一个排管的第5个孔,a06对应第一个排管的第6个孔,b07对应第一个排管的第7个孔,a08对应第一个排管的第8个孔。解读图1得到表4。
43.表4
排管孔序号12345678探针e542k突变型e542k野生型e545k突变型e545k野生型h1047r突变型h1047r野生型her2β-actin结果阳性阳性阴性阳性阴性阳性阴性阳性
第二个排管的实验结果如图2所示。图2为fam通道扩增效果,图中每个点表示微滴扩增情况,横坐标event number表示总反应数,纵坐标ch1amplitude表示fam荧光通道扩增效果, ch1pos:3020 neg:134979代表fam荧光通道中突变型总反应数为3020,无信号总反应数为134979。e01对应第一个排管的第1个孔,a01对应第一个排管的第2个孔,a03对应第一个排管的第3个孔,a04对应第一个排管的第4个孔,d05对应第一个排管的第5个孔,a06对应第一个排管的第6个孔,d07对应第一个排管的第7个孔,a07对应第一个排管的第8个孔。解读图2得到表5。
44.表5
排管孔序号12345678探针e542k突变型e542k野生型e545k突变型e545k野生型h1047r突变型h1047r野生型her2β-actin结果阴性阳性阳性阳性阴性阳性阴性阳性
第三个排管的实验结果如图3所示。图3为fam通道扩增效果,图中每个点表示微滴扩增情况,横坐标event number表示总反应数,纵坐标ch1amplitude表示fam荧光通道扩增效果, ch1pos:2347 neg:100047代表fam荧光通道中突变型总反应数为2347,无信号总反应数为100047。h01对应第一个排管的第1个孔,g02对应第一个排管的第2个孔,h03对应第一个排管的第3个孔,g03对应第一个排管的第4个孔,h04对应第一个排管的第5个孔,h05对应第一个排管的第6个孔,g06对应第一个排管的第7个孔,h06对应第一个排管的第8个孔。解读图3得到表6。
45.表6
排管孔序号12345678探针e542k突变型e542k野生型e545k突变型e545k野生型h1047r突变型h1047r野生型her2β-actin结果阴性阳性阴性阳性阳性阳性阴性阳性
第四个排管的实验结果如图4所示。图4为fam通道扩增效果,图中每个点表示微滴扩增情况,横坐标event number表示总反应数,纵坐标ch1amplitude表示fam荧光通道扩增效果, ch1pos:2503 neg:120387代表fam荧光通道中突变型总反应数为2503,无信号总反应数为120387。b12对应第一个排管的第1个孔,a12对应第一个排管的第2个孔,b11对应第一个排管的第3个孔,a11对应第一个排管的第4个孔,b10对应第一个排管的第5个孔,a10对应第一个排管的第6个孔,a09对应第一个排管的第7个孔,a08对应第一个排管的第8个孔。解读图4得到表7。
46.表7
排管孔序号12345678探针e542k突变型e542k野生型e545k突变型e545k野生型h1047r突变型h1047r野生型her2β-actin结果阴性阳性阴性阳性阴性阳性阳性阳性
该实验可以证明,本发明的探针的序列在与突变基因结合时具有很好的特异性。该实验利用特制的样本进行特异性验证,所以只需要用到单荧光通道,因此各探针均用fam标记。在实际应用中,样品为待测者的血液时,应遵从mutation type-e542k probe、mutation type-e545k probe、mutation type-h1047r-probe用fam标记,wild type-e542k-probe、wild type-e545k-probe、wild type-h1047r-probe用vic标记。
47.在本说明书的描述中,参考术语“一个实施方式”“某些实施方式”“示意性实施方式”“示例”“具体示例”、或“一些示例”等的描述意指结合所述实施方式或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施方式或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施方式或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施方式或示例中以合适的方式结合。
48.以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1