一种密歇根克雷伯氏菌及其产品与应用
1.本发明属于废水中氨氮的生物降解技术领域,具体涉及一种密歇根克雷伯氏菌及其产品与应用。
背景技术:
2.未经处理的畜禽养殖废水所引发的氮污染尤为严重,其中以氨氮污染最为突出。含高浓度氨氮的畜禽废水直接排入水体中,废水中的氨氮在硝化菌的作用下,被氧化转变为硝态氮和亚硝态氮,1mg氨氮完全氧化大约需要消耗4.6mg溶解氧,大量的溶解氧消耗导致水体溶解氧含量急剧下降。水体中过多的氮也会增加光合微生物(主要是藻类)的数量,使富营养化现象出现,导致水体发黑发臭,透明度下降,水质环境恶化,促使水中鱼类和其他生物大量死亡。
3.我国太湖污染源的调查显示,畜禽养殖废水是造成太湖流域氮污染以及富营养化的重要污染源之一。当使用含高浓度氨氮的畜禽废水灌溉农田时,则会导致土壤孔隙堵塞,使土壤透气性,透水性降低,土壤质量恶化,造成植物减产甚至死亡。水中过量的氮元素若不能被有效吸收,极易流失到地表水中或通过透气性土壤淋溶到地下水中,造成水体污染。
4.中国发明专利cn110452836a提供了一株降解氨氮的微生物菌株,所述菌株为养料嗜冷杆菌(psychrobacter cibarius)z-xww g,所述养料嗜冷杆菌(psychrobacter cibarius)z-xww g保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.17515,以及漳州芽孢杆菌(bacillus zhangzhouensis)z-xww 77,所述漳州芽孢杆菌(bacilluszhangzhouensis)z-xww 77保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.17516,对比文件还提供了上述菌株以及包含上述菌株的复合微生物在降解氨氮中的应用,但是对比文件中的复合微生物菌群处理废水中氨氮的效率较低。
技术实现要素:
5.为了克服现有技术中的问题,本技术提供一种密歇根克雷伯氏菌及其产品与应用,具体方法是从猪场废水中筛选出一株专一性强、耗时短、去除效率高的能够降解废水中氨氮的降解菌,为处理畜禽养殖废水提供丰富的微生物资源。
6.为了实现上述目的,本发明通过以下技术方案实现:
7.本发明第一方面提供一种密歇根克雷伯氏菌,所述密歇根克雷伯氏菌的名称为klebsiella michiganensis wf-2,其在中国微生物菌种保藏管理委员会普通微生物中心的保藏编号为cgmcc no.23386。
8.作为一种可选的实施方式,本发明提供密歇根克雷伯氏菌的核苷酸序列如seq id no.1所示。
9.作为一种可选的实施方式,本发明提供密歇根克雷伯氏菌从含有活性污泥的猪场废水中富集,分离和纯化得到,所述富集和分离过程中的培养温度为28-30℃,所述培养时
间为20-24h。
10.作为一种可选的实施方式,本发明提供的密歇根克雷伯氏菌富集,分离和纯化过程中所使用的础培养基为包含氯化铵的lb培养基。
11.作为一种可选的实施方式,本发明提供的密歇根克雷伯氏菌富集,分离和纯化过程中所使用的的筛选培养基为包含乙酸钠、七水硫酸镁、磷酸氢二钾、氯化钠、硫酸锰、硫酸亚铁以及氨氮溶液的培养基。
12.作为一种可选的实施方式,本发明提供的密歇根克雷伯氏菌富集,分离和纯化过程中所使用的的筛选培养基为包含乙酸钠2.0g、七水硫酸镁0.05g、磷酸氢二钾0.2g、氯化钠0.12g、硫酸锰0.01g、硫酸亚铁0.01g、氨氮溶液及蒸馏水1000ml的培养基。
13.作为一种可选的实施方式,本发明提供的密歇根克雷伯氏菌在富集,分离和纯化过程中所使用的的模拟废水中的碳源包含葡萄糖、蔗糖、淀粉、乙酸钠、丁二酸钠或碳酸氢钠中的至少一种,所述模拟废水中的碳氮比为3-15:1。
14.作为一种可选的实施方式,在本发明提供的密歇根克雷伯氏菌中,所述密歇根克雷伯氏菌富集,分离和纯化的具体过程包括以下步骤:
15.步骤一:菌株的富集,分离,纯化
16.从某猪场收集废水,用无菌三角瓶保存于
–
20℃冰箱中保存。将10ml含活性污泥的猪场废水转入含富集培养基90ml的三角瓶中,放入振荡培养箱中于28℃,160r/min条件下培养24h,得到富集菌液。按5%的接种量将富集菌液接种到初筛无机盐培养基中相同条件下培养24h,重复操作筛选两次。将筛选后的菌液按照涂布稀释的方法以10-3
、10-4
、10-5
、10-6
、10-7
、10-8
六个浓度梯度在固体富集培养基上涂布,涂布完成后放入28℃的培养箱中倒置培养24h完成初筛。挑选固体培养基上不同的单菌落,进行分离纯化(划线重复2~3次),纯化后的单菌用甘油保存的方法冻存于-80℃冰箱中备用。
17.步骤二:菌株的复筛
18.将初筛得到的菌株在lb液体培养基中活化培养24h,取适量菌液于10ml离心管中进行离心,去上清,之后用无菌生理盐水洗涤菌体(重复两次),并配置成菌悬液,将该菌悬液的od
600
值调节至统一。按5%的接种量接入复筛无机盐培养基中,置于振荡培养箱中,在28℃,160r/min条件下培养48h后用多功能水质测定仪对氨氮浓度进行测定并计算降解率。淘汰降解能力差的菌株,氨氮降解能力高的菌株用甘油管和斜面进行保存备用。
19.步骤三:降解菌株的鉴定
20.观察目的菌株的形态特征和显微镜下细菌细胞的形态,结合16srdna方法对细菌形态学和菌种种类进行全面鉴定。
21.本发明第二方面提供上述任一实施方式中所述的密歇根克雷伯氏菌在降解废水中氨氮的应用。
22.作为一种可选的实施方式,在本发明提供的密歇根克雷伯氏菌在降解废水中氨氮的应用中,所述密歇根克雷伯氏菌在降解废水中氨氮的过程中,降解溶液的ph值为6-8,降解温度为20-40℃。
23.作为一种可选的实施方式,在本发明提供的密歇根克雷伯氏菌在降解废水中氨氮的应用中,废水中氨氮的初始浓度为100-900mg/l,所述密歇根克雷伯氏菌的接种量为0.5%-10%。
24.本发明第三方面提供用于降解降解废水中氨氮的菌剂,所述降解降解废水中氨氮的菌剂中含有上述任一实施方式中所述的密歇根克雷伯氏菌。
25.作为一种可选的实施方式,在本发明提供的用于降解降解废水中氨氮的菌剂中,所述降解降解废水中氨氮的菌剂的制备方法为将所述密歇根克雷伯氏菌用液体培养基进行活化培养后,收集培养液即得。
26.本发明的有益效果如下:
27.本发明筛选得到一株氨氮高效降解细菌,通过生理化鉴定及16s rrna序列分析,该菌株被鉴定为密歇根克雷伯氏菌属klebsiella michiganensis sp,并将其命名为klebsiella michiganensis wf-2。保藏编号为:cgmcc no.23386。密歇根克雷伯氏菌对氨氮的降解率最高能达到92.37%,体现出良好的降解作用,可应用于去除或降低氨氮在环境中的残留,为氨氮残留问题提供安全,环保的微生物降解法。
附图说明
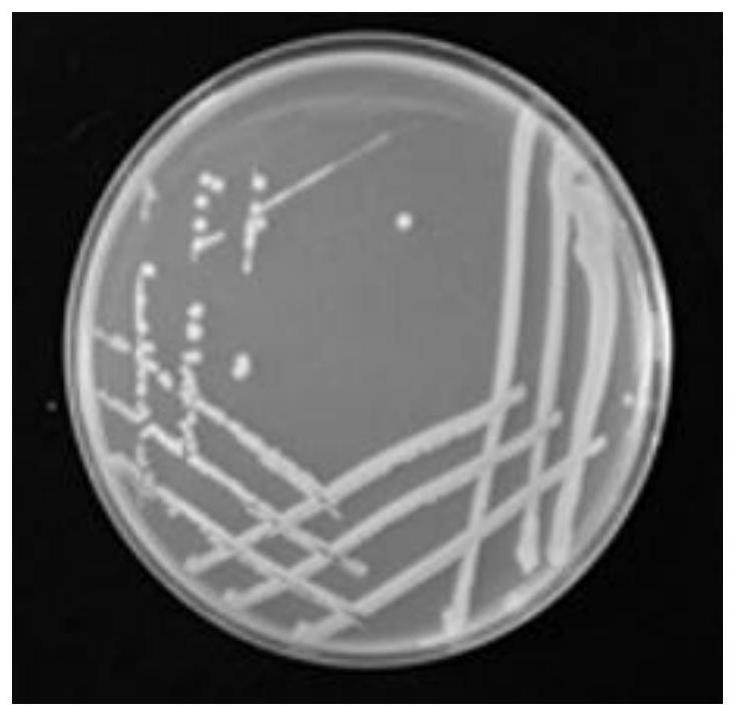
28.图1为实施例1中菌株klebsiella michiganensis wf-2的菌落形态图;
29.图2为实施例1中菌株klebsiella michiganensis wf-2在显微镜下的形态图;
30.图3为实施例2中菌株klebsiella michiganensis wf-2的系统发育树;
31.图4为实施例2中菌株klebsiella michiganensis wf-2的生长曲线图;
32.图5为实施例3中废水中氨氮浓度对菌株klebsiella michiganensis wf-2降解氨氮的实验结果图;
33.图6为实施例3中温度对菌株klebsiella michiganensis wf-2降解氨氮的实验结果图;
34.图7为实施例3中接种量对菌株klebsiella michiganensis wf-2降解氨氮的实验结果图;
35.图8为实施例3中废水中ph对菌株klebsiella michiganensis wf-2降解氨氮的实验结果图;
36.图9为实施例3中模拟废水中碳源对菌株klebsiella michiganensis wf-2降解氨氮的实验结果图;
37.图10为实施例3中模拟废水中碳氮比对菌株klebsiella michiganensis wf-2降解氨氮的实验结果图。
具体实施方式
38.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
39.此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
40.在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示意性实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本公开的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
41.实验过程中所需要的试剂和设备
42.在下述实施例中所用试剂,除非特别说明,均为本领域内的常规试剂,设备和方法均为该领域内常规设备和方法。
43.本发明所用培养基配置方法如下:
44.1、富集培养基(g/l):氯化铵0.382g;lb培养基25g;蒸馏水1000ml;ph 7.0。
45.2、初筛无机盐培养基(g/l):乙酸钠2.0g;七水硫酸镁0.05g;磷酸氢二钾0.2g;氯化钠0.12g;硫酸锰0.01g;硫酸亚铁0.01g;氯化铵1.9g;蒸馏水1000ml;ph 7.0。
46.3、复筛无机盐培养基(g/l):乙酸钠2.0g;七水硫酸镁0.05g;磷酸氢二钾0.2g;氯化钠0.12g;硫酸锰0.01g;硫酸亚铁0.01g;改变氯化铵的含量控制氨氮浓度;蒸馏水1000ml;ph 7.0。
47.4、固体富集培养基(g/l):氯化铵0.382;lb培养基25g;琼脂15g;蒸馏水1000ml;ph 7.0。
48.5、初始培养基(g/l):乙酸钠2.0g;七水硫酸镁0.05g;磷酸氢二钾0.2g;氯化钠0.12g;硫酸锰0.01g;硫酸亚铁0.01g;氯化铵0.382g;蒸馏水1000ml;ph 7.0。
49.实施例1
50.本技术发现一株能降解氨氮的降解菌,所述氨氮降解菌为密歇根克雷伯氏菌属klebsiella michiganensis sp,已于2021年09月10日送至中国微生物菌种保藏管理委员会普通微生物中心保藏,名称为:klebsiella michiganensis wf-2,保藏编号为cgmcc no.23386。地址:中国北京市朝阳区北辰西路。
51.上述的密歇根克雷伯氏菌(klebsiella michiganensis wf-2)从猪场废水中富集,分离,纯化得到,具体步骤如下:
52.步骤一:菌株的富集,分离,纯化
53.从某猪场收集废水,用无菌三角瓶保存于
–
20℃冰箱中保存。将10ml含活性污泥的猪场废水转入含富集培养基90ml的三角瓶中,放入振荡培养箱中于28℃,160r/min条件下培养24h,得到富集菌液。按5%的接种量将富集菌液接种到初筛无机盐培养基中相同条件下培养24h,重复操作筛选两次。将筛选后的菌液按照涂布稀释的方法以10-3
、10-4
、10-5
、10-6
、10-7
、10-8
六个浓度梯度在固体富集培养基上涂布,涂布完成后放入28℃的培养箱中倒置培养24h完成初筛。挑选固体培养基上不同的单菌落,进行分离纯化(划线重复2~3次),纯化后的单菌用甘油保存的方法冻存于-80℃冰箱中备用。
54.步骤二:菌株的复筛
55.将初筛得到的菌株在lb液体培养基中活化培养24h,取适量菌液于10ml离心管中进行离心,去上清,之后用无菌生理盐水洗涤菌体(重复两次),并配置成菌悬液,将该菌悬液的od
600
值调节至统一。按5%的接种量接入复筛无机盐培养基中,置于振荡培养箱中,在28℃,160r/min条件下培养48h后用多功能水质测定仪(lh-3ba)对氨氮浓度进行测定并计
算降解率。淘汰降解能力差的菌株,氨氮降解能力高的菌株用甘油管和斜面进行保存备用。
56.步骤三:降解菌株的鉴定
57.观察目的菌株的形态特征和显微镜下细菌细胞的形态,结合16srdna方法对细菌形态学和菌种种类进行全面鉴定。
58.菌落形态学观察方法如下:将目的菌株在富集液体培养基中富集培养24h后,运用划线法接种到固体富集培养基中,接种后的平板于28℃恒温培养箱中倒置培养48h后,从培养箱中取出,观察菌落的形态特征(大小、形状、透明度、颜色等)。
59.显微镜下细菌形态观察方法为:
60.制片与固定:用镊子夹取一片干净的载玻片,滴一小滴蒸馏水于载玻片上,使用接种环在富集液体培养基中蘸取少量菌体,于蒸馏水滴中涂匀,把载玻片放在酒精灯加热烘干,使菌体固定。
61.染色:等载玻片冷却后,用胶头滴管滴加结晶紫染液染色1分钟后,缓水流冲洗载玻片,洗去浮色,干燥载玻片,滴加香柏油。
62.镜检:将载玻片置于载物台上固定,调整光圈和粗准焦螺旋,先用低倍镜观察,待视野中出现清晰物象时,再换高倍油镜观察细菌形态。
63.目的菌株在平板上(lb固体培养基)培养24h后,菌落形态学特征如图1所示,菌株wf-2为圆形,湿润,半透明,乳白色,边缘整齐的菌落;在油镜下观察到的各菌株形态如图2所示。
64.基因组dna的提取:参照天根“细菌基因组dna提取试剂盒”的操作步骤进行。并使用琼脂糖凝胶电泳检测所提dna的质量。pcr扩增:选取细菌16s rdna通用引物,该引物序列如下:
65.上游引物:5
’‑
agagtttgatcctggctcag-3’,序列如seq id no.2所示;
66.下游引物:5
’‑
aaggaggtgatccagccgca-3’,序列如seq id no.3所示;
67.pcr产物经tiangen胶回收试剂盒纯化后,由生工生物工程(上海)股份有限公司进行测序(双向测通),将拼接后的测序结果在genbank数据库做序列比对分析,并用clustal x 1.8软件进行序列比对,同时用mega7软件构建系统发育进化树如图3所示。
68.从系统发育分析结果可知,菌株与klebsiella michiganensis(xs3-1)亲缘关系接近,同源性为99%,确定菌株wf-2为密歇根克雷伯氏菌(klebsiella michiganensis)。klebsiella michiganensis wf-2的核苷酸序列如seq id no.1所示。
69.实施例2
70.菌株klebsiella michiganensis wf-2生长曲线的绘制。
71.将实施例1中甘油冻存的菌液接种到装有100ml的lb液体培养基中进行活化培养,在振荡培养箱中于28℃、160r/min条件下培养16~18个小时,制作成种子液,分别以5%的接种量将种子液接种到14瓶活化液体培养基中,而后放置到振荡培养箱中在28℃、160r/min条件下培养28h,每隔2h使用紫外分光光度计测定菌液的od
600
值,对照组为未接菌的活化液体培养基。生长曲线如图4所示。培养10~14h的菌液细菌生命代谢活动旺盛,各种特征也比较稳定。采用培养10~14h的菌液作为后续实施例研究的接种液最为合适。
72.实施例3
73.菌株klebsiella michiganensis wf-2降解氨氮的最优条件。
74.接种液制备;将筛选得到的目的菌株接种到液体活化培养基中,28℃、160r/min条件下培养至菌株生长对数期,无菌条件下取适量菌液于离心管中高速离心,去上清,菌体用无菌生理盐水洗涤沉淀2-3次并制成菌悬液,调节菌液od
600
至统一后以5%的接种量接入不同处理的模拟废水中进行菌株在模拟废水中氨氮降解特性的研究。
75.氨氮降解率的计算方式:removal efficiency(%)=(c
0-c
t
)/c0*100%其中:c0和c
t
(mg/l)分别为氨氮初始浓度和t时刻浓度。
76.(1)废水中氨氮浓度对菌株降解氨氮的影响
77.将目的菌株接入ph值为7.0的模拟废水中,调节模拟废水中的氨氮浓度分别为100mg/l、300mg/l、500mg/l、700mg/l、900mg/l,在30℃、180r/min条件下振荡培养3d后对氨氮浓度进行测定并计算氨氮降解率。结果如图5所示。菌株wf-2在初始氨氮浓度为100mg/l、300mg/l、500mg/l、700mg/l、900mg/l氨氮降解率分别为71.65%、49.99%、42.93%、26.31%、21.89%。初始氨氮浓度为100mg/l时降解率显著高于其他浓度下的降解率。因此,综合菌株在不同初始氨氮浓度下的降解率,选择初始氨氮浓度为100mg/l的模拟废水进行后续试验。
78.(2)温度对菌株降解氨氮的影响
79.设置模拟废水的初始氨氮浓度为100mg/l,调节ph至7.0,将接种了目的菌株的模拟废水分别置于20℃、25℃、30℃、35℃和40℃的培养箱中,180r/min条件下振荡培养3d后对氨氮浓度进行测定并计算氨氮降解率。结果如图6所示。从图6我们可以看出菌株wf-2的氨氮降解率在温度35℃时最高达到68.10%,其次为30℃,氨氮降解率为67.16%。属于中温细菌,当该菌株在35~40℃条件下培养,其在模拟废水中氨氮降解能力均无显著变化,在后续的大规模培养中,不一定要求温度的恒定,但综合考虑之后,后续试验中的培养温度调节至35℃左右作为适宜。
80.(3)接种量对菌株降解氨氮的影响
81.在初始氨氮浓度为100mg/l,ph为7的模拟废水中,分别以0.5%、1%、2%、3%、4%、5%和10%的接种量接入目的菌株,在35℃、180r/min条件下振荡培养3d后对模拟废水氨氮浓度进行测定并计算氨氮降解率。结果如图7所示。菌株wf-2以0.5%~1%的接种量接入模拟废水中时,氨氮降解能力较强,可分别去除模拟废水中77.43%,76.53%的氨氮含量,随着接种量的增大,菌株氨氮降解能力逐渐减弱,当接种量增大至10%时,该菌株的氨氮降解能力仅为27.1%。结合实际情况考虑,后续试验中目的菌株将以0.5%的接种量接入模拟废水中。
82.(4)ph值对菌株降解氨氮的影响
83.调节模拟废水的ph值分别为6.0、6.5、7.0、7.5、8.0,初始氨氮浓度100mg/l,以0.5%的接种量接入目的菌株,在35℃、180r/min条件下振荡培养3d后对模拟废水的氨氮浓度进行测定并计算氨氮降解率。结果如图8所示。菌株wf-2在初始ph值为7的模拟废水中其氨氮去除效率最大,达到86.2%,氨氮降解率在ph 6.0、6.5、7.5、8.0分别为78.7%、85.0%、83.8%、81.3%。综合考虑后调节模拟废水中的初始ph值为7以进行后续试验。
84.(5)碳源对菌株降解氨氮的影响
85.分别以葡萄糖、蔗糖、淀粉、乙酸钠、丁二酸钠、碳酸氢钠为模拟废水中的唯一碳源,初始氨氮浓度100mg/l,调节ph值为7,以0.5%的接种量接入目的菌株,在35℃、180r/
min条件下振荡培养3d后对模拟废水的氨氮浓度进行测定并计算氨氮降解率。结果如图9所示。菌株wf-2在乙酸钠作为碳源时降解率最优秀为80.22%,在丁二酸钠和蔗糖作为碳源时效果次之,分别为63.63%,50.85%。在淀粉,碳酸氢钠和葡萄糖作为碳源时效果较差。总得来说,该菌对无机碳源的利用率要显著高于有机碳源的。综合考虑,后续试验中继续选用乙酸钠作为模拟废水中的唯一碳源进行研究。
86.(6)碳氮比对菌株降解氨氮的影响
87.以乙酸钠为唯一碳源,调节模拟废水中的碳氮比分别为3:1、5:1、8:1、10:1和15:1,设置浓度为100mg/l,调节ph值为7,以0.5%的接种量接入目的菌株,在35℃、180r/min条件下振荡培养3d后对氨氮浓度进行测定并计算氨氮降解率。结果如图10所示。菌株wf-2在碳氮比为3:1,5:1的条件下氨氮降解率一般,分别为57.38%,77.5%。在碳氮比8:1、10:1的条件氨氮降解率良好,分别为90.06%,89.45%。在碳氮比15:1的条件下氨氮降解率最优,为92.37%。一般来说,c/n越高,越有利于硝化细菌的生长,这与本实施例的结果相同。一般来讲,c/n越高,越有利于硝化细菌的生长,但当模拟废水中的c/n由8:1逐渐升高到15:1时,此过程中虽然菌株的氨氮降解效率有所提高,但提高效果不明显,目的菌株的氨氮降解率呈现逐渐稳定的趋势,说明在本实施例中,c/n比也并非是越大越好。综合菌株在不同c/n下的氨氮降解情况,选定c/n为15:1为最佳条件。
88.菌株klebsiella michiganensis wf-2氨氮降解菌在模拟废水中的最佳培养条件为初始氨氮浓度100mg/l、培养温度35℃、接种量0.5%、ph值7.0、以乙酸钠为唯一碳源、碳氮比为15:1,在最佳条件下培养3d,氨氮降解率可达到92.37%。
89.以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只限于这些说明。对于本发明所属领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1