联芳基化合物的制作方法
联芳基化合物
1.本技术主张如下优先权:
2.申请号cn202110624336.5,申请日2021年06月04日。
技术领域
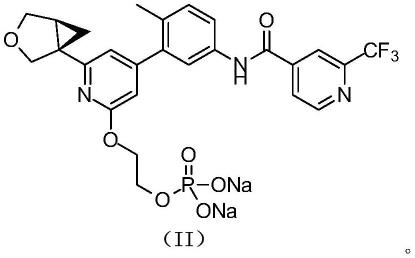
3.本发明公开了一种联芳基化合物,具体公开了式(ii)所示化合物、或其药学上可接受的盐,以及它们在治疗相关疾病中的应用。
背景技术:
4.丝分裂原活化蛋白激酶(mitogen-activated protein kinase,mapk)通路是细胞内一条重要的信号转导通路,该通路通过ras/raf/mek/erk的特异性级联磷酸化将信号由细胞外传入细胞核内,最终导致特定基因的激活,引起细胞增殖、凋亡或分化。该通路过度激活与多种肿瘤的发生密切相关。raf是ras/raf/mek/erk信号通路中一个非常重要的丝氨酸/苏氨酸蛋白激酶,位于ras的下游,可以被ras激活。raf家族包括araf、braf、craf(raf-1)三种亚型,具有高度的同源性和相似的结构域。野生型raf能够产生三种亚型的同源或异源二聚体。araf和craf突变较少发生,braf突变率较高。约5%~10%的恶性肿瘤,包括66%的黑色素瘤患者存在braf突变。raf激酶作为ras下游的关键信号蛋白,在ras突变基因突变肿瘤的治疗中具有重要的研究意义。通过抑制raf激酶,调控mapk信号传导,从而对ras突变肿瘤细胞的增殖发挥作用。因此,raf激酶已成为临床治疗肿瘤的重要靶标。
5.第一代braf激酶抑制剂vemurafenib,dabrafenib和encorafenib已经被fda批准用于发生b-raf
v600e
突变癌症的治疗。尽管vemurafenib,dabrafenib和encorafenib在b-raf
v600e
突变黑色素瘤的治疗上表现出可喜的疗效,但依然存在一定的局限性。大多数使用这两种药物的患者起初肿瘤缩小,但在一年内复发(获得性耐药性);产生这一耐药的主要机制是mapk信号通路被重新激活。研究发现在braf发生v600e突变的基础上,nras突变能够在抑制剂的存在下导致mapk通路激活,产生耐药性。突变的n-ras促进b-raf
v600e
和c-raf形成同源或异源二聚体。抑制剂结合在二聚体的某个单体上,可降低药物对另一个单体的亲和力,促进无抑制剂作用的单体磷酸化,导致mek的激活。目前,临床上克服mapk通路被重新激活导致耐药性的主要方法是通过联合使用raf和mek抑制剂阻断mapk通路的2个关键位点,以延缓耐药性产生。除此之外,开发新一代pan-raf抑制剂以克服耐药性以及扩展临床应用范围也正在开发中,pan-raf抑制剂可以抑制二聚体活性,阻断通路的反常激活(paradoxcal activation),从而可以减耐药性。处于临床研究的pan-raf二聚体抑制剂主要有hm95573、tak-580、bgb-283、lxh254,以及ly3009120等,这些新型raf抑制剂的研发,有望克服第一代抑制剂的耐药性,进一步扩大临床应用。
技术实现要素:
6.本发明提供式(ii)化合物
[0007][0008]
本发明还提供式(ii)化合物在制备raf激酶抑制剂中的应用,
[0009][0010]
本发明还提供式(ii)化合物在制备治疗肺癌药物中的应用,
[0011][0012]
技术效果
[0013]
本发明化合物类药性良好,具有良好的raf酶抑制活性和多种细胞抗增殖活性,同时具有良好的体内药效。有望解决当前braf
v600e
突变癌症治疗的耐药性问题,以及为ras突变类型癌症提供有效治疗。
[0014]
定义和说明
[0015]
本发明的化合物可以通过本领域技术人员所熟知的常规方法来确认结构,如果本发明涉及化合物的绝对构型,则该绝对构型可以通过本领域常规技术手段予以确证。例如单晶x射线衍射法(sxrd),把培养出的单晶用bruker d8 venture衍射仪收集衍射强度数据,光源为cukα辐射,扫描方式:扫描,收集相关数据后,进一步采用直接法(shelxs97)解析晶体结构,便可以确证绝对构型。
[0016]
本发明所使用的溶剂可经市售获得。
[0017]
本发明采用下述缩略词:
[0018]
pd(dppf)cl2·
dcm代表[1,1'-双(二苯基膦基)二茂铁]二氯化钯-二氯甲烷复合物,[ir(cod)ome]2代表环辛二烯甲氧基铱二聚物,tmphen代表3,4,7,8-四甲基-1,10菲萝啉,pd2dba3代表三-二苯丙酮-二钯,brettphos代表(2-二环己基膦-3,6-二甲氧基-2',4',
6'-三异丙基-1,1'-联苯,pe代表石油醚,ea代表乙酸乙酯,dmso代表二甲亚砜。
具体实施方式
[0019]
下面通过实施例对本发明进行详细描述,但并不意味着对本发明任何不利限制。本发明的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。对本领域的技术人员而言,在不脱离本发明精神和范围的情况下针对本发明具体实施方式进行各种变化和改进将是显而易见的。
[0020]
实施例1:式(i)化合物的制备
[0021][0022]
化合物2
[0023]-78℃下,向化合物1(10克,51.96毫摩尔)的二氯甲烷(100ml)溶液中加入正丁基锂(23ml,2.5m),搅拌30分钟。-78℃下,向该混合液中加入1a(4.92克,57.16毫摩尔),升温至25℃搅拌0.5小时。向反应混合物中加入饱和氯化铵溶液(40ml),用二氯甲烷(40ml
×
2)萃取,合并后的萃取液用无水硫酸钠干燥后浓缩,经柱层析(pe/ea=10/1至5/1,v/v)分离得化合物2。1hnmr(400mhz,cdcl3)δ7.72(t,j=7.8hz,1h),7.47(d,j=7.2hz,1h),7.28(d,j=7.2hz,1h),4.35(s,1h),4.24-4.14(m,2h),4.05-4.00(m,1h),3.96-3.92(m,1h),2.45(td,j=8.8,13.0hz,1h),2.32-2.22(m,1h)。
[0024]
化合物3
[0025]
向2(6克,30.06毫摩尔)的甲苯(80ml)溶液中加入对甲苯磺酸(11.5克,60.46毫摩尔),升温至110℃搅拌16小时。向反应混合物中加入饱和碳酸氢钠溶液(40ml)和乙酸乙酯(100ml),分液,有相机用饱和碳酸氢钠溶液(50ml
×
2)洗涤,无水硫酸钠干燥后浓缩,经硅胶柱层析(pe/ea=50/1至20/1,v/v)分离得化合物3。1hnmr(400mhz,cdcl3)δ7.64(t,j=7.8hz,1h),7.23(dd,j=5.2,7.8hz,2h),6.68(quin,j=2.0hz,1h),5.08(dt,j=2.0,5.0hz,2h),4.91(dt,j=2.0,5.0hz,2h)。
[0026]
化合物4
4.81(t,j=5.2hz,1h),4.35-4.30(t,j=5.2hz,2h),4.13-4.03(m,2h),3.83-3.70(m,4h),2.24(s,3h),2.22-2.08(ddd,j=2.4,5.0,7.8hz,1h),1.40-1.32(dd,j=3.6,7.8hz,1h),1.02-0.96(t,j=4.4hz,1h)。ms(esi)m/z:500.4[m+h]
+
。
[0036]
式(i)化合物
[0037]
化合物8经sfc手性分离(手性柱daicel chiralcel oj-h(250mm*30mm,5μm),流动相a:乙醇(含0.05%diea);流动相b:二氧化碳)得到8a(保留时间1.487min)和式(i)化合物(保留时间1.590min)。8a是式(i)化合物对映异构体。
[0038]
化合物8a:1hnmr(400mhz,dmso-d6)δ10.70(s,1h),9.06-8.95(d,j=5.0hz,1h),8.37(s,1h),8.23-8.18(d,j=4.2hz,1h),7.77-7.71(dd,j=2.2,8.4hz,1h),7.68-7.64(d,j=2.2hz,1h),7.39-7.31(d,j=8.4hz,1h),6.73(s,1h),6.59-6.54(d,j=1.0hz,1h),4.86-4.81(t,j=5.2hz,1h),4.35-4.30(t,j=5.2hz,2h),4.13-4.03(m,2h),3.83-3.70(m,4h),2.24(s,3h),2.22-2.08(ddd,j=2.4,5.0,7.8hz,1h),1.40-1.32(dd,j=3.6,7.8hz,1h),1.02-0.96(t,j=4.4hz,1h)。ms(esi)m/z:500.4[m+h]
+
,100%(ee%)。
[0039]
式(i)化合物:1hnmr(400mhz,dmso-d6)δ10.70(s,1h),9.06-8.95(d,j=5.0hz,1h),8.37(s,1h),8.23-8.18(d,j=4.2hz,1h),7.77-7.71(dd,j=2.2,8.4hz,1h),7.68-7.64(d,j=2.2hz,1h),7.39-7.31(d,j=8.4hz,1h),6.73(s,1h),6.59-6.54(d,j=1.0hz,1h),4.86-4.81(t,j=5.2hz,1h),4.35-4.30(t,j=5.2hz,2h),4.13-4.03(m,2h),3.83-3.70(m,4h),2.24(s,3h),2.22-2.08(ddd,j=2.4,5.0,7.8hz,1h),1.40-1.32(dd,j=3.6,7.8hz,1h),1.02-0.96(t,j=4.4hz,1h)。ms(esi)m/z:500.4[m+h]
+
,99.7%(ee%)。
[0040]
实施例2式(ii)化合物的制备
[0041][0042]
化合物ii-1
[0043]
向式(i)化合物(1.0克,2.0毫摩尔),ii-1a(1.4克,4.04毫摩尔)的二氯甲烷
(40ml)中加入四氮唑(284.0毫克,4.05毫摩尔),反应混合物在氮气保护下,加热至40℃搅拌16小时。反应液直接用于下步反应,得化合物ii-1粗品。
[0044]
化合物ii-2
[0045]
向化合物ii-1(1.5克,2.02毫摩尔)的二氯甲烷(40ml)中加入ii-2a(0.8毫升,4.05毫摩尔,5m正己烷溶液),反应混合物在氮气保护下,25℃搅拌45分钟。将反应液经硅胶柱层析(pe/ea=5/1至2/1,含20%二氯甲烷)分离,得化合物ii-2。1h nmr(400mhz,dmso-d6)δ10.69(s,1h),8.99(br d,j=5.0hz,1h),8.36(s,1h),8.19(br d,j=4.6hz,1h),7.82-7.71(m,1h),7.64(s,1h),7.33(s,11h),6.76(s,1h),6.56(s,1h),5.13-4.88(m,4h),4.47(br s,2h),4.33(br s,2h),4.14-4.02(m,2h),3.82-3.67(m,2h),2.25-2.16(m,3h),2.16-2.11(m,1h),1.36(br dd,j=3.6,7.8hz,1h),1.00-0.93(m,1h)。
[0046]
化合物ii-3
[0047]
向化合物ii-2(1.4克,1.84毫摩尔)的二氯甲烷(2ml)中加入三氟乙酸(10毫升,135.06毫摩尔)和水(1毫升,55.49毫摩尔),反应混合物在25℃搅拌8小时。将反应液浓缩,用乙酸乙酯(30ml)溶解后用水(20ml
×
2)洗涤,向有机相中加入饱和碳酸钠溶液(30ml),分液后弃去有机相,水相用乙酸乙酯洗涤(15ml
×
2),向水相中加入盐酸(2m)调ph=3-4,再用乙酸乙酯萃取(20ml
×
3),有机相用无水硫酸钠干燥后浓缩,得化合物ii-3粗品。1hnmr(400mhz,dmso-d6)δ10.70(s,1h),8.99(d,j=5.0hz,1h),8.36(s,1h),8.19(d,j=5.0hz,1h),7.75(dd,j=2.0,8.4hz,1h),7.65(d,j=2.0hz,1h),7.34(d,j=8.4hz,1h),6.76(s,1h),6.60(s,1h),4.50-4.40(m,2h),4.20-4.13(m,2h),4.11-4.03(m,2h),3.84-3.73(m,2h),2.23(s,3h),2.19(ddd,j=2.6,5.0,7.8hz,1h),1.39(dd,j=3.8,7.8hz,1h),0.98(t,j=4.4hz,1h)。
[0048]
式(ii)化合物
[0049]
向化合物ii-3(1.0克,1.73毫摩尔)的四氢呋喃(10ml)中加入氢氧化钠(140毫克,3.50毫摩尔)的水溶液(10ml),反应混合物25℃搅拌1小时。反应液浓缩后,用乙腈(10ml)和水(40ml)溶解,真空冻干,得式(ii)化合物。1hnmr(400mhz,dmso-d6)δ11.08(s,1h),8.99-8.92(d,j=5.0hz,1h),8.38(s,1h),8.33-8.25(d,j=5.0hz,1h),7.88-7.80(dd,j=1.6,8.4hz,1h),7.72-7.65(d,j=1.8hz,1h),7.33-7.26(d,j=8.4hz,1h),6.72(s,1h),6.59(s,1h),4.37-4.31(br t,j=4.8hz,2h),4.11-4.02(m,2h),3.98-3.92(br d,j=4.8hz,2h),3.80-3.75(m,2h),2.21(s,3h),2.18-2.10(ddd,j=2.4,4.8,7.6hz,1h),1.39-1.32(dd,j=4.0,7.6hz,1h),0.98-0.93(t,j=4.4hz,1h)。ms(esi)m/z:580.1[m+3h-2na]
+
。
[0050]
实施例3:体外酶活性测试
[0051]
实验目的:
[0052]
检测化合物对craf酶活性的抑制效应。
[0053]
实验材料:
[0054]
表1
[0055]
实验材料品牌货号craf蛋白creative biomart-raf1-416hmek1蛋白invitrogen-pr3984aadp-glo激酶检测试剂盒promega-v9102
tris-hcl,ph 7.4sigma-t2663-1lmgcl2sigma-63020-1lnaclsigma-s5150dttinvitrogen-p2325triton x-100sigma-x100h2ogibco-15230-162384中间板greiner-781280384实验板perkinelmer-6007299
[0056]
实验步骤:
[0057]
(1)化合物准备:
[0058]
用dmso将待测化合物及参考化合物稀释到100μm,并用echo对化合物进行3倍梯度稀释,得到11个浓度梯度的目标板。
[0059]
(2)实验流程:
[0060]
1)缓冲液配制:50mm tris-hcl(ph 7.4),3.5mm mgcl2,150mm nacl,1mm dtt,0.02%triton x-100,h2o;
[0061]
2)用缓冲液配置mek1和atp的混合液,向384中间板中加入5μl底物混合液;
[0062]
3)用缓冲液将craf酶稀释,向384中间板中加入5μl;
[0063]
4)用bravo转移5μl反应混合液到384实验板中,离心15秒后放入23度恒温箱中孵育。
[0064]
5)1小时后,向384实验板中加入5μl adp-glo,震荡,离心15秒后放入23度恒温箱中孵育。
[0065]
6)40分钟后,向384实验板中加入10μl激酶检测试剂,震荡,离心15秒后放入23度恒温箱中孵育。
[0066]
7)1小时后,在envision上读板。
[0067]
实验结果:表2提供了本发明的化合物对craf酶的抑制活性。
[0068]
表2:化合物的体外活性
[0069][0070]
实施例4:calu-6(kras
q61k
)抗增殖活性实验
[0071]
实验材料:
[0072]
表3实验试剂耗材
[0073]
名称品牌货号emem培养基维森特-320-005-cl胎牛血清biosera-fb-1058/5000.25%胰蛋白酶源培-s310kj双抗(青霉素、链霉素)procell-pb180120celltiter glopromega-g7573
细胞板corning-3610
[0074]
表4实验仪器
[0075]
名称品牌货号细胞计数板求精victor nivoperkinelmer
[0076]
实验步骤:
[0077]
细胞接种:
[0078]
(1)细胞培养基:89%emem,10%胎牛血清和1%青霉素-链霉素;
[0079]
(2)除去细胞培养瓶中原有培养基,用胰酶消化细胞后计数,用培养基将细胞悬液稀释到铺板所需的细胞密度3.75
×
104个细胞每毫升;
[0080]
(3)在细胞板四周每孔中加入100μl培养基,向其它孔中加入80μl细胞悬液,放入含5%co2的37度培养箱中培养过夜。
[0081]
加药:
[0082]
用echo对化合物进行梯度稀释和加药,然后将细胞板放回到培养箱中培养三天;
[0083]
读板、分析数据:
[0084]
加ctg并读板:向细胞板的每个孔中加入20μl celltiterglo,避光震荡10min,在victor nivo上读板。
[0085]
实验结果:表1提供了本发明化合物对calu-6细胞的抗增殖活性。
[0086]
实施例5:hct-116(kras
g13d
)抗增殖活性实验
[0087]
实验材料:
[0088]
表5实验试剂耗材
[0089]
名称品牌货号mc’coy 5a培养基bi-01-075-1acs胎牛血清biosera-fb-1058/5000.25%胰蛋白酶源培-s310kj双抗(青霉素、链霉素)procell-pb180120celltiter glopromega-g7573细胞板corning-3610
[0090]
表6实验仪器
[0091]
名称品牌货号细胞计数板求精victor nivoperkinelmer
[0092]
实验步骤:
[0093]
细胞接种:
[0094]
(1)细胞培养基:89%mc’coy 5a,10%胎牛血清和1%青霉素-链霉素;
[0095]
(2)除去细胞培养瓶中原有培养基,用胰酶消化细胞后计数,用培养基将细胞悬液稀释到铺板所需的细胞密度2.5
×
104个细胞每毫升;
[0096]
(3)在细胞板四周每孔中加入100μl培养基,向其它孔中加入80μl细胞悬液,放入
含5%co2的37度培养箱中培养过夜。
[0097]
加药:
[0098]
对化合物进行梯度稀释和加药,然后将细胞板放回到培养箱中培养三天;
[0099]
读板、分析数据:
[0100]
加ctg并读板:向细胞板的每个孔中加入20μl celltiterglo,避光震荡10min,在victor nivo上读板。
[0101]
实验结果:表2提供了式(i)化合物对hct-116细胞的抗增殖活性。
[0102]
实施例6:hct116(kras
g13d
)erk磷酸化抑制试验
[0103]
实验材料:
[0104]
表7试剂耗材
[0105]
试剂品牌货号人erk磷酸化蛋白高灵敏检测试剂盒cisbio-64aerpehrpmi1640培养基gibco-22400089胎牛血清hyclone-sv30087.0396htrf微孔板cisbio-66pl9602596微孔板costar-3599dmsosigma-d2650-100ml0.05%trypsin-edtagibco-25300-062
[0106]
表8主要仪器
[0107]
仪器生产厂家型号生物安全柜airtechbsc-1304iia2二氧化碳培养箱thermo311细胞计数仪beckmanvi-cellxr酶标仪perkinelmerenvision离心机eppendorfcentrifuge 5810r
[0108]
表9细胞信息
[0109]
细胞名称来源货号结肠癌hct116atccatcc-htb-132
[0110]
实验步骤和方法:
[0111]
1)复苏细胞并培养至对数生长期,用胰酶消化,种96孔板,放入培养箱中孵育过夜。
[0112]
2)将dmso溶解的系列梯度化合物加入96孔板中,放回至培养箱中孵育1小时。
[0113]
3)取出细胞板,去上清,加入细胞裂解液(含1%的封闭肽)室温孵育裂解30分钟。
[0114]
4)每孔转移16μl细胞裂解液至htrf板中,随后加入配置好的抗体混合液4μl。
[0115]
5)孵育过夜后用envision读板,根据ratio(ex665/ex615荧光强度的比值)得到拟合的曲线并根据
[0116]
graphpad的四参数拟合公式y=bottom+(top-bottom)/(1+10^((logec50-x)*hillslope))计算得出ec
50
。
[0117]
实验结果:表1提供了式(i)化合物对hct-116erk磷酸化抑制活性。
[0118]
实施例7:calu-6(kras
q61k
)erk磷酸化抑制试验
[0119]
实验材料:
[0120]
表10试剂耗材
[0121]
试剂品牌货号人erk磷酸化蛋白高灵敏检测试剂盒cisbio-64aerpehrpmi1640培养基gibco-22400089胎牛血清hyclone-sv30087.0396htrf微孔板cisbio-66pl9602596微孔板costar-3599dmsosigma-d2650-100ml0.05%trypsin-edtagibco-25300-062
[0122]
表11主要仪器
[0123]
仪器生产厂家型号生物安全柜airtechbsc-1304iia2二氧化碳培养箱thermo311细胞计数仪beckmanvi-cellxr酶标仪perkinelmerenvision离心机eppendorfcentrifuge 5810r
[0124]
表12细胞信息
[0125]
细胞名称来源货号calu6atccatcc-htb-56
[0126]
实验步骤和方法:
[0127]
1)复苏细胞并培养至对数生长期,用胰酶消化,种96孔板,放入培养箱中孵育过夜。
[0128]
2)将dmso溶解的系列梯度化合物加入96孔板中,放回至培养箱中孵育1小时。
[0129]
3)取出细胞板,加入细胞裂解液(含1%的封闭肽)室温孵育裂解30分钟。
[0130]
4)每孔转移16μl细胞裂解液至htrf板中,随后加入配置好的抗体混合液4μl。
[0131]
5)孵育过夜后用envision读板,根据ratio(ex665/ex615荧光强度的比值)得到拟合的曲线并根据graphpad的四参数拟合公式y=bottom+(top-bottom)/(1+10^((logec50-x)*hillslope))计算得出ec
50
。
[0132]
实验结果:表2提供了式(i)化合物对calu-6 erk磷酸化抑制活性。
[0133]
结论:式(i)化合物对craf酶具有较强的抑制活性,同时对calu-6细胞和hct-116细胞具有较好的抗增殖活性和erk磷酸化抑制活性。
[0134]
实施例8:小鼠体内药代动力学研究实验
[0135]
实验目的
[0136]
检测本发明化合物在小鼠体内的药代动力学参数
[0137]
实验方案
[0138]
1)实验药品:式(i)化合物和式(ii)化合物;
[0139]
2)实验动物:4只雌性cd-1小鼠,分为2组,每组2只;
[0140]
3)药物配制:称取适量药物溶解于solutol(5%体积)、dmso(5%体积)和peg-300(25%体积)的水溶液中,用于注射给药。称取适量药物分散于5%的solutol水溶液(80%体积),再加入peg-400(20%体积),混合均匀,用于灌胃给药。solutol为聚乙二醇-15-羟基硬脂酸酯。
[0141]
实验操作
[0142]
第一组动物通过静脉注射给予剂量为2mg/kg、浓度为1mg/ml的化合物。动物于给药后0.117、0.333、1、2、4、7和24小时采集血浆样品;第二组动物通过灌胃给予剂量为100mg/kg、浓度为10mg/ml的化合物。动物于给药后0.0833、0.25、0.5、1、2、4、6、8和24小时采集血浆样品;使用lc-ms/ms方法测定各点的药物浓度,得出测试药物的动力学参数如下表13和表14。
[0143]
表13
[0144][0145]
表14
[0146][0147]
注:
*
式(ii)化合物灌胃给药时折算成式(i)化合物的质量,
**
测量值为式(i)化合物的各项参数。
[0148]
实验结论:本发明化合物有良好的小鼠体内药代动力学性质。
[0149]
实施例9:大鼠体内药代动力学研究实验
[0150]
实验目的
[0151]
检测本发明化合物在大鼠体内的药代动力学性质
[0152]
实验方案
[0153]
1)实验药品:式(ii)化合物;
[0154]
2)实验动物:2只雄性sd大鼠;
[0155]
3)药物配制:称取适量药物溶解于水中,用于灌胃给药。
[0156]
实验操作
[0157]
动物通过灌胃给予剂量为870mg/kg、浓度为87mg/ml的化合物。动物于给药后0.0833、0.25、0.5、1、2、4、6、8和24小时采集血浆样品;使用lc-ms/ms方法测定各时间点的式(ii)化合物及式(i)化合物在血浆中的浓度如下表14。
[0158]
表15
[0159]
化合物/时间点0.083h0.25h0.5h1h2h4h6h8h24h式(i)化合物浓度(nm)336468714439152181330311684883897884060式(ii)化合物浓度(nm)2001111272731155179988225
[0160]
实验结论:本发明式(ii)化合物在大鼠体内可以快速代谢为式(i)化合物,有良好药代动力学性质。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1