一种分子标记引物及马铃薯晚疫病检测方法与流程
1.本发明属于马铃薯晚疫病基因检测领域,涉及检测马铃薯晚疫病的分子标记引物,以及使用该分子标记引物在马铃薯晚疫病检测方法中的应用。
背景技术:
2.马铃薯的全球种植面积和总产量仅次于水稻、小麦和玉米,是全球第四大作物。我国是全球最大的马铃薯生产国,将马铃薯列为水稻、小麦、玉米之后的第四大主粮。马铃薯生产实践中多采用块茎繁殖,但这种营养繁殖方式易造成病原菌代代相传并不断积累,其中尤以马铃薯晚疫病最为严重。马铃薯晚疫病是一种在全世界绝大多数马铃薯种植区流行的毁灭性病害,是马铃薯最具毁灭性的病害,在马铃薯整个生育期内,只要条件适宜,其病原菌——致病疫霉phytophthora infestans即可快速产生大量游动孢子,并在短时间内完成数代循环侵染,导致30-60%的产量损失,甚至绝收。时至今日,马铃薯晚疫病每年造成的经济损失依然超过60亿美元,如何有效防控该病害仍是全球面临的共同问题。
3.传统的晚疫病检测方法包括观察发病症状和分离病原物进行形态学鉴定两种。然而直接观察容易遗漏发病初期的植物材料,且致病疫霉引发的病害易与pythiumspp.,fusariumspp. 和rhizoctoniaspp.引起的病害症状混淆。因此,分离得到致病疫霉菌是非常有必要的。但致病疫霉的分离纯培养有较高的技术要求,且可用于病菌鉴定的形态学特征很少,鉴定起来也比较困难。
4.分子检测的出现为植物病害的快速、准确诊断提供了新的思路和方法。近年来基于pcr 技术的植物病害分子检测技术在植物病害防治中起着越来越重要的作用。
5.在实现本发明过程中,发明人发现现有技术中至少存在如下技术问题中的一个问题:
6.基于转录间隔区(its)、线粒体基因cox1-cox2等靶标的分子检测技术受限于序列差异小、gc含量高等原因,难以将靶标疫霉菌与其近缘种区分开或不适宜于用作分子靶标。
7.现有技术中公开了以致病疫霉ypt1序列为分子靶标,设计了2对引物对11种不同疫霉菌进行检测,结果显示11种疫霉菌均有扩增条带,引物特异性较低。
8.现有技术还公开了以致病疫霉核糖体dna转录间隔区(internal transcribed spacer,its) its-1为检测靶标开发了一套分子检测技术体系,但该检测靶标不能区分近缘种芋疫霉 (phytophthora colocasiae)、恶疫霉(phytophthora cactorum)和棕榈疫霉(phytophthorapalmivora)。
9.线粒体基因cox1-cox2通常gc含量较高,而lpv基因又少有研究,只针对部分疫霉菌可以进行有效检测,不适用于致病疫霉菌的检测。
10.病害分子检测体系的建立,关键在于使用合适的分子靶标。
11.因此,发掘新的分子检测靶标,对于完善致病疫霉分子精准检测体系及提高我国马铃薯晚疫病病害管理水平具有重要意义。
技术实现要素:
12.鉴于此,本发明目的在于提供一种能够精准检测马铃薯晚疫病的分子标记引物。
13.本发明的又一目的在于提供一种使用前述分子标记引物检测马铃薯晚疫病的方法。
14.发明人通过长期的探索和尝试,以及多次的实验和努力,不断的改革创新,为解决以上技术问题,本发明提供的技术方案是,提供一种用于检测马铃薯晚疫病的分子标记引物,所述分子标记为下列引物对中的一对或多对:
15.第一引物对:
16.第一上游引物pif1:5'-gctaccaacatcttccacaatct-3';
17.第一下游引物pir1:5'-tctctaaaacctctgagcccct-3';
18.第二引物对:
19.第二上游引物pif2:5'-ctgaaaatggacggggatagcga-3';
20.第二下游引物pir2:5'-tgcgatgtgagcgatggcaaatg-3';
21.第三引物对:
22.第三上游引物pif3:5'-atggacggggatagcgactctta-3';
23.第三下游引物pir3:5'-gatgcccttgctgactcacctg-3'。
24.本发明还提供了一种马铃薯晚疫病的检测方法,使用权利要求1所述分子标记引物,包括如下步骤:
25.a)提取待测材料组织dna;
26.b)以步骤a)提取得到的dna为模板,使用所示分子标记引物进行pcr扩增,扩增程序为:94℃预变性3min;94℃变性30s,59.3℃退火30s,72℃延伸1min,共30个循环;最后72℃延伸8min;
27.c)pcr扩增产物用1.5%的琼脂糖凝胶电泳检测。
28.根据本发明马铃薯晚疫病的检测方法的一个具体实施方式,所述pcr扩增的总体系为 20μl:无菌ddh2o7μl、10μm上游引物1μl、10μm下游引物1μl、2
×
easy taq pcr super mix 酶10μl、模板dna 1μl。
29.与现有技术相比,上述技术方案中的一个技术方案具有如下优点:
30.a)本发明提供的三对引物仅在致病疫霉dna为模板时能获得阳性扩增条带,扩增产物经测序分析与预期序列的相似度分别为94.96%、97.71%、96.44%,而在以辣椒疫霉等近缘种的基因组dna为模板时均无克隆条带,引物特异性好,能有效区分近缘种。
31.b)本发明3对引物在59.3℃均能获得很好的扩增效果,检测灵敏度分别达到26.9、 2.42、25.5拷贝/μl。
32.c)本发明方法中,以优化的检测体系对3个县市共63个大田叶片样本进行检测,病叶检出率分别达到83.33%、87.04%、85.19%;显著高于詹芳芳等的引物pi-f (ttgtgaaggcgtcattcc)、pi-r(ccgagaggatgcttacga)的检测结果。
33.d)本发明方法可以检测到0级病叶,即没有任何病斑、但是已经染菌的叶片,这对病害防控相当重要。
附图说明
34.为了更清楚地说明本发明实施方式的技术方案,下面将对实施方式中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
35.图1是本发明pcr引物特异性检测电泳图。图中,a:pif1/pir1;b:pif2/pir2;c:pif3/pir3; ck-:ddh2o。
36.图2是pcr退火温度优化。图中,a:pif1/pir1;b:pif2/pir2;c:pif3/pir3;1:55.0℃; 2:55.5℃;3:56.4℃;4:57.7℃;5:59.3℃;6:60.6℃;7:61.5℃;8:62.0℃。
37.图3是马铃薯晚疫病单株病叶。图中,a:0级;b:1级;c:3级;d:5级;e:7级; f:9级。
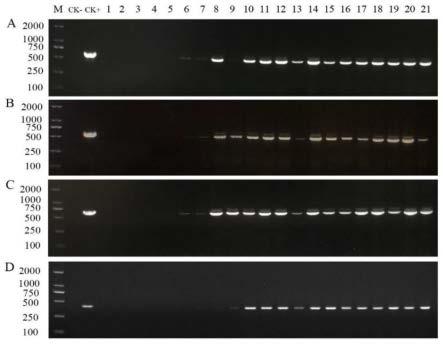
38.图4是彭州市大田马铃薯叶片样本pcr扩增产物的电泳检测结果图。图中,a:pif1/pir1; b:pif2/pir2;c:pif3/pir3;d:pi-f/pi-r;ck-:ddh2o;ck+:phytophthora infestans dna。
39.图5是金堂县大田马铃薯叶片样本pcr扩增产物的电泳检测结果图。图中,a:pif1/pir1; b:pif2/pir2;c:pif3/pir3;d:pi-f/p-ir;ck-:ddh2o;ck+:phytophthora infestans dna。
40.图6是崇州市大田马铃薯叶片样本pcr扩增产物的电泳检测结果图。图中,a:pif1/pir1; b:pif2/pir2;c:pif3/pir3;d:pi-f/p-ir;ck-:ddh2o;ck+:phytophthora infestans dna。
具体实施方式
41.下面结合附图与一个具体实施例进行说明。
42.为使本发明实施方式的目的、技术方案和优点更加清楚,下面将结合本发明实施方式中的附图,对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。因此,以下对在附图中提供的本发明的实施方式的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施方式。
43.应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中可以不对其进行进一步定义和解释。
44.为说明本发明的技术效果,以下通过具体实施过程进行说明。
45.本实施例中,使用的引物对为:
46.第一引物对如序列表seq id no:1和seq id no:2所示:
47.第一上游引物pif1:5'-gctaccaacatcttccacaatct-3';
48.第一下游引物pir1:5'-tctctaaaacctctgagcccct-3';
49.第二引物对如序列表seq id no:3和seq id no:4所示:
50.第二上游引物pif2:5'-ctgaaaatggacggggatagcga-3';
51.第二下游引物pir2:5'-tgcgatgtgagcgatggcaaatg-3';
52.第三引物对如序列表seq id no:5和seq id no:6所示:
53.第三上游引物pif3:5'-atggacggggatagcgactctta-3';
54.第三下游引物pir3:5'-gatgcccttgctgactcacctg-3'。
55.以现有技术晚疫病检测的引物pi-f/pi-r为对照引物对,引物pi-f/pi-r如序列表seqidno:7和seqidno:8所示:
56.pi-f:5'-ttgtgaaggcgtcattcc-3';
57.pi-r:5'-ccgagaggatgcttacga-3'。
58.使用以上四个引物对对大田马铃薯叶片采集样本基因组dna进行pcr扩增,比较3对特异性引物和对照引物对大田样本的阳性检出率。
59.本实施例的过程具体如下。
60.1pcr体系建立
61.1.1大田马铃薯叶片样本的采集
62.2020年3月15日~2021年4月18日于彭州市、金堂县、崇州市3个市县采集未发病田块中健康的马铃薯叶片样本(取样后一直跟踪该田块晚疫病发生情况直至收获后,确定晚疫病未发生),标记为ck,作为阴性对照;采集发病田块中受病害程度不同的马铃薯叶片样本,按照马铃薯晚疫病分级标准,将感病状况分为以下6个等级(表1)。每个病害等级取三个重复,拍照并装入一次性自封袋中,每个采集袋装一片病叶,袋口密封后置于冰盒或冰瓶内带回实验室。
63.表1马铃薯晚疫病分级标准
64.。
[0065][0066]
1.2供试菌株与载体
[0067]
本实施例中所涉及到的检测菌株包含真菌和细菌,供试真菌包括:致病疫霉菌(phytophthorainfestans)、大豆疫霉(phytophthorasojae)、辣椒疫霉菌(phytophthoracapsici)、芋疫霉(phytophthoracolocasiae)、烟草疫霉(phytophthoranicotianae);供试细菌包括:茄科雷尔氏菌(ralstoniasolanacearum)、疮痂链霉菌(streptomycesscabies)。其中致病疫霉分离自马铃薯病叶,大豆疫霉、烟草疫霉、芋疫霉、辣椒疫霉由四川省农科院植物保护研究所惠赠,其余菌株均由本实验室保存。克隆载体peasy-t1载体购自北京全式金生物技术有限公司(transgenbiotech)。
[0068]
1.3培养基配制
[0069]
黑麦培养基:称取100g黑麦洗净后加入1l蒸馏水,高压蒸汽灭菌锅121℃灭菌40min。冷却后用三层纱布挤压出汁,过滤收集滤液。加入蔗糖20g,琼脂粉15g,蒸馏水定容至1l,高压蒸汽灭菌锅121℃灭菌20min。
[0070]
黑麦选择培养基:取氨苄青霉素0.2g,利福平0.02g,制霉素0.1g,溶于2ml二甲基亚砜中,配置成“红药水”。
[0071]
将灭菌后的黑麦培养基冷却至50℃左右,加入“红药水”1ml,轻摇混匀后倒平板。
[0072]
1.4致病疫霉菌的分离纯化与鉴定
[0073]
采用“薯夹叶”的方法对马铃薯晚疫病病原菌进行分离纯化:取新鲜健康的马铃薯洗净, 75%酒精轻拭表面,过火焰直至酒精挥发干净;冷却后的马铃薯用小刀切成1cm厚的薯片,将田间采集的感病叶片组织夹在两块薯片之间,置于18℃黑暗培养,待薯片上长出疫霉菌菌丝,挑取菌丝接种于黑麦选择培养基上分离,18℃黑暗倒置培养;待黑麦选择培养基上长出菌丝后,再挑取菌丝接种于普通黑麦培养基上纯化。
[0074]
1.5基因组dna提取
[0075]
大田马铃薯叶片样品基因组dna采用easypure plant genomic dna kit(货号:ee111-01) 提取;致病疫霉菌、大豆疫霉、烟草疫霉、芋疫霉、辣椒疫霉菌基因组dna采用plantzol (货号:p10927)提取;细菌基因组dna采用easypure bacteria genomic dna kit(货号:ee161-11)提取。以上试剂盒均购北京全式金生物技术有限公司。用nanodrop400测定基因组dna的浓度及纯度。
[0076]
1.6引物设计与合成
[0077]
以发明人发现的致病疫霉基因组特异的dna片段作为分子靶标,应用premier5.0引物设计软件设计3对特异性引物(pif1/r1、pif2/r2和pif3/r3,依次见序列表seq id no:1~6),引物由生工生物工程(上海)股份有限公司合成。依据引物合成订单说明,添加无菌ddh2o 将引物稀释为工作浓度10μm,-20℃保存条件下备用。
[0078]
1.7目的片段的ta克隆与重组质粒的构建
[0079]
基于引物pif1/r1、pif2/r2和pif3/r3,利用2
×
easy taq pcr super mix酶(北京全式金生物技术有限公司,货号:o10708)对致病疫霉基因组dna进行扩增(扩增产物3’端带“a”碱基)。扩增产物利用easypure quick gel extraction kit试剂盒(北京全式金生物技术有限公司,货号:eg101-02)纯化回收目的片段,回收的目的片段按peasy-t1 simple cloning kit 试剂盒(北京全式金生物技术有限公司,货号:ct111)进行ta克隆和阳性克隆检测,构建含目的片段的重组质粒。
[0080]
1.8pcr反应体系的初步建立
[0081]
依据2
×
easy taq pcr super mix说明及引物设计软件premier5.0提供的退火温度,设计 pcr初始反应条件,反应程序如下:94℃预变性3min,94℃变性30s,61℃退火30s,72℃延伸1min,共30个循环,最后72℃延伸8min,4℃保存。pcr扩增产物用1.5%的琼脂糖凝胶电泳检测并观察扩增片段大小、条带亮度。pcr反应总体系为20μl:无菌ddh2o7μl、上游引物(10μm)1μl、下游引物(10μm)1μl、2
×
easy taq pcr super mix酶10μl、
[0082]
模板dna 1μl。
[0083]
1.9特异性引物的筛选
[0084]
以致病疫霉菌、茄科雷尔氏菌、疮痂链霉菌、辣椒疫霉菌、大豆疫霉菌、烟草疫霉菌、芋疫霉菌、马铃薯脱毒苗基因组dna作为pcr反应的模板,分别用引物对pif1/r1、pif2/r2 和pif3/r3按上述pcr反应体系进行扩增。
[0085]
1.10pcr反应体系退火温度优化
[0086]
为优化建立适宜的pcr反应扩增条件,实现马铃薯致病疫霉病菌基因组特异dna区段的快速有效检测,对pcr体系的退火温度进行优化。将反应体系置于梯度pcr仪上,设置55~62℃梯度退火温度,设置55.0℃、55.5℃、56.4℃、57.7℃、59.3℃、60.6℃、61.5℃、62.0℃共8个温度梯度,分别对pif1/pir1、pif2/pir2、pif3/pir3三对引物的退火温度进行优化,除退火温度外其余条件均与1.8相同。
[0087]
1.11灵敏度试验
[0088]
用nanodrop400测定引物对pif1/r1、pif2/r2和pif3/r3克隆片段构建的重组质粒浓度,并依次进行10倍梯度稀释构建重组质粒梯度稀释溶液,并以此为模板进行pcr扩增,明确能检测到核酸扩增条带的最低模板浓度,并换算获得目标dna模板分子的拷贝数,质粒拷贝数换算公式如下:
[0089][0090]
pcr扩增条件为优化后的扩增条件,扩增体系如1.8所述,灵敏度扩增结果用1.5%琼脂糖凝胶电泳分析。
[0091]
1.12大田马铃薯病叶的检测
[0092]
利用优化后的pcr反应条件及反应体系,分别用前述3对特异性引物和詹芳芳等人用于晚疫病检测的引物pi-f/pi-r(见序列表seq id no:7~8)作为对照引物对大田马铃薯叶片样本的基因组dna进行pcr扩增,比较3对特异性引物和对照引物对大田样本的阳性检出率。
[0093]
1.13pcr引物特异性检测
[0094]
以致病疫霉菌、茄科雷尔氏菌、疮痂链霉菌、辣椒疫霉菌、烟草疫霉菌、芋疫霉菌、大豆疫霉、马铃薯脱毒苗基因组dna作为pcr反应的模板,ddh2o为阴性对照,分别用引物对pif1/pir1、pif2/pir2、pif3/pir3进行pcr扩增。结果如图1所示:3对引物对供试菌株茄科雷尔氏菌、疮痂链霉菌、辣椒疫霉菌、大豆疫霉菌、烟草疫霉菌、芋疫霉菌、马铃薯脱毒苗基因组dna均无法扩增出目的条带,而以致病疫霉基因组dna为模板均可扩增出单一的目的dna片段。扩增产物经ta克隆构建重组质粒,并对重组质粒进行测序鉴定,测序结果表明3对引物所扩增出的目的片段序列与预期序列相似性分别为94.96%、97.71%、96.44%,表明3对引物均具有很好的特异性,可用于后续试验。
[0095]
1.14pcr退火温度的优化
[0096]
以软件dnaman对3对引物的退火温度进行评估结果,确定pif1和pir1的退火温度为59.5℃和60.7℃;pif2和pir2的退火温度为68.2℃和72.3℃;pif3和pir3的退火温度为 65.1℃和66.6℃。为优化获得3对引物的最佳退火温度,在55~62℃间设置8个退火温度:55.0℃、 55.5℃、56.4℃、57.7℃、59.3℃、60.6℃、61.5℃、62.0℃,分别进行pcr扩增。结果如图2 所示:8个退火温度下,3对引物均可扩增出目的条带。其中pif1/pir1引物在59.3℃、60.6℃、61.5℃、62.0℃退火温度下所扩增出的目的条带较55.0℃、55.5℃、56.4℃、57.7℃所扩增的目的条带明亮,扩增效果更好,最终选择59.3℃作为pif1/pir1的最佳退火温度;pif2/pir2 引物在8个退火温度下所扩增出的目的条带亮度均一,无显著差异,最终确定59.3℃为优化后的最佳退火温度;pif3/pir3引物在55.0℃、55.5℃、56.4℃、57.7℃、59.3℃、60.6℃退火温度下较61.5℃、62.0℃条带更为明亮,最终确定59.3℃为优化后的最佳退
火温度。综上,3 对引物优化后的pcr反应程序见表2。
[0097]
表2pcr反应程序
[0098]
。
[0099][0100]
1.15pcr灵敏度试验
[0101]
引物pif1/pir1、pif2/pir2、pif3/pir3的扩增产物经ta克隆构建含相应特异dna序列的重组质粒,测定重组质粒的浓度并依次进行10倍梯度稀释,同时换算其拷贝数,构建拷贝数为109、108、107、106、105、104、103、102拷贝/μl的重组质粒梯度稀释液,在20μl的反应体系中,以优化后的pcr条件及体系(表2)进行扩增,检测反应体系的灵敏度。扩增结果显示:随着模板dna分子拷贝数的降低,以pif1/pir1、pif2/pir2、pif3/pir3为引物的 pcr扩增产物的凝胶电泳条带亮度成梯度降低,其中引物pif1/pir1可检测出的最低模板浓度为:1.31pg/μl,模板拷贝数为2.69
×
105拷贝/μl;引物pif2/pir2可检测出的最低模板浓度为1.18pg/μl,最低模板拷贝数为2.42
×
105拷贝/μl;引物pif3/pir3可检测出的最低模板浓度为1.24pg/μl,最低模板拷贝数为2.55
×
105拷贝/μl。
[0102]
为探究循环次数对灵敏度的影响,且考虑到一般情况下35个pcr循环已达到扩增平台期,发明人将优化后的pcr反应体系(表2)循环数增加到35个循环,并梯度稀释上述检测最低浓度对应的质粒溶液,构建拷贝数为104、103、102、101、100、10-1
数量级的重组质粒溶液。引物pif1/pir1可检测出的最低模板浓度为1.31
×
10-1
fg/μl,对应模板拷贝数为26.9拷贝/μl;引物pif2/pir2可检测出的最低模板浓度为1.18
×
10-2
fg/μl,模板拷贝数为2.42拷贝/μl;引物pif3/pir3可检测出的最低模板浓度为1.24
×
10-1
fg/μl,最低模板拷贝数为:25.5拷贝/μl。
[0103]
2、pcr检测体系在检测大田马铃薯叶片样本中的应用
[0104]
2.1大田马铃薯叶片样本的采集
[0105]
本实施例采集了3个县市共63个大田马铃薯叶片样本(具体采样信息如表3所示),其中彭州市、金堂县、崇州市大田马铃薯叶片样本各21个。马铃薯叶片样本各病害分级如图3。
[0106]
表3马铃薯大田叶片样本信息及基因组dna浓度
[0107][0108]
注1:核酸浓度单位g/ml;
[0109]
注2:1-3为健康叶片,根据后续跟踪调查,直至收获时仍未发病,4-21分别为0、1、3、5、 7、9级病叶,每个病级3个重复。
[0110]
2.2大田马铃薯叶片样本的dna提取及检测
[0111]
提取大田马铃薯叶片样本的与基因组dna,用nano drop400测定所提取的dna的浓度和纯度(表3),最后用1.5%琼脂糖凝胶电泳检测结果,3个县市共63个样本提取的基因组 dna均由较亮的电泳条带,可满足后续试验检测要求。
[0112]
2.3pcr检测体系对大田马铃薯叶片样本的检测
[0113]
分别用本发明3对特异性引物(pif1/pir1、pif2/pir2、pif3/pir3)与1对对照引物(pi-f/pi-r) 对3个县市共63个大田马铃薯叶片样本进行pcr分子检测,电泳检测结果分别如图4、图5、图6所示。
[0114]
对彭州市采集的大田马铃薯叶片样本检测结果显示(图4):其中引物pif1/pir1可从发病大田采集的18个样本中检测出14个阳性样本,阳性检出率为77.78%;引物pif2/pir2可检测出16个阳性样本,阳性检出率为88.89%;引物pif3/pir3可检出15个样本,检出率为 83.33%;引物pi-f/pi-r可检出13个样本,阳性检出率为72.22%。
[0115]
对金堂县大田马铃薯叶片样本检测结果显示(图5):其中引物pif1/pir1、引物pif2/pir2 和引物pif3/pir3均可从发病大田采集的18个样本中检出16个阳性样本,阳性检出率为 88.89%;而引物pi-f/pi-r可检出15个样本,阳性检出率为83.33%。
[0116]
对崇州市大田马铃薯叶片样本检测结果显示(图6):其中引物pif1/pir1、引物pif2/pir2 和引物pif3/pir3均可从发病大田采集的18个样本中检测出15个阳性样本,阳性检出率为 83.33%;而引物pi-f/pi-r可检出14个阳性样本,阳性检出率为77.78%。
[0117]
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1