一种咖啡酸-生物素小分子探针的设计及制备方法和应用
1.本发明属于分子生物学技术领域,具体涉及一种咖啡酸-生物素小分子探针及其制备方法和应用。
背景技术:
2.植物多酚是一类广泛存在于植物体内的具有多元酚结构的次生代谢物,具有良好的抗氧化活性,作为天然抗氧化剂在肉制品中的应用日益广泛。然而,研究发现多酚在肉制品中存在“促氧化”的现象,即邻苯二酚类植物多酚在清除自由基过程中自身氧化形成半醌,与蛋白质侧链中活性基团(sh,nh2)发生迈克尔加成反应,形成多酚-蛋白加合物。这种加合物可能对蛋白质营养价值和消化吸收效率产生重要影响,目前对其生物活性及安全性尚未深入研究。
3.综上所述,植物多酚作为天然抗氧化剂,在应用过程中发生迈克尔加成反应,无法通过有效手段准确检测,导致目前关于多酚与蛋白加成机制研究较少,多酚-蛋白加合物在肉中形成机制尚不清晰、对食品品质和人体营养与健康影响尚未深入研究。这可能阻碍植物多酚的深入应用,甚至存在潜在的安全风险。
4.因此,设计与合成一种由植物多酚出发合成,得到仍然具备咖啡酸本身的生物活性的植物多酚小分子探针,进而以植物多酚小分子探针替代植物多酚与蛋白质反应,实现对多酚-蛋白加合物的检测,将对植物多酚与蛋白相互作用机制的研究具有重要意义。食品领域尚无使用分子探针来研究多酚-蛋白相互作用。
技术实现要素:
5.针对上述现有技术,本发明提供一种咖啡酸-生物素小分子探针及其制备方法和应用,以克服现有多酚-蛋白作用机制研究的不足。本发明选用邻苯二酚类植物多酚——咖啡酸(cfa),采用生物素作为标记基团,将生物素与咖啡酸连接形成“生物素-咖啡酸”小分子探针,从而钓取其作用位点。本发明首次合成、使用多酚小分子探针并借助sds-page鉴定多酚结合蛋白,即多酚-蛋白加合物。
6.本发明的第一个问题是提供一种咖啡酸-生物素小分子探针,所述小分子探针的结构如式ⅰ所示,
7.8.本发明的第二个问题是提供一种制备前述的咖啡酸-生物素小分子探针的制备方法,所述方法包括以下步骤:
9.s1:生物素-连接链部分的合成:
10.s1-1:化合物1经取代、硝化、还原反应,得中间体5;
11.所述化合物1为
12.中间体5为
13.s1-2:化合物6经酰胺化、加成反应,得中间体8;
14.所述化合物6为
15.中间体8为
16.s1-3:将中间体5、中间体8、三乙胺和六氟磷酸盐按1:0.5~1:0.5~1:1~1.5的质量之比溶于有机溶剂a中,室温下搅拌反应10~20h,然后避光静置、过滤、烘干,得中间体9,即生物素-连接链部分;
17.所述中间体9为
18.s2:咖啡酸酚羟基的保护:
19.s2-1:化合物10经酯化,得中间体11;
20.所述化合物10为
21.中间体11为
22.s2-2:将中间体11和三乙胺按1:2~2.5的质量之比溶于有机溶剂b中,加入甲基甲醚,室温下搅拌过夜,经过滤、旋干,得中间体12;
23.所述中间体12为
24.s2-3:将中间体12溶于有机溶剂c中,加入碱,室温搅拌过夜,经萃取、干燥,得中间
体13,即酚羟基受到保护的咖啡酸;
25.所述中间体13为
26.s3:咖啡酸-生物素小分子探针的合成:
27.将s1得到的中间体9、s2得到的中间体13、4-n,n-二甲氨基吡啶、盐酸盐按1:0.1~0.5:0.1~0.3:0.5~1的质量之比溶于有机溶剂d中,室温搅拌过夜,经打浆、旋干,得式ⅰ所示化合物,即咖啡酸-生物素小分子探针。
28.本发明所述制备方法的s1和s2的操作顺序没有特殊限定,s1和s2可以同步进行,或先进行s1后进行s2,或先进性s2后进行s1。
29.进一步的,s1-3中所述中间体5、中间体8、三乙胺和六氟磷酸盐按1:0.9:0.9:1.4的质量之比溶于有机溶剂a中。
30.进一步的,s1所述有机溶剂a为四氢呋喃、2-甲基四氢呋喃、二甲基亚砜、n,n二甲基甲酰胺、n,n-二甲基乙酰胺、丙酮中的一种。
31.中间体8在有机溶剂a中的浓度为12~16ml/g,优选14~15ml/g。
32.进一步,s2-2中所述中间体11和三乙胺按1:2的质量之比溶于有机溶剂b中;
33.进一步的,s2所述有机溶剂b为四氢呋喃、2-甲基四氢呋喃、二甲基亚砜、n,n二甲基甲酰胺、n,n-二甲基乙酰胺、丙酮、二氯甲烷、1,2-二氯乙烷、氯仿中的一种;
34.中间体11在有机溶剂b中的浓度为8~12ml/g,优选10~11ml/g。
35.所述有机溶剂c为四氢呋喃、2-甲基四氢呋喃、二氯甲烷、1,2-二氯乙烷、氯仿、甲基亚砜中的一种;
36.中间体12在有机溶剂c中的浓度为5~10ml/g,优选7~9ml/g。
37.所述碱为氢氧化钠和氢氧化钾中的一种;
38.优选的,碱为浓度为1mol/l的碱溶液,碱溶液与有机溶剂c的体积之比为2~3:1,优选2~2.1:1。
39.进一步,中间体9、中间体13、4-n,n-二甲氨基吡啶、edc盐酸盐按1:0.5:0.2:0.7的质量之比溶于有机溶剂d中;
40.进一步的,有机溶剂d为四氢呋喃、2-甲基四氢呋喃、二甲基亚砜、n,n二甲基甲酰胺、n,n-二甲基乙酰胺、丙酮中的一种或几种。
41.中间体9在有机溶剂d中的浓度为10~20ml/g,优选16~18ml/g。
42.本发明的第三个目的是提供前述的咖啡酸-生物素小分子探针在定性和/或定量检测多酚-蛋白加合物中的应用。
43.所述应用步骤为:将咖啡酸-生物素小分子探针氧化,得到氧化型咖啡酸-生物素小分子探针(式ⅱ),将氧化型咖啡酸-生物素小分子探针与待测蛋白样品混合,通过链霉亲和素磁珠富集,从待测蛋白样品中有效钓取出咖啡酸-生物素小分子-蛋白共价结合物,在λ=365nm紫外线条件下,断开咖啡酸-生物素小分子-蛋白共价物的链接键,通过sds-page等方法进行多酚-蛋白加合物的定性和/或定量检测。
[0044][0045]
进一步的,所述多酚-蛋白加合物为咖啡酸-蛋白加合物。
[0046]
本发明的第四个目的是提供一种用于定性和/或定量检测多酚-蛋白加合物的组合物,所述组合物包括前述的咖啡酸-生物素小分子探针。
[0047]
进一步的,所述组合物还包括链霉亲和素标记磁珠、二甲基亚砜、缓冲液a,优选的,所述组合物还包括肉桂酸-生物素小分子探针。
[0048]
进一步的,所述缓冲液a为pbs缓冲液(1
×
)或pbst中的一种。
[0049]
进一步的,所述肉桂酸-生物素小分子探针经过以下步骤制得:
[0050]
将中间体9、化合物15和三乙胺按1:0.2~0.6:0.2~0.6的质量之比溶于有机溶剂e中,室温搅拌过夜,经旋干、打浆、避光干燥,得化合物16,即肉桂酸-生物素小分子探针,
[0051]
所述化合物15结构式为:
[0052]
化合物16结构式为:
[0053]
进一步的,溶剂e为丙酮、二氯甲烷、1,2-二氯乙烷、氯仿中的一种或几种。
[0054]
本发明的第五个目的是提供前述的咖啡酸-生物素小分子探针或前述组合物在制备定性和/或定量检测多酚-蛋白加合物的试剂盒中的应用。
[0055]
进一步的,所述多酚-蛋白加合物为咖啡酸-蛋白加合物。
[0056]
本发明中所制备出的咖啡酸-生物素小分子探针,能够替代咖啡酸与蛋白反应,将无法有效检测的咖啡酸-蛋白共价物替代为生物素-咖啡酸-蛋白共价物,有效钓取咖啡酸-蛋白共价结合物,以克服现有多酚与蛋白作用机制研究的不足。
[0057]
本发明的有益效果是:
[0058]
1.合成了以含有邻硝基苄酯(λ=365nm紫外线条件下,分子探针中酯键可被断开)的结构为连接链、生物素作为报告基团的咖啡酸小分子探针;
[0059]
2.该咖啡酸小分子探针保持了咖啡酸的生物活性,为“钓取”其蛋白靶点以及研究多酚-蛋白作用机制提供基础和模板分子,同时合成的探针不失为探索咖啡酸其他药理作用机制的良好工具,具有重要的学术研究价值和应用前景。
附图说明
[0060]
图1为实施例3得到的化合物ⅰ的核磁氢谱图;
[0061]
图2为对比例4得到的化合物16的核磁氢谱图;
[0062]
图3为实施例3得到的化合物ⅰ的质谱图;
[0063]
图4为对比例4得到的化合物16的质谱图;
[0064]
图5为小分子探针bcfa的抗氧化效果图;
[0065]
图6为小分子探针bcfa对咖啡酸-蛋白加合物的钓取效果图;
[0066]
图7小分子探针bcfa钓取的特异性蛋白条带定量分析图;
[0067]
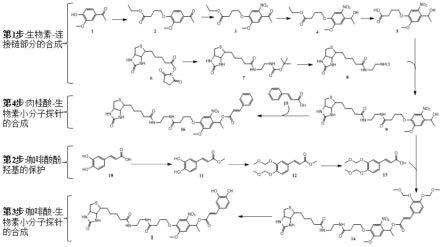
图8为本发明中的咖啡酸-生物素小分子探针制备路径。
具体实施方式
[0068]
下面结合实施例对本发明的具体实施方式做详细说明。
[0069]
实施例1:生物素-连接链部分(中间体9)的制备
[0070][0071]
(1)制备中间体5
[0072]
取代反应:化合物1(100g,602mmol),4-溴丁酸乙酯(117g,602mmol),碳酸钾(110g,800mmol)悬浮在360毫升n,n-二甲基甲酰胺,50℃加热18小时,倒入5升冰水中,静置过夜,过滤,用500毫升水洗三次,60℃烘干18小时,得79g白色粉末,即化合物2。
[0073]
硝化反应:400毫升浓硝酸冷却到0℃,缓慢加入80毫升醋酸酐,得到混酐溶液;将化合物2(20g,71mmol)溶解在60毫升醋酸酐中,慢慢滴加到混酐溶液中,保持温度在0℃,继续反应3小时,倒入3升冰水中,静置过夜,过滤,用500毫升水洗三次,60℃烘干18小时,得11g白色粉末,即化合物3。
[0074]
还原反应:化合物3(42g,130mmol)悬浮在500毫升乙醇中,硼氢化钠(3g,81mmol)在20分钟内缓慢加到上述溶液中。缓慢加温到40℃,继续反应12小时。用10毫升水淬灭反应。旋干溶剂,所得固体用400毫升甲醇重结晶,60℃烘干18小时,得21g白色粉末,即化合物4。
[0075]
化合物4(16.5g,50mmol)溶解在100毫升甲醇和100毫升水,加入50毫升6n氢氧化钠,加热到40℃使其完全溶解,室温搅拌18小时,旋干大部分溶剂,用6n盐酸酸化到ph 3静置6小时,过滤,60℃烘干18小时,得13g白色粉末,即中间体5。
[0076]
(2)制备中间体8
[0077]
酰胺化反应:化合物6(34g,100mmol)和boc-乙二胺(16g,100mmol)溶解在1000毫升二氯甲烷,室温搅拌18小时,旋干溶剂,所得固体用500毫升重结晶,过滤,60℃烘干18小时,得28g白色粉末,即化合物7。
[0078]
加成反应:化合物7(19g,50mmol)溶解在500毫升乙酸乙酯,加入125毫升浓盐酸,室温搅拌4小时,旋干溶剂,所得固体用200毫升乙醇打浆,过滤,60℃烘干18小时,得14g白色粉末,即中间体8。
[0079]
(3)制备生物素-连接链部分,即中间体9
[0080]
化合物8(14g,45mmol),化合物5(13g,45mmol),三乙胺(12g,100mmol)和六氟磷酸盐(19g,50mmol)溶解在200ml n,n-二甲基甲酰胺,室温搅拌18小时,倒入2升冰水,避光静置18小时,过滤,60℃烘干18小时,得9.5g褐色粉末,即生物素-连接链部分,即中间体9,避光干燥保存。
[0081]
实施例2:咖啡酸酚羟基的保护,即制备中间体13
[0082][0083]
化合物10(90g,500mmol)溶解在1500ml甲醇,加入5ml浓硫酸,加热回流过夜。冷却后,倒入4升冰水,静置6小时,过滤,60℃烘干18小时,得86.2g白色粉末,即中间体11。
[0084]
中间体11(19.4g,100mmol),三乙胺(39g,300mmol)溶解在200ml二氯甲烷,将溴甲基甲醚(37.5g,300mmol)慢慢滴加到上述溶液中,室温搅拌过夜,用800ml二氯甲烷稀释,用1升0.5m硫酸氢钾洗涤,滤过一个硅胶短柱,旋干溶剂,得26.2g油状物,冷却后结晶,得中间体12。
[0085]
中间体12(14.1g,50mmol),溶解在60ml四氢呋喃,加入120ml 1n氢氧化钾,室温搅拌过夜,用0.5m硫酸氢钾溶液中和到ph=3,用500毫升乙酸乙酯萃取,硫酸钠干燥,旋干溶剂,用五氧化二磷真空干燥,得12.2g白色粉末,即酚羟基受到保护的咖啡酸(中间体13)。中间体13直接用于下一步反应。
[0086]
实施例3:式ⅰ所示咖啡酸-生物素小分子探针的合成
[0087][0088]
化合物9(4g,7mmol),化合物13(1.9g,7mmol),4-n,n-二甲氨基吡啶(0.85g,7mmol),edc盐酸盐(2.68g,14mmol)溶解在70ml n,n-二甲基甲酰胺,室温搅拌过夜,倒入400ml冰水里,倾倒掉上清液,所得固体用400ml甲醇打浆。过滤,所得固体溶解在100ml乙酸乙酯/40ml甲醇/8ml浓盐酸。室温搅拌过夜。旋干溶剂。所得固体用100ml二氯甲烷/50ml甲醇溶解,旋干溶剂。得3.4g泡沫状固体,即式ⅰ所示咖啡酸-生物素小分子探针,命名为bcfa。
[0089]
本发明中的咖啡酸-生物素小分子探针制备路径如图8所示,其中,化合物14是“中间体9、13合成化合物
ⅰ”
过程中的一个暂时的中间体,其结构中的甲氧甲基不稳定,不用单独处理,即可得到化合物ⅰ。
[0090]
图1和图3为化合物ⅰ的核磁氢谱图和质谱图。
[0091]
所制得的化合物ⅰ的谱图数据解析如下:
[0092]1h nmr(dmso-d6,300mhz)1.25(m,2h)1.55(m,2h)1.58(m,2h)2.09(m,2h)2.13(m,
2h)2.34(t,2h)3.10(d,2h)3.27(m,1h)3.66(t,2h)3.75(s,3h)4.11(t,2h)4.50(q,1h)4.60(m,3h)6.05(q,1h)6.31(d,1h)6.67(d,1h)6.82(d,1h)7.06(s,1h)7.23(s,1h)7.48(d,1h)7.73(s,1h)8.01(t,1h)9.48(d,1h)10.86(d,1h)ppm.
[0093]
hrms-esi calculated for c
34h43o11
n5s[m+h]
+
:730.2758,found 730.2762.
[0094]
对比例4:肉桂酸-生物素小分子探针(16)的合成
[0095][0096]
化合物9(0.57g,1mmol),三乙胺(0.3g,3mmol),化合物15(0.32g,2mmol)溶解在10毫升二氯甲烷,旋干溶剂,所得固体用10ml水打浆。过滤。60℃避光干燥18小时,得0.4g泡沫状固体,即式16所示肉桂酸-生物素小分子探针,命名为bcna。
[0097]
化合物15结构式为:
[0098]
图2和图4为化合物16的核磁氢谱图和质谱图。
[0099]
所制得的化合物16的谱图数据解析如下:
[0100]1h nmr(dmso-d6,300mhz)1.25(m,2h)1.55(m,2h)1.58(m,2h)2.09(m,2h)2.13(t,2h)2.34(t,2h)3.10(d,2h)3.27(m,1h)3.66(t,2h)3.75(s,3h)4.11(t,2h)4.50(q,1h)4.60(m,1h)6.05(q,1h)6.31(d,1h)7.23(s,1h)7.33(q,1h)7.38(q,1h)7.48(d,1h)7.54(d,1h)7.73(s,1h)8.01(t,1h)10.86(d,1h)ppm.
[0101]
hrms-esi calculated for c34h43o9n5s[m+h]
+
:698.2860,found 698.2869.
[0102]
实验例1:咖啡酸-生物素小分子探针抗氧化活性测试
[0103]
1.主要试剂:咖啡酸-生物素小分子探针bcfa、二甲基亚砜(dmso)、dpph自由基清除试剂盒。
[0104]
2.仪器:自动酶标仪96孔培养板
[0105]
3.具体实验方法为:取本发明实施例3制备得到的bcfa溶于dmso中,配置成0.03mm溶液,用dpph自由基清除试剂盒测定其抗氧化活性(配置等浓度的咖啡酸溶液做为对照),实验结果如图5所示。
[0106]
4.实验结果:本发明制备得到的咖啡酸-生物素小分子的dpph自由基清除率(46.26%
±
1.86%)略高于咖啡酸(44.72%
±
3.78%),但两者之间不具有显著性差异(p》0.05),说明咖啡酸-生物素小分子保持了咖啡酸的基本活性,可用于后续实验。
[0107]
本发明合成的咖啡酸-生物素小分子探针bcfa结构正确,且由咖啡酸制备得到的咖啡酸-生物素小分子探针仍然保持咖啡酸本身的生物活性,说明本发明合成的探针是可靠的,可以代替咖啡酸来与蛋白进行迈克尔加成反应,研究咖啡酸与蛋白的相互作用机制。
[0108]
实验例2:咖啡酸-生物素小分子探针富集咖啡酸-蛋白加合物的研究
[0109]
1.试剂和仪器
[0110]
链霉亲和素标记磁珠(a-08483、950-1500pmol/mg、2ml=20mg)、实施例3制备得到的咖啡酸-生物素小分子探针bcfa、对比例4制备得到的肉桂酸-生物素小分子探针bcna、二甲基亚砜dmso、1
×
pbs缓冲液、磁力架、旋转混合仪、紫外灯(λ=365nm)。
[0111]
2.样品的制备
[0112]
(1)咖啡酸小分子探针的处理
[0113]
取本发明实施例3制备得到的咖啡酸-生物素小分子探针溶于dmso中,用6m naoh调节ph=8,室温磁力搅拌3h进行氧化;氧化结束后,用6m hcl调节ph=6,即得到氧化型咖啡酸-生物素小分子探针(式ⅱ),溶液可保存于-20℃备用。
[0114][0115]
肉桂酸-生物素小分子探针进行相同氧化处理。
[0116]
(2)样品的制备
[0117]
取待测猪背最长肌样品,根据杨玉玲等方法(杨玉玲,游远,彭晓蓓,等.加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[j].中国农业科学,2014,47(10):2013-2020)提取猪肌原纤维蛋白,将其搅拌溶解于10mm磷酸盐缓冲液(0.6n nacl,ph 6.0)中,形成最终浓度1mg/ml的溶液,即待测蛋白溶液,用于与探针进一步实验,以探究待测蛋白溶液中有哪些蛋白与咖啡酸相互作用,并进一步检测与咖啡酸相互作用的蛋白的含量。
[0118]
制备3组蛋白样品:bcfa组、bcna组、dmso组:
[0119]
溶液中添加浓度为100μm上述(1)制备的氧化型咖啡酸-生物素小分子探针溶液,置于旋转混合仪上4℃孵育12h,得到氧化型咖啡酸-生物素小分子-蛋白样品(bcfa组);
[0120]
设置对照组,分别向溶液中添加氧化型肉桂酸-生物素小分子探针溶液、dmso,得到氧化型肉桂酸-生物素小分子-蛋白对照组(bcna组)和溶剂-蛋白对照组(dmso组)。
[0121]
3.实验方法
[0122]
(1)取出链霉亲和素标记磁珠(4℃保存),涡旋混匀,操作轻柔避免产生气泡;每个1.5ml离心管中加入150ul磁珠,置于磁力架,磁性分离,弃上清;每个离心管中加入等体积的pbs缓冲液(1
×
)对磁珠进行洗涤,涡旋混匀,充分洗涤磁珠,置于磁力架,磁性分离,弃上清,重复此步骤2次;
[0123]
(2)按照链霉亲和素标记磁珠1000pmol/mg的负载量,加入“2”制备的蛋白样品(bcfa组、bcna组、dmso组),涡旋混匀,置于旋转混合仪上,4℃旋转孵育过夜;
[0124]
(3)取下离心管,置于磁力架,磁性分离,弃上清;
[0125]
(4)每个离心管中加入1ml的pbs缓冲液(1
×
),涡旋混匀,轻柔洗涤磁珠,置于磁力架,磁性分离,弃上清,重复此步骤5次(最后一次洗涤,需要除去尽可能多的上清液),洗去磁珠非特异性吸附的蛋白;
[0126]
(5)加入150ul磷酸盐缓冲液(10mm,0.6n nacl,ph 6.0)重悬磁珠,涡旋混匀,置于紫外灯(365nm)下照射0.5h断开“磁珠-生物素-连接链”部分,短暂离心,把液体收集在管
底;
[0127]
(6)离心管置于磁力架,磁性分离,此时bcfa组的上清即为链霉亲和素标记磁珠富集到的咖啡酸-蛋白质溶液(cfa-mp),将3组样品的上清液移至标记好的新的离心管中,用于sds-page实验以观察cfa作用的蛋白质。
[0128]
sds-page实验结果如图6所示,图中bcna、dmso为阴性对照;input组为磁珠钓取前的蛋白样品,即“2”制备的蛋白样品(bcfa组、bcna组、dmso组);pull-down组为本实施例磁珠钓取后的蛋白样品。
[0129]
4.实验结果
[0130]
(1)由input组可以看出,磁珠钓取前的bcfa组、bcna组、dmso组3组蛋白样品不存在问题,均具有相应蛋白的对应条带;pull-down组中,与对照组(bcna组、dmso组)相比,实验组(bcfa组)有效钓取到结合蛋白,标记到的特异性蛋白条带位于200kda及35kda-50kda之间,表明与咖啡酸相互作用的蛋白主要包括肌球蛋白重链(mhc)、肌钙蛋白(tnt)、原肌球蛋白(tm)和肌球蛋白轻链-2(mlc-2),说明本发明的咖啡酸-生物素小分子探针能够特异性抓取肌球蛋白重链、肌钙蛋白、原肌球蛋白和肌球蛋白轻链-2,而对比例4制备的肉桂酸-生物素小分子探针(bcna组)在相应位置无明显条带,显示并非任意植物多酚制备的探针均能钓取到结合蛋白。
[0131]
(2)使用quantity one软件通过灰度值对sds-page条带进行定量分析,结果如图7所示,可以看出bcfa组各特异性条带灰度值为mhc(10.15
±
0.21b)、tnt(5.44
±
0.16c)、tm(15.90
±
1.84a)、mlc-2(14.15
±
0.35a)。
[0132]
综上所述,本发明合成的式ⅰ所示咖啡酸-生物素小分子探针保持了咖啡酸的生物活性,以邻硝基苄酯的结构为连接链(λ=365nm紫外线条件下,分子探针中酯键可被断开),并以生物素作为报告基团。
[0133]
式ⅰ所示咖啡酸-生物素小分子探针能够替代咖啡酸与蛋白反应,将无法有效检测的咖啡酸-蛋白共价物替代为咖啡酸-生物素小分子-蛋白共价物,通过链霉亲和素标记磁珠从待测蛋白中有效钓取出咖啡酸-生物素小分子-蛋白共价结合物,即区分出能够与咖啡酸发生加成反应的蛋白。在λ=365nm紫外线条件下,断开咖啡酸-生物素小分子-蛋白共价物的链接键,并通过sds-page等方法进行多酚-蛋白加合物的定性和/或定量检测。
[0134]
式ⅰ所示咖啡酸-生物素小分子探针实现咖啡酸小分子探针为“钓取”其蛋白靶点以及研究多酚-蛋白作用机制提供基础和模板分子,同时合成的探针不失为探索咖啡酸其他药理作用机制的良好工具,具有重要的学术研究价值和应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1