一种甲基苯胺类Aβ蛋白显像剂的双柱合成方法
一种甲基苯胺类a
β
蛋白显像剂的双柱合成方法
技术领域
1.本发明涉及药物合成技术领域,具体为一种甲基苯胺类aβ蛋白显像剂的双柱合成方法。
背景技术:
2.阿兹海默病,简称ad,是影响人类健康的重大疾病,尤其是对中老年人而言,许多研究证实,β淀粉样蛋白(aβ)在阿兹海默病发病中起着关键作用,因此,以aβ为生物标志物,利用pet等分子影像学技术及相应的放射性药物,在临床症状发生之前进行aβ显像,已成为早期无创诊断ad的重要技术手段;
3.近年来,大量小分子被设计用于aβ显像,用于辅助诊断ad,但是,由于ad本身发病机理仍不明确,机理研究仍需深入,同时,新型aβ显像剂的研发仍需继续,以期更好地解决ad的早期诊断;
4.现有的aβ蛋白显像剂的合成方法,如高效液相法,其合成周期长,较为费时,因此会导致放射性衰变大大提升,危险隐患上升,并且合成产率较低,量产的需求难以满足,手动操作繁琐,时长高,操作人员所受辐照时间高。
技术实现要素:
5.(一)解决的技术问题
6.针对现有技术所存在的上述缺点,本发明提供了一种甲基苯胺类aβ蛋白显像剂的双柱合成方法,能够有效地解决现有技术合成周期长,较为费时,因此会导致放射性衰变大大提升,危险隐患上升,并且合成产率较低,量产的需求难以满足,手动操作繁琐,时长高,操作人员所受辐照时间高问题。
7.(二)技术方案
8.为实现以上目的,本发明通过以下技术方案予以实现,
9.本发明公开了一种甲基苯胺类aβ蛋白显像剂的双柱合成方法,包括以下步骤:
10.step1:预备阴离子交换柱柱,启用回旋加速器,以
18
o(p,n)
18
f反应生产
18
f水溶液;
11.step2:以氦气将照射后的水溶液传入合成器接收瓶中;
12.step3:回收
18
o水,以阴离子交换柱捕捉
18
f离子,使
18
f离子保留在阴离子交换柱上;
13.step4:使用0.2ml(0.33mol/l)的碳酸钾水溶液与0.7ml(0.3mol/l)的氨基聚醚乙腈溶液,混合溶液将
18
f离子从阴离子交换柱上洗脱进入反应瓶中,对反应瓶中的溶液进行蒸发干燥除水处理,温度保持为110℃;
14.step5:在反应瓶中加入1-2mg的前体溶液,而后进行加热处理,温度保持110℃,加热时长为10min,生成反应液;
15.step6:待step5中的反应液冷却后,加入0.7ml盐酸(3mol/l),加热反应瓶至120℃,水解反应7min;
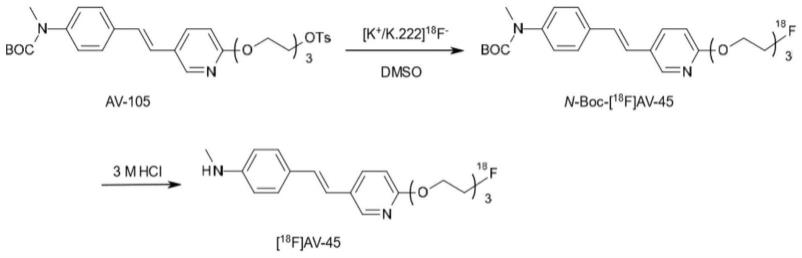
16.step7:待step6中的溶液冷却后,加入2ml氢氧化钠(1mol/l),进行中和,生成粗产物;
17.step8:将粗产物通过sep-pak c18和oasis hlb柱,粗产物被捕获;
18.step9:先用15ml 10%乙醇溶液洗脱双柱,再用10ml 30%乙醇溶液除去部分有机杂质,最后用1.5-2ml无水乙醇将产物洗脱至收集瓶;
19.step10:向收集瓶加入适量生理盐水,将乙醇浓度稀释至10%,过无菌滤膜后得放射性终产物;
20.step11:终产物的质量测定。
21.更进一步地,所述步骤step5中的前体化合物为(e)-2-(2-(2-(5-(4-(叔丁氧基羰基)苯乙烯基)吡啶-2-基氧基)乙氧基)乙氧基)乙基-4-甲基苯磺酸酯。
22.更进一步地,所述步骤step8中的粗产物为含有杂质的
18
f-(e)-4-(2-(6-(2-(2-(2-18
f-氟乙氧基)乙氧基)乙氧基)吡啶-3-基)乙烯基)-n-甲基苯胺。
23.更进一步地,所述步骤step11的质量测定的过程,包括以下步骤:
24.s1:提取100μl最终产品,点样于硅胶板,采用85%乙腈溶液作为展开剂上行展开;
25.s2:待涂布溶液晾干后,启动薄层扫描仪检测,测定放化纯度,作出记录;
26.s3:启用c18反相柱,流动相采用乙腈溶液、水溶液和三乙胺,其体积比为55:44.85:0.15;
27.s4:提取100μl的最终产品,加入1ml的生理盐水,并放置于室温下,逐步孵育20、40、80和120min,并逐步采用hplc法测定放化纯度,观察稳定性。
28.更进一步地,所述c18柱具体为sep-pak c18柱,所述hlb柱具体为oasis hlb柱。
29.更进一步地,所述终产物为含有
18
f-(e)-4-(2-(6-(2-(2-(2-18
f-氟乙氧基)乙氧基)乙氧基)吡啶-3-基)乙烯基)-n-甲基苯胺的乙醇生理盐水溶液。
30.(三)有益效果
31.采用本发明提供的技术方案,与已知的公有技术相比,具有如下有益效果,
32.1、本发明该合成方法方便、简单、产率高,并且容易掌握,整个合成过程处于全自动、全密闭的系统中进行,符合gmp要求,并且在必要的时候可以进行人工干预,确保合成的顺利进行,大大提升了容错率。
33.2、本发明量产化容易,难度低,有效缩短合成周期,降低了放射性衰变带来了危险隐患,提升安全性,操作人员操作时间短,所受辐射减少。
34.3、本发明亲脂性和体外稳定性良好,较为适合人体使用,为临床转化应用奠定了基础,针对阿兹海默症达到精准诊断的目的,可适应阿兹海默症患者的pet/ct检查需要,具有良好经济效益与社会效益。
附图说明
35.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
36.图1为一种甲基苯胺类aβ蛋白显像剂的双柱合成方法的合成过程示意图;
37.图2为本发明中一种甲基苯胺类aβ蛋白显像剂的高效液相色谱分析图谱;
38.图3为一种甲基苯胺类aβ蛋白显像剂的双柱合成方法的工艺流程示意图;
39.图4为本发明实施例中提供的正常健康者(上)及阿兹海默症患者(下)正电子发射断层成像pet/ct图像;
40.图5为本发明中一种甲基苯胺类aβ蛋白显像剂的薄层色谱分析图谱。
具体实施方式
41.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
42.下面结合实施例对本发明作进一步的描述。
43.实施例1
44.本实施例的一种甲基苯胺类aβ蛋白显像剂的双柱合成方法,如图1和图3所示,所述合成方法,包括以下步骤:
45.step1:预备阴离子交换柱柱,启用回旋加速器,以
18
o(p,n)
18
f反应生产
18
f水溶液;
46.step2:以氦气将照射后的水溶液传入合成器接收瓶中;
47.step3:回收
18
o水,以阴离子交换柱捕捉
18
f离子,使
18
f离子保留在阴离子交换柱上;
48.step4:使用0.2ml(0.33mol/l)的碳酸钾水溶液与0.7ml(0.3mol/l)的氨基聚醚乙腈溶液,混合溶液将
18
f离子从阴离子交换柱上洗脱进入反应瓶中,对反应瓶中的溶液进行蒸发干燥除水处理,温度保持为110℃;
49.step5:在反应瓶中加入1-2mg的前体溶液,而后进行加热处理,温度保持110℃,加热时长为10min,生成反应液;
50.step6:待step5中的反应液冷却后,加入0.7ml盐酸(3mol/l),加热反应瓶至120℃,水解反应7min;
51.step7:待step6中的溶液冷却后,加入2ml氢氧化钠(1mol/l),进行中和,生成粗产物;
52.step8:将粗产物通过sep-pak c18和oasis hlb柱,粗产物被捕获;
53.step9:先用15ml 10%乙醇溶液洗脱双柱,再用10ml 30%乙醇溶液除去部分有机杂质,最后用1.5-2ml无水乙醇将产物洗脱至收集瓶;
54.step10:向收集瓶加入适量生理盐水,将乙醇浓度稀释至10%,过无菌滤膜后得放射性终产物;
55.step11:终产物的质量测定
56.如图1所示,所述终产物为含有
18
f-(e)-4-(2-(6-(2-(2-(2-18
f-氟乙氧基)乙氧基)乙氧基)吡啶-3-基)乙烯基)-n-甲基苯胺的乙醇生理盐水溶液。
57.本实施例在具体实施时,准备试剂:配制0.33mol/l的碳酸钾水溶液(k2co3),0.3mol/l的氨基聚醚乙腈溶液(k.2.2.2/mecn),前者抽取0.2ml,后者抽取0.7ml,加入到一号瓶中,抽取0.5ml分析纯无水乙腈加入到2号瓶中,av105前体1mg用1.5ml二甲基亚砜溶解
加入到3号瓶中,0.7ml盐酸(3mol/l)加入到4号瓶中,2ml氢氧化钠(1mol/l)加入到5号瓶中,15ml10%乙醇溶液加入到6号瓶中,10ml30%乙醇加入到7号瓶中,2ml无水乙醇加入到8号瓶中,18ml生理盐水加入到产品收集瓶中,在收集瓶上方连接无菌滤膜;
58.辅助材料及预处理:qma柱依次用5ml无水乙醇、10ml0.1mol/l碳酸氢钠水溶液、10ml注射用水冲洗并排空。sep-pak c18和oasis hlb柱依次用5ml无水乙醇、10ml注射用水冲洗并排空;
59.通过医用回旋加速器生产
18
f离子,在氦气的载带下,传输至卡套上端的氧水中转v型瓶中,待活度计读数不再增长后,停止传输;氮气加压中转v型瓶,
18
f离子被阴离子交换柱捕获,其余
18
o-水回收至氧水回收瓶中;1号瓶中混合液洗脱阴离子交换柱中的
18
f离子进入反应瓶;加热反应瓶至110℃干燥除水;反应瓶干燥后向反应瓶中继续加入2号瓶乙腈,进行第二次干燥除水;反应瓶干燥冷却后加入3号瓶前体;加热反应瓶至110℃,氟化反应10分钟;冷却后,加入4号瓶盐酸,加热反应瓶至120℃,水解反应7min;冷却后,加入5号瓶氢氧化钠,进行中和,生成粗产物,转移反应瓶中的粗产物至sep-pak c18和oasis hlb柱,粗产物被捕获;先用6号瓶乙醇溶液洗脱双柱,再用7号瓶乙醇溶液除去部分有机杂质,最后用8号瓶无水乙醇将产物洗脱至收集瓶;过无菌滤膜后得放射性终产物
18
f-av45。测量产品活度,计算未校正放化产率为37
±
3%。
60.实施例2
61.本实施例还提供一种质量测定的方法,如图2和5所示,所述步骤step11的质量测定的过程,包括以下步骤:
62.s1:提取100ul最终产品,点样于硅胶板,采用85%乙腈溶液作为展开剂上行展开;
63.s2:待涂布溶液晾干后,启动薄层扫描仪检测,测定放化纯度,作出记录;
64.s3:启用c18反相柱,流动相采用乙腈溶液、水溶液和三乙胺,其体积比为55:44.85:0.15;
65.s4:提取100μl的最终产品,加入1ml的生理盐水,并放置于室温下,逐步孵育20、40、80和120min,并逐步采用hplc法测定放化纯度,观察稳定性。
66.实施例3
67.本实施例中,如图4所示,正常健康者及阿兹海默症患者正电子发射断层成像pet/ct图像,正常健康者及阿兹海默症患者静脉注射
18
f-av45注射液370
±
185mbq,卧床休息1-1.5h,进行pet/ct扫描,在软件重建后,得到pet/ct图像。正常健康者双侧大脑皮层各叶、基底核区及丘脑放射性分布均匀对称,未见明显代谢增高,阿兹海默症患者表现大脑皮层弥漫性代谢增高。
68.综上所述,本发明所采用双柱合成方法方便、简单、产率高,并且容易掌握,整个合成过程处于全自动、全密闭的系统中进行,符合gmp要求,并且在必要的时候可以进行人工干预,确保合成的顺利进行,大大提升了容错率,量产化容易,难度低,有效缩短合成周期,降低了放射性衰变带来了危险隐患,提升安全性,操作人员操作时间短,所受辐射减少;
69.亲脂性和体外稳定性良好,较为适合人体使用,为临床转化应用奠定了基础,达到阿兹海默症达到精准诊断的目的,可适应阿兹海默症患者的pet/ct检查需要,具有良好经济效益与社会效益。
70.以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例
对本发明进行了详细的说明,本领域的普通技术人员应当理解,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不会使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1