一种柯萨奇病毒A10型VP1蛋白表位肽、筛选方法及应用
一种柯萨奇病毒a10型vp1蛋白表位肽、筛选方法及应用
技术领域
1.本发明涉及生物技术领域,具体涉及一种柯萨奇病毒a10型vp1蛋白 表位肽、筛选方法及应用。
背景技术:
2.手足口病(hand,footandmousedisease,hfdm)是由多种肠道病毒引起的 常见儿童传染病,临床表现为发热、手、足、臀部皮疹、疱疹及口腔黏膜溃 疡等,多为自限性症状,少数患儿可继发脑炎、脑膜炎、心肌炎,严重可引 起急性迟缓性麻痹、神经源性肺水肿及肺出血等神经系统并发症,甚至危及 患儿生命。肠道病毒a组71型(enterovirus71,ev-a71)和柯萨奇病毒a组 16型(coxsackievirusa16,cv-a16)是引起手足口病的主要病原体,但近年 来流行病学研究表明,柯萨奇病毒a组10型(cv-a10)感染引起的手足口 病呈上升趋势。自2008年,芬兰首次出现由cv-a10感染hfdm流行后, 世界各地相继报道cv-a10的流行,cv-a10已成为引起hfdm的肠道病毒 重要型别。
3.cv-a10隶属于小rna病毒科、肠道病毒属a组,与其他型肠道病毒 一致,其电镜下分子结构为正二十面体对称球形,由60个亚单位构成,每 个亚单位包含vp1、vp2、vp3及vp4四种结构蛋白(viralprotein,vp),构 成病毒颗粒衣壳。vp1、vp2和vp3蛋白暴露于病毒成熟颗粒外部,是病毒 抗原表位的主要所在区域,其中vp1蛋白在不同组别的肠道病毒间具有抗原 特异性,是病毒型别鉴定及分型的主要区段;vp4蛋白包埋于病毒颗粒内部 与病毒核心相连。cv-a10基因组全长7.4kb,仅含有一个开放阅读框(orf), 编码一个多聚前体蛋白,可水解为p1~p3三个前体蛋白,其中p1前体蛋白 编码vp1~vp4四个结构蛋白,p2和p3前体蛋白编码2a~2c和3a~3d七 个非结构蛋白,其中2a和3c蛋白具有特异性水解酶作用,切割病毒rna 的编码蛋白;2b和3a蛋白协助rna复制;2c蛋白参与能量供给过程;3b 蛋白结合在5’端非编码区,参与vpg加工和合成;3d蛋白是rna聚合酶 病毒基因组的关键酶。
[0004][0005]
cv-a10引发的hfdm的流行和病毒的不断进化,目前缺乏有效的疫苗 和抗病毒药物,而研发疫苗是当前最可靠的预防cv-a10暴发的手段。zhang 等对甲醛灭活的cv-a10全病毒疫苗进行评价,其产生的抗血清中具有高度 的中和抗体效价,且具有体内免疫保护作用;使用β-丙内脂灭活的cv-a10 原性株(kowalik)和cv-a10/s0148b分离株的实验用疫苗均可诱导小鼠产 生cv-a10特异性抗血清,其研究表明两种实验用灭活疫苗均对cv-a10同 源病毒株的感染起到中和作用,且具有一定的体内免疫保护作用 [zhangz,dongz,lij,etal.protectiveefficaciesofformaldehyde-inactivatedwhole
‑ꢀ
virusvaccineandantiviralsinamurinemodelofcoxsackievirusa10infection[j].jvi rol,2017;91.]。病毒样颗粒(virus-likeparticles,vlp)疫苗在cv-a10中也已 有研究,基于cv-a10原性株(kowalik)和cv-a10/s0148b分离株的vlp 疫苗可有效诱导小鼠产生特异性抗体且具有免疫保护作用。这表明 cv-a10vlp疫苗具有巨大潜力可用于后期多价疫苗的研发,但仅针对原型 株和特定分离株的cv-a10vlp疫苗对具有其他基因型的cv-a10是否可起 到保护作用
vp1区蛋白线性中和表位进行综合筛选,并通过微量中和实验对筛 选出的表位肽基于的候选表位疫苗抗血清中和抗体滴度进行鉴定,得到具有 免疫保护性高的优势表位。
[0015]
进一步,所述的生物信息学法的筛选方法,包括如下步骤:
[0016]
步骤1:cv-a10 vp1蛋白二级结构分析:对cv-a10-p148分离株vp1 蛋白序列进行预测,采用dnastar软件protein模块中方法预测cv-a10vp1 蛋白的二级结构;
[0017]
步骤2:cv-a10 vp1蛋白表位的预测:利用abcpred、bcpred和 svmtrip三个在线服务器对cv-a10-p148分离株vp1蛋白进行表位预测, 并结合cv-a10-p148分离株vp1蛋白的二级结构进行表位的筛选,得到5 条符合条件的候选肽段p1、p2、p3、p4及p5,肽段p1、p2、p3、p4及 p5的氨基酸序列依次为seq id no:1、seq id no:2、seq id no:3、 seq id no:4、seq id no:5;
[0018]
步骤3:通过候选肽段结构定位进一步的筛选:为确定已筛选出的p1、 p2、p3、p4及p5的肽段在柯萨奇病毒a10型颗粒表面的具体位置,构建柯 萨奇病毒a10晶体结构用于进一步筛选,得到暴露于柯萨奇病毒a10晶体 结构的外侧的p3、p4、p5候选肽段;
[0019]
步骤4:候选表位疫苗制备及候选肽段的免疫原性测定:分别制备p3、 p4、p5候选肽段的合成肽,并分别与klh偶联,得到3个偶联肽—候选表 位疫苗,进行动物免疫得到相应的抗血清;再采用间接elisa法检测候选 肽段特异性抗体水平,验证p3、p4、p5候选肽段均具有免疫原性;
[0020]
步骤5:候选表位疫苗体外保护测定:采用微量中和实验对p3、p4、p5 候选肽段基于的表位疫苗抗血清中和抗体滴度进行测定,确认p4肽段为 cv-a10的中和性表位。
[0021]
采用上述进一步方案的有益效果是:生物信息学方法筛选通过联合多服 务器参数可提高表位筛选的准确性,但由于预测方法学的不同致使法预测蛋 白质二级结构时存在α-螺旋、β-折叠结构的预测差异,如chou-fasman与 garnier-rosin法,需通过三级结构进一步筛选;通过将预测出的5条肽段 展示在蛋白五聚体结构上,进一步得到3条(p3、p4、p5)暴露于柯萨奇 病毒a10型颗粒衣壳外侧更具有表位优势的线性表位;将候选的3条肽段 偶联klh以保证短肽免疫原性,将偶联肽免疫blab/c小鼠制备抗体血清 以测定其抗体中和能力;间接elisa实验显示p3、p4、p5均可诱导免疫 反应发生,具有免疫原性;体外保护实验或微量中和实验显示p4肽段抗血 清平均中和抗体效价为1:17.96,表明p4肽段为cv-a10的线性中和表 位。
[0022]
进一步,所述的重叠肽法的筛选方法,包括如下步骤:
[0023]
步骤1:制备重叠肽:通过已测序的cv-a10-p148分离株vp1蛋白的 序列,制备重叠肽,每条重叠肽段长度为15个氨基酸,相邻两肽重叠8个 氨基酸,共39条重叠肽段;
[0024]
步骤2:检测重叠肽的反应性:采用间接elisa法,以柯萨奇病毒a10 型全病毒抗血清为一抗,检测39条重叠肽的抗原性;得到p1、p6、p15、 p17、p33为反应性肽段,p1、p6、p15、p17、p33反应性肽段的氨基酸序 列依次为seq id no:1、seq id no:6、seq id no:7、seq id no:8、 seq id no:9;
[0025]
步骤3:微量中和抑制实验:通过微量中和抑制实验对p1、p6、p15、 p17、p33反应性肽段的中和潜能进行筛选,确认p1、p6为具有高中和抑制 作用的肽段;
[0026]
步骤4:候选表位疫苗制备及肽段的免疫原性测定:制备p1、p6肽段 的合成肽,并分别与klh偶联,得到2个偶联肽,进行动物免疫得到相应 的候选肽段基于的表位疫苗抗血
清;再采用间接elisa法检测p1、p6肽段 的特异性抗体水平,确认p1、p6肽段均具有免疫原性;
[0027]
步骤5:候选表位疫苗的体外保护实验:采用微量中和实验对p1、p6 肽段基于的候选表位疫苗抗血清中和抗体滴度进行测定,确认p6肽段为 cv-a10的中和性表位。
[0028]
采用上述进一步方案的有益效果是:为避免生物信息学法由于服务器参 数原因致使筛选结果存在疏漏,通过重叠肽法进行筛选以作互补。利用人工 合成的39条重叠的cv-a10 vp1蛋白肽段,首先筛选出具有抗cv-a10全 病毒血清高反应性的5条肽段(p1、p6、p15、p17、p33),存在潜在的抗 cv-a10抗体识别表位;为初步筛选高反应性肽段的中和潜能,且排除由于 elisa实验结果受抗体纯度及试剂质量的影响可能存在的假阳性反应,通 过微量细胞中和抑制性实验加以筛选。实验显示5条高反应肽段中只有2 条肽段(p1、p6)可抑制cv-a10抗体与cv-a10病毒间的反应,在稀释后 浓度至为3.91μg/ml时即可产生中和抑制作用,表明是潜在的候选线性中 和性表位。为进一步明确候选的肽段抗体中和能力,将其偶联klh后免疫 blab/c小鼠制备抗血清,采用间接elisa法测定其igg抗体确定其免疫 原性,其中p1、p6均可诱导免疫反应发生,具有免疫原性,微量中和实验 显示cv-a10 vp1-p6抗血清平均中抗体滴度(1:8),表明p6为cv-a10 vp1 的线性中和表位。
[0029]
本发明的第三个目的是提供上述的表位肽用于制备柯萨奇病毒a10型 表位疫苗、制备柯萨奇病毒a10型特异性抗体、制备诊断或检测柯萨奇病毒 a10型感染试剂。
[0030]
进一步,将所述的表位肽与载体蛋白偶联后,再与免疫佐剂组合,即得 柯萨奇病毒a10型的表位疫苗;所述表位疫苗免疫动物后,获得柯萨奇病毒 a10型的抗体。
[0031]
进一步,所述柯萨奇病毒a10型的抗体或所述表位肽可用于制备诊断或 检测柯萨奇病毒a10型感染的试剂。
[0032]
其中所述载体蛋白为klh。
附图说明
[0033]
图1为正常rd细胞及cv-a10感染的rd细胞形态;a:正常rd形态; b:cv-a10感染后rd细胞形态;
[0034]
图2为cv-a10vp1蛋白的二级结构分析图;
[0035]
图3为p1-p2各候选肽段在cv-a10五聚体三维结构中的位置;其中, a:cv-a10衣壳外侧;b:cv-a10衣壳内侧;
[0036]
图4为p3、p4、p5肽段抗血清总iggod值对比图;其中,anti-p3: cv-a10vp1-p3(aa96-104)抗血清;anti-p4:cv-a10vp1-p6(aa162-176) 抗血清;anti-p5:cv-a10vp1-p5(aa207-224);nc:hcv-e2抗血清; bc:注射生理盐水后血清;
[0037]
图5为p3、p4、p5肽段抗血清中和效价对比图;其中,anti-p3: cv-a10vp1-p3(aa96-104)抗血清;anti-p4:cv-a10vp1-p6(aa162-176) 抗血清;anti-p5:cv-a10vp1-p5(aa207-224);nc:hcv-e2抗血清;
[0038]
图6为间接elisa法筛选39条肽段图;
[0039]
图7为p1、p6肽段抗血清总iggod值对比图;其中,anti-p1:抗 cv-a10vp1-p1(aa1-15)血清;p6:抗cv-a10vp1-p6(aa39-53)血清; nc:抗hcv-e2(aa384-809)血清;bc:注射生理盐水后血清;
[0040]
图8为p1、p6肽段抗血清中和效价对比图;其中,anti-p1:抗 cv-a10vp1-p1(aa1-15)血清;anti-p6:抗cv-a10vp1-p6(aa39-53)血 清;nc:抗hcv-e2(aa384-809)血清;
[0041]
图9为cv-a10vp1区氨基酸序列对比图;其中,a:p4(vp1-paa162-176) 为对应框中位置;b:p6(vp1-paa39-53)为对应框中位置;“·”代表与 cv-a10/p148/zs/chn/2012氨基酸序列相同;
[0042]
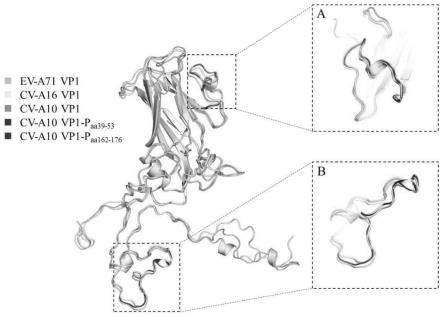
图10为vp1蛋白三维结构对比图,其中,a:cv-a10vp1-paa39-53 三维结构;b:cv-a10vp1-paa162-176三维结构。
具体实施方式
[0043]
以下对本发明的原理和特征进行描述,所举实例只用于解释本发明,并 非用于限定本发明的范围。
[0044]
1实验材料
[0045]
1.1实验毒株、血清与细胞
[0046]
cv-a10-p148病毒由中山市疾病预防控制中心从一临床手足口病患儿 粪便中分离,完成cv-a10(genbank:mk645898)测序并保存。使用sdt 和megax软件根据cv-a10vp1区序列的同源性进行划分并构建进化树, 本实验已测序的cv-a10-p148分离株属于我国常见的c基因型,且与其他 cv-a10分离株具有较高同源性(76.7%~96.8%),可视为我国目前cv-a10 代表株。
[0047]
抗cv-a10全病毒血清为cv-a10-p148分离株灭活、纯化并定量后交由 武汉金开瑞生物工程有限公司通过常规方法免疫balb/c小鼠获得,经 elisa实验验证,抗血清含cv-a10-p148特异的抗体水平达1:128000以上。
[0048]
人横纹肌肉瘤细胞(rd cell):病毒培养及中和实验所用的rd细胞由 本课题组制备并保存。
[0049]
1.2实验动物
[0050]
6~8周龄spf级雌性blab/c小鼠,体重16~18g,购于湖南斯莱克景达 实验动物有限公司,动物许可证号scxk(湘)2016-0002。
[0051]
2主要试剂
[0052]
2.1主要实验试剂
[0053]
表1主要实验试剂
[0054]
[0055][0056]
2.2主要试剂的配制
[0057]
dmem培养基(细胞维持液):dmem固体粉末13.5g,nahco32g, 青霉素2ml,ddh2o1l,高压灭菌,过滤除菌后存于4℃。
[0058]
细胞生长液:dmem 178ml,fbs 20ml,青霉素2ml。
[0059]
细胞冻存液:dmso 1ml,fbs 9ml。
[0060]
elisa洗涤液(0.1
×
pbst):1
×
pbs100ml,tween2010ml,ddh2o900ml。
[0061]
elisa封闭液(1%bsa-pbst):bsa1g,1
×
pbst100ml。
[0062]
抗体稀释液:取1ml封闭液,加入9ml 0.1%pbst,混匀。
[0063]
2.3主要实验仪器
[0064]
表2主要实验仪器
[0065]
仪器名称生产厂家生物安全柜bsc-1500,济南co2细胞培养箱mco-5ac,日本普通倒置显微镜leica,德国微量移液器eppendorf,德国全波长酶标仪thermo,德国恒温摇床欧诺,天津恒温水浴箱长风,北京高压蒸汽灭菌器博讯,上海4℃冰箱及-20℃冰箱海尔,青岛
[0066]
3.实验方法
[0067]
3.1细胞培养
[0068]
以下操作均在生物安全柜中严格消毒后操作:
[0069]
3.1.1rd细胞复苏
[0070]
(1)从本实验室液氮罐中取出一支装有rd细胞的冻存管,快速放入37℃的水浴箱中,轻轻转动使其融化。
[0071]
(2)将融化的rd细胞移至装有10ml rd细胞生长液的15ml离心管 中,轻轻颠倒使其分散、混匀。
[0072]
(3)离心(1000g5min)后弃去上清液,加入5ml细胞生长液重悬后, 移至t25细胞培养瓶中。
[0073]
(4)将t25细胞培养瓶平放于37℃5%co2细胞培养箱中,记录细胞 名称、复苏时
间、地点、操作人。
[0074]
3.1.2rd细胞传代
[0075]
(1)待95%的细胞平铺于t25细胞培养瓶时,选择无污染且生长良好 的培养瓶,弃去原细胞培养液。
[0076]
(2)加入2mld-hank’s洗涤液,轻摇洗涤3次,弃去。
[0077]
(3)加入2ml胰蛋白酶,平置于37℃5%co2细胞培养箱中作用1min 左右,待显微镜下观察细胞变圆后弃去胰蛋白酶消化液。轻震瓶身至细胞完 全脱落。
[0078]
(4)加入5ml细胞生长液,使用微量移液器轻轻吹打瓶壁至细胞均匀 悬浮,吸出细胞悬液按适当比例分装传代,补足细胞生长液,平置37℃5% co2细胞培养箱中培养,记录细胞名称、传代次数、传代时间、地点、操作 人。
[0079]
3.1.3细胞冻存
[0080]
(1)选择95%以上的细胞平铺于t25细胞培养瓶,弃去细胞生长液。
[0081]
(2)加入2mld-hank’s洗涤液,轻摇洗涤3次,弃去。
[0082]
(3)加入2ml胰蛋白酶,平置于37℃5%co2细胞培养箱中作用1min 左右,待显微镜下观察细胞变圆后弃去胰蛋白酶消化液。轻震瓶身至细胞完 全脱落。
[0083]
(4)加入1.8mlpbs,使用微量移液器轻轻吹打瓶壁至细胞悬浮均匀后 加入0.2ml细胞冻存液,轻摇混匀,分装至冻存管。
[0084]
(5)分级冻存:将冻存管放入程序降温盒分级冻存,记录细胞种类、 冻存时间、操作人。
[0085]
3.2病毒半数感染量(tcid
50
)滴定
[0086]
采用微量细胞培养法对保存的已纯化的cv-a10病毒株半数感染量 (tcid
50
)进行滴度测定,以下操作均在生物安全柜中严格消毒后操作:
[0087]
(1)种板:从95%以上的rd细胞平铺于t25细胞培养瓶中取出1ml 细胞悬液,吹打均匀后进行计数,使用细胞生长液将细胞稀释为 1
×
105~2
×
106/ml,并接种于96微孔板(每孔接种0.1ml),置于37℃5%co2细胞培养箱中待用。
[0088]
(2)病毒稀释:共设置8个稀释梯度(10-1
~10-8
),病毒稀释过程在冰 盒上操作,每稀释一次需更换枪头。
[0089]
(3)病毒接种:如图1,镜下观察上述rd细胞单层平铺于滴定板每孔 时,弃去细胞生长液,加入d-hank’s洗涤液洗涤,轻摇洗涤3次,弃去。 将上述稀释后的病毒悬液按由高至低的稀释度进行接种,每个稀释度接8孔, 每孔接种悬液0.1ml,对照孔加入0.1ml细胞维持液,轻摇混匀后置于37℃ 5%co2细胞培养箱,每日观察细胞病变效应(cytopathiceffect,cpe)。
[0090]
(4)病毒滴度计算:培养3至5天后,根据cpe结果计算病毒半数感 染量(tcid
50
),参照speasman-karber法计算,公式如下:
[0091]
lg tcid
50
/0.1ml=x0+d/2-d
×
∑pi/100
[0092]
x0:所用病毒最低浓度稀释度的对数;d:稀释度系数(倍数)的对数;∑pi: 各稀释度出现细胞病变百分数的总和。
[0093]
实施例1:生物信息学方法筛选cv-a10vp1蛋白线性表位及鉴定
[0094]
生物信息学方法筛选cv-a10vp1蛋白线性表位,包括以下步骤:
[0095]
1.cv-a10vp1蛋白二级结构分析
[0096]
本技术选择cv-a10-p148分离株vp1蛋白序列进行预测,采用dnastar 软件protein模块中方法预测cv-a10vp1蛋白的二级结构,了解vp1蛋白 结构特点。选择软件中已有的二级结构预测方案(chou-fasman法和 garnier-robson法)、双亲性方案(kyte-doolittle法和eisenbreg法)、柔性 方案(karplus-schulz法)、潜在位点方案(jameson-wolf法)和表面可及 性方案(emini法)进行分析。由图2可知,cv-a10vp1蛋白二级结构中存 在丰富的螺旋、转角结构,表明cv-a10vp1蛋白质具有良好的紧密结构。
[0097]
2.cv-a10vp1蛋白线性表位的预测
[0098]
利用abcpred、bcpred和svmtrip三个在线服务器对vp1蛋白进行线 性表位进行预测,并结合vp1蛋白的二级结构进行表位的筛选,其中:
[0099]
(1)abcpred:基于递归神经网络预测线性表位服务器;阈值设置为 0.51,线性肽长度设定为16个氨基酸;(2)bcpred:基于序列的线性表位 预测服务器;特异性设定为75%,线性肽长度设定为16个氨基酸;(3) svmtrip:基于支持向量机算法及倾向性线性表位预测服务器;线性肽长度 设定为16个氨基酸。
[0100]
根据其不同服务器预测分数及vp1蛋白二级结构特点,选取亲水性高、 柔韧性好和抗原性强且包含螺旋、转角和无规则卷曲的区域,得到5条符合 条件的肽段p1、p2、p3、p4及p5的表位,其对应氨基酸序列详细信息见表 3。
[0101]
表3cv-a10vp1蛋白可能的线性表位肽段信息
[0102]
肽段氨基酸位置氨基酸序列p11-15gdpvediihdalgntp230-44anttpsshrletgrvp396-104tdggtdttgp4162-176tdggtdttgp5207-224tdggtdttg
[0103]
3.候选表位结构定位
[0104]
为确定已筛选出的p1、p2、p3、p4及p5的表位在病毒颗粒表面的具体 位置,构建cva10病毒晶体结构用于进一步筛选。
[0105]
(1)上传已测序的cv-a10vp1、vp2、vp3及vp4氨基酸序列至swiss-model服务器,选择与其相似性较高的模板,以pdb文件保存, 用于表位空间结构筛选。(2)使用pymol软件打开已获取的模板,在命令 框中输入执行命令,标记已预测的线性表位及vp4蛋白,结合其空间位置筛 选出位于结构外部的表位。
[0106]
在swiss-mode中获取与cv-a10-p148分离株同源性较高(>60%) 的cv-a10五聚体模型(id:6iij.2),用pymol软件打开,并将cv-a10 整条vp4进行标记以确定五聚体的内部,再将上述预测的各cv-a10vp1线 性表位肽段序列进行标记,可见p3、p4、p5肽段位置暴露于衣壳蛋白的外 侧,为优势线性表位,而p1、p2肽段位于衣壳蛋白的内侧。因此,选择p3、 p4、p5为候选表位,见图3。
[0107]
4.候选表位疫苗制备及候选肽段的免疫原性测定
[0108]
为确定候选表位p3、p4、p5的免疫原性,委托上海吉尔生化有限公司 根据筛选出的表位序列制备合成肽,并与klh偶联,得到候选表位疫苗。
[0109]
(1)动物免疫:将6~8周龄雌性balb/c小鼠根据候选肽段数目进行 分组,每组6只。将合成的候选肽段偶联肽分别与完全弗氏免疫佐剂以1:1 体积比混合,充分乳化后采用皮下注射的方式初次免疫,免疫剂量50μg/只, 同时设置阴性对照组(hcv-e2)和空白对照组(生理盐水50μl/只)注射为 空白对照。各偶联肽分别与不完全弗氏免疫佐剂以1:1体积比混合后每两周 加强免疫一次,共加强免疫两次。第二次加强免疫后两周采集小鼠血清,得 到候选肽段抗血清。
[0110]
(2)采用间接elisa法检测候选肽段的抗血清的特异性水平:
[0111]
①
包被:使用包被液将各合成候选肽段浓度稀释为400ng/μl,100μl/ 孔包被至96微孔板内,4℃过夜。次日弃去包被液,elisa洗涤液洗板3~4 次。
[0112]
②
封闭:每孔加入100μl elisa封闭液,放置37℃恒温箱中封闭1h。 弃去elisa封闭液,elisa洗涤液洗板3~4次。
[0113]
③
加入一抗:将候选肽段抗血清(1:2000稀释)按1:2000进行稀释, 200μl/孔进行加样,37℃恒温箱中温育1h。然后加入200μl/孔elisa洗涤 液洗板3~4次。
[0114]
④
加入二抗:将hrp标记的hrp-羊抗鼠igg按1:5000进行稀释,100μl/ 孔加入,37℃恒温箱中温育1h。然后加入200μl/孔elisa洗涤液洗板3~4 次。
[0115]
⑤
显色:按1:1比例将tmb显色液与缓冲液进行混合,100μl/孔加入, 37℃避光显色10min。
[0116]
⑥
加入终止液:各反应孔中加入1mol/l硫酸(终止液)50μl以终止反 应。
[0117]
⑦
结果判定:经酶标仪测定od值,450nm波长处进行测定。以大于阴 性对照孔od值2.1倍即判定为阳性。
[0118]
根据各候选表位肽的氨基酸序列合成对应肽段并偶联klh后免疫小鼠 获得候选肽段抗血清,通过间接elisa法测定候选肽段抗血清总igg的od 值来反应其抗体水平,其中p3、p4、p5肽段抗血清中igg水平均高于对照 组,表明p3、p4、p5均可引起小鼠产生免疫应答,诱导产生igg,见图4, 其中左侧为p3抗血清的抗体水平;中部为p4抗血清的抗体水平;右侧为 p3抗血清的抗体水平。
[0119]
5.候选表位疫苗体外保护测定(微量中和实验)
[0120]
采用微量中和实验对候选肽段抗血清中和抗体滴度进行测定。
[0121]
(1)血清灭活:56℃加热30min上述获得的候选肽段抗血清。
[0122]
(2)血清稀释:在96微孔板上对灭活的候选肽段抗血清进行稀释, 0.25ml/孔加入细胞维持液,以2倍比将灭活的候选肽段抗血清进行稀释, 共12个梯度,每个梯度做2个复孔。
[0123]
(3)中和:根据病毒滴度,稀释至100tcid
50
/0.025ml的工作浓度, 取25μl垂直悬滴至每孔(细胞孔除外)。轻摇微孔板至病毒与血清均匀混 合,37℃培养箱中中和2h。
[0124]
(4)病毒回滴:中和结束后,将已稀释的病毒做10倍梯度稀释至 0.1tcid
50
/0.025ml,每个稀释度分别回滴2孔。
[0125]
(5)加入细胞悬液:加入细胞悬液(2
×
105/ml)0.1ml/孔。同时设置8 孔正常细胞对照孔。轻摇后置于37℃5%co2细胞培养箱内培养,逐日观察 细胞病变效应(cytopathiceffect,cpe)。
[0126]
(6)结果判定:待病毒阳性孔内细胞完全出现cpe时,记录各孔出现 cpe情况,以能
保护50%细胞不出现cpe的血清稀释倍数的倒数作为该血清 中和抗体滴度。
[0127]
注意:如果病毒回滴后结果如不在32~320tcid
50
/0.025ml范围内,实验 无效。
[0128]
通过微量中和实验对p3、p4、p5肽段抗血清中和抗体滴度进行测定,其 中p4肽段抗血清中和抗体平均效价为1:17.96,而p3、p5肽段抗血清中和抗 体效价分别为1:4、1:3.56(见图5),表明p4肽段为cv-a10vp1蛋白的优势 线性中和表位。
[0129]
实施例2:重叠肽法筛选cv-a10vp1蛋白线性中和表位及鉴定 重叠肽法筛选cv-a10vp1蛋白线性中和表位及鉴定,包括以下步骤:
[0130]
1.根据已测序的cv-a10vp1序列,委托上海吉尔生化有限公司制备重 叠肽(每条肽段长度为15个氨基酸,相邻两肽重叠8个氨基酸,共39条肽 段),液相色谱-质谱联用(hplc-ms)技术分析保证各重叠肽纯度均>90%。
[0131]
2.检测各重叠肽的反应性
[0132]
采用间接elisa法测定各重叠肽段与抗cv-a10全病毒血清的反应性, 其中一抗为抗cv-a10全病毒血清(1:2000稀释),二抗为hrp标记的 hrp-羊抗鼠igg(1:5000稀释);具体方法参照实施例1中的步骤4中的(2) 采用间接elisa法检测候选肽段的免疫原性。
[0133]
使用酶标仪检测三次独立重复实验结果的od450nm值,以大于阴性对 照孔(hcv-e2合成肽)od值2.1倍以上的重叠肽为反应性肽段。在待筛选 的39条肽段中,有5条肽段可判断其与抗cv-a10全病毒血清有明显反应, 分别为:p1、p6、p15、p17、p33(见图6),p1、p6、p15、p17、p33对 应氨基酸序列详细信息见表4。
[0134]
表4待选5条肽段详细信息
[0135]
肽段氨基酸位置氨基酸序列p11-15gdpvediihdalgntp639-53letgrvpalqaaetgp15106-120atwdidimgfvqlrrp17121-135kcemftymrfnaeftp33241-255asqlklqtrvymklk
[0136]
3.微量中和抑制实验
[0137]
通过微量中和抑制实验对上述具有反应性的肽段的中和潜能进行筛选;
[0138]
(1)稀释:分别稀释抗cv-a10全病毒血清(按1:400比例)及各合成 肽(2倍比梯度稀释)。根据病毒滴度,稀释至100tcid
50
/0.025ml的工作 浓度。
[0139]
(2)中和:96微孔板中分别加入50μl/孔不同稀释度的重叠肽段及稀 释后抗血清(每个稀释度的重叠肽设2个复孔),轻震混合后置于37℃培养 箱中中和2h。
[0140]
(3)加入细胞及毒株:加入100μl/孔2
×
105/mlrd细胞悬液后,每孔 加入25μl 100tcid
50
/0.025ml cv-a10毒株。同时设立阴性对照组(抗病毒 血清+病毒+rd细胞)和阳性对照组(病毒+rd细胞)轻轻混和后,置于37℃ 培养箱内培养,逐日观察细胞cpe。
[0141]
(4)结果判定:当阳性对照组细胞出现cpe时,记录各实验孔细胞cpe 情况,如50%细胞出现cpe,则认为该重叠肽段对抗cva10全病毒血清具 有中和抑制作用,判为“+”;反之判
“‑”
,其中“+”且对应浓度低的肽段则认为 其具有中和潜能的候选肽段。
[0142]
通过微量细胞中和抑制实验对上述具有高反应性的5条肽段进行筛选, 验证其中和抑制作用。其中p1、p6肽段具有高中和抑制作用,其稀释后浓 度在3.91μg/ml时仍有中和
抑制作用,而p15肽段稀释后浓度在低于 31.25μg/ml时无中和抑制作用,p17、p33肽段各在各稀释浓度均未产生中 和抑制作用,见表5。
[0143]
表5不同浓度待选肽段的中和抑制作用
[0144][0145]
4.候选表位疫苗制备及候选肽段的免疫原性测定
[0146]
为确定候选肽段p1、p6的免疫原性,委托上海吉尔生化有限公司根据 筛选出的重叠肽段氨基酸序列制备合成肽,并与klh偶联。通过免疫小鼠 获得候选肽段抗血清,采用间接elisa法检测候选肽特异性抗体水平,其 中一抗为p1、p6说候选肽段抗血清(1:2000稀释),二抗为hrp标记的 hrp-羊抗鼠igg(1:5000稀释),具体步骤参照实施例1中的步骤4。
[0147]
将上述具有高反应性且高中和抑制作用的肽段制成偶联肽免疫小鼠后 获得抗血清,通过间接elisa法测定p1、p6肽段抗血清总igg的od值来 反应其抗体水平,其中p1、p6肽段抗血清中igg水平均高于对照组,表明 其均可引起小鼠产生免疫应答,诱导产生igg,见图7。
[0148]
5.候选表位疫苗体外保护测定(微量中和实验)
[0149]
采用微量中和实验对候选肽段抗血清中和抗体滴度进行测定。具体方法 参照实施例1中的步骤5。
[0150]
通过微量中和实验对p1、p6肽段抗血清中和抗体滴度进行测定,其中 p6肽段抗血清中和抗体平均效价为1:8,而p1肽段抗血清中和抗体效价为1:2;表明p6肽段为cv-a10vp1蛋白的线性中和表位,见图8。
[0151]
实施例3:cv-a10vp1蛋白线性中和表位p4和p6结构分析
[0152]
1.一级结构保守性分析
[0153]
对两种方法得说到的cv-a10vp1蛋白的线性中和表位p4(cv-a10 vp1-paa162-176)和p6(cv-a10 vp1-paa39-53)肽进行氨基酸序列保守分 析,通过对比各cv-a10分离株及ev-a71和cv-a16的vp1区,由图9可 见,两种方法得到的表位p4和p6肽的氨基酸序列在cv-a10型间均具有高 度保守,其中生物信息学方法得到的线性中和表位p4与ev-a71、cv-a16 对应区域存在明显的氨基酸序列差异(见图9a),重叠肽段法得到的线性 中和表位与ev-a71、cv-a16对应区域仅存在个别氨基酸差异(见图9b)。
[0154]
2.空间结构分析
[0155]
为进一步明确得到的cv-a10线性中和表位空间位置,分析所得线性中 和表位的结构特点,发现cv-a10 vp1-paa39-53和cv-a10 vp1-paa162-176肽段对应的氨基酸序列在型内具有高保守性,也表明选择 cv-a10-p148分离株作为当前流行株具有可靠性和适用性。
[0156]
通过对比ev-a71、cv-a16和cv-a10vp1蛋白三维结构,由图10可 见,cv-a10 vp1paa39-53(letgrvpalqaaetg)在40e、43r、52i处 存在氨基酸序列型间(ev-a71、cv-a16)差异,与gao[42]等人已鉴定的 ev-a71的igg表位(vp1的第40-51位氨基酸:dtgkvpalqaae相 比,cv-a10 vp1的第40位氨基酸谷氨酸(e)、第43为氨基酸精氨酸 (r),而ev-a71 vp1其对应位点氨基酸为天冬氨酸(d)和赖氨 酸(k);cv-a10 vp1-paa162-176(ptgrdafqwqtatnp)肽段对应 的氨基酸序列与ev-a71和cv-a16对应氨基酸序列明显差异,这可能是 由于cv-a10在进化过程中vp1区核苷酸序列发生重组,个别核苷酸序列 的插入或丢失致使氨基酸对应序列发生移码突变造成的;vp1-paa162-177 (ptgrdafqwqtatnp)与已鉴定的ev-a71 vp1蛋白中和表位sp55 (vp1的第164-177位氨基酸:pesreslawqtatnpc)及cv-a16 vp1 蛋白中和表位pep(vp1的第163-177位氨基酸:ptsrdsfawqtatnp) 存在部分氨基酸序列的重叠。结构分析发现,cv-a10 vp1-paa39-53和 cv-a10 vp1-paa162-176位于α-螺旋和无规则卷曲结构连接处,符合表位结 构特征,且与ev-a71及cv-a16对应区域氨基酸残基存在部分重合。
[0157]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施 例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发 明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1