一种核酸适配体及热启动DNA聚合酶的制作方法
一种核酸适配体及热启动dna聚合酶
技术领域
1.本发明公开了一种特异性封闭dna聚合酶的核酸适配体及由此制备的热启动dna聚合酶,属于生物技术、生物酶工程领域。
背景技术:
2.dna聚合酶是广泛应用于核酸扩增领域的工具,然而该酶在高温条件下具有的聚合酶活性在常温下依然存在。因此,扩增反应初始阶段易产生引物二聚体和非特异性扩增,导致恒温扩增速度与灵敏度下降,从而影响检测结果。可逆性消除聚合酶在常温下的聚合酶活性是抑制非特异性扩增的有效途径。
3.热启动dna聚合酶在常温下聚合酶活性结构域被特异性封闭,从而有效防止了引物二聚体和非特异性扩増的形成;当反应体系温度升高到一定阈值,封闭物质即与酶发生解离,聚合酶活性得到恢复,扩增反应开始。目前,低温下对酶进行可逆性封闭的主要方法主要有:化学修饰、酶抗体或核酸适配体。引入化学试剂容易对扩增造成抑制,影响扩增灵敏度;酶抗体的筛选与制备过程复杂,成本较高,且在扩增反应过程中酶需要较高温度预变性,复性才可恢复聚合酶活性,所以在恒温扩增领域有一定的应用难度。而核酸适配体不仅能特异性结合聚合酶抑制活性,并可在低温条件下复性,可用于恒温扩增技术。
4.核酸适配体是通过指数富集的配基系统进化技术(systematicevolution of ligands by exponential enrichment,简称selex)筛选分离得到的较短dna或rna单链。selex筛选一般包括以下3个部分:(1)随机核酸文库(初级文库、次级文库)与靶标结合;(2)通过特定的方法将与靶标结合的和未结合的核酸序列分离;(3)将与靶标结合的核酸序列进行扩增,制备成单链投入到下一轮筛选。几乎所有已报道的适配体都对靶标具有高亲和性,其解离常数(kd值)在微摩尔至纳摩尔范围内,因此适配体也被称为“化学抗体”。核酸适配体自1990年被发现以来,已迅速成为研究、诊断和治疗领域中的成熟工具。
5.核酸适配体可以与蛋白质、金属离子、小分子、多肽甚至整个细胞等靶标进行高亲和力和特异性的结合。与传统的抗体相比,核酸适配体具有分子量小、稳定性更好、无批次间差异性、易改造修饰、无免疫原性、制作周期短、生产成本低、可以人工合成等优势,免去了动物免疫和饲养、蛋白提取和纯化等一系列流程。这些优点使其在生物医学领域具有广阔的应用前景,因此在基础研究及应用研究领域均呈现了快速发展的趋势。
6.cn 113817708 b专利文件记载了一种扩增效率较高的突变型dna聚合酶。然而目前并没有利用核酸适配体特异性结合该dna聚合酶来制备热启动dna聚合酶的报道。因此,有必要提供一种热启动dna聚合酶,以减少扩增反应前所产生的非特异性扩增,并且在扩增过程中加快扩增速度与检测灵敏度,从而更好地应用于恒温扩增领域。
技术实现要素:
7.本发明的目的是提供一种特异性结合dna聚合酶的核酸适配体,和一种新型热启动dna聚合酶及其在恒温扩增上的应用。
8.为实现上述目的,本发明采用如下技术方案:
9.本发明提供一种核酸适配体,其特征在于,所述核酸适配体序列如seq id no.1所示。上述核酸适配体以氨基酸序列如seq id no.2所示的dna聚合酶(cn 113817708 b专利记载)为靶标物质,经磁珠selex 40℃正向筛选和50℃反向筛选,交替进行22轮得到。
10.本发明还提供一种热启动dna聚合酶,其特征在于,由上述的核酸适配体结合上述dna聚合酶构成。该热启动dna聚合酶在常温下聚合酶活性结构域被上述核酸适配体特异性封闭,dna聚合酶活性被抑制,扩增反应不能进行;而当温度高过50℃时,上述核酸适配体与上述dna聚合酶解离,酶活性恢复,扩增反应开始,从而达到热启动的目的。
11.本发明还提供一种热启动dna聚合酶的保存液,其特征在于,所述保存液的配方为:20mm tris-hcl、100mm kcl、1.5mm dtt、0.1mm edta、0.5%(v/v)tween20、0.5%(v/v)np40、50%(v/v)甘油;其中,tris-hcl的ph值为8.9。
12.本发明还提供由上述热启动dna聚合酶和上述保存液所构成的核酸检测试剂盒。
13.本发明还提供上述核酸适配体、热启动dna聚合酶、保存液、试剂盒在恒温扩增核酸检测中的应用。
14.在一些实施方案中,上述的核酸检测使用恒温扩增的方法。
15.在一些实施方案中,上述的恒温扩增方法为交叉引物或环介导恒温扩增,其中反应温度范围为高于50℃且低于65℃。当温度高过50℃时,上述核酸适配体与上述dna聚合酶解离,酶活性恢复,扩增反应开始,从而达到热启动的目的。而根据该dna聚合酶的性质,低于65℃可以保证其扩增活性。
16.在一些实施方案中,上述的恒温扩增反应温度为60℃。
17.本发明的有益效果是:与现有技术相比,本发明提供的核酸适配体优于其他酶封闭物,可在温度低于50℃时抑制dna聚合酶活性,同时分子量小,易于人工合成,并可以对不同部位进行修饰和取代,稳定性高,易保存。由此得到的热启动dna聚合酶可以减少扩增程序前的非特异性扩增,有效控制扩增反应初始阶段由于引物互搭或模板非靶标位点错配形成二聚体或非特异性产物的产生,从而增加恒温扩增速度与灵敏度。此外,本发明提供的热启动酶优于市面上其他酶扩增速度,不仅可应用于学术研究,也可应用于病原体感染等临床检测,具有广阔的应用前景。
附图说明
18.图1:磁珠selex筛选法流程图。
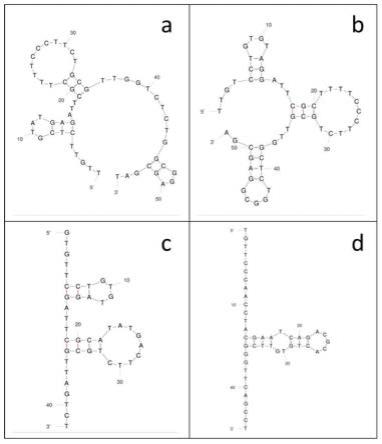
19.图2:a~d依次为apt-1、apt-2、apt-3、apt-4的二级结构预测结果。预测时条件设置为45℃,na+浓度150mm,mg2+浓度1mm。
20.图3:热启动酶特异性分析。
具体实施方式
21.下面结合附图和具体实施例对本发明进一步说明。
22.实施例
23.实施例1特异性结合dna聚合酶的适配体的筛选
24.cn 113817708 b专利文件记载了一种扩增效率较高的突变型dna聚合酶(序列如
seq id no.2所示)。本发明拟通过磁珠selex方法筛选与之配对的核酸适配体,具体筛选方法如下:
25.(1)第一轮与次轮筛选:
26.偶联:筛选所需的磁珠微粒数目为107~10
10
,需要加20μl聚合酶蛋白-微珠,此聚合酶蛋白-微珠是利用化学法将蛋白上的羧基与氨基微珠形成偶联。
27.孵育:利用结合缓冲液清洗聚合酶蛋白-微珠2次后,加入450μl初级ssdna文库与50μl 10
×
结合缓冲液,在95℃金属浴锅上孵育3分钟,然后冰浴5分钟,加入处理过的聚合酶蛋白-微珠,40℃混合仪上轻微振荡反应45分钟。
28.清洗和分离:将上述混合物通过磁力架进行磁分离,上清液弃用。然后用结合缓冲液清洗聚合酶蛋白-微珠数次,将未结合与弱结合的ssdna清洗干净。在dna聚合酶蛋白-微珠复合物中加入100μl洗脱缓冲液,95℃金属浴锅孵育15分钟,通过高温将ssdna从磁珠上洗脱。
29.扩增:将含ssdna的上清液进行pcr扩增。
30.10
×
结合缓冲液:1m nacl、50mm kcl、200mm tris-hcl、40mm mgcl2、0.2%tween 20所组成;其中,tris-hcl的ph值为7.4。洗脱缓冲液:0.4mm tris-hcl、0.1mm edta、35mm脲、0.02%tween 20所组成;其中,tris-hcl的ph值为8.0。
31.ssdna文库pcr扩增实验反应体系如下:
32.ssdna文库序列:
33.5'-ataccagcttattctt-n40-agatagtaagtgcaatct-3'
34.其中,n40表示40个任意核苷酸碱基连接而成的序列。
35.文库扩增引物:
36.正向引物序列1:5'-ataccagcttattcaatt-3';
37.反向引物序列2:5'-biotin-agattgcacttactatct-3'。
38.文库pcr扩增体系如下:
[0039][0040]
pcr反应程序为:95℃预变性3分钟;其中35个循环包括94℃变性30秒,55℃退火30秒,72℃延伸20秒;最终的延伸5分钟。
[0041]
(2)制备次级文库:
[0042]
双链dna解链:将上一轮筛选到的pcr产物与链霉亲和素微球混合(体积比20:3)放置于1.5ml离心管中,室温下反应20分钟,带有生物素的双链dna会与链霉亲和素微球结合。然后8000rpm离心5分钟后,弃上清。加入500μl 200mm naoh,混合均匀,反应15分钟,naoh会破坏dna的双链结构,8000rpm离心5分钟,取上清液即为ssdna。
[0043]
单链dna脱盐:将脱盐柱固定在铁架上,用灭菌去离子水洗两遍,然后加入解链所
得单链dna溶液,等液体滴完;加1000μl去离子水,用管柱接住滴下的液体,即为脱盐后的单链dna。
[0044]
(3)第一轮以后的正向筛选:将上一轮筛选制备的450μl次级文库作为该轮筛选的ssdna文库,与聚合酶蛋白-微珠反应。重复一轮筛选步骤,直至获得新的次级结构。
[0045]
(4)反向筛选:取20μl聚合酶蛋白-微珠,用结合缓冲液将聚合酶蛋白-微珠清洗2次。将上一轮筛选制备的90μl次级文库和10μl 10
×
结合缓冲液混合,在95℃金属浴锅上孵育3分钟,然后冰浴5分钟,加入处理过的聚合酶蛋白-微珠。50℃混合仪上轻微振荡反应45分钟。将上述得混合物通过磁力架进行磁分离,吸取上清液为ssdna文库,进入下一筛选。
[0046]
(5)按照上述筛选步骤,进行22轮selex筛选过程,并分别在第7、8、10、13、15、18、21轮的筛选后加入一轮反向筛选。
[0047]
(6)将最后一轮次级文库进行pcr扩增,取40μl产物进行高通量测序,选择4条丰富度高的核酸序列,如下:
[0048]
apt-1:ttgttctcgtatgagattcgcttttcccttctgcgttggtctctggcggagcgat;
[0049]
apt-2:ttgtcctgtgtaggattcgcttttcccttctgcgttggctctggcggagcga;
[0050]
apt-3:gtgttcctgtgtaggattcgcatatgacttctgcgttagtct;
[0051]
apt-4:tgttcccaacctacgaatcagacgcactgtgttcgggttcagcct;
[0052]
利用mfold软件将测序好的二级结构进行模拟分析(图2)
[0053]
(7)预测结果显示适配体具有较多的核酸二级结构,常见于trna作为辨识结构。由此可以推测核酸适配体二级结构中的茎环结构是辨识靶标分子的主要形式。
[0054]
(8)将筛选好的候选适配体与seq id no.2所示聚合酶制备适配体-dna聚合酶蛋白复合物。
[0055]
实施例2 4种候选适配体在不同温度下封闭酶活性的效果试验
[0056]
以合成的包含荧光标记的发夹型寡核苷酸序列作为模板序列,设计一条引物作为扩增引物,模板和引物序列如下:
[0057]
模板序列:5
’‑
(fam)-tgctcccgcggccgatctgccggccgcgggagca-(bhq1)-tagcgaaggatgtgaacctaataactgtaacgtac-3’[0058]
引物序列:5
’‑
gtacgttacagttattaggt-3’;
[0059]
将上述引物与模板搭配实施例1中筛选出的4种候选适配体-聚合酶复合物构建扩增体系,记为apt-1p、apt-2p、apt-3p和apt-4p共4组。另外设置阴性对照组,即将体系中的聚合酶用等体积的水代替。
[0060]
反应体系如下:
[0061][0062]
将4种dna聚合酶复合物按上述体系进行扩增反应,反应仪器为bio-rad cfx96,反应条件为40℃、45℃、50℃,反应60分钟后采集荧光,记录荧光检出结果。荧光值高于阴性对照记为检出荧光;荧光值不高于阴性对照记为未检出荧光。上述试验的结果如表1所示。
[0063]
表1不同适配体封闭dna聚合酶酶效果试验
[0064][0065]
n表示技术重复数量
[0066]
由表1可以看出,apt-3在40℃条件下不能完全封闭聚合酶活性;apt-2与apt-4在45℃条件下不能完全封闭聚合酶活性;apt-1在50℃条件下不能完全封闭聚合酶活性。所以选定apt-1作为dna聚合酶的封闭核酸适配体(序列如seq id no.1所示),实现该聚合酶的热启动效果。
[0067]
实施例3热启动酶的特异性测试
[0068]
利用人β-actin基因dna为模板,运用荧光定量pcr扩增人β-actin基因片段,通过检测荧光信号出现时间,比较利用apt-1适配体封闭的酶与未封闭的酶恒温扩增的特异性。以不同dna模板浓度进行恒温扩增的具体方法如下:
[0069]
dna模板浓度分别为10、30、100、1000、10000拷贝数/反应,实验反应体系如下:
[0070]
cpa人源β-actin基因扩增引物如下:
[0071]
正向外围引物fb:5
’‑
agtaccccatcgagcacg-3’[0072]
反向外围引物rb:5
’‑
agcctggatagcaacgtaca-3’[0073]
正向交叉扩增引物cpf:5
’‑
gagccacacgcagctcattgtatcaccaactgggacgaca-3’[0074]
反向交叉扩增引物cpr:5
’‑
ctgaaccccaaggccaaccggctggggtgttgaaggtc-3’[0075]
增强引物ip1:5
’‑
gagtgtgggtgttccctttgtacgggcccg-3’[0076]
检测探针ip2:5
’‑
(fam)-gcgtcggcctaccctcgtcctaacacgggagcctgcactgacccgacgc-(bhq1)3’[0077]
cpa反应体系如下:
[0078][0079]
将不同的dna聚合酶复合物按上述体系进行荧光扩增反应,反应条件为60℃,持续反应60分钟,反应仪器为bio-rad cfx96,记录扩增产物检出时间。
[0080]
上述试验的结果如图3所示:模板浓度于100~10000拷贝/反应时,封闭酶比未封闭酶扩增速度快,且灵敏度优于未封闭酶,说明经核酸适配体封闭后的聚合酶特异性更好。
[0081]
热启动酶可以根据应用场景配置为不同的dna聚合酶试剂盒。作为其中一种优选的实施方式,本实施例提供了一种热启动聚合酶试剂盒,特别适用于恒温扩增技术,例如交叉引物恒温扩增技术、滚轮核酸扩增、环介导等温扩增、链置换扩增、重组聚合酶扩增等。其中,热启动酶适配体为seq id no.1所示的核甘酸序列,而聚合酶为seq id no.2所示的氨基酸序列,保存液为20mm tris-hcl、100mm kcl、1.5mm dtt、0.1mm edta、0.5%(v/v)tween20、0.5%(v/v)np40、50%(v/v)甘油;其中,tris-hcl的ph值为8.9。
[0082]
实施例4热启动酶与非热启动dna聚合酶扩增特异性比较
[0083]
非结核分枝杆菌(ntm)是一种引起非肺结核的病原菌,在ntm检测系统开发中,经序列比对发现ntm序列与大肠杆菌16s序列相似度达到80%以上,所以针对ntm的检测系统容易扩增出大肠杆菌的基因。热启动聚合酶的应用可以减少由于错配而产生的非特异性扩增。本发明基于此设计了热启动酶与非热启动酶对不同模板的扩增特异性对比实验。
[0084]
测试酶包括本发明筛选的热启动酶apt-1p、未进行核酸适体封闭的dna聚合酶以及对照a组的非热启动dna聚合酶作为对照。
[0085]
检测样本及处理方法:经生理盐水稀释的非结核分枝杆菌和大肠杆菌培养物。将非结核分枝杆菌与大肠杆菌使用生理盐水进行稀释至:1000cfu/ml,使用生理盐水作为阴性对照。取1ml不同浓度的样本煮沸10分钟后作为模板,每个测试加入5μl模板,进行交叉引物恒温扩增cpa。
[0086]
cpa非结核分枝杆菌核酸检测引物如下:
[0087]
正向外围引物fb:5
’‑
gagtactgcaggggagact-3’;
[0088]
负向外围引物rb:5
’‑
ggatcccaaggaaggaaacc-3’;
[0089]
正向交叉扩增引物cpf:5
’‑
gtcagttactgcccagagaccc-ggaattcctggtgtagcgg-3’;
[0090]
负向交叉扩增引物cpr:5
’‑
ctgaggagcgaaagcgtggg-acacctagtacccaccgtt-3’;
[0091]
增强引物ip1:5
’‑
ccggtgttcctcctgatatc-3’;
[0092]
检测探针ip2:5
’‑
(fam)-gcgtcggaccctggtagtccacgccccgacgc-(bhq1)3’;
[0093]
cpa反应体系如下:
[0094][0095]
根据上述方案配制反应体系,于60℃进行交叉引物恒温扩增,持续反应1小时。反应结束后统计各组检出时间。
[0096]
上述试验的结果如表2所示:
[0097]
表2不同dna聚合酶对两种模板的扩增试验
[0098][0099]
n表示技术重复数量
[0100]
如表2所示,apt-1p热启动酶(封闭酶)相比未封闭酶和公司a的非热启动酶,检测系统的特异性和检出效率均更高。在ntm模板组中封闭酶比未封闭酶检出时间提高了34.03%,比公司a酶的检出时间提高了50.5%。经过适配体封闭的聚合酶在反应时间内未能检出大肠杆菌,表明该热启动聚合酶可以通过减少低温下非特异性扩增来提高检测系统的特异性。
[0101]
实施例5热启动dna聚合酶在环介导等温扩增方法上的应用
[0102]
本发明提供一种新型热启动dna聚合酶在环介导等温扩增(lamp)方法上的应用。通过lamp检测沙门氏菌的核酸,检测样本:加热80℃,30分钟,经生理盐水稀释的沙门氏菌培养物。
[0103]
引物序列:
[0104]
正向分离引物:5
’‑
cggcccgattttctctgg-3’;
[0105]
反向分离引物:5
’‑
cggcaatagcgtcacctt-3’;
[0106]
正向环引物:5
’‑
gcgcggcatccgcatcaatatgcccggtaaacagatgagt-3’;
[0107]
负向环引物:5
’‑
gcgaacggcgaagcgtactgtcgcaccgtcaaaggaac-3’;
[0108]
增强引物:5
’‑
ggccttcaaatcggcatcaat-3’;
[0109]
检测探针:5
’‑
(fam)-agggaaagccagctttacg-3’;
[0110]
lamp反应体系如下:
[0111][0112]
样本处理方法:按照上述体系配制反应,将沙门氏菌使用生理盐水进行浓度梯度稀释:10000cfu/ml、1000cfu/ml、100cfu/ml、10cfu/ml、1cfu/ml,使用生理盐水作为阴性对照。取1ml不同浓度的样本煮沸10分钟后作为模板。每个测试加入5μl模板。
[0113]
测试方法:使用biorad荧光pcr仪,反应程序为扩增温度60℃,持续反应1小时,记录扩增产物检出时间。
[0114]
表3热启动dna聚合酶应用在lapm检测中
[0115][0116]
测试结果如表3所示,本发明的热启动dna聚合酶结合lamp方法检测沙门氏菌可以检出100cfu/ml浓度的样本。
[0117]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1