用于蛋白质双向电泳中等电聚焦质控的荧光多肽及其制备方法与流程
1.本发明属于检测领域。更具体地,本发明涉及应用于蛋白质双向电泳中等电聚焦质控的荧光多肽及其制备方法。
背景技术:
2.1975年,意大利生化学家o'farrell发明双向电泳技术,主要是利用蛋白质的带电性和分子量大小的差异,通过等电聚焦电泳和sds-page电泳达到分离蛋白质组的技术。该技术中的等电聚焦电泳主要依据蛋白质或其它两性分子等电点的不同,在一个稳定的、连续的ph梯度中进行分离和分析。
3.等电聚焦电泳基本原理可分为两个部分,第一步构建电场,在一电解池中加入载体两性电解质,当通过直流电时,载体就根据各自等电点的不同而移动,并逐渐形成一个由阳极到阴极ph值逐渐增加的ph梯度。第二步分离蛋白质:由于蛋白质分子所带电荷量都取决于所处环境的ph值,在环境的ph值高于其pi值处带负电,反之则带正电,带正负电荷的蛋白分别向其等电点处泳动,直至其等电点处电荷消失而停止,达到平衡,等电点相近的蛋白聚集,形成一个很窄的区带,使不同等电点的样品相互分离。
4.等电聚焦电泳具有分辨率高(0.01ph单位)、抵消扩散的作用、浓缩低浓度样本等优点,不仅可以用来分离两性大分子,还可以通过测定等电点来鉴定蛋白质。
5.目前,在双向电泳的研究中,聚焦时间与胶条的长度、两性电解载体、样品基质中的离子浓度、ipg胶条水化状态、胶条泡涨等因素均会影响样品等电聚焦结果。而对于聚焦结果的检测,一般通过第二向电泳结束,sds-page胶染色后获知。虽然可以在等电聚焦的过程中对电流进行监测,但无法直接验证样品中蛋白的聚焦完全度。与此同时,即使通过对胶条进行银染或考马斯染色等方式进行结果的验证,但胶条无法继续进行第二向sds-page电泳。而市面上的等电聚焦标准品,往往用蛋白质分子,存在分子量大,使用时需要单独进行电泳的缺陷,无法做为真正的内参。如果与样品一起进行电泳,则会残留于sds-page胶中,对结果存在一定干扰。
6.因此,本领域急需一种能够与样品一起进行电泳,从而能够真正作为等电聚焦电泳的内参的标准品。
技术实现要素:
7.本发明的目的在于提供一种用于等电聚焦质控的内参多肽,所述内参多肽的分子量足够小,从而能够与样品一起进行电泳,同时不影响样品的等电聚焦,进而保证了双向电泳数据结果的重复性。
8.在第一方面,本发明提供一种用于等电聚焦质控的内参多肽,所述多肽是:
9.1)如下式(1)所示的多肽:
10.f-l-aa
1-aa
2-aa
3-aa
4-aa
5-aa
6-aa
7-aa8(1)
11.式(1)中,
12.f为荧光基团;
13.l为任选的连接分子;
14.aa1独立选自:e、k、d、r、q、n;
15.aa2独立选自:e、d;
16.aa3独立选自:i、k、l、v、m、a、f、r、q、n;
17.aa4独立选自:r、k、q、n、r、n;
18.aa5独立选自:r、k、q、n、r、n;
19.aa6独立选自:c、h、a、s、n、q、k、r、v、l、i或不存在;
20.aa7独立选自:y、c、w、f、t、s或不存在;
21.aa8独立选自:k、r、q、n或不存在;
22.或者,
23.2)在1)所述的多肽的序列中经过缺失、插入或置换一个或几个氨基酸得到的与1)所述的多肽具有相同功能的多肽衍生物。
24.在具体的实施方式中,式(1)中,
25.aa1独立选自:e、k、d、r;
26.aa2独立选自:e、d;
27.aa3独立选自:i、k、l、r;
28.aa4独立选自:r、k;
29.aa5独立选自:r、k;
30.aa6独立选自:c、h、a、s、r、v或不存在;
31.aa7独立选自:y、c、f、s或不存在;
32.aa8独立选自:k、r或不存在。
33.在具体的实施方式中3.如权利要求2所述的内参多肽,其特征在于,式(1)中,
34.aa1独立选自:e、k;
35.aa2独立选自:e;
36.aa3独立选自:i、k;
37.aa4独立选自:r、k;
38.aa5独立选自:r、k;
39.aa6独立选自:c、h、a或不存在;
40.aa7独立选自:y、c或不存在;
41.aa8独立选自:k或不存在。
42.在具体的实施方式中,所述内参多肽选自下组:
43.f-l-eeirr;
44.f-l-eekkk;
45.f-l-keirr;
46.f-l-keirry;
47.f-l-keirryk;
48.f-l-keirrcy;
49.f-l-keirrhyk;
50.f-l-keirrcyk;
51.f-l-keirrcck;
52.f-l-eekkkyk;
53.f-l-eeirrayk。
54.在优选的实施方式中,所述荧光基团是fitc、cy系列荧光(例如,cy2、cy3、cy5)、fam和罗丹明等;优选fitc或cy系列荧光;
55.所述连接分子是氨基己酸、β-丙氨酸;优选氨基己酸。
56.在具体的实施方式中,所述内参多肽选自下组:
57.fitc-acp-eeirr;
58.fitc-acp-eekkk;
59.fitc-acp-keirr;
60.fitc-acp-keirry;
61.fitc-acp-keirryk;
62.fitc-acp-keirrcy;
63.fitc-acp-keirrhyk;
64.fitc-acp-keirrcyk;
65.fitc-acp-keirrcck;
66.fitc-acp-eekkkyk;
67.fitc-acp-eeirrayk。
68.在第二方面,本发明提供用于等电聚焦质控的内参多肽的组合,所述组合包含第一方面所述的两种内参多肽。
69.在具体的实施方式中,所述组合包含fitc-acp-keirr和fitc-acp-keirryk。
70.在第三方面,本发明提供第一方面所述的内参多肽或第二方面所述的内参多肽的组合的用途,用于制备等电聚焦质控的内部参照品或用于等电聚焦方法中。
71.在第四方面,本发明提供一种等电聚焦方法,所述方法包括利用第一方面所述的内参多肽或第二方面所述的内参多肽的组合进行等电聚焦的步骤。
72.在优选的实施方式中,所述内参多肽的用量在1~5ng。
73.在第五方面,本发明提供一种双向电泳的方法,所述方法包括利用第一方面所述的内参多肽或第二方面所述的内参多肽的组合进行等电聚焦的步骤;以及,随后进行sds-page的步骤。
74.在优选的实施方式中,所述内参多肽的用量在1~5ng。
75.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
76.图1显示了在实施例2中,利用本发明的荧光多肽fitc-acp-keirr(fp-3)和fitc-acp-keirryk(fp-5)进行等电聚焦电泳的荧光扫描结果。结果显示多肽聚焦完全,等电聚焦
过程稳定,样本聚焦完全;
77.图2显示了在实施例3中,用本发明的两种荧光多肽(fp-3和fp-5)进行两次等电聚焦电泳的荧光扫描结果。结果显示,多肽聚焦完全,等电聚焦过程稳定,样本聚焦完全,且两次实验结果一致。
78.图3显示了在实施例3中,用本发明的两种荧光多肽(fp-3和fp-5)进行两次2d电泳的银染结果。结果显示:两张银染图的蛋白总体分布一致,蛋白匹配率大于80%。表明同一样本在不同次2d电泳实验中结果一致。
79.图4和图5显示了在实施例1中,对合成荧光多肽fitc-acp-keirr(fp-3)进行ms和hplc的质检,荧光多肽的分子量为1203.30符合要求的,且纯度为98.559%。
具体实施方式
80.发明人经过广泛而深入的研究,出乎意料地获得一系列荧光多肽。所述荧光多肽的分子量足够小,从而能够用作内参多肽与样品一起进行电泳。利用所述荧光多肽进行等电聚焦不仅能够做到多肽聚焦完全,等电聚焦过程稳定,样本聚焦完全,并且不同次实验之间的结果一致。在此基础上完成了本发明。
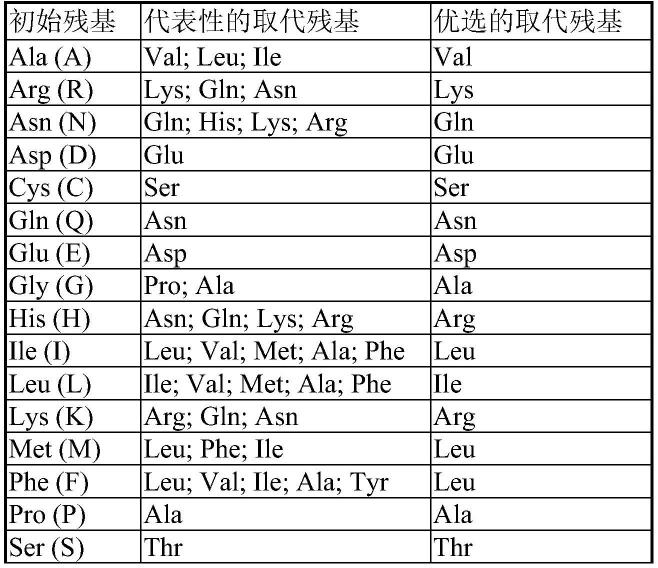
81.本文所用的术语具有本领域技术人员常规理解的含义。为清晰理解本发明起见,对本文所用的一些术语解释或定义如下。本领域技术人员应该理解,下文对术语的解释或定义并不以任何方式限制本发明的保护范围。
82.本发明的内参多肽
83.鉴于现有技术存在的问题,本发明的目的在于提供等电聚焦质量控制的内部参照品及其用途。本发明设计了几种荧光多肽化合物,该类化合物可直接溶于样品溶液,通过水化上样进入胶条,同样本一并进行等点聚焦电泳,通过荧光扫描系统检测质控的聚焦完全度,从而判断样品聚焦的完全度,为等电聚焦电泳提供了质量控制的内部参照品,也为后续是否进行sds-page电泳提供了判断的依据。
84.为解决上述的技术问题,本发明建立了一类低分子量、高纯度,易溶解、带荧光,在等电聚焦电泳中稳定的多肽,两种多肽为一组,聚焦结束后多肽位于胶条两端,通过检测多肽条带的聚合度及两多肽间距离,确定样品聚焦的完全度。
85.因此,本文所用的“本发明的内参多肽”、“本发明的多肽”、“本发明的荧光蛋白”、“本发明的蛋白”、“本发明的内参蛋白”等术语具有相同的含义,均是指如上所述的具有荧光的并且可用于等电聚焦,特别是双向电泳中的第一向等电聚焦电泳过程进行质量控制的内参多肽。
86.在具体的实施方式中,本发明设计了以下多肽,其氨基酸序列如下所示:
87.fitc-acp-eeirr(fp-1;seq id no:1);fitc-acp-eekkk(fp-2;seq id no:2);fitc-acp-keirr(fp-3;seq id no:3);fitc-acp-keirry(fp-4;seq id no:4);fitc-acp-keirryk(fp-5;seq id no:5);fitc-acp-keirrcy(fp-6;seq id no:6);fitc-acp-keirrhyk(fp-7;seq id no:7);fitc-acp-keirrcyk(fp-8;seq id no:8);fitc-acp-keirrcck(fp-9;seq id no:9);fitc-acp-eekkkyk(fp-10;seq id no:10);fitc-acp-eeirrayk(fp-11;seq id no:11)。
88.在等电聚焦电泳中用作内参多肽时,可以在本发明的多肽中选择两种多肽为一
组,从而能够在聚焦结束后,通过检测多肽条带的聚合度及两多肽间距离来确定样品聚焦的完全度。在具体的实施方式中,利用上述fp-3和fp-5为一组在等电聚焦电泳中用作内参多肽。
89.基于本发明的教导,本领域技术人员会基于现有技术选择本发明的内参多肽中的荧光基团,只要所选择的荧光基团具有发出荧光以供检测的功能即可。在具体的实施方式中,本发明的内参多肽中的荧光基团可以是fitc、cy2、cy3、cy5、fam和罗丹明等;优选fitc。
90.基于本发明的教导和本领域的常规技术手段,本领域技术人员还会理解,本发明的内参多肽中的荧光基团可以直接与氨基酸序列相连,也可以通过连接分子与氨基酸序列相连。在具体的实施方式中,本发明的内参多肽中的荧光基团通过连接分子与氨基酸序列相连。所述连接分子可以是氨基己酸、β-丙氨酸;优选氨基己酸。
91.本领域普通技术人员也不难知晓,在多肽的某些区域,改变少数氨基酸残基基本上不会改变生物活性,例如,适当替换某些氨基酸得到的序列并不会影响其活性(可参见watson等,molecular biology of the gene,第四版,1987,the benjamin/cummings pub.co.p224)。本领域普通技术人员根据现有的技术手段能够实施这种替换并且确保所得分子仍具有所需生物活性。
92.因此,本发明应包括上述内参多肽的保守性突变体;即在上述多肽的序列中经过缺失、插入或置换一个或几个氨基酸得到的与上述多肽具有相同功能的多肽衍生物。
93.例如,这些保守性突变体可以根据下表所示进行氨基酸替换而产生。
[0094][0095][0096]
本发明还提供了编码本发明多肽的多核苷酸。术语“编码多肽的多核苷酸”可以是
包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
[0097]
因此,本文所用的“含有”,“具有”或“包括”包括了“包含”、“主要由
……
构成”、“基本上由
……
构成”、和“由
……
构成”;“主要由
……
构成”、“基本上由
……
构成”和“由
……
构成”属于“含有”、“具有”或“包括”的下位概念。
[0098]
本发明的内参多肽的应用领域
[0099]
基于本发明的教导以及现有技术中的公知常识,本领域技术人员可以理解本发明的内参多肽可以应用于细胞治疗、基因治疗、重组药物、抗体药物的检测领域。
[0100]
在具体的实施方式中,本发明的内参多肽可以用作等电聚焦质控的内部参照品,从而用于等电聚焦方法中。因此,本发明还提供了一种进行等电聚焦方法,所述方法包括利用本发明的内参多肽或内参多肽的组合进行等电聚焦。进一步地,本发明还提供了一种进行双向电泳的方法,所述方法包括利用本发明的内参多肽或内参多肽的组合先进行等电聚焦;随后进行sds-page。
[0101]
在用作等电聚焦质控的内部参照品时,本发明的内参多肽的用量可以控制在很低的用量,从而不会影响样品的等电聚焦。在具体的实施方式中,在用作等电聚焦质控的内部参照品时,本发明的内参多肽的用量约为1~5ng。
[0102]
与现有技术相比,本发明的有益效果如下:
[0103]
(1)本发明的内参多肽的分子量低于2kd,在第二向sds-page电泳中全部从胶底部跑出,因此不影响sds-page胶中蛋白点的分析;
[0104]
(2)本发明的内参多肽采用了荧光标记技术,在等电聚焦电泳结束后,经荧光扫描系统检测胶条,可判断是否继续用于第二向sds-page电泳;
[0105]
(3)本发明的内参多肽的用量低,不影响样品等点聚焦;和
[0106]
(4)本发明的内参多肽保证了双向电泳数据结果的重复性。
[0107]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(cold spring harbor laboratory press,2001)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0108]
实施例1.荧光多肽的合成
[0109]
在本实施例中,以fp-3为例描述了本发明的荧光多肽的合成。
[0110]
1、荧光多肽的序列:fitc-acp-keirr(fp-3)。
[0111]
2、树脂肽的合成:用2-chlorotritylchloride(0.3mmol/g)s=0.2mmol/g,取树脂采用fmoc-工艺,按上述肽序列从c端向n端(从右到左)依次缩合氨基酸链接至肽链缩合完成。
[0112]
3、多肽的裂解:配置裂解试剂(tfa:h2o:edt:tis=95:1:2:2),用于切割多肽及树脂,反应结束,滤出裂解液,并用冰乙醚沉淀,室温减压干燥,得粗品。
[0113]
4、纯化:使用制备液相色谱系统,以0.1%tfa水溶液和0.1%tfa乙腈为流动相;采用反相c18(50
×
250mm)填料,40%0.01min-60%40min乙腈浓度梯度洗脱的方法,除去杂峰,收集目标产物。
[0114]
5、质检:采用hplc检测样本纯度,ms检测样本分子量。
[0115]
6、上述荧光多肽的合成实验均由合肥国肽生物科技有限公司完成。
[0116]
本发明的其它荧光多肽可以采用类似的方法合成得到。
[0117]
实施例2.荧光多肽的使用
[0118]
取荧光多肽fitc-acp-keirr(fp-3,1.0mg*管)和fitc-acp-keirryk(fp-5,1.0mg*管)各一管,用dmf、dmso等有机溶剂直接溶解稀释,低浓度样品可放于-20摄氏度保存,两种质控各自分别取1-5ng,体积控制在1-5μl,加入至样本溶液(100μg)中,水化上样总体积用2d水化液补足至340μl,采用ph3-10 l,18cm胶条水化上样,等电聚焦电泳,结束后用多模式多光谱的激光成像系统选在488/518bp22通道扫描。聚焦结果如附图1所示,在ph3-10 l线性胶条上多肽宽度为0.2cm
±
0.1cm,多肽间距为6cm
±
0.5cm,多肽聚焦完全,等点聚焦过程稳定,样本聚焦完全。
[0119]
实施例3.荧光多肽在hcp分析中的应用
[0120]
实验一:两种质控各自分别取2.5ng加至hcp样本溶液(100μg)中,用2d水化液补足至340μl,采用ph3-10 nl,18cm胶条水化上样,进行等电聚焦,胶条进行488/518bp22通道荧光扫描,最后进行垂直电泳,样本转移至sds-page胶,并根据分子量大小进行分离,sds-page胶的蛋白经过银染显色。实验二:一周后,同一样本重复实验一的步骤。
[0121]
荧光扫描结果如图2所示,在ph3-10 nl非线性胶条上,多肽宽度为0.2cm
±
0.1cm,多肽间距为8.6cm
±
0.5cm,多肽聚焦完全,等点聚焦过程稳定,样本聚焦完全,且两次实验结果一致。
[0122]
2d电泳的银染结果如图3所示:两张银染图的蛋白总体分布一致,蛋白匹配率大于80%。表明同一样本在不同次2d电泳实验中结果一致。
[0123]
在生物制品hcp研究中,双向电泳作为常用的分析手段,由于hcp样本ph分布广、蛋白种类多、单个蛋白丰度低的特性,在2d电泳表征时,图谱易受等点聚焦不完全、垂直电泳试剂和电压不稳定、银染试剂显色差异的影响而导致实验结果的不一致,荧光多肽质的应用,为hcp样品在等电聚焦过程提供了内部质控,保证了hcp样本结果在不同次2d电泳后的一致性和重复性。
[0124]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1