一种抗赤羽病病毒单克隆抗体及其应用的制作方法
1.本发明涉及生物技术领域,特别是涉及一种抗赤羽病病毒单克隆抗体及其应用。
背景技术:
2.赤羽病又称阿卡斑病,是由赤羽病病毒(akabane viru,akav)引起牛、山羊和绵羊等反刍动物的一种以早产、流产、死胎、木乃伊胎、胎儿畸形及新生儿发生关节弯曲积水性无脑综合征为临床特征的病毒性传染病。该病是目前严重危害养牛业和养羊业的疫病。
3.akav为布尼亚病毒科(bunyaviridae)布尼亚病毒属(orthobunyavirus)辛波病毒群(simbu serogroup)成员,为单股负链rna病毒。akav基因组由l、m和s三个片段组成,共编码4个结构蛋白(n、gn、gc和rdrp)和2个非结构蛋白(nss和nsm),其中l片段编码rdrp蛋白,m片段编码gn、gc和nsm蛋白,s片段编码n和nss蛋白。n蛋白为akav核衣壳蛋白,呈二十面体对称,也是akav中含量最多的蛋白及主要的免疫原性蛋白。akav n蛋白具有较高的保守性,通过对23个分离株之间n蛋白的orf进行比对研究,毒株之间的相似度为93%~100%,氨基酸序列的相似度为97%~100%,能够诱导机体产生抗体,可用于akav核酸和免疫学诊断。在免疫学检测方法中,前期已经建立了多种针对akav抗体的酶联免疫吸附试验(elisa)方法。但目前的检测方法多为akav抗体间接elisa检测方法。由于辛波病毒血清群内各成员具有交叉性,以akav纯化的病毒或n蛋白为包被抗原建立的间接elisa方法的特异性均有一定的限制性。目前为止,国内还未见有基于n蛋白的akav特异性的阻断elisa方法的报道。
技术实现要素:
4.本发明的目的是提供一种抗赤羽病病毒单克隆抗体及其应用,以解决上述现有技术存在的问题,该单克隆抗体能够特异性识别akav n蛋白,可以为制备赤羽病检测试剂盒提供技术支持。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提供一种赤羽病病毒单克隆抗体,所述单克隆抗体的重链如seq id no.1所示,轻链如seq id no.3所示。
7.本发明还提供上述的赤羽病病毒单克隆抗体在制备赤羽病病毒检测产品中的应用。
8.进一步地,所述产品为试剂或试剂盒。
9.本发明还提供一种赤羽病病毒检测试剂,包含上述的赤羽病病毒单克隆抗体。
10.本发明还提供一种赤羽病病毒检测试剂盒,包含上述的赤羽病病毒单克隆抗体。
11.进一步地,所述试剂盒为阻断elisa检测试剂盒。
12.进一步地,所述阻断elisa检测试剂盒还包括akav n蛋白。
13.进一步地,所述akav n蛋白的包被浓度为0.05μg/ml。
14.进一步地,所述试剂盒还包括阳性血清、阴性血清、20倍浓缩洗涤液、底物和终止液。
15.本发明公开了以下技术效果:
16.本发明提供的单克隆抗体能够特异性识别akav n蛋白,可以为制备赤羽病检测试剂或试剂盒提供技术支持。
17.本发明以纯化的akav n蛋白为包被抗原,以akav n蛋白为免疫原获得的单克隆抗体(monoclonal antibody,mcab)1c5为标记抗体,构建了一种赤羽病病毒的阻断elisa检测试剂盒,以满足当前基层动物防疫检疫和进出境动物检疫的检测需要。
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
19.图1为纯化后的akav n蛋白的sds-page鉴定;其中,1:纯化后akav n蛋白;m:预染蛋白质分子质量标准;
20.图2为纯化后mcab 1c5的wb及sds-page鉴定;其中,a:mcab 1c5的wb鉴定;b:纯化后mcab 1c5的sds-page鉴定;1:prv ep0重组蛋白;2:akav n蛋白;m:预染蛋白质分子质量标准;3:纯化前的mcab 1c5腹水;4:纯化后的mcab 1c5腹水。
具体实施方式
21.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
22.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
23.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
24.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
25.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
26.实施例1
27.1材料与方法
28.1.1细胞、菌株及主要试剂
29.宿主菌bl21(de3)购自全式金生物技术有限公司;pet28a-akav-n(1-702bp)重组质粒已在专利公开文本cn112979797a中已经公开;pet28a-ep0载体购买于北京擎科生物科技有限公司;akav阳性血清、阴性血清由本实验室从临床中采集并保存;tmb底物显色液购自索莱宝公司;牛病毒性腹泻病毒(bvdv)、蓝舌病病毒(btv)、牛结节性皮肤病病毒(lsdv)阳性血清均由本实验室从临床中收集保存;商品化id screen akav抗体检测试剂盒购自法国idvet公司。
30.1.2akav n蛋白的表达与纯化
31.将重组质粒pet28a-akav-n(1-702bp)转化至bl21(de3)中,加入终浓度为1mmol/l iptg(异丙基-β-d-硫代半乳糖苷)16℃过夜诱导表达,超声破碎后4℃12000rpm/min离心10min,并进行镍柱纯化。将纯化的蛋白进行sds-page鉴定。纯化后的akav n蛋白经bca法测定蛋白浓度后,保存于-80℃备用。
32.1.3mcab 1c5的制备、纯化及辣根过氧化物酶(hrp)标记
33.mcab 1c5杂交瘤细胞株由本实验室制备并保存,该mcab 1c5杂交瘤细胞株的制备过程如下:
34.取纯化后的akav n蛋白与弗氏完全佐剂按体积1:1比例混合乳化均匀,在小鼠背部皮下多点注射进行第一次免疫,每只小鼠免疫100μg akav n蛋白。21天后,再用纯化的akav n蛋白与弗氏不完全佐剂按体积1:1比例混合乳化均匀,进行第二次免疫,同样每只小鼠皮下注射100μg蛋白。7天后,小鼠断尾采血,用ifa方法检测血清抗体效价。具体操作如下:
35.将bhk细胞接种到96孔板,待细胞长满孔底时,用含akav病毒液的培养基孵育细胞1h后更换新的培养基,继续培养30h左右,弃去培养基用冰乙醇固定20min,pbs溶液洗3次;37℃条件下,小鼠血清孵育细胞1h,pbs溶液洗3次;37℃、避光条件下,荧光二抗(fitc标记的山羊小鼠igg)孵育细胞1h,pbs溶液洗3次,荧光显微镜下观察结果。与第二次免疫间隔21天,进行第三次免疫,此次免疫不需要佐剂乳化,直接将蛋白注入小鼠腹腔,3天后无菌摘取小鼠脾脏用于细胞融合。
36.细胞融合前24h,取两只健康的balb/c雌性小白鼠,摘掉眼球采血,作为阴性血清对照,拉颈使小鼠死亡,放入75%酒精中浸泡消毒5min后,取出小鼠使其仰卧,用剪子在小鼠腹部皮肤剪开一个小口,然后用镊子钝性撕开皮肤,以避免损伤腹腔完整性,暴露腹膜,用10ml注射器吸取培养基注入小鼠腹腔,反复吹吸几次,期间应防止针头刺破腹腔脏器和注意尽量不将针头取出腹腔,以避免污染培养基,最后吸出培养基加到96孔板,每孔100μl,置于37℃、5%co2培养箱备用。
37.取加强免疫的小鼠,摘眼球采血,离心获得血清,作为阳性血清对照,脱颈使小鼠死亡,将其放入75%酒精溶液中浸泡5min消毒,取出小鼠,将其仰卧放在平皿上,用剪子镊子剖开小鼠腹腔,小心取出完整脾脏,用培养基清洗后,放在新的干净的培养皿中,用注射器在脾脏一端扎2-3个孔,在另一端注入培养基吹出脾细胞至脾脏变白。离心该培养基收集脾细胞并计数备用。将脾细胞和sp2/0以5:1-10:1比例均匀混合,离心得细胞沉淀,用不含血清培养基洗一次,再次离心,将培养基吸弃干净,轻轻拨动离心管底使细胞沉淀松动。在37℃条件下,将提前37℃预热的1ml 50%peg溶液在60s内缓慢转动地加入该离心管后静置90s,进行细胞融合。然后将提前37℃预热的5ml hat培养基缓慢贴管壁转动地加入管中,终
止细胞融合。将融合后的细胞加到前一天铺饲养层细胞的96孔板,每孔100μl,置于37℃、5%co2培养箱中培养5天后,每孔更换一半培养基为ht培养基,继续培养5天后,完全更换为ht培养基继续培养。到融合细胞生长至20%~50%时,吸取孔内培养基通过elisa和ifa方法进行抗体检测以筛选出阳性杂交瘤细胞,并将该细胞接种到24孔细胞培养板继续用ht培养基扩大培养,待细胞增殖到80%左右时再检测一次,若结果依然为阳性则进一步亚克隆细胞。即对阳性杂交瘤细胞稀释计数,尽量将其以每孔1个细胞的数量接种到96孔板,待细胞生长至20%~50%时进行检测,再亚克隆阳性孔细胞,直到所有亚克隆孔均为阳性。
38.选取6-8月龄的balb/c雌性小鼠腹腔注射灭菌石蜡油(500μl/只),间隔1w后将1c5杂交瘤细胞株从液氮中取出复苏培养后腹腔注射小鼠(2
×
106/只)。采集腹水后利用western blot鉴定其与akav n蛋白的反应特性。将腹水送至北京博奥森生物技术有限公司进行纯化和hrp标记。将纯化后的1c5单抗进行sds-page鉴定,并置于-80℃长期保存。
39.1.4阻断elisa反应程序及最佳反应条件的选择
40.用ph9.6碳酸盐缓冲液对akav n蛋白稀释至终浓度为0.2μg/ml、0.1μg/ml、0.05μg/ml和0.025μg/ml包被elisa酶标板,每孔100μl,放于37℃作用2h后转4℃作用12h,用pbst洗涤3次后加入1%bsa于37℃作用1.5h;pbst洗涤酶标板3次,每次3min。将akav阳性血清和阴性血清用pbst进行1:1、1:10、1:20、1:50和1:100稀释,每孔100μl,孵育1h;pbst洗涤酶标板3次,每次3min,将hrp标记的mcab 1c5按照1:1000,1:2000,1:4000,1:8000,1:16000稀释,反应时间为1h;pbst洗涤3次后加入tmb底物显色液室温避光作用15min(100μl/孔),随后加入2mol/l硫酸终止反应,并用酶标仪读取d
450
值。每次只改变一个条件,筛选出最佳的抗原包被浓度、血清稀释浓度及酶标二抗作用浓度。
41.2结果
42.2.1akav n蛋白的表达和纯化
43.纯化后的akav n蛋白sds-page结果表明,pet28a-akav-n质粒转化的bl21表达菌诱导表达后能够在26kda左右看到与目标条带大小一致的蛋白(图1),bca法测定的蛋白浓度为1.98mg/ml。
44.2.2mcab 1c5的wb鉴定、纯化和hrp标记
45.mcab 1c5能与akav n蛋白的wb结果显示(图2a),26ku处有特异性目的条带,而pet28a-ep0为载体表达的猪伪狂犬病毒(pseudorabies virus,prv)ep0重组蛋白相应位置未出现特异性反应条带,说明mcab 1c5能与akav n蛋白发生特异性反应。纯化的mcab 1c5腹水sds-page鉴定结果表明(图2b),mcab 1c5由轻链(25ku)和重链(50ku)两个明显条带。
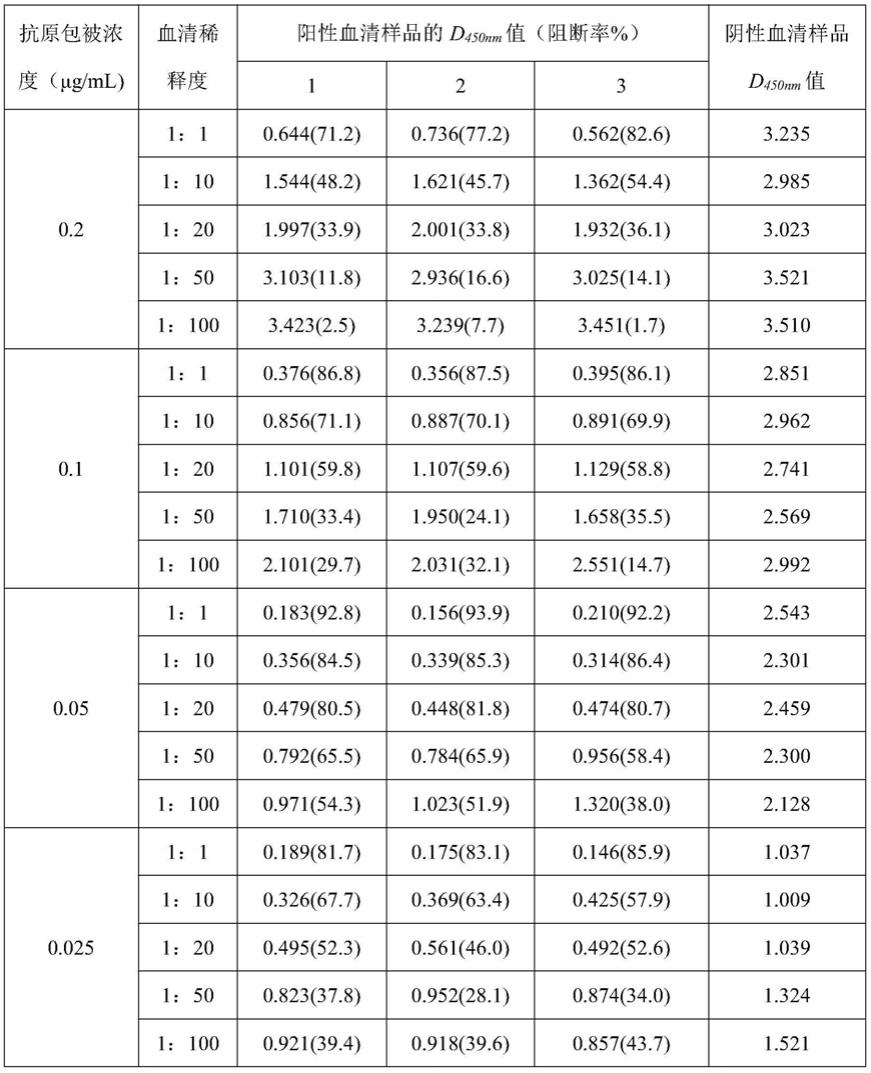
46.单克隆抗体1c5的重链序列(seq id no.1)如下:
47.mewpciflfllsvtegvhsqvqlqqsgaelvrpgssvkisckasgfafssywmnwvkqrpgqglewigqiypgdgdtnyngefkakvtlsadkssttaymqlssltsedsavyfcvrsdfgsssfgdwgqgttltvss;
48.其编码基因序列为(seq id no.2):
49.atggaatggccttgtatctttctcttcctcctgtcagtaactgaaggtgtccactcccaggttcaactgcagcagtctggggctgagctggtgaggcctgggtcctcagtgaagatttcctgcaaggcttcaggctttgcattcagtagctactggatgaactgggtgaagcagaggcctggacagggtcttgagtggattggacagatttatcctggagatggtgacactaactacaatggagagttcaaggctaaagtcactctgtctgcagacaaatcctccaccacagcctacatgcagctctccagccttacatctgaggactctgcggtctacttctgtgtaagatcggacttcggtagtagttcc
tttggcgactggggccaaggcaccactctcacagtctcctca。
50.单克隆抗体1c5的轻链序列(seq id no.3)如下:
51.mvstsqllglllfwtsasrcdivmtqspatlsvapgdrvslscrasqsisdhlhwyqqkshesprllikyasqsisgipsrisgsgsgsdftlsinsvepedvgvyycqnghslpftfgsgtkleik;
52.其编码基因序列为(seq id no.4):
53.atggtgtccacttctcagctccttggacttttgcttttctggacttcagcctccagatgtgacattgtgatgactcagtctccagccaccctgtctgtggctccaggagatagagtctctctttcctgcagggccagccagagtattagcgaccacttacactggtatcaacaaaaatcacatgagtctccaaggcttctcatcaaatatgcttcccaatccatctctgggatcccctccaggatcagtggcagtggatcagggtcagatttcactctcagtatcaacagtgtggaacctgaagatgttggagtgtattactgtcaaaatggtcacagcctgccattcacgttcggctcggggacaaagttggaaataaaa。
54.2.3阻断elisa条件的优化
55.通过对阻断elisa方法的优化,最终确定:最佳抗原包被浓度为0.05μg/ml(表1),最佳血清稀释度为1:1(表1),最佳酶标抗体稀释度为1:2000(表2)。
56.表1抗原包被浓度和血清稀释度的确定
[0057][0058]
表2酶标单抗1c5稀释度的确定
[0059]
[0060][0061]
实施例2
[0062]
本发明建立的akav阻断elisa抗体检测试剂盒:
[0063][0064]
性能测试:
[0065]
1临界值的确定
[0066]
运用本发明建立的阻断elisa方法检测67份已知akav阴性参考血清,以不加血清的空白对照作为阴性对照血清。根据公式阻断率pi=[(d
450
阴性对照血清-d
450
被检血清)]/d
450
阴性对照血清
×
100%,计算67份阴性血清的pi平均值和标准差(s)。根据统计学原理,将和作为阴、阳性血清的临界值。大于临界值判定为阳性,小于临界值判定为阴性,介于两者之间判定为可疑。
[0067]
利用实施例2的试剂盒对67份猪阴性血清进行检测(表3),经统计平均阻断率pi为34.2%,标准差s为0.063,即当pi》53.1%时,判定结果为阳性,当pi《46.8时,判定结果为阴性,介于两者之间判定为可疑,需重复检测一次。
[0068]
表3 akav阴性血清阻断elisa结果
[0069]
[0070][0071]
2特异性试验
[0072]
运用实施例2的试剂盒分别检测akav阳性血清、bvdv灭活阳性血清、btv灭活阳性血清和lsdv灭活阳性血清,根据d
450
读值计算阻断率,由阻断率的高低来评价该阻断elisa方法的特异性,结果见表4。结果表明,除akav阳性血清检测结果为阳性外,其他均为阴性,证明该方法具有良好的特异性。
[0073]
表4阻断elisa特异性试验结果
[0074][0075]
3符合性试验
[0076]
用商品化id screen akav抗体检测试剂盒和本发明建立的akav阻断elisa抗体检测试剂盒,同时检测79份临床血清样品,通过结果比较,计算两种方法的符合率。
[0077]
用实施例2的阻断elisa试剂盒与市售的id screen akav抗体检测试剂盒共同检
测79份田间牛血清样品。由表5所示,阻断elisa检测出阳性样品37份,阴性样品39份,可疑样品3份。商品化的id screen akav抗体检测试剂盒检测出阳性样品44份,阴性样品35份。两种检测方法的阳性符合率为84.0%(37/44),阴性符合率为100%(35/35),总符合率为91.1%。
[0078]
表5阻断elisa和id screen akav抗体检测试剂盒的比较
[0079][0080]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1