一种合成α-熊果苷的方法与流程
本发明属于一种天然糖苷的合成方法,具体涉及一种合成α-熊果苷的方法。
背景技术:
1、熊果苷(arbutin)最初是在杜鹃花科熊果属小灌木植物熊果叶子中发现的。其具有平咳止喘、保湿美白的作用,美白机制主要是通过抑制黑色素细胞中络氨酸酶,从而阻断多巴及多巴醌的合成,抑制黑色素的合成,达到美白的功效。熊果苷具有α型和β型两种形态。研究发现虽然两者均有美白功效,但α-熊果苷的增白效果是β-熊果苷的10倍以上,并且不会抑制人体细胞的生长,无毒副作用。α-熊果苷对紫外线灼伤导致的瘢痕有较好的治疗功效,有较好的抗炎、修复和美白的作用。
2、目前合成熊果苷的方法主要有四种,有机合成法、植物提取法、生物转化法和酶合成法。其中有机合成法和植物提取法主要获得β-熊果苷,而α-熊果苷目前获取途径主要是生物转化法和酶合成法。因此α-熊果苷的价格约为β-熊果苷的十倍左右。如何经济地使用有机合成法制备α-熊果苷是一个亟待解决的重要问题。
3、目前β-熊果苷最经济的合成手段为:五乙酰基葡萄糖在三氟化硼乙醚的催化下与对苯二酚反应获得(2,3,4,6-四乙酰基)-β-熊果苷,在酸性条件中进行酯交换获得β-熊果苷。
4、由于乙酰基会在反应中形成五元环中间体保护住c1的α位,因此无法合成α- 熊果苷。使用有机合成方法合成α-熊果苷则必须考虑不能使用带有羰基的保护基团,否则无法实现α-熊果苷的选择性。因此如果想要合成α-熊果苷通常需要使用苄基或者硅醚类的保护基团,势必导致合成成本升高,固废增多。且产物为α型和β型的混合物。
5、2008年cn101274951a公开了一种由五苯甲酰基葡萄糖与氢醌在三氟化硼催化下,制得α/β-混合糖苷的方法,其实施例1中熊果苷的异构体比例α/β=6.14。
6、2013年cn103159805a公开了一种α-熊果苷的合成方法,使用三氟化硼乙醚催化剂将其中β型熊果苷进一步转化为α型熊果苷后再行提纯分离,得到的α-型异构体(α-熊果苷)含量达到95%以上。但它在工业生产中却难以实现,上述公开的方法弊端之一必须使用剧毒且操作危险性较大的三氟化硼乙醚作为催化剂,增加了安全性风险;弊端之二来均相催化剂必须分离大幅增加分离成本;弊端之三分离时通过碱性水解方式,由于α型熊果苷包含酸性酚羟基,碱性水解并乙酸中和后会引入等摩尔盐的副产物(实施例中方法会引入大量乙酸钠),后期通过甲醇重结晶将会消耗巨量甲醇并形成大量无机盐固废,形成工业化时的诸多困难和成本。 jafar soleymani等人在j.chem.eng.data 2013,58,3399-3404(dx.doi.org/10.1021/je400625f)中详细研究了乙酸钠在水、甲醇等溶剂中的溶解性的数据,由于乙酸钠溶解在甲醇中能够形成多达1.58摩尔/升的溶液(即约每升溶液中含有129.6克乙酸钠),如此大的溶解度如果使用重结晶方法进行分离将极大地降低重结晶效率,使得上述公开的技术方案无法实际应用在工业上。
7、综上所述,目前尚未有反应条件温和、避免使用剧毒或高危险性反应物、副产物少、方便分离的适合经济地工业化合成α-熊果苷的方法。
技术实现思路
1、除非另有定义,否则本说明书文中使用的所有技术和科学术语均具有与本领域一般技术人员通常所理解的含义相同的含义。为了本发明的目的,下文定义了以下术语。
2、本领域普通技术人员将理解“约”或“大约”,并且在使用该术语的上下文中将在某种程度上变化。如果术语的使用对于本领域普通技术人员来说是不清楚的,考虑到使用它的上下文,“约”或“大约”将意味着高达特定术语的加或减20%。
3、术语“和/或”当用于连接两个或多个可选项时,应理解为意指可选项中的任一项或可选项的任意两项或多项。
4、如本文中所用,术语“包含”或“包括”意指包括所述及的要素、整数或步骤,但是不排除任意其他要素、整数或步骤。在本文中,当使用术语“包含”或“包括”时,除非另有指明,否则也涵盖由所述及的要素、整数或步骤组成的情形。例如,当提及“包含”或“包括”某个具体成分时,也旨在涵盖由该具体成分组成的混合物。
5、本文中所述的“主要由……组成”指构成该混合物的主要成分。如无特别说明,通常重量百分比含量高于50%即可称为主要成分。主要成分可以是纯净物,也可以由一类结构或化学性质相近、本领域技术人员能够知晓它们通常能归为一类的混合物组成。
6、本文中任何有关温度范围、ph范围、重量(质量)范围、分子量范围、百分比范围等,不论是否使用“范围”或“各个范围”的措词进行表达,都包括所指定的端点以及两端点间的各点。
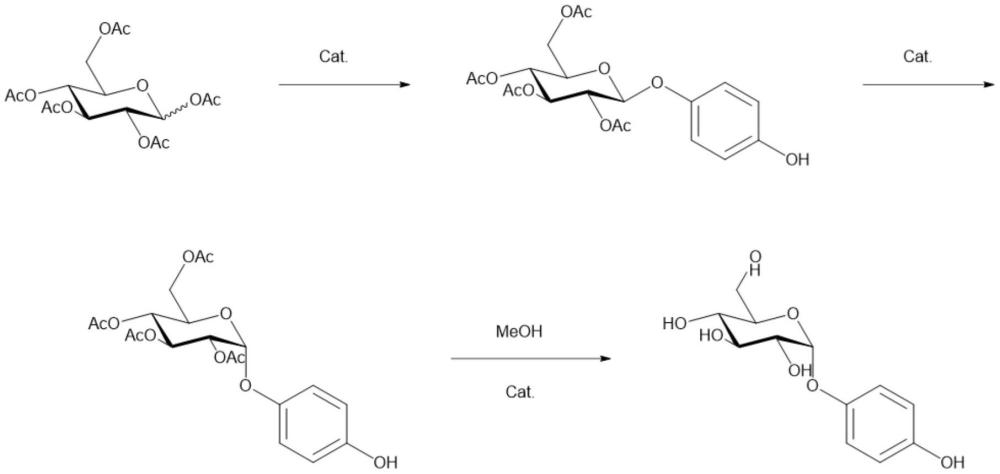
7、针对以上至少一个问题,一方面,本发明公开的技术方案提供了一种通过如下反应式工业化合成α-熊果苷的方法:
8、
9、其中,cat.指催化剂,ac指乙酰基,meoh指甲醇。
10、在其中一个或多个具体实施方式中,具体为五乙酰基葡萄糖在固体酸催化剂的催化下与对苯二酚反应,合成(2,3,4,6-四乙酰基)-β-熊果苷。(2,3,4, 6-四乙酰基)-β-熊果苷在固体酸催化剂的催化下,由β型向α型转变,生成(2,3, 4,6-四乙酰基)-α-熊果苷;再经由酸性催化酯交换获得α-熊果苷。
11、在其中一个或多个具体实施方式中,包含步骤s100:在反应器中投入5-40 第一重量份固体酸催化剂,10-200第一重量份五乙酰基葡萄糖和5-100第一重量份对苯二酚,加入适量溶剂(溶剂可以选自乙腈、四氢呋喃、二氧六环、n,n- 二甲基甲酰胺即dmf、二甲基亚砜即dmso、二氯乙烷、二氯甲烷等中的一种或多种;优选为50-500第一重量份二氯甲烷)溶解(优选为溶解约10分钟),并持续搅拌(优选为常温搅拌约24小时)。以薄层色谱法(tlc)显示判定反应终点;待反应停止,过滤并用少量溶剂(溶剂可以选自乙腈、四氢呋喃、二氧六环、dmf、dmso、二氯乙烷、二氯甲烷等中的一种或多种;优选为与本步骤反应时所用溶剂相同;优选为前述二氯甲烷)清洗固体酸催化剂回收催化剂。滤得有机相浓缩后加入20-500第一重量份去离子水,加热(优选为约60℃) 下搅拌约半小时,趁热抽滤。用适量(约5-100第一重量份)水清洗滤饼若干次。将水相合并回收反应物对苯二酚。滤饼干燥后得到中间产物(2,3,4, 6-四乙酰基)-β-熊果苷。
12、在其中一个或多个具体实施方式中,在步骤s100之后包含步骤s200:在反应器中投入5-40第二重量份固体酸催化剂,10-200第二重量份(2,3,4,6-四乙酰基)-β-熊果苷和适量溶剂(溶剂可以选自乙腈、四氢呋喃、二氧六环、dmf、 dmso、二氯甲烷、二氯乙烷等中的一种或多种;优选为50-500第二重量份二氯乙烷),加热反应(优选为加热回流约24小时),tlc显示反应终点,冷却至室温,过滤并用少量溶剂(溶剂可以选自乙腈、四氢呋喃、二氧六环、dmf、 dmso、二氯甲烷、二氯乙烷等中的一种或多种;优选为与本步骤反应时所用溶剂相同;优选为前述二氯乙烷)清洗固体酸催化剂回收催化剂。有机相浓缩得到(2,3,4,6-四乙酰基)-α-熊果苷。
13、在其中一个或多个具体实施方式中,在步骤s200之后包含步骤s300:在反应器中加入10-200第三重量份22g(2,3,4,6-四乙酰基)-α-熊果苷,2-50第三重量份固体酸催化剂,适量溶剂(溶剂可以选自乙醇、丙醇、异丙醇、甲醇、水等中的一种或多种;优选为5-100第三重量份无水甲醇)。加热反应(优选为加热回流约8小时)。冷却至室温后过滤,并用适量溶剂(溶剂可以选自乙醇、丙醇、异丙醇、甲醇、水等中的一种或多种;优选为与本步骤反应时所用溶剂相同;优选为前述无水甲醇)清洗固体酸催化剂回收催化剂。有机相浓缩干燥后得到粘稠固体。经重结晶(优选用乙酸乙酯)后,得到α-熊果苷白色的针状晶体。
14、需要特别注意的是:上述每个步骤s100、s200或s300的重量份数仅在该步骤中具有关联性,步骤与步骤之间的重量份数无关,即s100中的5重量份固体酸催化剂与s200或s300中的5重量份固体酸催化剂的重量并不必然相等。为进一步明确,分别以第一重量份、第二重量份或第三重量份进行区分。
15、在其中一个或多个具体实施方式中,固体酸催化剂优选为磺酸树脂(例如amberlyst等);更优选为全氟磺酸树脂(例如nafion树脂等)。
16、在其中一个或多个具体实施方式中,固体酸催化剂直接通过过滤方式回收。
17、在其中一个或多个具体实施方式中,固体酸催化剂以酯交换反应,避免产物中酚羟基与碱性催化剂反应后需要进一步中和的步骤及需要进一步脱盐的步骤。
18、另一方面,本发明公开的技术方案提供了一种直接由β-熊果苷通过催化剂工业化合成α-熊果苷的方法。
19、在其中一个或多个具体实施方式中,以β-熊果苷溶液为原料在固体酸催化剂的催化下反应制备α-熊果苷。
20、在其中一个或多个具体实施方式中,将β-熊果苷、固体酸催化剂与适量溶剂混合,加热回流反应,以薄层色谱法(tlc)显示判定反应终点;反应结束后冷却,过滤并用少量溶剂清洗固体酸催化剂并回收催化剂。滤得有机相浓缩后经重结晶后得到α-熊果苷白色的针状晶体。
21、在其中一个或多个具体实施方式中,固体酸催化剂优选为磺酸树脂(例如amberlyst等);更优选为全氟磺酸树脂(例如nafion树脂等)。
22、在其中一个或多个具体实施方式中,溶剂可以选自乙腈、四氢呋喃、二氧六环、dmf、dmso、二氯甲烷、二氯乙烷等中的一种或多种;溶剂优选为二氯乙烷;重结晶时优选添加乙酸乙酯。
23、在其中一个或多个具体实施方式中,优选为固体酸催化剂重量份数5-40重量份,5-40重量份β-熊果苷和20-200重量份溶剂(溶剂可以选自乙腈、四氢呋喃、二氧六环、dmf、dmso、二氯甲烷、二氯乙烷等中的一种或多种;溶剂优选为二氯乙烷);加热回流约24h,通过tlc显示反应终点,冷却至室温,过滤并用少量溶剂(溶剂可以选自乙腈、四氢呋喃、二氧六环、dmf、dmso、二氯甲烷、二氯乙烷等中的一种或多种;优选为与本步骤反应时所用溶剂相同;溶剂优选为前述二氯乙烷)清洗树脂回收固体酸催化剂。有机相浓缩经适量乙酸乙酯重结晶后,得到α-熊果苷白色的针状晶体。
24、在其中一个或多个具体实施方式中,固体酸催化剂直接通过过滤方式回收。
25、在其中一个或多个具体实施方式中,固体酸催化剂以酯交换反应,避免产物中酚羟基与碱性催化剂反应后需要进一步中和的步骤及需要进一步脱盐的步骤。
26、本发明公开的技术方案克服了现有技术的多种弊端,通过使用固体酸催化剂进行糖苷化反应,催化剂可回收,产物便于处理:
27、一方面,通过使用酸性催化剂,优选固体酸催化剂将(2,3,4,6-四乙酰基) -β-熊果苷转化为(2,3,4,6-四乙酰基)-α-熊果苷,使得α型产物易于制备,固体酸催化剂可回收;通过使用酸性催化进行酯交换反应,避免了酚羟基与碱反应后续还要进行中和的步骤,同时固体酸催化剂可回收。
28、另一方面,通过使用酸性催化剂,优选固体酸催化剂转化β-熊果苷为α-熊果苷,使得α型产物易于制备,固体酸催化剂可回收。
29、因此,本发明公开的技术方案具有如下优点:
30、①合成成本低,产率高;
31、②避免使用剧毒或高危险性反应物;
32、③避免现有技术中通过碱催化酯交换获得α-熊果苷的工艺;利用酸性催化酯交换,保证酚羟基不参与反应;
33、④对苯二酚原料容易回收;
34、⑤固体酸催化剂可以重复利用,易于分离。
- 还没有人留言评论。精彩留言会获得点赞!