一种多糖及在肿瘤细胞免疫治疗中的应用的制作方法
1.本发明涉及免疫细胞治疗领域,尤其涉及一种多糖及在肿瘤细胞免疫治疗中的应用。
背景技术:
2.自然杀伤(nk)细胞是机体抵抗病原微生物感染及清理自身癌变细胞的重要固有免疫细胞。nk细胞的功能受抑制型受体和活化型受体介导的信号强度之间的平衡来调节,活化后的nk细胞可直接杀伤靶细胞,也可以分泌细胞因子和炎性因子参与免疫调节。近年来,基于nk细胞免疫功能的抗肿瘤免疫疗法成为肿瘤治疗的新兴热门领域。
3.将nk细胞用于免疫细胞治疗首先要解决的问题就是如何获得大量nk细胞进而输入人体。因此,对nk细胞增殖能力提高的研究一直没有松懈。
4.多糖的一级结构由单糖通过糖苷键连接而成,一级结构再通过范德华力等作用力形成高级结构,多变的一级结构和高级结构决定了不同多糖可以形成不同的结构域,这些不同的结构域让不同多糖产生了不同的、丰度的生物活性。
5.多糖在免疫领域也早有应用,开发更多活性多糖也是细胞免疫领域研究的重要方向。
6.银耳属真菌作为重要的食用真菌之一,在中国境内广泛存在。常见银耳属的可食用真菌主要有银耳、脑耳、金耳和血耳。银耳属多糖具有多种生物活性,如抗肿瘤,免疫调节,降血糖,抗氧化,降血脂和抗血栓等,银耳属多糖因此受到广泛关注。血耳(tremella sanguinea peng)隶属银耳科(treimellaceae)、银耳属(tremella),相较于银耳属其它多糖,目前国内外有关血耳多糖的研究报道较少。王昭晶等从血耳中分离得到一种均一多糖tsp-ii,并发现该多糖具有抗炎活性(血耳多糖的提取工艺、微观结构及其抗炎症作用,中国食品学报,2019年1月)。最新研究表明,血耳总多糖可以显著促进小鼠巨噬细胞的增殖(血耳多糖对小鼠raw264.7巨噬细胞的免疫调节作用研究,农产品加工,2022年4月)。
技术实现要素:
7.本发明的目的在于提供一种多糖及在肿瘤细胞免疫治疗中的应用。
8.为实现上述目的,本发明提供了以下技术方案:
9.一种多糖,通过如下步骤制备:
10.取适量血耳,加入蒸馏水,沸水浴提取,过滤收集滤液,减压浓缩、冷却、离心,离心条件为3500r/min离心10min;取上清液,加入4倍体积无水乙醇沉淀、离心,离心条件为3500r/min离心10min;收集沉淀得血耳总多糖,sevag法脱蛋白;
11.取脱蛋白的血耳总多糖,用蒸馏水配制成质量分数为5%的糖液,缓慢加入硫酸铵,使得硫酸铵的浓度达到30mg/ml,静置12h,5000r/min离心20min,收集滤液;滤液继续缓慢加入硫酸铵,使得硫酸铵的浓度达到50mg/ml,静置12h,5000r/min离心20min,收集沉淀;蒸馏水复溶,用截留分子量3500u的透析袋透析,冷冻干燥得分级多糖;
12.取分级多糖,用蒸馏水配制成20mg/ml的糖液,3500r/min离心10min,取20ml上清液上样于内径2.5cm、柱床高度30cm的sephadex g-100葡聚糖凝胶层析柱,蒸馏水洗脱,流速为2ml/min,10ml收集1管并从1开始按顺序编号,每管取少量进行苯酚-硫酸显色测定od490nm吸光度值,以管号为横坐标,吸光度值为纵坐标,绘制洗脱曲线,合并洗脱曲线主峰对应编号12~20的收集管中的洗脱液,合并,冷冻干燥即得。
13.进一步地,sevag法脱蛋白的具体步骤为:取血耳总多糖,用蒸馏水配制成质量分数为5%的糖液进行sevag法脱蛋白,将糖液与sevag试剂按体积比4:1混合,充分振荡,3500r/min离心10min,分液漏斗回收上层糖液;反复脱蛋白直至无固体蛋白层为止,将脱蛋白后的糖液冷冻干燥。
14.更进一步地,所述sevag试剂为氯仿和正丁醇按体积比4:1混合制备而成。
15.上述任一多糖用于促进nk细胞体外增殖的用途。
16.本发明从血耳中分离得到一种分子量不同于现有技术中tsp-ii多糖的均一多糖tsp-x,活性研究发现该多糖具有促进nk细胞增殖的作用,且不会降低nk细胞对肿瘤细胞的杀伤力。因此,本发明提供的血耳均一多糖tsp-x可以用于扩增nk细胞进而用于细胞免疫治疗。
附图说明
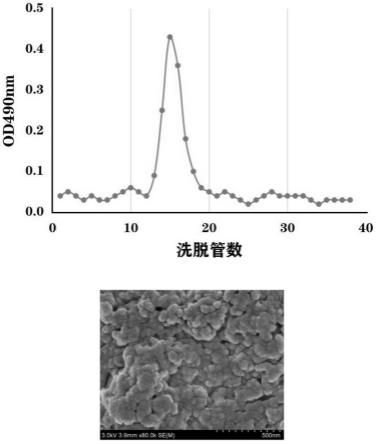
17.图1中上图是sephadex g-100葡聚糖凝胶柱层析的洗脱曲线,下图是多糖tsp-x在扫描电镜下观察的形貌(
×
80000)。
18.图2中上图是集落观察结果,下图是蛋白表达水平测定结果。
具体实施方式
19.一、实验材料
20.血耳购自安徽亳州中药材市场,为银耳属真菌血耳(tremella samguinea peng)的干燥品。
21.人外周血单个核细胞(pbmc)购自武汉赛奥斯生物科技有限公司。il-2、il-15、cck8试剂、一抗和二抗购自碧云天。流式抗体购自bd。人源nk细胞完全培养基的品牌为procell,购自武汉普诺赛生命科技有限公司。
22.二、实验方法
23.1、血耳总多糖提取和脱蛋白
24.称取血耳500g,按质量比20:1加入蒸馏水,沸水浴提取2h,过滤收集滤液,滤渣重复提取1次,合并两次滤液,减压浓缩至5l,冷却后3500r/min离心10min,取上清液;加入4倍体积无水乙醇沉淀6h,3500r/min离心10min,收集沉淀,即得血耳总多糖。
25.取血耳总多糖,用蒸馏水配制成质量分数为5%的糖液进行sevag法脱蛋白,将糖液与sevag试剂(氯仿:正丁醇=4:1,体积比)按体积比4:1混合,充分振荡,3500r/min离心10min,分液漏斗回收上层糖液。反复脱蛋白直至无固体蛋白层为止,将脱蛋白后的糖液冷冻干燥。
26.2、硫酸铵分级沉淀
27.取脱蛋白的血耳总多糖,用蒸馏水配制成质量分数为5%的糖液,缓慢加入硫酸
铵,使得硫酸铵的浓度达到30mg/ml,静置12h,5000r/min离心20min,收集滤液;滤液继续缓慢加入硫酸铵,使得硫酸铵的浓度达到50mg/ml,静置12h,5000r/min离心20min,收集沉淀;蒸馏水复溶,用截留分子量3500u的透析袋透析72h,冷冻干燥得分级多糖。
28.3、sephadex g-100葡聚糖凝胶柱层析
29.取分级多糖,用蒸馏水配制成20mg/ml的糖液,3500r/min离心10min,取上清液20ml上样于sephadex g-100葡聚糖凝胶层析柱(内径2.5cm,柱床高度30cm),蒸馏水洗脱,流速为2ml/min,10ml收集1管并从1开始按顺序编号,每管取少量进行苯酚-硫酸显色测定od490nm吸光度值,以管号为横坐标,吸光度值为纵坐标,绘制洗脱曲线,合并洗脱曲线主峰对应编号12~20的收集管中的洗脱液,合并,冷冻干燥得多糖tsp-x。扫描电镜观察形貌。苯酚-硫酸法测定多糖含量为98.7%。
30.4、分子量测定
31.按照常规葡聚糖凝胶测量多糖相对分子质量的方法,以不同相对分子质量mw的葡聚糖为标准品,以保留时间(rt)为横坐标,以lgmw为纵坐标,绘制标准曲线并得到曲线方程,再根据多糖tsp-x的保留时间,代入曲线方程计算得到tsp-x的相对分子质量。
32.色谱条件如下:
33.色谱柱:tskgel g3000swxl凝胶色谱柱(7.8mm
×
30cm,5μm);
34.流动相:0.06mol/l氯化钠溶液;
35.流速:0.6ml/min进行等度洗脱;
36.进样量:20μl;
37.柱温:35℃。
38.5、nk细胞培养
39.将pbmc细胞用含10%fbs的rpmi 1640培养基于37℃、5%co2、饱和湿度条件下培养,细胞培养至密度达约80%时传代。取生长状态良好的pbmc细胞置于37℃、5%co2培养箱,用含有500u/ml il-2、20ng/ml il-15的人源nk细胞完全培养基按照培养基使用说明书诱导分化,每3d补液一次,并控制细胞密度约2.0
×
106/ml。待cd3-cd56
+
细胞比例>80%时进行后续试验(约14d)。
40.6、nk细胞增殖活性测定(cck-8法)
41.取生长状态良好的nk细胞,胰酶消化,pbs洗涤,用人源nk细胞完全培养基重悬(密度5
×
104/ml),接种于96孔板,每孔100μl,适应性培养24h后,更换为含有50μg/ml、100μg/ml多糖tsp-x的人源nk细胞完全培养基继续培养,同时设置不含有多糖tsp-x的对照。48h后,每孔加入20μl cck8试剂,继续培养4h,用酶标仪于450nm处测定各孔吸光值。
42.7、nk细胞增殖活性测定(集落形成法)
43.取生长状态良好的nk细胞,胰酶消化,pbs洗涤,用人源nk细胞完全培养基重悬,按500个细胞/孔接种于6孔板中,适应性培养24h后,更换为含有50μg/ml、100μg/ml多糖tsp-x的人源nk细胞完全培养基继续培养,同时设置不含有多糖tsp-x的对照。继续培养约10d,单细胞集落约含50个细胞时,pbs洗涤,冰甲醇固定,结晶紫染色,显微镜下观察统计集落数目。
44.8、nk细胞杀伤活性测定
45.取生长状态良好的nk细胞,胰酶消化,pbs洗涤,用人源nk细胞完全培养基重悬(密
度5
×
104/ml),接种于24孔板,每孔1ml,适应性培养24h后更换为含有50μg/ml、100μg/ml多糖tsp-x的人源nk细胞完全培养基继续培养,同时设置不含有多糖tsp-x的对照。48h后收集细胞并用pbs洗涤3次,裂解液裂解,离心取上清,bca法测定蛋白浓度。根据sds-page凝胶配制试剂盒说明书配胶,各组取等量蛋白进行电泳,转膜,封闭,加入granzyme b、perforin、β-actin一抗,在4℃孵育过夜;洗膜后加入二抗,室温放置2h,洗膜3次,置于ecl发光剂中,显影,定影,蒸馏水冲洗终止,凝胶图像处理系统拍照分析。
46.9、统计学分析
47.采用spss 19.0统计软件进行分析,用均数
±
标准差表示,组间比较采用t检验,p《0.05代表差异具有统计学意义。
48.三、实验结果
49.1、多糖tsp-x的制备和相对分子质量
50.sephadex g-100葡聚糖凝胶柱层析的洗脱曲线如图1上图所示,洗脱曲线可见1个明显的主峰,收集该主峰对应编号的收集管(12~20管)中的洗脱液,合并,冷冻干燥得多糖tsp-x。该主峰峰形对称性好,说明tsp-x的均一性较高。按照常规葡聚糖凝胶测量tsp-x相对分子质量的方法,标准曲线对应的曲线方程为lgmw=-0.1893rt+11.485(r2=0.9985),将tsp-x的rt值38.25min代入该方程获得tsp-x相对分子质量约为17520u(17.52ku)。tsp-x的相对分子质量远远小于王昭晶等从血耳中分离得到的多糖tsp-ii的相对分子质量350ku(血耳多糖的提取工艺、微观结构及其抗炎症作用,中国食品学报,2019年1月)。扫描电镜观察的形貌如图1下图所示(
×
80000),形貌均一性高。
51.2、nk细胞增殖活性
52.各组od450nm值如表1所示,多糖tsp-x组od450nm值显著高于对照组(p《0.05),且多糖浓度越高od450nm值越高。各组集落观察结果如图2上图所示,多糖tsp-x组集落数量明显多于对照组,且多糖浓度越高集落数量越多。cck-8试验和集落形成试验结果表明,多糖tsp-x具有促进nk细胞增殖的作用。
53.表1各组od450nm值
[0054] 对照50μg/mltsp-x100μg/mltsp-xod450nm0.308
±
0.0160.425
±
0.0190.762
±
0.018
[0055]
3、nk细胞杀伤活性
[0056]
蛋白表达水平测定结果如图2下图所示,各组决定nk细胞杀伤力强弱的蛋白granzyme b、perforin的表达水平无明显差异,说明多糖tsp-x对nk细胞细胞杀伤既没有明显增益作用,也没有明显损害作用,试验结果中性。
[0057]
综合上述试验可以说明:本发明从血耳中分离得到一种分子量不同于现有技术中tsp-ii多糖的均一多糖tsp-x,活性研究发现该多糖具有促进nk细胞增殖的作用,且不会降低nk细胞对肿瘤细胞的杀伤力。本发明提供的血耳均一多糖tsp-x可以用于扩增nk细胞进而用于细胞免疫治疗。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1