一种光黑壳真菌、抗菌化合物及其制备方法和应用
25-35天。
30.具体地,发酵为静置培养发酵。
31.具体地,上述方法还可以包括(在发酵前)菌种扩大培养的步骤,例如将经过斜面培养基活化的菌种在种子培养基中进行扩大培养。
32.具体地,扩大培养的温度可以为20-35℃(例如20、22、24、25、26、27、28、29、30、31、 32、33、34、35℃),特别是28℃。
33.具体地,扩大培养的时间可以为1-5天,特别是1-3天。
34.具体地,扩大培养在振荡条件(例如200rpm)下进行。
35.具体地,种子培养基可以为任意合适的真菌培养基,例如沙氏培养基、马铃薯葡萄糖培养基等;
36.在本发明的一个实施例中,种子培养基为马铃薯葡萄糖液体培养基,其由马铃薯浸粉、葡萄糖和水组成,例如其包含马铃薯浸粉4g/l,葡萄糖20g/l。具体地,种子培养基的ph值可以为5-7 (例如5、5.4、5.6、5.8、6、6.5、7)。
37.在本发明第四方面,提供一种化合物及其药学上可接受的盐、立体异构体、前药或溶剂化物,该化合物具有如下结构:
[0038][0039]
其中,r1至r3独立地选自以下基团:h、烷基、环烷基、环烷基烷基、杂环基、杂环基烷基、
ꢀ‑
cora、-c(o)ora、-c(o)nrarb;任选地,其中所述基团上的h可被选自以下的一种或多种取代基取代:卤素、-cn、-cf3、-no2、-cho、-cooh、-c(o)nh2、-oh、-oc(o)h、-sh、-s(o)2h、
ꢀ‑
nh2、烷氧基、烷胺基;
[0040]
r4至r
10
独立地选自以下基团:h、烷基、烯基、环烷基、环烷基烷基、杂环基、杂环基烷基、卤素、-cn、-no2、-cora、-c(o)ora、-ocora、-c(o)nrarb、-ch=nra、-ora、-oc(o)ra、-s(o)
t-ra、
ꢀ‑
s(o)
t-nrarb、-nrarb、-nrac(o)rb;任选地,其中各基团上的h可被选自以下的一种或多种取代基取代:卤素、-cn、-cf3、-no2、-cho、-cooh、-c(o)nh2、-oh、-oc(o)h、-sh、-s(o)2h、
ꢀ‑
nh2、烷氧基、烷胺基;或者,r4至r
10
中的两者与其中间的碳原子一起形成取代或未取代的环烷基或杂环基;
[0041]
t选自0、1和2;
[0042]
各个ra和rb彼此独立地选自:h、烷基、环烷基、烯基、芳基、杂环基和卤素。
[0043]
在本发明的一个实施方式中,r
10
和r6与其中间的碳原子一起形成取代或未取代的环烷基或杂环基,r7和r9与其中间的碳原子一起形成取代或未取代的环烷基或杂环基。
[0044]
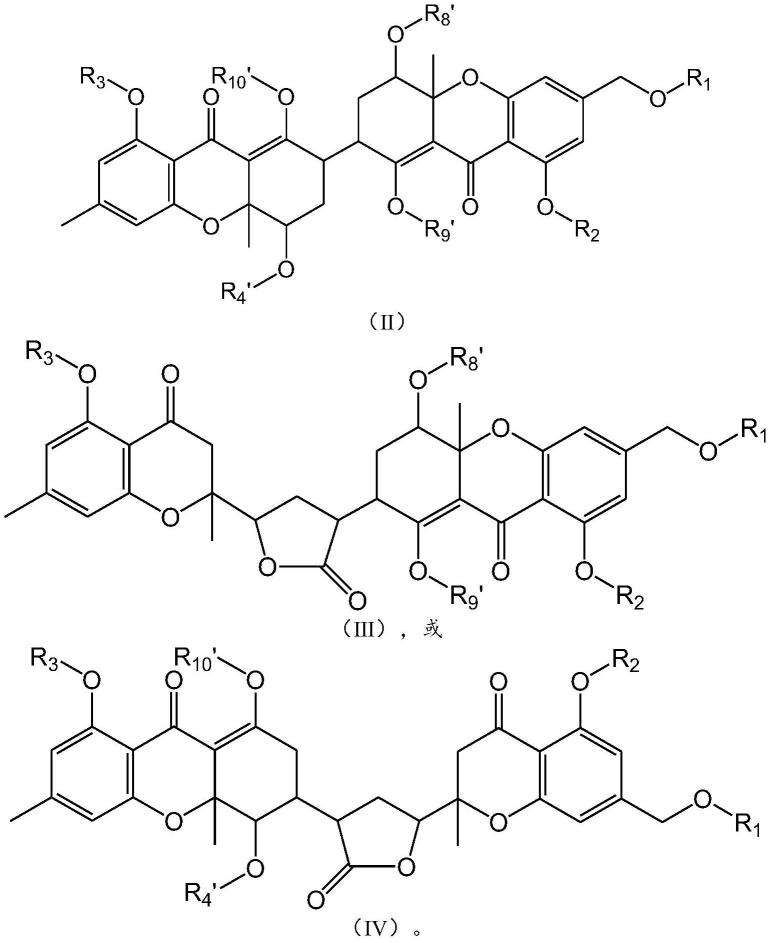
具体地,该化合物可以具有如下结构:
[0045][0046]
r4'、r8'、r9'和r
10
'独立地选自:h、烷基、环烷基、环烷基烷基、杂环基、杂环基烷基、-cora、
ꢀ‑
c(o)ora、-c(o)nrarb;任选地,其中所述基团上的h可被选自以下的一种或多种取代基取代:卤素、-cn、-cf3、-no2、-cho、-cooh、-c(o)nh2、-oh、-oc(o)h、-sh、-s(o)2h、-nh2、烷氧基、烷胺基。
[0047]
在本发明另一个实施方式中,r4和r6与其中间的碳原子一起形成取代或未取代的环烷基或杂环基,r7和r9与其中间的碳原子一起形成取代或未取代的环烷基或杂环基。
[0048]
具体地,该化合物可以具有如下结构:
[0049][0050]
r8'和r9'独立地选自:h、烷基、环烷基、环烷基烷基、杂环基、杂环基烷基、-cora、-c(o)ora、
ꢀ‑
c(o)nrarb;任选地,其中所述基团上的h可被选自以下的一种或多种取代基取代:卤素、-cn、
ꢀ‑
cf3、-no2、-cho、-cooh、-c(o)nh2、-oh、-oc(o)h、-sh、-s(o)2h、-nh2、烷氧基、烷胺基。
[0051]
在本发明另一个实施方式中,r
10
和r5与其中间的碳原子一起形成取代或未取代的环烷基或杂环基,r6和r8与其中间的碳原子一起形成取代或未取代的环烷基或杂环基。
[0052]
具体地,该化合物可以具有如下结构:
[0053][0054]
r4'和r
10
'独立地选自:h、烷基、环烷基、环烷基烷基、杂环基、杂环基烷基、-cora、-c(o)ora、
ꢀ‑
c(o)nrarb;任选地,其中所述基团上的h可被选自以下的一种或多种取代基取代:卤素、-cn、
ꢀ‑
cf3、-no2、-cho、-cooh、-c(o)nh2、-oh、-oc(o)h、-sh、-s(o)2h、-nh2、烷氧基、烷胺基。
[0055]
具体地,r1至r3可以独立地选自:h、c1-6烷基、-cora、-c(o)ora、-c(o)nrarb;任选
地,其中所述烷基上的h可被选自以下的一种或多种取代基取代:卤素(特别是f)、-cn、-cf3、-no2、-cho、-cooh、-c(o)nh2、-oh、-oc(o)h、-sh、-s(o)2h、-nh2、c1-3烷氧基、c1-3烷胺基;更具体地,r1至r3可以独立地选自:h、甲基、乙基、正丙基、异丙基、-c(o)h、-c(o)-(c1-3烷基)、-c(o)oh、-c(o)o-(c1-3烷基)、-c(o)nh2。
[0056]
在本发明的一个实施例中,r1为h。
[0057]
在本发明的一个实施例中,r2为h。
[0058]
在本发明的一个实施例中,r3为h。
[0059]
具体地,r8'和r9'可以独立地选自:h、c1-6烷基、-cora、-c(o)ora、-c(o)nrarb;任选地,其中所述烷基上的h可被选自以下的一种或多种取代基取代:卤素(特别是f)、-cn、-cf3、-no2、
ꢀ‑
cho、-cooh、-c(o)nh2、-oh、-oc(o)h、-sh、-s(o)2h、-nh2、c1-3烷氧基、c1-3烷胺基;更具体地,r8'和r9'可以独立地选自:h、甲基、乙基、正丙基、异丙基、-c(o)h、-c(o)-(c1-3烷基)、-c(o)oh、-c(o)o-(c1-3烷基)、-c(o)nh2。
[0060]
在本发明的一个实施例中,r8'为h。
[0061]
在本发明的一个实施例中,r9'为h。
[0062]
具体地,r4'和r
10
'可以独立地选自:h、c1-6烷基、-cora、-c(o)ora、-c(o)nrarb;任选地,其中所述烷基上的h可被选自以下的一种或多种取代基取代:卤素(特别是f)、-cn、-cf3、-no2、
ꢀ‑
cho、-cooh、-c(o)nh2、-oh、-oc(o)h、-sh、-s(o)2h、-nh2、c1-3烷氧基、c1-3烷胺基;更具体地,r4'和r
10
'可以独立地选自:h、甲基、乙基、正丙基、异丙基、-c(o)h、-c(o)-(c1-3烷基)、-c(o)oh、-c(o)o-(c1-3烷基)、-c(o)nh2。
[0063]
在本发明的一个实施例中,r4'为h。
[0064]
在本发明的一个实施例中,r
10
'为h。
[0065]
在本发明的一个实施例中,本发明所述化合物具有如下结构:
[0066][0067]
在本发明的一些实施例中,该化合物的立体异构体具有如下结构:
[0068][0069]
在本发明的一个实施例中,本发明所述化合物具有如下结构:
[0070][0071]
在本发明的一个实施例中,该化合物的立体异构体具有如下结构:
[0072][0073]
在本发明的一个实施例中,本发明所述化合物具有如下结构:
[0074][0075]
在本发明的一个实施例中,该化合物的立体异构体具有如下结构:
[0076][0077]
具体地,本发明第四方面所述的化合物及其药学上可接受的盐、立体异构体、前药、溶剂化物可通过化学合成、半合成、微生物发酵或动植物提取等本领域已知任何合适的方法制备得到,例如,可通过对微生物(例如光黑壳真菌)发酵产物进行提取分离得到,还可通过对提取分离所得化合物进行化学结构修饰(和物理处理过程)制得(半合成),也可由化学结构较简单的化工原料经过一系列化学合成和物理处理过程制得(全合成)。
[0078]
在本发明的一些实施例中,本发明第四方面所述的化合物及其药学上可接受的盐、立体异构体、前药、溶剂化物的制备方法可包括对微生物(例如光黑壳真菌)发酵产物进行提取分离的步骤;更进一步地,该制备方法还可包括对提取分离所得化合物进行化学结构修饰的步骤。
[0079]
在本发明另一些实施例中,本发明第四方面所述的化合物及其药学上可接受的盐、立体异构体、前药、溶剂化物的制备方法可包括由化学结构较简单的化工原料经过一系列化学合成和物理处理过程制备所述化合物(全合成)的步骤。
[0080]
在本发明第五方面,提供选自如下a1至a6的化合物及其结构类似物:
[0081][0082][0083]
具体地,上述结构类似物是以化合物a1至a6基本母核为出发点进行的结构修饰和改造的化合物,例如本发明第四方面所述通式ⅰ所涵盖的(除a1至a6外)其他化合物或立体异构体。结构修饰和改造方法可以采用本领域技术人员所熟知的方法。
[0084]
在本发明第六方面,提供第五方面所述的化合物的制备方法,其包括对第一方面所述的光黑壳真菌的发酵产物进行提取分离的步骤。
[0085]
具体地,该发酵产物可采用本发明第三方面所述发酵方法制备得到。
[0086]
具体地,所述提取分离包括:
[0087]
(1)将发酵产物用有机溶剂提取,得到粗提物;
[0088]
(2)将步骤(1)所得粗提物进行吸附层析,收集洗脱液;
[0089]
任选地,(3)将步骤(2)所得洗脱液进行提取分离。
[0090]
在本发明的一个实施方式中,步骤(1)中所述提取为超声浸提。
[0091]
具体地,步骤(1)中所述提取温度为20-30℃,例如室温。
[0092]
具体地,步骤(1)所述有机溶剂可选自:乙酸乙酯、n,n-二甲基乙酰胺、乙酸异丙酯、乙酸甲酯、甲基异丁基酮;在本发明的一个实施例中,步骤(1)所述有机溶剂为乙酸乙酯。
[0093]
具体地,步骤(1)所述提取可以为一次或多次,例如三次。
[0094]
具体地,步骤(1)还包括将提取液过滤的步骤;更具体地,步骤(1)还包括将滤液浓缩的步骤。
[0095]
具体地,步骤(2)中所述吸附层析的吸附剂(固定相)为硅胶,特别是硅胶h。
[0096]
具体地,步骤(2)中所述吸附层析的流动相为二氯甲烷和/或甲醇,特别是二氯甲烷和甲醇的混合物,其体积比可以为85-95:5-15。
[0097]
在本发明的一个实施方式中,步骤(2)中所述吸附层析的洗脱程序包括:
[0098]
(2-1)用二氯甲烷洗脱2个柱体积;
[0099]
(2-2)用95:5的二氯甲烷-甲醇溶液洗脱2个柱体积;
[0100]
(2-3)用90:10的二氯甲烷-甲醇溶液洗脱4个柱体积;
[0101]
(2-4)用85:15的二氯甲烷-甲醇溶液洗脱4个柱体积,收集洗脱液。
[0102]
具体地,步骤(3)包括将步骤(2)所得洗脱液(具体为步骤(2-4)所得洗脱液)溶于溶剂中,缓慢挥发的步骤。
[0103]
具体地,步骤(3)中所述溶剂可选自:甲醇、乙醇、异丙醇;在本发明的一个实施例中,步骤(3)中所述溶剂为甲醇。
[0104]
具体地,该制备方法还可以包括步骤(4):将步骤(3)所得产物进行进一步转化(和分离)。
[0105]
具体地,步骤(4)中所述转化步骤包括将步骤(3)所得产物溶于溶剂中,静置。
[0106]
具体地,步骤(4)中所述转化溶剂为二甲基亚砜(dmso)或吡啶,特别是dmso。
[0107]
具体地,静置温度可以为20-30℃,例如室温。
[0108]
具体地,静置时间可以为1-24小时(例如2、4、6、8、10、12、14、16、18、20、24小时)。
[0109]
具体地,步骤(4)中所述分离步骤包括转化产物通过液相色谱分离,例如采用sb-c18液相色谱柱,以乙腈和水的混合物(例如以50:50的体积比)为流动相;进一步地,还可以采用手性色谱柱如chiralpak as-h,以乙腈和水的混合物(例如以80:20的体积比)为流动相,进行进一步分离。
[0110]
在本发明第七方面,提供一种药物组合物,其包含第二方面的组合物、第四方面所述的化合物或其药学上可接受的盐、立体异构体、前药、溶剂化物,或第五方面所述化合物或其结构类似物,以及一种或多种药学上可接受的辅料。
[0111]
在本发明的一个实施方式中,该药物组合物作为抗菌药物,特别是抗细菌药物。
[0112]
具体地,所述细菌为病原性细菌,例如,但不限于,金黄色葡萄球菌(包括甲氧西林敏感型金黄色葡萄球菌(mssa)、耐甲氧西林金黄色葡萄球菌(mrsa)、耐万古霉素金黄色葡萄球菌(vrsa)(例如万古霉素中度耐性金黄色葡萄球菌(visa)))、表皮葡萄球菌(包括甲氧西林敏感型表皮葡萄球菌(msse)、耐甲氧西林表皮葡萄球菌(mrse))、粪肠球菌(包括万古霉素敏感型粪肠球菌、耐万古霉素粪肠球菌(vre))、屎肠球菌(包括万古霉素敏感型屎肠球菌、耐万古霉素屎肠球菌(vre))、肺炎链球菌(包括青霉素敏感型肺炎链球菌、耐青霉素肺炎链球菌(prsp))、铜绿假单胞菌(包括多重耐药铜绿假单胞菌(mdr-pa)、耐碳青霉烯铜绿假单胞菌(crpa))、肺炎克雷伯菌(包括耐第三代头孢菌素肺炎克雷伯菌(3gcrkp))、大肠杆菌(包括耐第三代头孢菌素大肠杆菌(3gcrec)、耐氟喹诺酮大肠杆菌(fqrec)、耐多粘菌素大肠杆菌(colr-ec))、鲍曼不动杆菌(包括多重耐药鲍曼不动杆菌(mdr-ab)、耐碳青霉烯耐药鲍曼不动杆菌(crab))、艰难梭菌、化脓链球菌、沙雷氏菌、溶壁微球菌、藤黄微球菌、沙门氏菌、绿脓杆菌等。
[0113]
特别是,所述细菌为革兰氏阳性细菌。
[0114]
特别是,所述细菌为耐药菌株,例如,但不限于,耐甲氧西林金黄色葡萄球菌(mrsa)、耐万古霉素金黄色葡萄球菌(vrsa)、耐甲氧西林表皮葡萄球菌(mrse)、耐万古霉素肠球菌(vre)、耐青霉素肺炎链球菌(prsp)、多重耐药铜绿假单胞菌(mdr-pa)、耐碳青霉烯铜绿假单胞菌(crpa)、耐第三代头孢菌素肺炎克雷伯菌(3gcrkp)、耐第三代头孢菌素大肠杆菌(3gcrec)、耐氟喹诺酮大肠杆菌(fqrec)、耐多粘菌素大肠杆菌(colr-ec)、多重耐药鲍曼不动杆菌(mdr-ab)、耐碳青霉烯耐药鲍曼不动杆菌(crab)等,特别是耐甲氧西林金黄色
葡萄球菌(mrsa)、耐万古霉素金黄色葡萄球菌(vrsa)、耐甲氧西林表皮葡萄球菌(mrse)、耐万古霉素肠球菌(vre)、耐青霉素肺炎链球菌(prsp)。
[0115]
在本发明的一些实施例中,所述细菌为表皮葡萄球菌,例如表皮葡萄球菌(atcc 12228,msse)、表皮葡萄球菌(19-1,mrse)。
[0116]
在本发明另一些实施例中,所述细菌为金黄色葡萄球菌,例如金黄色葡萄球菌(atcc 29213, mssa)、金黄色葡萄球菌(atcc 33591,mrsa)、金黄色葡萄球菌(atcc 43300,mrsa)、金黄色葡萄球菌(atcc 700698,mrsa、visa)、金黄色葡萄球菌(15,mssa)。
[0117]
在本发明另一些实施例中,所述细菌为屎肠球菌,例如屎肠球菌(atcc 29212,vse)、屎肠球菌(atcc 51299,vre)、屎肠球菌(atcc 700221,vre)、屎肠球菌(20-2,vse)。
[0118]
具体地,该药物组合物的制剂形式可以为任何合适的剂型,例如,但不限于,片剂、糖衣片剂、薄膜衣片剂、肠溶衣片剂、胶囊剂、硬胶囊剂、软胶囊剂、口服液、口含剂、颗粒剂、冲剂、丸剂、散剂、膏剂、丹剂、混悬剂、粉剂、溶液剂、注射剂、栓剂、软膏剂、硬膏剂、霜剂、喷雾剂、滴剂、贴剂等,优选为注射剂。
[0119]
具体地,药学上可接受的辅料可以为,例如,但不限于,粘合剂、填充剂、稀释剂、压片剂、润滑剂、崩解剂、着色剂、调味剂和湿润剂等;适宜的填充剂可以为,例如纤维素、甘露糖醇、乳糖和其它类似的填充剂;适宜的崩解剂可以为,例如淀粉、聚乙烯吡咯烷酮和淀粉衍生物可以为,例如羟基乙酸淀粉钠;适宜的润滑剂可以为,例如硬脂酸镁;适宜的湿润剂可以为,例如十二烷基硫酸钠。
[0120]
在本发明第八方面,提供第一方面所述的光黑壳真菌、第二方面所述的组合物、第四方面所述的化合物或其药学上可接受的盐、立体异构体、前药、溶剂化物、第五方面所述化合物或其结构类似物在制备抗菌剂中的应用。
[0121]
具体地,该抗菌剂可用于杀灭或抑制病原体,特别是病原性细菌,如本发明第七方面所述。
[0122]
特别是,该抗菌剂可用于杀灭或抑制耐药菌株,如本发明第七方面所述。
[0123]
在本发明的一个实施方式中,该抗菌剂为药物,可用于预防和/或治疗病原体感染引起的疾病。
[0124]
在本发明第九方面,提供第一方面所述的光黑壳真菌、第二方面所述的组合物、第四方面所述的化合物或其药学上可接受的盐、立体异构体、前药、溶剂化物、第五方面所述化合物或其结构类似物、第七方面所述的药物组合物在制备预防和/或治疗疾病的药物中的应用。
[0125]
在本发明的一个实施方式中,该疾病为病原体感染引起的疾病。
[0126]
具体地,病原体可以为微生物、寄生虫(原虫、蠕虫等)或其他媒介。
[0127]
具体地,病原微生物可选自:病毒、衣原体、立克次体、支原体、细菌、螺旋体、真菌等中的一种或多种,特别是细菌。
[0128]
具体地,细菌如本发明第七方面所述。
[0129]
特别是,细菌为耐药菌株,如本发明第七方面所述。
[0130]
具体地,该药物的受试者可以为哺乳动物,例如人类、猴、猪、牛、马、羊、狗、猫、鼠等,特别是人类。
[0131]
在本发明第十方面,提供一种预防和/或治疗疾病的方法,其包括向有此需要的受
试者施用有效量的第四方面所述的化合物或其药学上可接受的盐、立体异构体、前药、溶剂化物、第五方面所述化合物或其结构类似物、或第七方面所述的药物组合物的步骤。
[0132]
具体地,该疾病为病原体感染引起的疾病,特别是细菌(例如耐药菌株)感染引起的疾病。
[0133]
具体地,细菌如本发明第七方面所述。
[0134]
具体地,受试者如本发明第九方面所述。
[0135]
本发明以药用植物内生真菌为研究对象发现了一株光黑壳真菌,将其发酵、分离可获得结构新颖的强效抗细菌化合物,特别是对耐药菌株也具有非常高的抑菌活性,具有非常好的应用前景和研发价值,为后续抗菌药物研发提供了基础。
[0136]
本发明的生物材料的保藏信息如下:
[0137]
一种光黑壳真菌(preussia intermedia)cpcc 401464,其已于2022年4月25日保藏于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏号为cgmcc no.40182,分类命名为preussia intermedia。
附图说明
[0138]
图1为本发明所述化合物a1的紫外光谱图。
[0139]
图2为本发明所述化合物a2的紫外光谱图。
[0140]
图3为本发明所述化合物a3的紫外光谱图。
[0141]
图4为本发明所述化合物a4的紫外光谱图。
[0142]
图5为本发明所述化合物a5的紫外光谱图。
[0143]
图6为本发明所述化合物a6的紫外光谱图。
[0144]
图7为本发明所述化合物a1的高分辨质谱图。
[0145]
图8为本发明所述化合物a2的高分辨质谱图。
[0146]
图9为本发明所述化合物a3的高分辨质谱图。
[0147]
图10为本发明所述化合物a4的高分辨质谱图。
[0148]
图11为本发明所述化合物a1溶于pyridin-d5中的1h-nmr谱图。
[0149]
图12为本发明所述化合物a1溶于pyridin-d5中的
13
c-nmr谱图
[0150]
图13为本发明所述化合物a1溶于pyridin-d5中的hsqc谱图。
[0151]
图14为本发明所述化合物a1溶于pyridin-d5中的hmbc谱图。
[0152]
图15为本发明所述化合物a1溶于pyridin-d5中的noe谱图。
[0153]
图16为本发明所述化合物a1溶于pyridin-d5中的1h-1
h cosy谱。
[0154]
图17为本发明所述化合物a2溶于pyridin-d5中的1h-nmr谱图。
[0155]
图18为本发明所述化合物a2溶于pyridin-d5中的
13
c-nmr谱图
[0156]
图19为本发明所述化合物a2溶于pyridin-d5中的hsqc谱图。
[0157]
图20为本发明所述化合物a2溶于pyridin-d5中的hmbc谱图。
[0158]
图21为本发明所述化合物a2溶于pyridin-d5中的noe谱图。
[0159]
图22为本发明所述化合物a2溶于pyridin-d5中的1h-1
h cosy谱。
[0160]
图23为本发明所述化合物a3溶于pyridin-d5中的1h-nmr谱图。
[0161]
图24为本发明所述化合物a3溶于pyridin-d5中的
13
c-nmr谱图
[0162]
图25为本发明所述化合物a3溶于pyridin-d5中的hsqc谱图。
[0163]
图26为本发明所述化合物a3溶于pyridin-d5中的hmbc谱图。
[0164]
图27为本发明所述化合物a3溶于pyridin-d5中的noe谱图。
[0165]
图28为本发明所述化合物a3溶于pyridin-d5中的1h-1
h cosy谱。
[0166]
图29为本发明所述化合物a4溶于methanol-d4中的1h-nmr谱图
[0167]
图30为本发明所述化合物a4溶于methanol-d4中的
13
c-nmr谱图。
[0168]
图31为本发明所述化合物a4溶于methanol-d4中的hsqc谱图。
[0169]
图32为本发明所述化合物a4溶于methanol-d4中的hmbc谱图。
[0170]
图33为本发明所述化合物a4溶于methanol-d4中的1h-1
h cosy谱。
[0171]
图34为本发明所述化合物a4溶于methanol-d4中的noe谱图。
[0172]
图35为本发明所述化合物a5和a6溶于pyridin-d5中的1h-nmr谱图。
[0173]
图36为本发明所述化合物a5和a6溶于pyridin-d5中的
13
c-nmr谱图。
[0174]
图37为本发明所述化合物a5和a6溶于pyridin-d5中的hsqc谱图。
[0175]
图38为本发明所述化合物a5和a6溶于pyridin-d5中的hmbc谱图。
[0176]
图39为本发明所述化合物a5和a6溶于pyridin-d5中的1h-1
h cosy谱。
[0177]
图40为本发明所述化合物a5和a6溶于pyridin-d5中的noe谱图。
具体实施方式
[0178]
除非另有定义,本发明中所使用的所有科学和技术术语具有与本发明涉及技术领域的技术人员通常理解的相同的含义。
[0179]
术语“培养物”是指一定时间一定空间内微生物的细胞群或生长物,特别是指经人工接种和培养后,生长有微生物(如本发明所述光黑壳真菌cpcc 401464)群体的液体或固体培养基,例如微生物的斜面培养物、发酵产物等。
[0180]
术语“菌悬液”是指将微生物(如本发明所述光黑壳真菌cpcc 401464)细胞分散于溶剂(例如水)中所得的悬浮液。
[0181]
术语“裂解物”是指微生物(如本发明所述光黑壳真菌cpcc 401464)细胞裂解后所得产物。
[0182]
术语“碳源”是指含有碳元素且能被微生物生长繁殖所利用的一类营养物质,包括糖类、油脂、有机酸及有机酸酯和小分子醇等速效、迟效碳源。
[0183]
术语“氮源”是指提供微生物营养所需氮元素的物质,包括花生饼粉、黄豆饼粉、酵母粉、蛋白胨、氨水、铵盐和硝酸盐等速效、迟效氮源。
[0184]
术语“烷基”指的是直链或支链的且不含不饱和键的烃基,且该烃基以单键与分子其它部分连接。在本文中所使用的烷基通常含有1至10(例如1、2、3、4、5、6、7、8、9、10)个碳原子(即, c1-10烷基),优选含有1至6个碳原子(即,c1-6烷基)。烷基的实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基、正己基、异己基等。如果烷基被环烷基取代,其相应为“环烷基烷基”,如环丙基甲基、环丙基乙基、环丁基甲基、环戊基甲基、环己基甲基等。如果烷基被芳基取代,那么其相应为“芳烷基”,如苄基、二苯甲基或苯乙基。如果烷基被杂环基取代,那么其相应为“杂环基烷基”。
[0185]
术语“烯基”指的是至少含两个碳原子、至少一个不饱和键的直链或支链的烃基,且该烃基以单键与分子其它部分连接。在本文中所使用的烯基通常含有1至10(例如1、2、3、4、5、6、7、8、 9、10)个碳原子(即,c1-10烯基),优选含有1至6个碳原子(即,c1-6烯基)。烯基的实例包括但不限于乙烯基、1-甲基-乙烯基、1-丙烯基、2-丙烯基或丁烯基等。
[0186]
术语“环烷基”是指脂环烃,在本文中所使用的环烷基通常含1至4个单环和/或稠环、含3-18个碳原子,优选3-10(例如3、4、5、6、7、8、9、10)个碳原子(例如,c3-10环烷基,c3-6环烷基),如环丙基、环丁基、环戊基、环己基、环庚基、环辛基或金刚烷基等。
[0187]
术语“芳基”指的是任何从简单芳香环衍生出的官能团或取代基,包括单环的芳基基团和/或稠环的芳基基团,如包含1-3个环的、单环或稠环的且具有6-18(例如6、8、10、12、14、16、18)个碳环原子。本文中所使用的芳基通常为包含1-2个环的、单环或稠环的且具有6-12个碳环原子的芳基(即,c6-12芳基),其中碳原子上的h可以被取代,例如被烷基、卤素等基团取代。所述芳基的实例包括但不限于苯基、对甲基苯基、萘基、联苯基、茚基等。
[0188]
术语“烷氧基”指的是羟基中的氢被烷基取代后形成的取代基,如含有1-10个碳原子的烷氧基,例如甲氧基、乙氧基、丙氧基、丁氧基等。
[0189]
术语“烷胺基”指的是氨基(-nh2)中的一个或两个氢被烷基取代后形成的取代基,如含有1-10 个碳原子的烷胺基,例如
[0190]
术语“卤素”是指溴、氯、碘或氟。
[0191]
术语“杂环基”是指3至18元非芳香环基团,其包含2至17个碳原子以及1至10个杂原子。杂环基可以为单环、双环、三环、或四环的环系统,其可包含稠合的、螺环的或桥接的环系统。杂环基可以是部分饱和的(杂芳基)或完全饱和的(杂环烷基)。本发明的化合物中的合适的杂芳基含 1、2或3种杂原子,所述杂原子选自n、o或s原子,所述杂芳基包括,如,香豆素,包括8-香豆素、喹啉基,包括8-喹啉基、异喹啉基、吡啶基、吡嗪基、吡唑基、嘧啶基、呋喃基、吡咯基、噻吩基、噻唑基、异噻唑基、三唑基、四唑基、异噁唑基、噁唑基、咪唑基、吲哚基、异吲哚基、吲唑基、吲嗪基、酞嗪基、蝶啶基、嘌呤基、噁二唑基、噻二唑基、呋吖基、哒嗪基、三嗪基,噌啉基、苯并咪唑基、苯并呋喃基、苯并呋吖基、苯并噻吩基、苯并噻唑基、苯并噁唑基、喹唑啉基、喹喔啉基、萘啶基和呋喃并吡啶基。本发明的化合物中的合适的杂环烷基含1、2或3种杂原子,所述杂原子选自n、o或s原子,所述杂环烷基包括,如,吡咯烷基、四氢呋喃基、二氢呋喃、四氢噻吩基、四氢噻喃基、哌啶基、吗啉基、硫代吗啉基、氧硫杂环己烷基、哌嗪基、氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、高哌啶基、氧杂环丙烷基、硫杂环丙烷基、吖庚因基、氧氮杂环庚基基、二吖庚因基、三吖庚因基、1,2,3,6-四氢吡啶基、2-吡咯啉基、3-吡咯啉基,二氢吲哚基、2h
‑ꢀ
吡喃基、4h-吡喃基、二氧杂环己烷基、1,3-二氧戊环基、吡唑啉基、二噻烷基、二硫戊环基、二氢吡喃基、二氢噻吩基、吡唑烷基、咪唑啉基、咪唑烷基、3-氮杂双环[3.1.0]己基、3-氮杂双环[4.1.0] 庚基、3h-吲哚基和喹嗪基。
[0192]
本发明所述的药学上可接受的盐中包括酸加成盐和碱加成盐。
[0193]
所述的酸加成盐包括但不限于来自无机酸诸如盐酸、硝酸、磷酸、硫酸、氢溴酸、氢碘酸和膦酸的盐,以及来自有机酸如脂肪族单羧酸和二羧酸、苯基取代的链烷酸、羟基链烷
酸、链烷二酸、芳香酸和脂肪族和芳香族磺酸的盐。因此,这些盐包括但不限于硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、硝酸盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐、盐酸盐、氢溴酸盐、碘酸盐、乙酸盐、丙酸盐、辛酸盐、异丁酸盐、乙二酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、苦杏仁酸盐、苯甲酸盐、氯代苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、酞酸盐、苯磺酸盐、甲苯磺酸盐、苯基乙酸盐、柠檬酸盐、乳酸盐、马来酸盐、酒石酸盐和甲磺酸盐,还包含氨基酸的盐如精氨酸盐、葡糖酸盐、半乳糖醛酸盐等。酸加成盐可以通过以常规方式使游离碱形式与足够量的所需酸接触形成盐的方式制备。可通过使盐形式与碱接触重新生成游离碱形式,并且以常规方式分离该游离碱。
[0194]
所述的碱加成盐是指与金属或者胺形成的盐,诸如碱金属和碱土金属的氢氧化物,或者与有机胺形成。用作阳离子的金属的例子包括但是不限于钠、钾、镁、和钙。适当的胺的例子包括但是不限于n,n
′‑
二苄基乙二胺、氯普鲁卡因、胆碱、二乙醇胺、乙二胺(乙烷-1,2-二胺)、n-甲基葡糖胺和普鲁卡因。碱加成盐可通过以常规方式使游离酸形式与足够量的所需碱接触形成盐的方式制备。可通过使盐形式与酸接触重新生成游离酸形式,并且以常规方式分离游离酸。
[0195]
本发明所述的立体异构体包括对映体、非对映体和几何异构体的形式存在。本发明的一些化合物具有环烃基,其可在超过一个碳原子上被取代,在这种情况下,其所有的几何形式,包括顺式和反式,及其混合物,都处在本发明的范围内。所述的环烃基包括脂环烃基和芳基,其中脂环烃基可以为非芳香的单环、稠环、桥环或螺环的饱和或不饱和的环状烃基,芳基如苯基、萘基、菲基、联苯基等。
[0196]
本发明所述的溶剂化物是指本发明的化合物与一种或多种溶剂分子的物理结合。该物理结合包括各种程度的离子和共价键合,包括氢键合。在某些情况下,溶剂化物可被分离出来,例如当一个或多个溶剂分子掺入到结晶固体的晶格中。溶剂化物包括溶液相和可分离的溶剂化物。代表性的溶剂化物包括乙醇化物、甲醇化物等。
[0197]
本发明所述的前药指适于对患者给药的无过分毒性、刺激性和变态反应等的并且对其应用目的有效的式ⅰ化合物形式,包括缩醛、酯和两性离子形式。前药在体内转化,如通过在血液中水解,得到母体化合物。
[0198]
术语“患者”或“受试者”等等在本文中可交换使用,是指根据本文所述的方法治疗的任何动物或其细胞,不论是体外或原位。具体地,前述动物包括哺乳动物,例如,大鼠、小鼠、豚鼠、兔、狗、猫、猪、牛、马、羊、猴子或人类,特别是人类。
[0199]
本发明中所述“治疗”是指在疾病发作之后预防、治愈、逆转、减弱、减轻、最小化、抑制、制止和/或停止疾病的一种或多种临床症状。
[0200]
本发明中所述“预防”指在疾病发作之前,通过治疗以避免、最小化或令疾病难于发作或发展。
[0201]
本文所引用的各种出版物、专利和公开的专利说明书,其公开内容通过引用整体并入本文。
[0202]
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明
保护的范围。
[0203]
实施例1:光黑壳真菌cpcc 401464的分离及鉴定
[0204]
1、菌株的分离
[0205]
光黑壳真菌cpcc 401464分离自西藏自治区林芝市巴宜区沼生橐吾植物样品。具体方法如下:采集整个橐吾植株装入自封袋内,带回实验室处理。将整个植株,依次用75%酒精漂洗1min,2%次氯酸钠漂洗3min,75%酒精漂洗30s,无菌水漂洗3次,后用无菌吸水纸将植株表面水吸干,并用无菌剪刀将植株剪成长约0.5cm的组织块,置于含有硫酸链霉素(50mg l-1
)和四环素(50mg l-1
)的pda固体培养基平板。放置于28℃培养箱中培养。5-7天后,根据菌落的颜色、大小、形状等特征挑取单菌落,置于含有 pda培养基的试管斜面上,获得纯培养,待长好后,置于冰箱中保存。取编号为cpcc 401464的菌株进行下述鉴定。
[0206]
菌株cpcc 401464的保藏方法:于20%甘油冻存管-80℃保藏。
[0207]
2、菌株的鉴定
[0208]
(1)形态特征
[0209]
菌株cpcc 401464的菌落在pda培养基上生长近于平坦,薄,具稀疏的气生菌丝,菌丝体灰白色至棕色,表面无光泽,干燥;反面白色或棕色。
[0210]
(2)分子生物学鉴定
[0211]
从固体培养基上挑取菌株cpcc 401464菌体于无菌1.5ml离心管中,加入液氮,待冷却后,迅速用特制的玻璃研磨棒将样品研碎至粉末状;加入300μl 2
×
ctab提取液,轻轻混匀,95℃水浴2min;加入等体积(300μl)酚氯仿混合液(苯酚:氯仿:异戊醇(25:24:1,v/v/v)),振荡混匀,12000rpm离心5min;将上清液移至新的1.5ml无菌离心管中,加入等体积的异丙醇,振荡混匀,移入硅质膜吸附离心柱,静置2min,12000rpm离心30s;弃液体,在硅质膜吸附离心柱中加入500μl eb洗涤液,12000rpm 离心30s;将硅质柱12000rpm离心干燥2min;将硅质膜吸附离心柱移入新的1.5ml无菌离心管,加入 65℃50μl te洗脱液,12000rpm离心30s;弃硅质柱,离心管中收集50μl液体,得到总dna的粗提液。上述dna的粗提液送上海生工公司测序。序列测定结果提交至ncbi,与相关属种中有效描述菌株的相应基因序列相比对,初步判定菌株的所属类群。
[0212]
菌株cpcc 401464的its基因序列如seq id no:1所示,与菌株preussia intermedia strain uamh 7460 在its序列相似性为99%;与preussia intermedia strain 18thes003在tublin序列相似性为99%;与preussiaintermedia voucher ups:kruys 304在lsu序列相似性为100%。根据菌株cpcc 401464形态特征和its 基因序列,确定菌株cpcc 401464为preussia intermedia。
[0213]
该菌株已于2022年4月25日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为 cgmcc no.40182。下文简称光黑壳真菌cpcc 401464。
[0214]
实施例2:发酵培养
[0215]
(1)将光黑壳真菌cpcc 401464菌种孢子接种于斜面培养基,于28℃培养5天,得到斜面菌种。
[0216]
其中,斜面培养基由马铃薯浸粉、葡萄糖、琼脂和水组成。以上成分在斜面培养基中浓度分别为:马铃薯浸粉4g/l,葡萄糖20g/l,琼脂15g/l;所述斜面培养基的ph值为5.6
±
0.2。
[0217]
(2)在多个500ml玻璃瓶中分别装入100ml种子培养基,于121℃下灭菌20分钟,由斜面挑取菌丝体接种。于28℃振荡(200rpm)培养2天,得到种子液。
[0218]
其中,种子培养基由马铃薯浸粉、葡萄糖和水组成。以上成分在种子培养基中浓度分别为:马铃薯浸粉4g/l;葡萄糖20g/l;所述液体培养基的ph值为5.6
±
0.2。
[0219]
(3)500ml三角瓶装有80g大米,加入80ml水浸泡,121℃灭菌20分钟得到发酵培养基。将上述步骤(2)得到的种子液接种于发酵培养基(每瓶发酵培养基接种种子液5ml),28~30℃静态培养30天获得发酵产物。
[0220]
实施例3:抗细菌化合物的分离纯化和鉴定
[0221]
1、抗细菌化合物的分离纯化
[0222]
吸附层析:
[0223]
将实施例2的发酵产物用乙酸乙酯超声提取3次,所得乙酸乙酯提取产物使用布氏漏斗过滤,滤液用减压浓缩得到乙酸乙酯粗提物。乙酸乙酯粗提物进行硅胶柱层析分离,分别用不同比例二氯甲烷-甲醇溶液(v/v,100:0,95:5,90:10,85:15)进行分步洗脱。
[0224]
所述硅胶柱层析中的硅胶的型号为层析硅胶h。硅胶柱层析中所用的洗脱程序分如下四步:1)先用二氯甲烷洗脱2个柱体积;2)接着用95:5的二氯甲烷-甲醇溶液(由二氯甲烷和甲醇组成的液体,该液体中二氯甲烷和甲醇的体积比为95:5)洗脱2个柱体积;3)接着用90:10的二氯甲烷-甲醇溶液(由二氯甲烷和甲醇组成的液体,该液体中二氯甲烷和甲醇的体积比为96:4)洗脱4 个柱体积;4)再用85:15的二氯甲烷-甲醇溶液(由二氯甲烷和甲醇组成的液体,该液体中二氯甲烷和甲醇的体积比为85:15)洗脱4个柱体积。从洗脱程序开始不间断收集洗脱出的液体,收集第 4)步中3个柱体积洗脱出的液体,将其命名为流份8。
[0225]
上述制备方法中,所述步骤4)包括从所述流份8中分离得到化合物a1。具体方法如下:将所述流份8溶于甲醇溶液中,然后在通风橱中缓慢挥发,挥发12小时候溶液中析出固体化合物,离心,得固体化合物52.0mg,即为化合物a1。
[0226]
取化合物a1 25.0mg溶于2ml dmso中,室温下静置12小时,采用安捷伦sb-c18液相制备分离得到化合物a2和化合物a3的混合物8.8mg、化合物a4 4.0mg,化合物a5和a6混合物2.3mg。所述流动相为50%乙腈-水(由乙腈和水组成的液体,该液体中乙腈和水的体积比为50:50),流速为4.0ml/min,收集保留时间为15.7min的洗脱峰,得到化合物a5和a6混合物2.3mg;收集保留时间为18.1min的洗脱峰,得到化合物a2和化合物a3的混合物8.8mg;收集保留时间为19.5 min的洗脱峰,得到化合物a4 3.5mg。
[0227]
所述化合物a2和化合物a3的混合物采用大赛璐daicel手性柱液相制备分离得到化合物a2和化合物a3。该手性柱液相制备中所用的分离色谱柱为chiralpak as-h。流动相为80%乙腈-水(由乙腈和水组成的液体,该液体中乙腈和水的体积比为80:20),流速为4.0ml/min,收集保留时间为10.5min 的洗脱峰,得到化合物a2;收集保留时间为11.2min的洗脱峰,得到化合物a3。
[0228]
2、抗细菌化合物的鉴定
[0229]
将上述得到的化合物a1~a6进行鉴定:
[0230]
(1)外观:化合物a1、化合物a2、化合物a3、化合物a4、化合物a5和化合物a6为浅黄色固体粉末。
[0231]
(2)溶解性:化合物a1、化合物a2、化合物a3、化合物a4、化合物a5和化合物a6均可
溶于甲醇、乙腈。
[0232]
(3)紫外光谱:将化合物配置成0.5mg/ml的浓度,在安捷伦1290hplc-uv检测器中进行检测,直接通过光谱吸收数据读出化合物的紫外吸收峰。化合物a1的甲醇溶液的紫外光谱在351nm处有最大吸收峰。化合物a2的甲醇溶液的紫外光谱在351nm处有最大吸收峰。化合物a3的甲醇溶液的紫外光谱在351nm处有最大吸收峰。化合物a4的甲醇溶液的紫外光谱在351nm处有最大吸收峰。化合物a5的甲醇溶液的紫外光谱在343nm处有最大吸收峰。化合物a6的甲醇溶液的紫外光谱在343nm处有最大吸收峰。上述紫外光谱分别见图1~图6。紫外光谱测试仪器为agilent 1290system。
[0233]
(4)质谱:图7是化合物a1的hresims质谱图,显示其[m+h]
+
峰为m/z 567.18638,提示其分子式为c
30h30o11
。图8是化合物a2的hresims质谱图,显示其[m+h]
+
峰为m/z 567.18542,提示其分子式为c
30h30o11
。图9是化合物a3的hresims质谱图,显示其[m+h]
+
峰为m/z 567.18377,提示其分子式为c
30h30o11
。图10是化合物a4的hresims质谱图,显示其[m+h]
+
峰为m/z 567.18719,提示其分子式为c
30h30o11
。hresims测试采用thermo scientific ltq orbitrap xl质谱系统,甲醇为溶剂。
[0234]
(6)核磁共振谱:图11~图16分别是化合物a1的1h-nmr、
13
c-nmr、hsqc、hmbc、noe、1h-1
h cosy核磁谱图,图17~图22分别是化合物a2的1h-nmr、
13
c-nmr、hsqc、hmbc、noe、1h-1
h cosy 核磁谱图,图23~图28分别是化合物a3的1h-nmr、
13
c-nmr、hsqc、hmbc、noe、1h-1
h cosy 核磁谱图,图29~图34分别是化合物a4的1h-nmr、
13
c-nmr、hsqc、hmbc、1h-1
h cosy、noe 的谱图,图35~图40分别是化合物a5和a6的混合物的1h-nmr、
13
c-nmr、hsqc、hmbc、1h-1
h cosy、 noe核磁谱图。根据化合物的核磁数据,对化合物核磁信号进行了归属,如表1-1和1-2所示。
[0235]
表1-1.化合物a1至a3的核磁数据
[0236]
[0237][0238]
表1-2.化合物a4至a6的核磁数据
[0239][0240][0241]
化合物a1-a6平面结构根据其1h-nmr、
13
c-nmr、hsqc、hmbc、dept、1h-1
h cosy和noe 谱图确定,化合物a1-a6的结构如下:
[0242][0243]
实施例4:化合物的抗细菌活性的检测
[0244]
使用微孔板法检测化合物a1-a6的mic,具体步骤如下:
[0245]
根据美国临床实验室标准化委员会标准,采用微稀释法对分离得到的化合物进行抗临床耐药菌体外活性测定:将测试菌从冻存管中划线接种于营养琼脂平板活化,35
±
2℃培养过夜,挑取其中3-5 个单菌落至营养肉汤培养基,35
±
2℃培养6-8小时。待测化合物使用camhb培养基稀释至256 μg/ml,吸取100μl稀释好的化合物加入96孔板第二列各孔,其余每列各孔加入100μl camhb培养基,用排枪吸取100μl camhb培养基加入第二列各孔,反复吹打使其混合均匀,从其中吸取100μl 平行加入至第三列各孔,再次吹打至混合均匀,吸取100μl混合液加入到第四列各孔,以此类推,二倍稀释至倒数第二列,从倒数第二列中取出100μl弃去,则第二列至倒数第二列中药物的终浓度依次为:128、64、32、16、8、4、2、1、0.5、0.25μg/ml,体系终体积为100μl。96孔板第一列和最后一列分别作为培养基空白对照和菌株的生长对照(仅加入培养基或菌液)。将培养后的菌悬液用0.85%生理盐水调整至0.5mcf(约为1
×
108cfu/ml),再使用camhb培养基稀释20倍,制成浓度约为5
×
106cfu/ml的菌悬液。取稀释好的菌悬液分别加入1~7行第二列至第十二列各孔,每孔10μl菌液,第8行作为药物的空白对照,则每孔内的细菌终浓度约为5
×
105cfu/ml。将96孔板置35
±
2℃静置培养16-18小时后观察结果,未见菌株生长(肉眼未见浑浊)的小孔内所含化合物最小的浓度即为最低抑菌浓度(minimal inhibitory concentration,mic)。实验中所用抗菌活性测试菌株保藏于中国医学科学院病原菌(毒)种保藏中心药用相关微生物菌(毒)种保藏分中心,北京,100054。信息为:表皮葡萄球菌(atcc 12228,msse)、表皮葡萄球菌(19-1,mrse)、金黄色葡萄球菌(atcc 29213,mssa)、金黄色葡萄球菌(atcc 33591,mrsa)、金黄色葡萄球菌(atcc43300,mrsa)、金黄色葡萄球菌(atcc 700698,mrsa、visa)、金黄色葡萄球菌(15,mssa)、屎肠球菌(atcc 29212,vse)、屎肠球菌(atcc 51299,vre)、屎肠球菌(atcc 700221, vre)、屎肠球菌(20-2,vse)。实验结果见表2。
[0246]
表2.化合物a1-a6的抗菌活性
[0247][0248]
以上数据表明,化合物a1-a6对表皮葡萄球菌(atcc 12228,msse)、表皮葡萄球菌(19-1, mrse)、金黄色葡萄球菌(atcc 29213,mssa)、金黄色葡萄球菌(atcc 33591,mrsa)、金黄色葡萄球菌(atcc 43300,mrsa)、金黄色葡萄球菌(atcc 700698,mrsa、visa)、金黄色葡萄球菌(15,mssa)、屎肠球菌(atcc 29212,vse)、屎肠球菌(atcc 51299,vre)、屎肠球菌(atcc 700221,vre)、屎肠球菌(20-2,vse)均具有抑制作用,尤其是金黄色葡萄球菌和屎肠球菌都具有较好的抗菌活性。
[0249]
此外,化合物a1还可以有效的抑制表皮葡萄球菌(19-1,mrse)、金黄色葡萄球菌(atcc 700698, mrsa,visa)、屎肠球菌(atcc 700221,vre)、屎肠球菌(20-2,vse),其mic优于阳性对照药左氧氟沙星,化合物a1对屎肠球菌(atcc 51299,vre)的mic与阳性对照药左氧氟沙星相当。
[0250]
化合物a2还可以有效的抑制金黄色葡萄球菌(atcc 700698,mrsa,visa)、屎肠球菌(atcc700221,vre)、屎肠球菌(20-2,vse)其mic优于阳性对照药左氧氟沙星。化合物a3-a6可以有效的抑制屎肠球菌(atcc 700221,vre)、屎肠球菌(20-2,vse)其mic优于阳性对照药左氧氟沙星。
[0251]
化合物a3/a5/a4抑制金黄色葡萄球菌(atcc 700698,mrsa,visa)的mic与阳性对照药左氧氟沙星相当。
[0252]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换等,均应包含在本发明的保护范围之内。
[0253]
本发明中描述的前述实施例和方法可以基于本领域技术人员的能力、经验和偏好而有所不同。
[0254]
本发明中仅按一定顺序列出方法的步骤并不构成对方法步骤顺序的任何限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1