一种快速鉴别猪繁殖障碍症候群病原的iiPCR试剂盒及其使用方法
一种快速鉴别猪繁殖障碍症候群病原的iipcr试剂盒及其使用方法
技术领域
1.本发明涉及动物病毒学技术领域,尤其涉及一种快速鉴别猪繁殖障碍症候群病原的iipcr试剂盒及其使用方法。
背景技术:
2.近年来,我国生猪产业集约化的养殖新模式渐成趋势,规模化猪场养殖密度的增加使得猪群之间的接触频率显著升高,这也间接地加快了疾病(特别是病毒性疾病)的传播速度,许多猪类疫病混合感染的比例大幅度上升,并且多种病原体共感染可引起相似且典型的临床症状(通称为“症候群”)。其中,猪繁殖障碍性疾病,又称为“猪繁殖障碍症候群”,就是一大类以妊娠母猪发生流产、产死胎、木乃伊胎、产弱仔、母猪不孕、公猪不育为主要特征表现的疾病。目前,猪繁殖障碍性疾病在我国养猪场中普遍存在,严重危害着国内养猪业的健康发展。虽然,不同的病原所造成的猪繁殖障碍的临床症状可能存在一定的差异,但是由于临床中经常会出现多种病原或者一种病原的不同基因型、血清型混合感染的现象,而且很难通过大体剖检对致病原进行确诊,因此针对同一症候群下的不同病原进行精准地鉴别诊断是非常必要的。当前,以猪繁殖与呼吸综合征病毒(porcine reproductive andrespiratory syndrome virus,prrsv)、猪伪狂犬病毒(pseudorabies virus,prv)、古典猪瘟病毒(classical swine fever virus,csfv)、日本脑炎病毒(japaneseencephalitis virus,jev)、猪细小病毒(porcine parvovirus,ppv)所引起的猪群主要垂直传播性疾病为主要危害。
3.猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndromevirus,prrsv)是一种单股正链rna病毒,可分为欧洲型(基因i型)和美洲型(基因ii型)两种基因型。虽然,欧洲型prrsv在我国某些省份有被检出过,但是绝大多数毒株都呈现出偶发或者散发的特征。1996年,中国首次报道了美洲型prrsv的出现,随后在国内各主要养猪地区均存在该类病毒的流行。2006年以来,我国相继出现了高致病性的prrsv毒株、类nadc30 毒株、类nadc34毒株、rflp 1-4-4lineage 1c毒株等优势变异株。prrsv 具有复杂的遗传多样性,病毒基因组中的orf5和nsp2是两个较为高变的区域。基于orf5基因的系统发生树分析法将美洲型prrsv分为lineage 1~ 9分支谱系,在中国主要流行的是lineage 1(代表毒株:类nadc30、类 nadc34)、lineage 3(代表毒株qyyz、gm2)、lineage 5(代表毒株vr2332)、 lineage 8(代表毒株ch-1a)、lineage 9(代表毒株:xjnj)等谱系毒株。此外,我国疫苗毒株与流行毒株以及流行毒株之间常发生重组事件,致使田间毒株生物学特性复杂多变。
4.猪伪狂犬病病毒(pseudorabies virus,prv)是一种线性双链dna病毒, prv只有一个血清型,但不同毒株之间毒力有所差异。20世纪60年代以后,随着prv强毒株的出现,猪伪狂犬病在世界范围内频繁暴发,我国为了控制 prv的流行,1979年从匈牙利进口了bartha-k61疫苗,该疫苗在国内得到了广泛的应用,并且取得了良好的防控效果,猪群新生仔猪的发病率和死亡率均低于10%。但是自2011年以后,我国prv免疫失败的案例层出不
穷,具体表现为接种了bartha-k61弱毒疫苗的猪群再次出现感染,并且其发病率和死亡率呈现明显上升趋势。对当前prv流行毒株分子特征的分析结果表明,流行株的gb、gc、gd和ge基因已经出现了一定程度的遗传变异,这使得变异株与经典毒株处于不同的进化分支上,经典毒株属于基因1型,变异株多为基因2型。
5.古典猪瘟病毒(classical swine fever virus,csfv)是一种单股、正链rna 病毒。通过序列比对分析可将全球范围内的csfv分离毒株分为3种基因型 (1型、2型和3型)和11个基因亚型(1.1、1.2、1.3、1.4、2.1、2.2、2.3、 3.1、3.2、3.3和3.4亚型),而2.1亚型又可以进一步划分为2.1a~2.1j十个亚群。自20世纪90年代起,中国的csfv分离毒株主要包括1.1、2.1、2.2 和2.3四种基因亚型。当前,2.1亚型毒株在我国流行最为广泛,其中2.1b 亚群已经成为主要流行的优势毒株,2.1c亚群主要在我国南方地区流行。1.1、 2.2和2.3亚型毒株呈现出地方性散发的特征。
6.猪细小病毒(porcine parvovirus,ppv)是一种单股、线性、无囊膜的dna 病毒。自20世纪80年代起,中国上海、北京、江苏等地陆续分离到猪细小病毒,当前ppv呈现出全国性散发、零星流行。根据毒株vp蛋白的遗传多样性,猪细小病毒至少可分为7种基因型,包括ppv1、ppv2、ppv3、ppv4、 ppv5、ppv6和ppv7,通常用于区分猪细小病毒亚科成员。其中,ppv1是从污染的细胞中分离获得的经典基因型毒株,而ppv2~ppv6毒株则是通过宏基因组测序等检测技术被发现的。这7个基因型ppv根据ns1蛋白序列同源性在细小病毒系统发育树上又被划分为protoparvovirus(ppv1)、 tetraparvovirus(ppv2和ppv3)、copiparvovirus(ppv4、ppv5和ppv6) 和chaphamaparvovirus(ppv7)四个不同的属。截至目前,中国国内发现的本土毒株涵盖了全部的七种基因型。其中,ppv2和ppv3是主要流行的基因型,其次是ppv1和ppv7,ppv 4、ppv5和ppv6分离率相对较低。针对 ppv的免疫防控,我国ppv商品化疫苗均为全病毒灭活苗,但是不同地区所选择的毒株之间存在一定的差异,这些毒株通常包括ppv cp-99、s-1、bj-2、 wh-1、nj、cg-05、ybf01、l等。
7.日本脑炎病毒(japanese encephalitis virus,jev)是一种单股、正链、有囊膜的rna病毒,它能够引起一种急性、自然疫源性蚊媒传播的人兽共患传染病——“日本脑炎”。jev感染谱较广,自然情况下,鸟类、蝙蝠、马、牛、人等均可感染。对人而言,大部分感染者呈隐性感染,但少数患者会出现严重的脑炎症状,表现为神经麻痹、痉挛性瘫痪、小脑共济失调。此外,猪是jev重要的储存宿主和增殖宿主,也是日本脑炎的主要传染源。jev仅有1种血清型,基于c/prm、e基因的核苷酸序列,可将其分为5种基因型 (gi型~gv型)。其中,基因i、ii、iii型是其主要基因型,iv型和v型分别分布于印度尼西亚东部和马来西亚。我国猪群中jev大多数为基因iii 型,但近十年来,从猪群中分离鉴定出i型jev的相关报道逐渐增多,这说明jev在不同宿主中流行的优势基因型正在发生转变。
8.传统的pcr检测技术必须在专业实验室才能进行操作,需要专门的仪器设备,操作步骤繁琐,耗时长、成本高,操作人员需要专业培训。因此,对病原学检测,开发及时检测(point-of-care testing,poct)技术,在现场采样即刻进行分析,省去样品在实验室检验时的处理程序,能够快速、精准得到检测结果的诊断技术是现代兽用疫病诊断的市场需求和发展趋势。
9.快速、精准的现场诊断对该病的防治尤为重要,病原检测可以提供感染的直接证据。2002年krishnar等对荧光定量pcr检测仪器进行了改进和创新,研发出基于taqman探针
原理的恒温隔绝式pcr(insuated isothermalpchiipcr)系列检测仪,其中手持式pockit自重仅380g,自带电源,一键操作即可在42min内完成检测,结果直接显示在液晶屏上,实现了病原分子检测的小型化、便捷化,特别适用于现场的快速诊断。目前国外已建立了虾白斑病、犬瘟热、犬细小病毒病、猪瘟、马流感等iipcr检测方法,其中检测虾白斑病的iipcr方法获得了oie的认证,但是将iipcr技术运用到猪繁殖障碍症候群鉴别诊断方面的报道甚少。
技术实现要素:
10.本发明旨在解决现有技术中存在的技术问题。为此,本发明提供一种快速鉴别猪繁殖障碍症候群病原的iipcr试剂盒及其使用方法,目的是实现快速、精准地鉴别猪群繁殖障碍性疾病的致病原prrsv、prv、csfv、jev、 ppv2。
11.基于上述目的,本发明提供了一种快速鉴别猪繁殖障碍症候群病原的 iipcr试剂盒,包括iipcr扩增液,所述iipcr扩增液包括引物探针组,所述引物探针组包括第一引物对和第一探针、第二引物对和第二探针、第三引物对和第三探针、第四引物对和第四探针、第五引物对和第五探针,所述第一引物对包括如seq id no.1所示的prrsv上游引物和如seq id no.2所示的prrsv下游引物,所述第一探针包括如seq id no.3所示的prrsv探针,所述第二引物对包括如seq id no.4所示的prv上游引物和如seq idno.5所示的prv下游引物,所述第二探针包括如seq id no.6所示的prv 探针,所述第三引物对包括如seq id no.7所示的csfv上游引物和如seqid no.8所示的csfv下游引物,所述第三探针包括如seq id no.9所示的 csfv探针,所述第四引物对包括如seq id no.10所示的jev上游引物和如seq id no.11所示的jev下游引物,所述第四探针包括如seq id no.12 所示的jev探针,所述第五引物对包括如seq id no.13所示的ppv2上游引物和如seq id no.14所示的ppv2下游引物,所述第五探针包括如seq idno.15所示的ppv2探针。
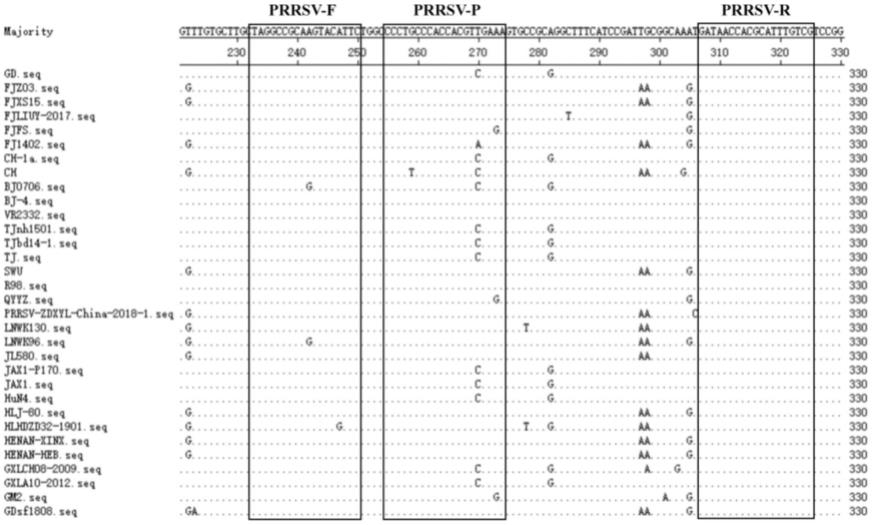
12.所述试剂盒还包括阳性对照和阴性对照。
13.所述阳性对照为进行灭活处理过的prrsv、prv、csfv、jev、ppv2 病毒液,接毒剂量为1
×
106tcid
50
/ml;所述阴性对照为nuclease-free水。
14.所述试剂盒还包括待测样品,所述待测样品类型为猪的病理组织。
15.所述猪的病理组织为心、肝、脾、肺、肾或淋巴结中的一种。
16.所述iipcr扩增液用量为48μl,添加模板量为2μl,iipcr扩增液包括 (premix缓冲液)dntp、tris-buffer、edta、dtt、甘油和tween-20,含量分别为0.5mm、10mm、0.05mm、0.05mm、30%v/v和0.1%v/v,taq dna 聚合酶的浓度0.1u/μl、mmlv反转录酶的浓度为0.5u/μl,prrsv上游引物、 prv上游引物、csfv上游引物、jev上游引物、ppv2上游引物、prrsv 下游引物、prv下游引物、csfv下游引物、jev下游引物和ppv2下游引物的浓度均为1μm,第一探针、第二探针、第三探针、第四探针和第五探针的浓度均为0.05μm,所述模板为猪的病理组织中提取的核酸。
17.优选的,所述第一探针、第二探针、第三探针、第四探针、第五探针的 5’端均使用fam荧光报告基团,3’端均使用mgb荧光淬灭基团。
18.本发明中,针对prrsv、prv、csfv、jev、ppv2毒株,从ncbi genbank 数据库中分别下载至少30条参考毒株的基因组序列进行对比与分析,结果发现它们分别在各自的orf6基因、ge基因、5’utr基因、3’utr基因、ns1 基因上相对保守。因此,本发明中prrsv的引物和探
针针对病毒的orf6 基因进行设计,最终选取的上游引物存在两个位点的单核苷酸多态性(snp),即242a→g(2/32)和247a→g(1/32),但是这种不保守性并非显著的,可以观察到,在32株prrsv代表毒株中碱基a在这两个位点上是绝对优势的存在,理论上其出现的频率或者概率是非常高的。pprsv下游引物非常保守,而探针上存在三个位点的单核苷酸多态性,即259g→
t
(1/32)、270
t
→c(12/32)、 273a→g(3/32),其中,鉴于第270位具有较为明显的不保守碱基特征,将其设计为t和c的简并碱基y。prv的引物和探针针对病毒的ge基因进行设计,最终选取的上、下游引物以及探针均很保守。csfv的引物和探针针对病毒的5’utr基因进行设计,最终选取的上、下游引物以及探针上各存在 1~2单核苷酸多态性位点,其中,位于探针5’端的第二个碱基具有明显的多样性,将其设计成c和t的简并碱基y。jev的引物和探针针对病毒的3’utr 基因进行设计,最终选取的上游引物和下游引物存在1~2单核苷酸多态性位点,探针非常保守。ppv2的引物和探针针对病毒的ns1基因进行设计,最终选取的上游引物高度保守,下游引物和探针存在1~2单核苷酸多态性位点。本发明中所有的探针5’端分别用fam荧光报告基团标记,3’端均标记mgb 荧光淬灭基团标记。据此建立的荧光iipcr方法可同时鉴别诊断prrsv、 prv、csfv、jev、ppv2。
19.选取prrsv、prv、csfv、jev、ppv2部分基因组参考序列比对及引物、探针设计位置如下:
20.[0021][0022]
[0023][0024][0025]
本发明还提供所述快速鉴别猪繁殖障碍症候群病原的iipcr试剂盒的使用方法,包括如下步骤:
[0026]
步骤一、取试剂盒中的iipcr扩增液分装至iipcr反应管中,瞬时离心;
[0027]
步骤二、取待检样品加入到步骤一准备好的iipcr反应管中,瞬时离心后置入iipcr仪器;
[0028]
步骤三、选择520nm单通道荧光波长进行检测,待iipcr仪器反应结束后,读取判定结果。
[0029]
所述iipcr仪器采用手持式pockit tm micro duo核酸分析仪。
[0030]
本发明的有益效果:本发明针对临床中猪的心、肝、脾、肺、肾、淋巴结等病理组织
样品,只需粗提核酸,便可直接作为iipcr模板。本发明的试剂盒能够针对“猪群繁殖障碍性疾病”展开快速、精准地鉴别诊断,只需42 分钟便可鉴别诊断出样本中是否含有prrsv、prv、csfv、jev和ppv2,为猪群病毒性腹泻类疾病的现场监测、防控提供有力的技术支持,具有重要的临床实用价值和很好的应用前景。
具体实施方式
[0031]
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,对本发明进一步详细说明。
[0032]
需要说明的是,除非另外定义,本发明实施例使用的技术术语或者科学术语应当为本公开所属领域内具有一般技能的人士所理解的通常意义。本公开中使用的“第一”、“第二”以及类似的词语并不表示任何顺序、数量或者重要性,而只是用来区分不同的组成部分。“包括”或者“包含”等类似的词语意指出现该词前面的元件或者物件涵盖出现在该词后面列举的元件或者物件及其等同,而不排除其他元件或者物件。
[0033]
1.prrsv、prv、csfv、jev和ppv2荧光pcr引物、探针组合设计
[0034]
1.1引物、探针设计
[0035]
针对prrsv、prv、csfv、jev和ppv2各选取至少30条基因序列(附录1~5),通过比对找到各自最保守的区域分别为orf6基因、ge基因、5’utr 基因、3’utr基因和ns1基因,借助beacon designer 7.9软件,基于这些靶标基因设计出的引物和探针,可有效地涵盖国内绝大多数基因亚型或者谱系的流行毒株,具有广泛的通用性,序列信息如表1(seq id no.1-12)。
[0036]
表1实时pcr引物/探针设计序列
[0037][0038]
其中:f代表上游引物;p代表探针;r代表下游引物。
[0039]
1.2iipcr方法的反应体系优化
[0040]
本实施例通过多组份微量组合技术工艺将试剂盒原有多种化学试剂及酶类混合成iipcr扩增液,来实现试剂盒检测使用的便捷性和敏感性,经优化的反应体系如下:
[0041][0042][0043]
1.3结果描述及判定
[0044]
阳性对照检测为阳性,阴性对照检测为阴性,需要在实验中同时成立,否则本次实验无效,需重新检测。仪器在检测结束时自动显示样品的检测结果,被检测样品在仪器中对应的检测控中可分别显示:prrsv阳性(+)或者阴性(-)、prv阳性(+)或者阴性(-)、csfv阳性(+)或者阴性(-)、jev阳性(+)或者阴性(-)、ppv2阳性(+)或者阴性(-),这些结果之间相互组合,共可能出现二十五种不同结果。
[0045]
2.iipcr引物探针组合的筛选
[0046]
针对pprsv orf6基因、prv ge基因、csfv 5’utr基因、jev 3’utr 基因、ppv2 ns1基因各设计2组引物,并与各自唯一的特异性探针进行组合,其中,2组引物分别为a组和b组,其中a组采用如上表1中的引物组, b组的引物组如下,应用荧光定量pcr方法对上述引物探针组合进行验证。 b组引物(seq id no.16-25所示),具体如下:
[0047]
prrsv-f2:tag gcc gca agt aca ttc
[0048]
prrsv-r2:tgc gtg gtt atc att tgc
[0049]
prv-f2:cct tcg tga tga cgt gcg
[0050]
prv-r2:cgt agt agt cct cgt gcg
[0051]
csfv-f2:ggt cta agt cct gag tac a
[0052]
csfv-r2:ggg tta agg tgt gtc ttg
[0053]
jev-f2:aca cct ggg aat aga ctg
[0054]
jev-r2:ctc acc acc agc tac ata
[0055]
ppv2-f2:gag aga atc tac cac ttt c
[0056]
ppv2-r2:tcc tca tct caa agt aca a
[0057]
3.iipcr反应方法的建立
[0058]
1)iipcr反应体系配置
[0059]
取适量专用iipcr反应管,使用窄口枪头对iipcr扩增液进行分装,分装完后瞬时离心。
[0060]
2)加样
[0061]
向上述iipcr反应管中加入事先提取好的样本(猪心、肝、脾、肺、肾、淋巴结等病理组织)核酸2μl,盖紧管盖,瞬时离心,放置iipcr仪器中,iipcr 仪器使用的是中国台湾地区瑞基海洋生物科技股份有限公司开发的手持式 pockit
tm micro duo核酸分析仪。
[0062]
3)上机扩增
[0063]
使用热对流pcr仪,选择520nm单通道荧光波长进行检测,待iipcr 仪器反应结束后可直接读取判定结果。
[0064]
4)结果
[0065]
上述条件和参数可有效扩增阳性样品。
[0066]
4.prrsv、prv、csfv、jev、ppv2鉴别诊断iipcr试剂盒的设置
[0067]
试剂盒包括针对这五种病原独立配置的iipcr扩增液、阳性对照和阴性对照。其中iipcr扩增液如上述1.2,阳性对照为进行灭活处理过的prrsv、 prv、csfv、jev、ppv2病毒液(1
×
106tcid
50
/ml),阴性对照为 nuclease-free水。
[0068]
该试剂盒适用于猪心、肝、脾、肺、肾、淋巴结等病理组织样品的prrsv、 prv、csfv、jev、ppv2的核酸检测。
[0069]
附录1:用于本发明pcr引物和探针设计的prrsv靶基因序列(共32条参考毒株,除 vr2332为国外疫苗株,其余均为中国本土猪群中分离的毒株)
[0070][0071]
附录2:用于本发明pcr引物和探针设计的prv靶基因序列(共36条参考毒株,均为中国本土猪群中分离的毒株)
[0072][0073][0074]
附录3:用于本发明pcr引物和探针设计的csfv靶基因序列(共30条参考毒株,均为中国本土猪群中分离的毒株)
[0075][0076]
附录4:用于本发明pcr引物和探针设计的jev靶基因序列(共30条参考毒株,均为中国本土猪群中分离的毒株)
[0077][0078][0079]
附录5:用于本发明pcr引物和探针设计的ppv2靶基因序列(共30条参考毒株,均为中国本土分离毒株)
[0080][0081]
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。
[0082]
本发明的实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进
等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1