优化的人凝血因子IX基因表达盒及其应用
优化的人凝血因子ix基因表达盒及其应用
1.优先权声明
2.本技术要求于2017年5月31日提交的美国临时申请第62/512,833号的权益,其全部内容通过引用并入本文。
技术领域
3.本发明涉及用于在受试者的肝脏中生成多肽和功能性核酸的合成肝脏特异性启动子和表达构建体。本发明还涉及编码因子ix(factor ix)蛋白的优化的多核苷酸序列、包含所述优化的多核苷酸序列的载体以及使用这些组合物以治疗出血性疾病的方法。
背景技术:
4.通过加速因子x转化为因子xa,因子ix(fix)在凝血级联中起关键作用。fix活性不足是出血性疾病血友病b的原因。血友病b的现有治疗方法是静脉输注血浆来源或重组的fix蛋白。尽管这种治疗在控制出血事件方面很有效,但是由于fix半衰期短(8-12小时),进行频繁输注使该方法自身成本高昂。基因疗法已经成为最终治愈这种疾病的有吸引力的策略。然而,由于fix表达水平不足,因此使用最有前景的病毒载体之一腺病毒伴随病毒(adeno-associated virus)(aav)递送fix基因的进展不太理想。
5.通过提供适于在aav载体上使用的的短的合成肝脏特异性启动子和表达构建体,本发明克服了在该领域的不足之处。本发明还提供了能够生成在延长的时间段内具有超生理学水平的fix的优化的fix编码序列以及其在治疗出血性疾病的方法中的用途。
技术实现要素:
6.本发明部分基于长度小于200个碱基对的合成的肝脏特异性启动子的开发。所述启动子可以用于以肝特异性方式(尤其是使用aav载体)生成多肽和功能性核酸,所述多肽和功能性核酸具有严格的长度限制并具有短而强的启动子的可用性的有益效果。
7.本发明还部分基于开发了能够生成在延长的时间段内具有超生理学水平的fix的优化的fix编码序列。
8.在一个方面,本发明涉及包含合成的肝脏特异性启动子的多核苷酸,其中启动子包含核苷酸序列seq id no:1或与其具有至少90%同一性的序列。
9.在另一方面,本发明涉及编码人凝血因子ix的多核苷酸序列,该序列已进行了密码子优化以在人体中表达。
10.在另一方面,本发明涉及包含本发明的多核苷酸的载体、细胞和/或转基因动物。
11.在又一方面,本发明涉及在受试者的肝脏中生成多肽或功能性核酸的方法,包括向受试者递送本发明的多核苷酸、载体和/或转化的细胞,从而在受试者的肝脏中生成多肽或功能性核酸。
12.在另一方面,本发明涉及治疗受试者的血友病b的方法,包括向受试者递送治疗有效量的本发明的多核苷酸、载体和/或转化的细胞,从而治疗受试者的血友病b。
13.在另一方面,本发明涉及提高受试者因子ix多肽的生物利用度的方法,包括向受试者递送有效量的本发明的多核苷酸、载体和/或转化的细胞,从而提高受试者的因子ix多肽的生物利用度。
14.在又一方面,本发明涉及本发明的多核苷酸、载体和/或转化的细胞在用于在受试者的肝脏中生成多肽或功能性核酸的方法中的用途。
15.在另一方面,本发明涉及本发明的多核苷酸、载体和/或转化的细胞在用于治疗受试者的血友病b的方法中的用途。
16.在另一方面,本发明涉及本发明的多核苷酸、载体和/或转化的细胞在用于提高受试者的因子ix多肽的生物利用度的方法中的用途。
17.在又一方面,本发明涉及本发明的多核苷酸、载体和/或转化的细胞在用于制备在受试者的肝脏中生成多肽或功能性核酸的药物中的用途。
18.在另一方面,本发明涉及本发明的多核苷酸、载体和/或转化的细胞在用于制备治疗受试者的血友病b的药物中的用途。
19.在另一方面,本发明涉及本发明的多核苷酸、载体和/或转化的细胞在用于制备提高受试者的因子ix多肽的生物利用度的药物中的用途。
20.本发明的这些方面和其他方面将在下文中进行更详细地阐述。
附图说明
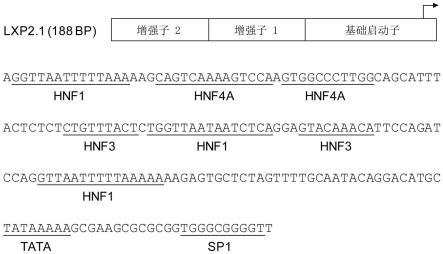
21.图1示出了lxp2.1启动子(seq id no:1)的结构和序列。假定的肝脏看家内转录因子(putative hepatic house-keeping transcriptional factor)结合位点以下划线突出显示。
22.图2示出了优化的肝脏特异性人因子ix(fix)基因表达盒的构建过程。
23.图3示出了质粒转染48小时后在huh7细胞培养基中的fix活性。huh7肝癌细胞接种在6孔板中并用2μg fix基因表达构建体转染。24小时后改变细胞培养基,在无血清opti-mem培养基中转染48小时后收获。通过aptt测试来测量fix活性,用纯化的正常fix蛋白作为参照标准。wt fix基因表达构建体含有原始的人fix cdna,所述人fix cdna没有被密码子优化但含有r338l突变。opti-fix-1、2、3基因表达构建体全都含有r338l突变,但具有不同的人密码子优化算法,如实施例1中所描述的。
24.图4示出了在fix基因ko小鼠模型中aav8-lxp2.1-opti-fix-1载体剂量递增后强力且长期的因子ix表达和凝血活性分析。
具体实施方式
25.现在参考附图更详细地描述本发明,在附图中示出了本发明的优选实施方案。然而,本发明可以以不同的形式实施并且不应该被解释为限于本文所阐述的实施方案。相反,提供这些实施方案是为了使本发明的公开深入和完整,并将本发明的范围向本领域技术人员完整地表述出来。
26.除非上下文另有说明,否则很明显地,本文所述的本发明的各个特征可以以任何组合使用。此外,本发明还考虑在本发明的一些实施方案中可以排除或省略本文阐述的任何特征或特征的组合。为了说明,如果说明书声明复合体包含组分a、b和c,则明显地是指a、
b或c中的任何一个或其组合可以单独或以任何组合形式被省略和放弃。
27.除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解所相同的含义。在本发明的描述中使用的术语仅是用于描述特定实施方案的目的,而不旨在限制本发明。
28.除非另外特别说明,否则在本文中的核苷酸序列仅以单链表示,在5'至3'方向,从左至右。本文中核苷酸和氨基酸以iupac-iub生物化学命名委员会(iupac-iub biochemical nomenclature commission)推荐的方式表示,或(对于氨基酸)通过单字母密码或三字母密码表示,均与37c.f.r.
§
1.822和已建立的用法一致。
29.除非另外说明,否则本领域技术人员已知的标准方法可用于克隆基因、扩增和检测核酸等。这些技术是本领域技术人员已知的。参见,例如sambrook等人,molecular cloning:a laboratory manual 2nd ed.(冷泉港实验室(cold spring harbor),纽约(ny),1989);ausubel等人,current protocols in molecular biology(绿色出版协会公司(green publishing associates,inc.)和约翰威立公司(john wiley&sons,inc.),纽约(new york))。
30.定义
31.除非上下文另外明确说明,否则在本发明的说明书和所附权利要求中使用的单数形式“a(一)”、“an(一)”和“the(所述)”旨在也包括复数形式。
32.同样,本文使用的“和/或”意思为且涵盖一个或多个相关所列项目的任何和所有可能的组合,以及当以择一选择(“或”)的方式解释时不包括组合。
33.当涉及可测量的值时,例如多肽的量、剂量、时间、温度、酶活性或其他生物活性等,本文所用的术语“约”是指涵盖特定量的
±
10%、
±
5%、
±
1%、
±
0.5%甚至
±
0.1%的变化。
34.连接词“基本上由...组成”是指权利要求的范围被解释为涵盖权利要求中的具体材料或步骤以及那些实质上不影响所要求保护的发明的基本的和新颖的特征。
35.当用于本发明的多核苷酸或多肽序列时,术语“基本上由...组成”(及语法变形)是指多核苷酸或多肽由列举的序列(例如seq id no)和在所述列举的序列的5'和/或3'或n-端和/或c-端上总数为10或更少(例如1、2、3、4、5、6、7、8、9或10个)的额外的核苷酸或氨基酸组成,使得多核苷酸或多肽的功能不发生实质性改变。总数为10或更少的额外的核苷酸或氨基酸包括两端的额外核苷酸或氨基酸加在一起的总数。用于本发明的多核苷酸的术语“实质性改变”是指,与由列举的序列组成的多核苷酸的表达水平相比,表达编码的多肽的能力增加或降低至少约50%或更多。用于本发明的多肽的术语“实质性改变”是指,与由列举的序列组成的多肽的活性相比,凝血刺激活性增加或降低至少约50%或更多。
36.本文所用的术语“增强(enhance)”或“提高(increase)”或其语法变形是指具体的参数增加至少约1.25倍、1.5倍、2倍、3倍、4倍、5倍、6倍、8倍、10倍、12倍,或者甚至15倍。
37.本文所用的术语“抑制(inbibit)”或“降低(reduce)”或其语法变形是指具体的水平或活性降低或减少至少约15%、25%、35%、40%、50%、60%、75%、80%、90%、95%或更多。在具体的实施方案中,抑制或减少导致很少或基本上不可检测的活性(最多为些微的量,例如少于约10%或甚至5%)。
38.本文使用的“有效”量是提供期望的效果的量。
39.本文所用的“治疗有效”量是为受试者提供一些改善或益处的量。换句话说,“治疗有效”量是为受试者的至少一种临床症状提供一些减轻、缓解或减少的量。本领域技术人员应理解,只要向受试者提供一些益处,治疗效果不需要是完整的或治愈的。
40.本文所用的“预防有效”量是足以预防(如本文所定义的)受试者的疾病、病症和/或临床症状的量。本领域技术人员应理解,只要向受试者提供一些益处,预防水平不需要是完整的。
41.通过本发明的方法治疗出血性疾病的功效可以通过检测由受试者的症状和/或临床参数的变化指示的临床改善来确定,这对于本领域技术人员而言是已知的。
42.术语“治疗(treat)”、“治疗(treating)”或“治疗(treatment)”是指在降低或至少部分改善或改良受试者病症的严重程度,并且是指减轻或减少至少一种临床症状得以实现。
43.术语“预防(prevent)”、“预防(preventing)”和“预防((prevention)”(及其语法变形)是指相对于疾病、病症和/或临床症状发作前不进行本发明的方法,发作后减少或延迟疾病、病症和/或临床症状的严重程度。就血友病b而言,“预防”是指出血事件的发生次数和/或严重程度低于没有预防性治疗时发生的出血事件的次数和/或严重程度。
44.本文所用的“核酸”、“核苷酸序列”和“多核苷酸”可互换使用并涵盖rna和dna,包括cdna、基因组dna、mrna、合成的(例如化学合成的)dna或rna以及rna和dna的嵌合体。术语多核苷酸、核苷酸序列或核酸是指核苷酸链而不考虑链的长度。核酸可以是双链或单链。在单链情况下,核酸可以是有义链(sense strand)或反义链(antisense strand)。可以使用寡核苷酸类似物或衍生物(例如肌苷或硫代磷酸核苷酸)来合成核酸。例如,可以使用这样的寡核苷酸来制备具有改变的碱基配对能力或对核酸酶增加的抗性的核酸。本发明还提供了为本发明的核酸、核苷酸序列或多核苷酸的互补体(其可以是完全互补体或部分补补体)的核酸。
[0045]“分离的多核苷酸”是一核苷酸序列(例如dna或rna),其没有直接与其在所来源的生物体的天然存在的基因组中直接连接的核苷酸序列(一个在5'末端和一个在3'末端)相连接。因此,在一个实施方案中,分离的核酸包括与编码的序列直接连接的一些或所有的5'非编码(例如,启动子)序列。因此,该术语包括例如掺入载体、掺入自主复制的质粒或病毒,或掺入原核生物或真核生物的基因组dna中的重组dna,或者独立于其他序列以单独的分子存在的(例如通过pcr或限制性内切核酸酶处理生成的cdna或基因组dna片段)的重组dna。该术语也包括作为编码其他多肽或肽序列的杂交核酸的一部分的重组dna。包含基因的分离的多核苷酸不是包含此基因的染色体片段,而是包含与基因相关的编码区和调控区,但在染色体上没有天然存在的其他基因。
[0046]
用于多核苷酸的术语“片段”应理解为是指相对于参考核酸或参考核苷酸序列长度减少的核苷酸序列,并且包括与参考核酸或参考核苷酸序列相同或几乎相同(例如,90%、92%、95%、98%、99%同一性)的连续的核苷酸的核苷酸序列,基本上由和/或由与参考核酸或参考核苷酸序列相同或几乎相同(例如,90%、92%、95%、98%、99%同一性)的连续的核苷酸的核苷酸序列组成。如果合适,根据本发明的这种核酸片段可以包括在其作为组分的更大的多核苷酸中。在一些实施方案中,这种片段可以包括下述寡核苷酸,基本上由和/或由下述寡核苷酸组成:所述寡核苷酸具有的长度为根据本发明的核酸或核苷酸序列
的至少约8、10、12、15、20、25、30、35、40、45、50、75、100、150、200或更多个连续的核苷酸。
[0047]
术语“分离的”可以指基本上不含细胞材料、病毒材料和/或培养基(当通过重组dna技术生成时)或化学前体或其他化学品(当化学合成时)的核酸、核苷酸序列或多肽。此外,“分离的片段”是核酸、核苷酸序列或多肽的片段,所述核酸、核苷酸序列或多肽不是以片段天然存在并且发现为非天然状态。“分离的”并不意味着该制剂在技术上是纯的(均质的),而是其足够纯以提供可用于预期目的的多肽或核酸形式。
[0048]
用于多肽的术语“片段”应理解为是指相对于参考多肽或参考氨基酸序列长度减少的氨基酸序列,并且包括与参考多肽或参考氨基酸序列相同或几乎相同(例如,90%、92%、95%、98%、99%同一性)的连续的氨基酸的氨基酸序列,基本上由和/或由与参考多肽或参考氨基酸序列相同或几乎相同(例如,90%、92%、95%、98%、99%同一性)的连续的氨基酸的氨基酸序列组成。如果合适,根据本发明的这种多肽片段可以包括在其作为组分的更大的多肽中。在一些实施方案中,这种片段可以包括以下肽,基本上由和/或由以下肽组成,所述肽具有的长度为根据本发明的多肽或氨基酸序列的至少约4、6、8、10、12、15、20、25、30、35、40、45、50、75、100、150、200或更多个连续的氨基酸。
[0049]“载体”是用于将核酸克隆和/或转移到细胞中的任何核酸分子。载体可以是连接有另一个核苷酸序列的复制子,以允许连接的核苷酸序列的复制。“复制子”可以是任何遗传元件(例如,质粒、噬菌体、粘粒、染色体、病毒基因组),所述遗传元件在体内作为核酸复制的自主单元,即能够在其自身控制下进行复制。术语“载体”包括用于在体外、离体和/或体内将核酸引入细胞的病毒和非病毒(例如质粒)核酸分子。可以使用本领域已知的许多载体来操纵核酸,将响应元件和启动子整合到基因中等。例如,通过将适当的核酸片段连接到具有互补的粘性末端的选择的载体中,可以实现将对应于响应元件和启动子的核酸片段插入合适的载体中。或者,核酸分子的末端可以被酶促修饰,或者可以通过将核苷酸序列(连接体(linker))连接到核酸末端来生成任何位点。可以将这种载体工程化以包含编码选择性标记物的序列,所述选择性标记物用于选择包含载体和/或将载体的核酸整合到细胞基因组中的细胞。这种标记物实现对掺入并表达由标记物编码的蛋白质的宿主细胞的鉴定和/或选择。“重组”载体是指包含一个或多个异源核苷酸序列(即转基因)的病毒或非病毒载体,例如2、3、4、5或更多个异源核苷酸序列。
[0050]
病毒载体已经用于细胞以及活体动物受试者中的各种基因递送应用。可以使用的病毒载体包括但不限于逆转录病毒、慢病毒、腺病毒伴随病毒、痘病毒、α病毒、杆状病毒、牛痘病毒、疱疹病毒、埃-巴二氏病毒和腺病毒载体。非病毒载体包括质粒、脂质体、带电脂质(细胞转染剂)、核酸-蛋白质复合物和生物聚合物。除了目标核酸外,载体还可以包含一个或多个调控区,和/或选择性标记物,所述选择性标记物用于选择、测量和监测核酸转移结果(递送至特定组织、表达持续时间等)。
[0051]
可以通过本领域已知的方法将载体引入所需的细胞中,例如转染、电穿孔、显微注射、转导、细胞融合、deae葡聚糖、磷酸钙沉淀、脂转染(溶酶体融合)、使用基因枪或核酸载体转运蛋白(参见,例如wu等人,j.biol.chem.267:963(1992);wu等人,j.biol.chem.263:14621(1988);和hartmut等人于1990年3月15日提交的加拿大专利申请第2,012,311号)。在各个实施方案中,其他分子可以用于在体内促进核酸的递送,例如阳离子寡肽(例如wo95/21931)、来自核酸结合蛋白的肽(例如wo96/25508)和/或阳离子聚合物(例如wo95/21931)。
也可以在体内引入载体作为裸核酸(参见美国专利5,693,622、5,589,466和5,580,859)。还可以使用受体-介导的核酸递送方法(curiel等人,hum.gene ther.3:147(1992);wu等人,j.biol.chem.262:4429(1987))。
[0052]
除非另有说明,否则本文所用的术语“蛋白质”和“多肽”可互换使用并且涵盖肽和蛋白质两者。
[0053]“融合蛋白”是当编码两种(或多种)不同的多肽的两个异源核苷酸序列或其片段在正确的翻译阅读框中融合在一起时生成的多肽,在自然界中未发现所述异源核苷酸序列或其片段融合在一起。示例性的融合多肽包括本发明的多肽(或其片段)与谷胱甘肽-s-转移酶、麦芽糖-结合蛋白或报告蛋白(例如绿色荧光蛋白、β-葡萄糖醛酸酶、β-半乳糖苷酶、萤光素酶等)、血凝素、c-myc、flag表位等的全部或部分融合。
[0054]
本文所用的“功能性”多肽或“功能性片段”是基本上保留了与该多肽正常相关的至少一种生物学活性(例如,酶活性、蛋白质结合、配体或受体结合)的多肽或片段。在具体的实施方案中,“功能性”多肽或“功能性片段”基本上保留了未修饰的肽所具有的全部活性。“基本上保留”生物活性是指多肽保留了天然多肽至少约20%、30%、40%、50%、60%、75%、85%、90%、95%、97%、98%、99%或更多的生物活性(甚至可以具有比天然多肽更高水平的活性)。“非功能性”多肽是表现出很少或基本上不具有与该多肽正常相关的可检测的生物活性的多肽(例如,仅具有些微的量,例如少于约10%或甚至5%)。可以使用本领域已知以及本文所述的分析方法来测量生物活性(例如蛋白质结合和酶活性)。
[0055]
术语多核苷酸编码序列的“表达(express)”或“表达(expression)”是指该序列被转录,并且任选地被翻译。通常,根据本发明,本发明的编码序列的表达将导致生成本发明的多肽。整个表达的多肽或片段也可以在完整的细胞中发挥功能而无需纯化。
[0056]
本发明中的术语“腺病毒伴随病毒”(aav)包括但不限于aav 1型、aav 2型、aav 3型(包括3a型和3b型)、aav 4型、aav 5型、aav 6型、aav 7型、aav 8型、aav 9型、aav 10型、aav 11型、aav12、禽类aav、牛aav、犬aav、马aav和羊aav以及现在已知或以后发现的任何其他aav。参见,例如bernard n.fields等人,virology,第2卷,第69章(第4版,lippincott-raven publishers)。已经鉴别出了许多其他的aav血清型和分化枝(参见,例如gao等人,(2004)j.virol.78:6381-6388和表1),其也被术语“aav”涵盖。
[0057]
各种aav和自主性细小病毒(autonomous parvoviruses)的基因组序列以及itr、rep蛋白和衣壳亚单元(capsid subunits)的序列是本领域已知的。这些序列可以在文献或公共数据库(例如数据库)中找到。参见,例如登记号(accession numbers)nc 002077、nc 001401、nc 001729、nc 001863、nc 001829、nc 001862、nc 000883、nc 001701、nc 001510、af063497、u89790、af043303、af028705、af028704、j02275、j01901、j02275、x01457、af288061、ah009962、ay028226、ay028223、nc 001358、nc 001540、af513851、af513852、ay530579、ay631965、ay631966;其公开的内容全部并入本文。还参见,例如srivistava等人,(1983)j.virol.45:555;chiorini等人,(1998)j.virol.71:6823;chiorini等人,(1999)j.virol.73:1309;bantel-schaal等人,(1999)j.virol.73:939;xiao等人,(1999)j.virol.73:3994;muramatsu等人,(1996)virology 221:208;shade等人,(1986)j.virol.58:921;gao等人,(2002)proc.nat.acad.sci.usa 99:11854;国际专利公开wo00/28061、wo 99/61601、wo 98/11244;美国专利第6,156,303号;其公开的内容全部
并入本文。还参见表1。aav1、aav2和aav3末端重复序列的早期描述由xiao,x.(1996),“characterization of adeno associated virus(aav)dna replication and integration,”博士学位论文(宾夕法尼亚州匹兹堡大学,宾夕法尼亚州匹兹堡)提供,其全文并入本文。
[0058]“重组aav载体基因组”或“raav基因组”是包含至少一个反向末端重复(例如,一个、两个或三个反向末端重复)和一个或多个异源核苷酸序列的aav基因组(即vdna)。raav载体通常保持顺式的145个碱基末端重复(tr),以生成病毒;然而,包括部分或完全合成的序列的修饰aav tr和非-aav tr也可以用于该目的。所有其他病毒序列是可有可无的并且可以以反式供应(muzyczka,(1992)curr.topics microbiol.immunol.158:97)。raav载体任选地包含两个tr(例如,aav tr),所述tr一般位于异源核苷酸序列的5'和3'端,但不必与其连接。tr可以彼此相同或不同。载体基因组在3'或5'端也可以包含单个itr。
[0059]
术语“末端重复”或“tr”包括形成发夹结构并充当反向末端重复(即,介导所需的功能,例如复制、病毒包装、整合和/或前病毒拯救(provirus rescue)等)的任何病毒末端重复或合成序列。tr可以是aav tr或非-aav tr。例如,非-aav tr序列,例如其他细小病毒(例如犬细小病毒(cpv)、鼠细小病毒(mvm)、人细小病毒b-19)的非-aav tr序列或作为sv40复制起点的sv40发夹,可以用作tr,其可以通过截短、取代、缺失、插入和/或添加进一步修饰。此外,tr可以是部分或完全合成的,例如samulski等人的美国专利第5,478,745号中所述的“双重-d序列(double-d sequence)”。
[0060]“aav末端重复”或“aav tr”可以来自任何aav,包括但不限于血清型1、2、3、4、5、6、7、8、9、10、11或12或现在已知或以后发现的任何其他aav(参见,例如表1)。aav末端重复不需要具有天然的末端重复序列(例如,可以通过插入、缺失、截短和/或错义突变来改变天然的aav tr序列),只要末端重复介导所需的功能,例如复制、病毒封装、整合和/或前病毒拯救等。
[0061]
本发明的病毒载体还可以是“靶向的”病毒载体(例如,具有定向取向)和/或“杂交的”细小病毒(即其中病毒itr和病毒衣壳来自不同的细小病毒),如国际专利公开wo 00/28004和chao等人,(2000)mol.therapy 2:619中所述。
[0062]
此外,病毒衣壳或基因组元件可以包含其他修饰,包括插入、缺失和/或取代。
[0063]
本文所用的术语“氨基酸”涵盖任何天然存在的氨基酸、其修饰形式和合成的氨基酸。
[0064]
表2示出了天然存在的左旋(l-)氨基酸。
[0065]
表1
[0066]
[0067]
[0068][0069]
表2
[0070]
[0071][0072]
或者,氨基酸可以是修饰的氨基酸残基(在表3中示出了非限制性实例)或可以是通过翻译后修饰(例如,乙酰化、酰胺化、甲酰化、羟基化、甲基化、磷酸化或硫酸化)的氨基酸。
[0073]
表3:氨基酸残基衍生物
[0074]
[0075][0076]
此外,非天然存在的氨基酸可以是“非天然(unnatural)”的氨基酸,如wang等人,(2006)annu.rev.biophys.biomol.struct.35:225-49中所述。这些非天然的氨基酸可以有利地用于将目标分子化学连接至aav衣壳蛋白。
[0077]
本文使用的术语“模板”或“底物”是指可以复制以生成细小病毒的病毒dna的多核苷酸序列。为了载体生产的目的,通常将模板嵌入到更大的核苷酸序列或构建体中,包括但不限于质粒、裸dna载体、细菌人工染色体(bac)、酵母人工染色体(yac)或病毒载体(例如腺病毒、疱疹病毒、埃-巴二氏病毒、aav、杆状病毒、逆转录病毒载体等)。或者,模板可以稳定地整合到包装细胞的染色体中。
[0078]
本文所用的细小病毒或aav“rep编码序列”是指编码细小病毒或aav非结构蛋白的核酸序列,所述细小病毒或aav非结构蛋白介导病毒复制和新病毒颗粒的生成。细小病毒和aav复制基因和蛋白已经描述在,例如fields等人,virology,第2卷,第69和70章(第4版,lippincott-raven publishers)中。
[0079]“rep编码序列”不需要编码所有的细小病毒或aav rep蛋白。例如,关于aav,rep编码序列不需要编码全部四种aav rep蛋白(rep78、rep68、rep52和rep40),事实上,认为aav5仅表达剪接的rep68和rep40蛋白。在代表性实施方案中,rep编码序列至少编码病毒基因组复制和包装成新病毒颗粒所必需的那些复制蛋白。rep编码序列通常编码至少一个大rep蛋
白(即rep78/68)和一个小rep蛋白(即rep52/40)。在具体的实施方案中,rep编码序列编码aav rep78蛋白和aav rep52和/或rep40蛋白。在其他实施方案中,rep编码序列编码rep68和rep52和/或rep40蛋白。在又一个实施方案中,rep编码序列编码rep68和rep52蛋白、rep68和rep40蛋白、rep78和rep52蛋白或rep78和rep40蛋白。
[0080]
本文所用的术语“大rep蛋白”是指rep68和/或rep78。本发明所要求保护的大rep蛋白可以是野生型或合成的。野生型大rep蛋白可以来自于任何细小病毒或aav,包括但不限于血清型1、2、3a、3b、4、5、6、7、8、9、10、11或13或现在已知或以后发现的任何其他aav(参见,例如表1)。合成的大rep蛋白可以通过插入、缺失、截短和/或错义突变进行改变。
[0081]
本领域技术人员将理解,复制蛋白不必由相同的多核苷酸编码。例如,对于mvm、ns-1和ns-2蛋白质(其是剪接变体)可以彼此独立地表达。同样,对于aav,可以使p19启动子失活,并且由一个多核苷酸表达大rep蛋白而由不同的多核苷酸表达小rep蛋白。然而,通常情况下,由单一的构建体表达复制蛋白会更方便。在一些系统中,病毒启动子(例如,aav p19启动子)可能不被细胞识别,因此有必要由独立的表达盒表达大和小rep蛋白。在其他情况下,可能需要分别表达大rep和小rep蛋白,即在独立的转录和/或翻译控制元件的控制下。例如,可能需要控制大rep蛋白的表达,从而降低大rep蛋白和小rep蛋白的比例。在昆虫细胞的例子中,下调大rep蛋白(例如rep78/68)的表达以避免对细胞的毒性是有利的(参见,例如urabe等人,(2002)human gene therapy 13:1935)。
[0082]
本文所用的细小病毒或aav“cap编码序列(cap coding sequences)”编码形成功能性细小病毒或aav衣壳的结构蛋白(即可以包装dna并感染靶细胞)。通常,cap编码序列将编码全部的细小病毒或aav衣壳亚单元,但是,只要能生成功能性衣壳,则可以编码少于全部的衣壳亚单元。通常,但不是必须地,cap编码序列将存在于单个核酸分子上。
[0083]
本文的术语“raav颗粒”和“raav病毒颗粒”可互换使用。“raav颗粒”或“raav病毒颗粒”包含包装在aav衣壳内的raav载体基因组。
[0084]
在bernard n.fields等人,virology,第2卷,第69和70章(第4版,lippincott-raven publishers)中更详细地描述了aav衣壳结构。
[0085]
术语“药物动力学性质”具有其通常和惯用的含义,并且指fix蛋白的吸收、分布、代谢和排泄。
[0086]“生物利用度”通常和惯用的含义是到达体循环的生物活性药物的给药剂量的分数或量。在本发明的实施方案的内容中,术语“生物利用度”包括通常的和惯用的含义,但是还认为其具有更广泛的含义,以包括fix蛋白具有生物活性的程度。例如,在fix的情况下,“生物利用度”的一种度量方式是输注后在循环中获得的fix蛋白的促凝血活性。
[0087]“翻译后修饰”具有其通常和惯用的含义,并且包括但不限于去除前导序列、谷氨酸残基的γ-羧酸化、天冬氨酸残基的β-羟基化、天冬酰胺残基的n-连接糖基化、丝氨酸和/或苏氨酸残基的o-连接糖基化、酪氨酸残基的硫酸化、丝氨酸残基的磷酸化及其任意组合。
[0088]
本文所用的“生物活性”是参照来自例如人血浆或重组生成的标准来确定的。对于fix,标准可以是(辉瑞(pfizer))或(杰特贝林(csl behring))。标准的生物活性被认为是100%。
[0089]
本文所用的术语“因子ix蛋白”或“fix蛋白”包括野生型fix蛋白以及天然存在的或人造的蛋白。本发明的fix蛋白还可以包括文献中已知的fix的突变形式(例如padua突
变)。本发明的fix蛋白还包括现在已知或以后鉴定的任何其他天然存在的人fix蛋白或人造的fix蛋白及其衍生物和活性片段/活性结构域,如本领域已知的那些。
[0090]
来自多种哺乳动物物种的fix的氨基酸序列可以从序列数据库(例如genbank)获得。fix序列的示例见下表。
[0091]
物种genbank登记号智人aab59620.1家猫aar26346.1小家鼠np_032005.1野猪np_001157475.1狗aaa75006.1褐家鼠np_113728.1猕猴np_001103153.1
[0092]
本发明的fix蛋白还包括药理活性形式的fix,所述药理活性形式的fix是已经去除了信号肽并且已经通过蛋白酶的作用切割了蛋白质(或者通过在核酸水平上除去蛋白质而将其设计出来)的分子,生成通过二硫键连接的两个非连续的多肽链。
[0093]
人fix蛋白的氨基酸序列是本领域中已知的,并且可以在例如genbank登记号aab59620.1中找到。人fix蛋白长461个氨基酸,并且由信号肽(残基1-46)、gla结构域(残基28-92)、egf结构域(残基93-129)和胰蛋白酶结构域(残基226-454)组成。
[0094]
术语“半衰期”是一个广义的术语,其包括通常和惯用的含义以及在fix的科学文献中发现的通常和惯用的含义。该定义中具体包括与fix相关的参数的测量,其限定了从输注时测量的初始值减小至初始值的一半的输注后时间。在一些实施方案中,在各种免疫分析中使用针对fix的抗体,可以在血液和/或血液成分中测量fix的半衰期,如本领域已知并且如本文所述。或者,使用包括标准凝血分析的功能测定法,可以以fix活性的降低来测量半衰期,如本领域已知并且如本文所述。
[0095]
本文所用的术语“恢复”包括通过任何可接受的方法测量的fix的量,所述方法包括但不限于fix抗原水平或fix蛋白酶或凝血活性水平,其在去除生物样品(例如血液或血液制品样品)的最早的实际时间在受体动物或人受试者中检测到(例如,在循环中),以在其输注、注射、递送或施用等之后测量fix的水平。按照目前的方法,用于测量fix恢复的最早的生物学采样时间通常落在fix的输注、注射或递送/施用等后的前15分钟内,但随着科学和/或临床技术的改进,期待更快的采样时间是合理的。本质上,本文中fix的恢复值是指代表在输注、注射或其他方式递送至受体动物或患者后,在尽可能早的时间点可以在受体(例如,在循环中)中测量的输注、注射或以其他方式递送/施用的fix的最大分数。
[0096]
本文所用的“转化的”细胞是已经用编码本发明的fix蛋白的核酸分子转化、转导和/或转染的细胞,包括但不限于使用重组dna技术构建的fix蛋白载体。
[0097]
本文所用的术语“出血性疾病”反映了出血时表现出的任何有缺陷的、先天性的、获得性的或诱导性的细胞、生理或分子来源。示例是凝血因子缺乏症(例如,血友病a和b或凝血因子xi、vii、viii或ix缺乏症)、凝血因子抑制剂、血小板功能缺陷、血小板减少症、血管性血友病或由手术或创伤引起的出血。
[0098]
过量出血也在血液凝结级联正常(无凝血因子缺陷或对任何凝血因子的抑制剂)
的受试者中出现,可能是由血小板功能缺陷、血小板减少症或血管性血友病引起的。在这种情况下,出血可能与血友病引起的出血相似,因为止血系统(如在血友病中)缺乏或具有异常的基本凝血“化合物”(如血小板或血管性血友病因子蛋白),导致严重出血。在受到与手术或创伤相关的大面积组织损伤的受试者中,正常止血机制可能被即刻止血的需求所压制,并且尽管具有正常的止血机制,但受试者可能发生出血。由于手术止血的可能性有限,当器官(例如大脑、内耳区域和眼睛)出血时,实现令人满意的止血效果也是一个问题。在各种器官(肝、肺、肿瘤组织、胃肠道)进行活组织检查的过程中以及在腹腔镜手术中可能会出现同样的问题。所有这些情况的共同之处在于,难以通过手术技术(缝合线、夹子等)提供止血,当出血是弥漫性(出血性胃炎和大量子宫出血)时也是如此。抗凝治疗的受试者也可能出现急性和大量出血,其中给予受试者的治疗导致止血不足。如果抗凝效果必须被迅速消除,则这些受试者可能需要手术干预。耻骨后前列腺根治切除术是常用于局部性前列腺癌患者的手术。由于明显且偶尔出现的大量失血,该手术常常变得复杂。在前列腺切除术过程中,相当多的失血主要与复杂的解剖情况有关,各种密集的血管化部位不易通过手术止血,并且可能导致大面积弥漫性出血。此外,脑内出血是中风最不可治愈的形式,并且与脑内出血后前几个小时内的高死亡率和血肿生长相关。在止血效果不佳的情况下,可能导致问题的另一种情况是具有正常止血机制的受试者接受抗凝血剂疗法以预防血栓栓塞性疾病的时候。这种治疗可以包括肝素、其他形式的蛋白聚糖、华法令阻凝剂(warfarin)或其他形式的维生素k拮抗剂以及阿司匹林和其他血小板聚集抑制剂。
[0099]
在本发明的一个实施方案中,出血与血友病有关。在另一个实施方案中,出血与带有获得性抑制抗体的血友病相关。在另一个实施方案中,出血与血小板减少症有关。在另一个实施方案中,出血与血管性血友病有关。在另一个实施方案中,出血与严重的组织损伤相关。在另一个实施方案中,出血与严重的创伤相关。在另一个实施方案中,出血与手术相关。在另一个实施方案中,出血与腹腔镜手术相关。在另一个实施方案中,出血与出血性胃炎相关。在另一个实施方案中,出血是大量子宫出血。在另一个实施方案中,出血发生在机械止血可能性有限的器官中。在另一个实施方案中,出血发生在大脑、内耳区域或眼睛中。在另一个实施方案中,出血与进行活组织检查的过程相关。在另一个实施方案中,出血与抗凝血剂疗法相关。
[0100]
本发明的“受试者”包括具有或易患出血性疾病或出血性病症的任何动物,其需要和/或期望控制出血,通过向受试者施用fix来治疗、改善或预防出血性疾病或出血性病症,(例如血友病b和获得性fix缺乏症(例如,由于针对fix或血液恶性肿瘤的自身抗体))。这样的受试者通常是哺乳动物受试者(例如实验室动物,如大鼠、小鼠、豚鼠、兔、灵长类动物等)、农场或商品化动物(例如牛、马、山羊、驴、绵羊等)或家畜(例如猫、狗、雪貂等)。在具体的实施方案中,受试者是灵长类动物受试者、非人灵长类动物受试者(例如黑猩猩、狒狒、猴子、大猩猩等)或人。本发明的受试者可以是已知或认为有出血性疾病或出血性病症风险中而需要和/或期望控制的受试者。或者,根据本发明的受试者也可以包括先前未知或怀疑患有出血性疾病或出血性病症的风险而需要或期望控制的受试者。作为进一步的选择,受试者可以是实验室动物和/或动物疾病模型。
[0101]
受试者包括任何年龄的男性和/或女性,包括新生儿、青少年、青年和老年受试者。关于人受试者,在代表性实施方案中,受试者可以是婴儿(例如,小于约12个月、10个月、9个
月、8个月、7个月、6个月或更小)、幼儿(例如,至少约12、18或24个月和/或小于约36、30或24个月)或儿童(例如,至少约1、2、3、4或5岁和/或小于约14、12、10、8、7、6、5或4岁)。在本发明的实施方案中,受试者是人受试者,其为约0至3、4、5、6、9、12、15、18、24、30、36、48或60个月的年龄,约3至6、9、12、15、18、24、30、36、48或60个月的年龄,从约6至9、12、15、18、24、30、36、48或60个月的年龄,约9至12、15、18、24、30、36、48或60个月的年龄,约12至18、24、36、48或60个月的年龄,约18至24、30、36、48或60个月的年龄,或约24至30、36、48或60个月的年龄。
[0102]
启动子和表达盒
[0103]
本发明的一个方面涉及包含合成的肝脏特异性启动子的多核苷酸,其中所述启动子包括核苷酸序列seq id no:1或与其具有至少约90%同一性的序列,基本由或由核苷酸序列seq id no:1或与其具有至少约90%同一性的序列组成。在一些实施方案中,核苷酸序列与核苷酸序列seq id no:1具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。启动子是短(少于200个碱基对)而强的肝脏特异性启动子,其对于目标多核苷酸的肝脏特异性表达是理想的,并且由于其短的长度和aav载体有限的容量而特别适用于aav载体。启动子被设计成包含保守的基本启动子元件和转录起始位点。基本启动子在其5'端与许多肝特异性转录因子结合位点连接,以用于肝脏特异性表达(图1)。启动子呈现出高活性,如在体外使用萤光素酶报告基因和在人肝脏癌细胞系huh7中的转染实验最初鉴定的那样,然后在小鼠体内得到证实。
[0104]
启动子可以可操作地连接到目标多核苷酸。在一些实施方案中,目标多核苷酸编码多肽或功能性核酸。在某些实施方案中,目标多核苷酸编码凝血因子,例如fvix。在一些实施方案中,编码fix的多核苷酸序列已被密码子优化,以用于在人中表达。在某些实施方案中,密码子优化的序列包括、基本上由或由与seq id nos:14-16其中之一具有至少90%同一性的序列组成,例如与核苷酸序列seq id nos:14-16具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。在一些实施方案中,编码fix的多核苷酸序列编码fix序列,所述fix序列包含本领域已知的突变或序列改变。在一个实例中,因子ix编码序列包含导致r338l突变(padua突变)或在该位点的其他突变(相对于人因子ix的编号)的错义突变。
[0105]
在一些实施方案中,多核苷酸还包含在启动子和目标多核苷酸之间的合成的5'-非翻译区(5'-utr)。合成的5'-utr可以包括、基本上由或由核苷酸序列seq id no:3或与其具有至少约90%同一性的序列组成,例如与核苷酸序列seq id no:3具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。在一些实施方案中,合成的5'-utr包括合成的内含子。合成的内含子可以包括、基本上由或由核苷酸序列seq id no:13或与其具有至少约90%同一性的序列组成,例如与核苷酸序列seq id no:13具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。在一些实施方案中,合成的5'-utr和合成的内含子包括、基本上由或由核苷酸序列seq id no:4或与其具有至少约90%同一性的序列组成,例如与核苷酸序列seq id no:4具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。在某些实施方案中,启动子、合成的5'-utr和合成的内含子包括、基本上由或由核苷酸序列seq id no:2或与其具有至少约90%同一性的序列组成,例如与核苷酸序列seq id no:2具有至少约90%、91%、92%、93%、94%、
95%、96%、97%、98%或99%的同一性。
[0106]
在某些实施方案中,与本发明的启动子或任何启动子相连接的目标多核苷酸包括合成的内含子。在一些实施方案中,合成的内含子包括、基本上由或由核苷酸序列seq id no:5或与其具有至少约90%同一性的序列组成,例如与核苷酸序列seq id no:5具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
[0107]
在某些实施方案中,目标多核苷酸是密码子优化的因子ix编码序列,并且密码子优化的因子ix编码序列和合成的内含子一起包括、基本上由或由seq id nos:6、7或8其中之一的核苷酸序列或与其具有至少约90%同一性的序列组成,例如与核苷酸序列seq id nos:6、7或8具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
[0108]
在某些实施方案中,本发明的任何多核苷酸可以可操作地连接到聚腺苷酸化位点,例如双向的聚腺苷酸化位点。在一些实施方案中,聚腺苷酸化位点包括、基本上由或由核苷酸序列seq id no:9或与其具有至少约90%同一性的序列组成,例如与核苷酸序列seq id no:9具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
[0109]
本发明的另一方面涉及编码fix的多核苷酸序列已被密码子优化,用于在人中表达。在某些实施方案中,密码子优化的序列包括、基本上由或由与seq id nos:14-16其中之一具有至少90%同一性的序列组成,例如与seq id nos:14-16的核苷酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。在一些实施方案中,密码子优化的序列包括合成的内含子。在一些实施方案中,合成的内含子包括、基本上由或由核苷酸序列seq id no:5或与其具有至少约90%同一性的序列组成,例如与核苷酸序列seq id no:5具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性,基本上由其组成或由其组成。在某些实施方案中,密码子优化的因子ix编码序列和合成的内含子一起包括、基本上由或由seq id nos:6、7或8其中之一的核苷酸序列或与其具有至少约90%同一性的序列组成,例如与核苷酸序列seq id nos:6、7或8具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
[0110]
在某些实施方案中,本发明的任何多核苷酸可以是表达盒的形式,例如包括启动子、5'utr、目标多核苷酸、一种或多种合成的内含子和/或聚腺苷酸化位点的任何组合和任何顺序的表达盒。在一些实施方案中,表达盒包括、基本上由或由seq id nos:10、11或12其中之一的核苷酸序列或与其具有至少约90%同一性的序列组成,例如与核苷酸序列seq id nos:10、11或12具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
[0111]
本发明的另一方面是包含本发明多核苷酸的载体,例如表达载体。该载体可以是本领域已知的任何类型的载体,包括但不限于质粒载体和病毒载体。在一些实施方案中,病毒载体是逆转录病毒或慢病毒载体。在一些实施方案中,病毒载体是来自任何已知aav血清型的aav载体,所述aav血清型包括但不限于aav 1型、aav 2型、aav 3型(包括3a型和3b型)、aav 4型、aav 5型、aav 6型、aav 7型、aav 8型、aav 9型、aav 10型、aav 11型、aav 12型、禽类aav、牛aav、犬aav、马aav和羊aav以及现在已知或以后发现的任何其他aav。在一些实施方案中,aav载体是aav8或aav9。
[0112]
本发明的另一方面涉及包含本发明的多核苷酸和/或载体的细胞(例如分离的细
胞、转化的细胞、重组细胞、体外或离体细胞等)。因此,本发明的各个实施方案涉及含有载体(例如表达盒)的重组宿主细胞。这样的细胞可以被分离和/或存在于转基因动物中。下文进一步描述了细胞的转化。
[0113]
本发明的另一个方面涉及包含本发明的多核苷酸、载体和/或转化的细胞的转基因非人动物。下文进一步描述了转基因动物。
[0114]
本发明的多核苷酸、载体和/或细胞可以包含在药物组合物中。一些实施方案涉及包含本发明的多核苷酸、载体和/或细胞的试剂盒和/或试剂和/或使用所述试剂盒的说明书,例如以实施本发明的方法。
[0115]
发明方法
[0116]
本发明的又一方面涉及本发明的启动子、优化的序列和表达盒在以例如肝特异性方式生成多肽或功能性核酸中的用途。因此,一个方面涉及在受试者的肝脏中生成多肽或功能性核酸的方法,包括向受试者递送本发明的多核苷酸、载体和/或转化的细胞,从而在受试者的肝脏中生成多肽或功能性核酸。多核苷酸、载体和/或转化的细胞在一定条件下进行递送,在该条件下发生目标多核苷酸的表达,从而生成多肽或功能性核酸。这种条件在本领域中是公知的,其将在下文进一步描述。
[0117]
本发明的另一方面涉及使用本发明的启动子、优化的序列和表达盒治疗受试者的血友病b或获得性因子ix缺乏症的方法,包括向受试者递送治疗有效量的本发明多核苷酸、载体和/或转化的细胞,从而治疗受试者的血友病b或获得性因子ix缺乏症。在一些实施方案中,目标多核苷酸编码如上所述的fix多肽。
[0118]
本发明的另一方面涉及使用本发明的启动子、优化的序列和表达盒提高受试者fix多肽的生物利用度的方法,包括向受试者递送有效量的多核苷酸、载体和/或转化的细胞,从而提高受试者fix多肽的生物利用度。在该方面,目标多核苷酸可以编码如上所述的fix多肽。
[0119]
本发明的一个方面涉及在受试者的肝脏中生成fix的方法,包括向受试者递送本发明的编码fix多肽的多核苷酸、载体和/或转化的细胞,从而在受试者的肝脏中生成fix。
[0120]
本发明的又一方面涉及提高受试者fix多肽的生物利用度的方法,包括向受试者递送有效量的本发明的编码fix多肽的多核苷酸、载体和/或转化的细胞,从而提高受试者fix多肽的生物利用度。
[0121]
可以根据本发明的方法治疗出血性疾病,包括可以用fix治疗的任何疾病,比如血友病b和获得性fix缺乏症。用于将本发明的编码fix蛋白的多核苷酸施用或递送给受试者(例如,有需要的受试者)的此类治疗方案和给药方案在本领域中是公知的。
[0122]
在本发明的实施方案中,本发明的编码fix蛋白的载体(例如,病毒载体或其他核酸载体)的剂量可以是达到fix蛋白的治疗血浆浓度的量。fix蛋白的治疗浓度被认为是高于健康个体正常水平的1%,基于平均100%进行测量,即在1ml正常人血浆中有1个国际单位(iu)的fix。本领域技术人员将能够确定给定受试者和给定条件的最佳剂量。
[0123]
对于有意干预的治疗,通常在进行干预之前约24小时内,在进行干预之后差不多7天或更长时间施用本发明的fix蛋白。作为促凝剂施用时可以采用本文所述的各种途径进行。
[0124]
药物组合物主要用于预防性和/或治疗性治疗的肠胃外给药。优选地,药物组合物
不经肠道施用,即静脉内给药、皮下给药或肌内给药,或者其可以通过连续或脉动输注施用。或者,可将药物组合物配制成以多种方式给药,包括但不限于口服、皮下、静脉内、脑内、鼻内、透皮、腹膜内、肌内、肺内、阴道、直肠、眼内或任何其他可接受的方式。
[0125]
用于肠胃外给药的组合物包含本发明的编码fix蛋白的多核苷酸、载体或细胞与药学上可接受的载体(优选水性载体)组合(例如溶解于其中)。可以使用各种水性载体,比如水、缓冲水、0.4%盐水、0.3%甘氨酸等。本发明的编码fix蛋白的多核苷酸、载体或细胞也可以与能延长稳定性和储存性的组合物(如蛋氨酸和蔗糖)一起配制。本发明的编码fix蛋白的多核苷酸、载体或细胞也可以配制成脂质体制剂,用于递送至或靶向受损部位。脂质体制剂大体上在例如美国专利4,837,028、4,501,728和4,975,282中有描述。该组合物可以通过常规的、公知的灭菌技术进行灭菌。所得水溶液可以包装使用或在无菌条件下过滤并冻干,冻干制剂在给药前与无菌水溶液混合。该组合物可以含有接近生理条件的药学上可接受的辅助物质,例如ph调节剂和缓冲剂、张力调节剂等,例如乙酸钠、乳酸钠、氯化钠、氯化钾、氯化钙等。该组合物还可以含有防腐剂、等渗剂、非离子表面活性剂或清洁剂、抗氧化剂和/或其他各种添加剂。
[0126]
在这些制剂中编码fix蛋白的多核苷酸、载体或细胞的浓度可以在较大范围变化,即从小于约0.5重量%(通常为或至少为约1重量%)至高达约15或20重量%,并且将根据所选的特定给药方式主要通过流体体积、粘度等进行选择。用于制备肠胃外给药的组合物的实际方法对于本领域技术人员来说是公知的或显而易见的,并且其更详细地描述于例如remington's pharmaceutical sciences,第21版,mack publishing company,easton,pa(2005年)。
[0127]
可以施用包含本发明的编码fix蛋白的核酸分子、载体或细胞的组合物以进行预防性和/或治疗性治疗。在治疗性应用中,将组合物以足以治愈、减轻或部分控制疾病及其并发症的量施用给已患有如上所述疾病的受试者。足以实现上述目的的量被定义为“治疗有效量”。如本领域技术人员将理解的,对于该目的的有效的量将取决于疾病或损伤的严重程度以及受试者的体重和总体状况。
[0128]
在预防性应用中,将含有本发明的编码fix蛋白的多核苷酸、载体或细胞的组合物施用给易患或有处于疾病状态或损伤风险的受试者,以增强受试者自身的凝血能力。这样的量被定义为“预防有效量”。在预防性应用中,精确的量同样取决于受试者的健康状况和体重。
[0129]
可以根据治疗医师选择的剂量水平和方式进行组合物的单次或多次给药。对于需要每天维持水平的非卧床患者,编码fix蛋白的多核苷酸、载体或细胞可以通过使用例如便携泵系统进行连续输注来施用。
[0130]
本发明的编码fix蛋白的多核苷酸、载体或细胞也可以配制成缓释或延长释放的制剂。配制缓释或延长释放组合物的方法是本领域已知的,包括但不限于含有所述多核苷酸、载体或细胞的固体疏水性颗粒的半渗透性基质。
[0131]
本发明的编码fix蛋白的多核苷酸、载体或细胞的局部递送,例如局部应用,可以通过例如喷雾、灌注、双气囊导管、支架、并入血管移植物或支架、用于涂覆气囊导管的水凝胶,或其他已建立的方法。无论如何,所述药物组合物应提供足以有效治疗受试者的fix蛋白量。
[0132]
在一些实施方案中,使用aav载体将目标多核苷酸(例如fix蛋白)递送给受试者。因此,本发明还提供了包含目标多核苷酸的aav病毒颗粒(即病毒体),其中所述病毒颗粒封装(即衣壳包裹)载体基因组,任选地aav载体基因组。
[0133]
在具体的实施方案中,病毒体是包含例如用于递送至细胞的异源目标多核苷酸的重组载体。因此,本发明可采用体外、离体和体内方式将多核苷酸递送至细胞。在代表性实施方案中,本发明的重组载体可以有利地用于将多核苷酸递送或转移至动物(例如哺乳动物)细胞,例如,当使用本发明的肝特异性启动子时将其递送至肝细胞。
[0134]
可以通过本发明的病毒载体递送任何异源核苷酸序列。目标多核苷酸包括编码多肽的多核苷酸,任选地为治疗性(例如,用于医学或兽医用途)和/或免疫原性(例如,用于疫苗)多肽。
[0135]
治疗性多肽包括但不限于囊性纤维化跨膜调节蛋白(cftr)、肌营养不良蛋白(包括肌营养不良蛋白小基因或微小基因的蛋白产物,参见例如vincent等人,(1993)nature genetics 5:130;美国专利公开第2003017131号;wang等,(2000)(2000)proc.natl.acad.sci.usa 97:13714-9[mini-dystrophin];harper等,(2002)nature med.8:253-61[micro-dystrophin])、微小集聚蛋白、层粘连蛋白-α2、肌聚糖(α、β、γ或δ)、fukutin相关蛋白、肌生长抑制素前肽、卵泡抑素、显性负性肌生长抑制素、血管生成因子(例如vegf、血管生成素-1或2)、抗凋亡因子(例如血红素加氧酶-1、tgf-β、促凋亡信号抑制剂,如半胱天冬酶,蛋白酶,激酶、死亡受体[例如cd-095]、细胞色素c释放调节剂、线粒体孔隙开放和肿胀的抑制剂);活化素ii型可溶性受体、抗炎多肽,例如ikappa b显性突变体、sarcospan、肌营养相关蛋白(utrophin)、微小肌萎缩蛋白、抗肌生长抑制素或肌生长抑制素前肽的抗体或抗体片段、细胞周期调节剂、rho激酶调节剂,如cethrin,其为修饰细菌c3胞外酶[得自bioaxone therapeutics,inc.,saint-lauren,加拿大魁北克]、bcl-xl、bcl2、xiap、flicec-s、显性负性半胱天冬酶-8、显性负性半胱天冬酶-9、spi-6(参见例如美国专利申请第20070026076号)、转录因子pgc-α1、pinch基因、ilk基因和胸腺素β4基因)、凝血因子(例如因子viii、因子ix、因子x等)、促红细胞生成素、血管抑制素、内皮抑制素、过氧化氢酶、酪氨酸羟化酶、细胞内和/或细胞外超氧化物歧化酶、瘦素、ldl受体、脑啡肽酶、脂蛋白脂肪酶、鸟氨酸转氨甲酰酶、β-珠蛋白、α-珠蛋白、血影蛋白、α
1-抗胰蛋白酶、甲基胞嘧啶结合蛋白2、腺苷脱氨酶、次黄嘌呤鸟嘌呤磷酸核糖转移酶、β-葡糖脑苷脂酶、鞘磷脂酶、溶酶体氨基己糖苷酶a、支链酮酸脱氢酶、rp65蛋白、细胞因子(例如,α-干扰素、β-干扰素、干扰素-γ、白细胞介素-1至白细胞介素-14、粒细胞-巨噬细胞集落刺激因子、淋巴毒素等)、肽生长因子、神经营养因子和激素(例如生长激素、胰岛素、胰岛素生长因子,包括igf-1和igf-2、glp-1、血小板衍生生长因子、表皮生长因子、成纤维细胞生长因子、神经生长因子、神经营养因子-3和-4、脑源性神经营养因子、胶质源性生长因子、转化生长因子
–
α和
–
β等)、骨形态发生蛋白(包括rankl和vegf)、溶酶体蛋白、谷氨酸受体、淋巴因子、可溶性cd4、fc受体、t细胞受体、apoe、apoc、蛋白磷酸酶抑制剂1的抑制剂1(i-1)、受磷蛋白、serca2a、溶酶体酸性α-葡糖苷酶、α-半乳糖苷酶a、barkct、β2-肾上腺素能受体、β2-肾上腺素能受体激酶(bark)、磷酸肌醇-3激酶(pi3激酶)、calsarcin、受体(例如肿瘤坏死生长因子-α可溶性受体)、抗炎症因子(如irap、pim-1、pgc-1α、sod-1、sod-2、ecf-sod)、激肽释放酶、胸腺素-β4、缺氧诱导转录因子[hif]、血管生成因子、s100a1、小清蛋白、6型腺苷酸环化酶、影响g蛋白
偶联受体激酶2型敲落的分子,如截短型组成型活性barkct;受磷蛋白抑制性或显性负性分子,例如受磷蛋白s16e、单克隆抗体(包括单链单克隆抗体)或自杀基因产物(例如胸苷激酶、胞嘧啶脱氨酶、白喉毒素和肿瘤坏死因子,如tnf-α),以及对有需要的受试者具有治疗效果的任何其他多肽。
[0136]
编码多肽的异源核苷酸序列包括编码报道多肽(例如酶)的那些。报道多肽是本领域公知的,包括但不限于荧光蛋白(例如,egfp、gfp、rfp、bfp、yfp或dsred2)、能生成可检测产物例如萤光素酶(例如,来自gaussia、renilla或photinus)的酶、β-半乳糖苷酶、β-葡糖醛酸糖苷酶、碱性磷酸酶和氯霉素乙酰转移酶基因,或能直接被检测到的蛋白质。事实上,任何蛋白质都可以通过使用例如该蛋白质的特异性抗体直接进行检测。在sambrook和russell(2001),molecular cloning,第3版,冷泉港实验室出版社,冷泉港,纽约,以及ausubel等人,(1992),current protocols in molecular biology,john wiley&sons(包括定期更新)中公开了适合用于真核细胞的阳性或阴性选择的其他标志物(以及相关抗菌素)。
[0137]
或者,异源核酸可编码功能性rna,例如反义寡核苷酸、核酶(如美国专利第5,877,022号中描述的)、影响剪接体介导的反式剪接的rna(参见puttaraju等人,(1999)nature biotech.17:246;美国专利第6,013,487号;美国专利第6,083,702号)、包括介导基因剪接的小干扰rna(sirna)的干扰rna(rnai)(参见sharp等人,(2000)science 287:2431)、微小rna或其他未翻译的“功能性”rna(如“指导”rna)(gorman等人,(1998)proc.nat.acad.sci.usa95:4929;yuan等人的美国专利第5,869,248号),等等。示例性的未翻译rna包括抗多药耐药性(mdr)基因产物(例如,治疗肿瘤和/或用于向心脏施用以预防化疗损伤)的rnai或反义rna、抗肌生长抑制素(杜兴氏或贝克氏肌营养不良症)的rnai或反义rna、抗vegf或肿瘤免疫原(包括但不限于本文中具体描述的(用于治疗肿瘤)那些肿瘤免疫原)的rnai或反义rna、靶向突变的肌营养不良蛋白(杜兴氏或贝克氏肌营养不良症)的rnai或反义寡核苷酸、抗乙型肝炎表面抗原基因(以预防和/或治疗乙型肝炎感染)的rnai或反义rna、抗hiv tat和/或rev基因(以预防和/或治疗hiv)的rnai或反义rna,和/或抗来自病原体的免疫原(以保护受试者免受病原体侵害)或有缺陷的基因产物(以预防或治疗疾病)的任何其他的rnai或反义rna。针对上述靶标或任何其他靶标的rnai或反义rna也可用作研究试剂。
[0138]
如本领域已知的,可以使用反义核酸(例如dna或rna)和抑制性rna(例如,微小rna和rnai,如sirna或shrna)序列来诱导患有因肌营养不良蛋白基因缺陷引起的肌营养不良症的患者的“外显子跳跃”。因此,异源核酸可以编码诱导合适的外显子跳跃的反义核酸或抑制性rna。本领域技术人员将会理解,诱导外显子跳跃的具体方法取决于肌营养不良蛋白基因中潜在缺陷的性质,并且本领域已知许多此类手段。示例性的反义核酸和抑制性rna序列靶向一个或多个肌营养不良蛋白外显子(例如外显子19或23)的上游分支点和/或下游供体剪接位点和/或内部剪接增强子序列。例如,在具体的实施方案中,异源核酸编码直接针对肌营养不良蛋白基因的外显子19或23的上游分支点和下游剪接供体位点的反义核酸或抑制性rna。可以将这种序列掺入到递送修饰的u7 snrna和反义核酸或抑制性rna的aav载体中(参见例如goyenvalle等人,(2004)science 306:1796-1799)。采用另一种手段时,可以将修饰的u1 snrna与能与肌营养不良蛋白外显子的上游和下游剪接位点互补的sirna、
微小rna或反义rna一起掺入aav载体中(参见例如denti等人,(2006)proc.nat.acad.sci.usa103:3758-3763)。此外,反义核酸和抑制性rna可以靶向外显子19、43、45或53内的剪接增强子序列(参见例如美国专利第6,653,467号;美国专利第6,727,355号;和美国专利第6,653,466号)。
[0139]
核酶是rna-蛋白质复合物,其以位点特异性方式切割核酸。核酶具有特定的催化结构域,该结构域具有核酸内切酶活性(kim等人,(1987)proc.natl.acad.sci.usa 84:8788;gerlach等人,(1987)nature 328:802;forster和symons,(1987)cell 49:211)。例如,大量核酶加速具有高度特异性的磷酸酯转移反应,该反应通常仅切割寡核苷酸底物中几种磷酸酯中的一种(michel和westhof,(1990)j.mol.biol.216:585;reinhold-hurek和shub,(1992)nature 357:173)。这种特异性是因为需要在化学反应前通过特异性碱基配对相互作用将底物结合到核酶的内部指导序列(“igs”)。
[0140]
核酶催化作用主要是作为涉及核酸的序列特异性切割/连接反应的一部分被观察到的(joyce,(1989)nature 338:217)。例如,美国专利第5,354,855号报道某些核酶可以作为内切酶起作用,其序列特异性大于已知核糖核酸酶的序列特异性,并接近dna限制酶的序列特异性。因此,序列特异性核酶介导的核酸表达抑制特别适用于治疗应用(scanlon等人,(1991)proc.natl.acad.sci.usa 88:10591;sarver等人,(1990)science 247:1222;sioud等人,(1992)j.mol.biol.223:831)。
[0141]
微小rna(mir)是天然细胞rna分子,其可以通过控制mrna的稳定性调节多种基因的表达。可以使用特定微小rna的过表达或减少来治疗功能障碍,并且已经显示其在许多疾病状态和动物疾病模型中有效(参见例如couzin,(2008)science 319:1782-4)。嵌合aav可用于将微小rna递送到细胞、组织和受试者中,用于治疗遗传和获得性疾病,或用于增强功能并促进某些组织的生长。例如,mir-1、mir-133、mir-206和/或mir-208可用于治疗心脏和骨骼肌肉疾病(参见例如chen等人,(2006)genet.38:228-33;van rooij等人,(2008)trends genet.24:159-66)。微小rna也可用于在基因递送后调节免疫系统(brown等人,(2007)blood 110:4144-52)。
[0142]
本文使用的术语“反义寡核苷酸”(包括“反义rna”)是指与特定dna或rna序列互补并特异性杂交的核酸。根据常规技术可以制备反义寡核苷酸和编码它的核酸。参见例如tullis的美国专利第5,023,243号;pederson等人的美国专利第5,149,797号。
[0143]
本领域技术人员将会理解,反义寡核苷酸不必与靶序列完全互补,只要序列相似性的程度足以使反义核苷酸序列能与其靶标特异性杂交(如前文所定义的)并减少蛋白质产物的生成(例如减少至少约30%、40%、50%、60%、70%、80%、90%、95%或更多)。
[0144]
为了确定杂交的特异性,可以在降低的严格性、中等严格性或甚至严格条件下进行这种寡核苷酸与靶序列的杂交。实现降低的、中等的和严格的杂交条件的合适条件如本文所描述的。
[0145]
换句话说,在具体的实施方式中,本发明的反义寡核苷酸与靶序列的互补序列具有至少约60%、70%、80%、90%、95%、97%、98%或更高的序列同一性并减少蛋白质产物(如上文所定义的)的生成。在一些实施方案中,与靶序列相比,反义序列含有1、2、3、4、5、6、7、8、9或10个错配。
[0146]
确定核酸序列百分比同一性的方法在本文其他地方有更详细的描述。
[0147]
反义寡核苷酸的长度并不重要,只要它能与预期靶标特异性杂交并减少蛋白质产物(如上文所定义的)的生成并且可以根据常规程序来确定。一般来说,反义寡核苷酸的长度至少约为8个、10个或12个或15个核苷酸和/或小于约20、30、40、50、60、70、80、100或150个核苷酸。
[0148]
rna干扰(rnai)是用于减少蛋白质产物(例如,shrna或sirna)生成的另一种有用的方法。rnai是转录后基因沉默的机制,其中与目标靶序列对应的双链rna(dsrna)被引入细胞或生物体中,从而使相应的mrna降解。在sharp等人,(2001)genes dev 15:485-490和hammond等人,(2001)nature rev.gen.2:110-119对rnai实现基因沉默的机制进行了综述。在恢复基因表达之前,rnai效应对多次细胞分裂持续存在。因此rnai是在rna水平上实现靶向敲除或“敲落”的有效方法。rnai已在人类细胞上得到成功的证明,包括人胚胎肾和海拉细胞(参见例如elbashir等人,nature(2001)411:494-8)。
[0149]
在哺乳动物细胞中使用rnai的初步尝试得到了涉及响应于dsrna分子的pkr的抗病毒防御机制(参见例如gil等人,(2000)apoptosis 5:107)。已经证明约21个核苷酸的短合成dsrna(称为“短干扰rna”(sirna))能够介导哺乳动物细胞中的沉默而不会引发抗病毒反应(参见例如elbashir等人,nature(2001)411:494-8;caplen等人,(2001)proc.nat.acad.sci.usa 98:9742)。
[0150]
所述rnai分子(包括sirna分子)可以为发夹rna(shrna;参见paddison等人,(2002),proc.nat.acad.sci.usa 99:1443-1448),其被认为是通过rna酶iii样酶dicer进入20-25mer sirna分子中的作用在细胞中得到加工。shrna通常具有茎-环结构,其中两个反向重复序列被环出的短间隔序列分开。已经有报道环的长度为3至23个核苷酸的shrna。环顺序通常不重要。示例性的环序列包括以下基序:aug、ccc、uucg、ccacc、ctcgag、aagcuu、ccacacc和uucaagaga。
[0151]
rnai可进一步包含环状分子,所述环状分子包含在任一侧上具有两个环区域的有义和反义区域,以在有义区域和反义区域之间在形成dsrna时形成“哑铃”形结构。该分子可以在体外或体内加工,以释放dsrna部分,例如sirna。
[0152]
国际专利公开wo 01/77350描述了用于双向转录以在真核细胞中生成异源序列的正义和反义转录物的载体。该技术可用于生成根据本发明用途的rnai。
[0153]
shinagawa等人,(2003)genes dev.17:1340报道了从cmv启动子(pol ii启动子)表达长dsrna的方法,该方法也能用于组织特异性pol ii启动子。同样的,xia等人,(2002)nature biotech.20:1006的方法避免了聚(a)拖尾并能用于连接组织特异性启动子。
[0154]
生成rnai的方法包括化学合成、体外转录、dicer消化长dsrna(体外或体内)、从递送的载体体内表达生成,以及从pcr衍生的rnai表达盒体内表达生成(参见例如technotes 10(3)“five ways to produce sirnas,”来自ambion公司,德克萨斯州奥斯汀;可从www.ambion.com获得)。
[0155]
可以找到设计sirna分子的指导手册(参见例如来自ambion公司的文献,德克萨斯州奥斯汀;可从www.ambion.com获得)。在具体的实施方案中,sirna序列具有约30-50%的g/c含量。此外,如果使用rna聚合酶iii来转录rna,通常可避免大于4个t或a残基的长延伸。可以从例如ambion公司(www.ambion.com)、通过whitehead institute of biomedical research(www.jura.wi.mit.edu)或者从dharmacon research公司(www.dharmacon.com)
获得在线sirna target finders。
[0156]
rnai分子的反义区域可以与靶序列完全互补,但并不需要完全互补,只要与靶序列(如上文所定义的)特异性杂交并减少蛋白质产物的生成(例如减少至少约30%、40%、50%、60%、70%、80%、90%、95%或更多)即可。在一些实施方案中,此类寡核苷酸与靶序列的杂交可以在如上文所定义的降低的严格性、中等严格性或者甚至严格条件的条件下进行。
[0157]
在其他实施方案中,rnai的反义区域与靶序列的互补序列具有至少约60%、70%、80%、90%、95%、97%、98%或更高的序列同一性并且能减少蛋白质产物的生成(例如,减少至少约30%、40%、50%、60%、70%、80%、90%、95%或更多)。在一些实施方案中,与靶序列相比,反义区域含有1、2、3、4、5、6、7、8、9或10个错配。通常与在中心部分的错配相比,更能允许在dsrna末端的错配。
[0158]
在具体的实施方案中,rnai通过两个分开的有义和反义分子之间的分子间复合形成。rnai包含由两条分开的链之间的分子间碱基配对形成的ds区。在其他实施方案中,rnai包含在包含有义和反义区域的单个核酸分子内通过分子内碱基配对形成的ds区域,通常作为反向重复(例如,shrna或其他茎环结构或环状rnai分子)。rnai可以进一步包含在有义区和反义区之间的间隔区。
[0159]
通常,rnai分子是高度选择性的。如果需要,本领域技术人员可通过搜索相关数据库来鉴定与其他已知序列不具有实质性序列同源性的rnai序列,例如,使用blast(可从www.ncbi.nlm.nih.gov/blast获得),从而容易地消除可能干扰除靶标之外的核酸表达的候选rnai。
[0160]
用于生成rnai的试剂盒可商购获得,例如从new england biolabs,inc.(纽英伦生物技术公司)和ambion,inc(ambion公司)。
[0161]
重组病毒载体还可以包含与宿主染色体上的基因座同源并与其重组的异源核苷酸序列。这种方法可以用于纠正宿主细胞中的遗传缺陷。
[0162]
本发明还提供了表达免疫原性多肽的重组病毒载体,例如用于疫苗接种。异源核酸可编码本领域已知的任何目标免疫原,包括但不限于来自人免疫缺陷病毒、流感病毒、gag蛋白、肿瘤抗原、癌抗原、细菌抗原、病毒抗原等的免疫原。或者,免疫原可存在于病毒衣壳(例如,掺入其中)中或与病毒衣壳(例如通过共价修饰)连接。
[0163]
细小病毒作为疫苗的用途在本领域中是已知的(参见例如miyamura等人,(1994)proc.nat.acad.sci.usa 91:8507;young等人的美国专利第5,916,563号、mazzara等人的美国专利第5,905,040号、美国专利第5,882,652号、samulski等人的美国专利第5,863,541号;它们的公开通过引用整体并入本技术中)。抗原可以在病毒衣壳中存在。或者,抗原可以从被引入重组载体基因组中的异源核酸表达。
[0164]
免疫原性多肽或免疫原可以是适于保护受试者抵抗疾病(包括但不限于微生物、细菌、原生动物、寄生虫、真菌和病毒疾病)的任何多肽。例如,免疫原可以是正粘病毒免疫原(例如,流感病毒免疫原,比如流感病毒血凝素(ha)表面蛋白或流感病毒核蛋白基因,或马流感病毒免疫原)或慢病毒免疫原(例如,马传染性贫血病毒免疫原、猿猴免疫缺陷病毒(siv)免疫原,或人免疫缺陷病毒(hiv)免疫原,例如hiv或siv包膜gp160蛋白、hiv或siv基质/衣壳蛋白和hiv或siv gag、pol和env基因产物)。免疫原还可以是沙粒病毒免疫原(例
如,拉沙热病毒免疫原,如拉沙热病毒核衣壳蛋白基因和拉沙热包膜糖蛋白基因)、痘病毒免疫原(例如,牛痘,如牛痘l1或l8基因)、黄病毒免疫原(例如,黄热病病毒免疫原或日本脑炎病毒免疫原)、丝状病毒免疫原(例如,埃博拉病毒免疫原,或马尔堡病毒免疫原,如np和gp基因)、布尼亚病毒免疫原(例如,rvfv、cchf和sfs病毒),或冠状病毒免疫原(例如,感染性人冠状病毒免疫原,如人冠状病毒包膜糖蛋白基因,或猪传染性胃肠炎病毒免疫原,或禽传染性支气管炎病毒免疫原,或严重急性呼吸综合症(sars)免疫原,如s[s1或s2]、m、e或n蛋白,或其免疫原性片段)。免疫原还可以是脊髓灰质炎免疫原、疱疹免疫原(例如cmv、ebv、hsv免疫原)、腮腺炎免疫原、麻疹免疫原、风疹免疫原、白喉毒素或其他白喉毒素免疫原、百日咳抗原、肝炎(例如甲型肝炎、乙型肝炎或丙型肝炎)免疫原或本领域已知的任何其它疫苗免疫原。
[0165]
或者,所述免疫原可以是任何肿瘤或癌细胞抗原。任选地,所述肿瘤或癌症抗原可以在癌细胞的表面上表达。示例性癌症和肿瘤细胞抗原在s.a.rosenberg,(1999)immunity 10:281中有所描述。说明性的癌症和肿瘤抗原包括但不限于:brca1基因产物、brca2基因产物、gp100、络氨酸酶、gage-1/2、bage、rage、ny-eso-1、cdk-4、β-连环蛋白、mum-1、半胱天冬酶-8、kiaa0205、hpve、sart-1、prame、p15、黑素瘤肿瘤抗原(kawakami等人,(1994)proc.natl.acad.sci.usa 91:3515;kawakami等人,(1994)j.exp.med.,180:347;kawakami等人,(1994)cancer res.54:3124),包括mart-1(coulie等人,(1991)j.exp.med.180:35)、gp100(wick等人,(1988)j.cutan.pathol.4:201)和mage抗原(mage-1、mage-2和mage-3)(van der bruggen等人,(1991)science,254:1643)、cea、trp-1;trp-2;p-15和络氨酸酶(brichard等人,(1993)j.exp.med.178:489);her-2/neu基因产物(美国专利第4,968,603号);ca 125;he4;lk26;fb5(内皮唾液酸蛋白);tag 72;afp;ca19-9;nse;du-pan-2;ca50;span-1;ca72-4;hcg;stn(sialyl tn抗原);c-erbb-2蛋白;psa;l-canag;雌激素受体;乳脂球蛋白;p53肿瘤抑制蛋白(levine,(1993)ann.rev.biochem.62:623);粘蛋白抗原(国际专利公开wo 90/05142);端粒酶;核基质蛋白;前列腺酸性磷酸酶;乳头状瘤病毒抗原;以及与以下癌症有关的抗原:黑素瘤、腺癌、胸腺瘤、肉瘤、肺癌、肝癌、结肠直肠癌、非霍奇金淋巴瘤、霍奇金淋巴瘤、白血病、子宫癌、乳腺癌、前列腺癌、卵巢癌、宫颈癌、膀胱癌、肾癌、胰腺癌、脑癌、肾癌、胃癌、食管癌、头颈癌等等(参见例如rosenberg,(1996)annu.rev.med.47:481-91)。
[0166]
或者,异源核苷酸序列可编码希望采用体外、离体或体内方式在细胞中生成的任何多肽。例如,可以将病毒载体引入培养的细胞以及从中分离出的表达的蛋白质产物中。
[0167]
本领域技术人员将会理解,目标异源多核苷酸可以与合适的控制序列可操作地结合起来。例如,异源核酸可以与表达控制元件(比如转录/翻译控制信号、复制起点、聚腺苷酸化信号、内部核糖体进入位点(ires)、启动子、增强子等)可操作地结合。
[0168]
本领域技术人员将进一步认识到,根据所期望的水平和组织特异性表达,可以使用各种启动子/增强子元件。根据所期望的表达模式,启动子/增强子可以是组成型或诱导型的。启动子/增强子可以是天然的或外源的,可以是天然的或合成的序列。采用外源的时,这表示在引入转录起始区的野生型宿主中不存在引入转录起始区。
[0169]
启动子/增强子元件对于靶细胞或待处理对象是天然的,和/或对于异源核酸序列是天然的。启动子/增强子元件通常是经过选择的,使其可以在目标靶细胞中起作用。在代
表性实施方案中,启动子/增强子元件是哺乳动物启动子/增强子元件。启动子/增强元件可以是组成型或诱导型的。
[0170]
诱导型表达控制元件通常用于希望对异源核酸序列过表达进行调控的那些应用中。用于基因递送的诱导型启动子/增强子元件可以是组织特异性的或组织优选的启动子/增强子元件,包括肌肉特异性的或优选的(包括心脏、骨骼和/或平滑肌)启动子/增强子元件、神经组织特异性的或优选的(包括脑特异性的)启动子/增强子元件、眼(包括视网膜特异性的和角膜特异性的)启动子/增强子元件、肝特异性的或优选的启动子/增强子元件、骨髓特异性的或优选的启动子/增强子元件、胰特异性的或优选的启动子/增强子元件、脾特异性或优选的启动子/增强子元件,以及肺特异性或优选的启动子/增强子元件。其他诱导型启动子/增强子元件包括激素诱导型和金属诱导型元件。示例性的诱导型启动子/增强子元件包括但不限于tet开/关元件、ru486诱导型启动子、蜕皮激素诱导型启动子、雷帕霉素诱导型启动子和金属硫蛋白启动子。
[0171]
在其中异源核酸序列被转录然后在靶细胞中被翻译的实施方案中,通常使用特异性起始信号来有效翻译插入的蛋白质编码序列。这些外源翻译控制序列(包括atg起始密码子和邻近序列)可以有多种来源,天然的和合成的都可以。
[0172]
本发明还提供了生成本发明病毒载体的方法。在代表性实施方案中,本发明提供了生成重组病毒载体的方法,所述方法包括在体外向细胞提供(a)包含(i)目标多核苷酸和(ii)足以将aav模板衣壳包入病毒颗粒的包装信号序列(例如,一个或多个(例如,两个)末端重复,比如aav末端重复),和(b)足以用于复制模板和将模板衣壳包入病毒颗粒的aav序列(例如,aav rep和aav cap序列)。在一定条件下提供模板和aav复制以及衣壳序列,使得包含包装在衣壳内的模板的重组病毒颗粒能在细胞中生成。该方法可以进一步包括从细胞中收集病毒颗粒的步骤。可以从培养基中和/或通过裂解细胞收集病毒颗粒。
[0173]
在一个说明性实施方案中,本发明提供了生成包含aav衣壳的raav颗粒的方法,所述方法包括:在体外向细胞提供编码aav衣壳的核酸、aav rep编码序列、含目标多核苷酸的aav载体基因组,和能够生成生产性aav感染的辅助功能(helpler function);以及进行包含aav衣壳和衣壳包装aav载体基因组的aav颗粒的装配。
[0174]
细胞通常是能自由进行aav病毒复制的细胞。可以使用本领域已知的任何合适的细胞,例如哺乳动物细胞。还适宜使用的是提供从复制缺陷型辅助病毒中缺失的功能的反式互补包装细胞系,例如293细胞或其他e1a反式互补细胞。
[0175]
可以通过本领域已知的任何方法提供aav复制和衣壳序列。现有的方案通常在单个质粒上表达aav rep/cap基因。aav复制和包装序列不需要一起提供,尽管这样做可能很方便。aav rep和/或cap序列可以由任何病毒或非病毒载体提供。例如,rep/cap序列可以由杂合腺病毒或疱疹病毒载体提供(例如,插入缺失的腺病毒载体的e1a或e3区)。ebv载体也可用于表达aav cap和rep基因。该方法的一个优点是ebv载体是附加型的,但在整个连续细胞分裂过程中将保持高拷贝数(即作为染色体外元件稳定整合到细胞中),称为基于ebv的核附加体。
[0176]
作为进一步的替换方案,rep/cap序列可以在细胞内稳定携带(附加的或整合的)。
[0177]
一般来说,aav rep/cap序列不会侧接aav包装序列(例如aav itr),以防止这些序列的拯救和/或包装。
[0178]
可以使用本领域已知的任何方法将模板(例如,raav载体基因组)提供给细胞。例如,模板可以由非病毒(例如质粒)或病毒载体提供。在具体的实施方案中,模板由疱疹病毒或腺病毒载体提供(例如,插入缺失的腺病毒的e1a或e3区)。作为另一个例子,palombo等人,(1998)j.virol。72:5025描述了携带侧接了aav itr的报道基因的杆状病毒载体。ebv载体也可用于递送模板,如上面关于rep/cap基因的描述。
[0179]
在另一个代表性实施方案中,模板由复制型raav病毒提供。在其他实施方案中,aav原病毒能稳定整合到细胞的染色体中。
[0180]
为了获得最大的病毒滴度,通常向细胞提供对于生产性aav感染至关重要的辅助病毒功能(例如,腺病毒或疱疹病毒)。aav复制所需的辅助病毒序列是本领域已知的。通常,这些序列由辅助腺病毒或疱疹病毒载体提供。作为替换,腺病毒或疱疹病毒序列可由另一种非病毒或病毒载体提供,例如作为携带了有效的aav生成所需的所有辅助基因的非感染性腺病毒小质粒,如ferrari等人,(1997)nature med.3:1295,以及美国专利第6,040,183号和第6,093,570号描述的。
[0181]
此外,所述辅助病毒功能可由具有整合到染色体中或作为稳定的染色体外元件维持的辅助基因的包装细胞提供。在代表性实施方案中,辅助病毒序列不能被包装进aav病毒粒子中,例如不能被aav itr侧接。
[0182]
本领域技术人员将会理解,在单个辅助构建体上提供aav复制和衣壳序列以及辅助病毒序列(例如腺病毒序列)是有利的。该辅助构建体可以是非病毒或病毒构建体,但是任选地是包含aav rep/cap基因的杂合腺病毒或杂合疱疹病毒。
[0183]
在一个特定的实施方案中,aav rep/cap序列和腺病毒辅助序列由单个腺病毒辅助载体提供。该载体还包含raav模板。可将aav rep/cap序列和/或raav模板插入腺病毒的缺失区(例如e1a或e3区)。
[0184]
在另一个实施方案中,aav rep/cap序列和腺病毒辅助序列由单个腺病毒辅助载体提供。raav模板作为质粒模板提供。
[0185]
在另一个说明性实施方案中,aav rep/cap序列和腺病毒辅助序列由单个腺病毒辅助载体提供,并且raav模板作为原病毒被整合到细胞中。或者,raav模板由作为染色体外元件维持在细胞内的ebv载体提供(例如,作为“基于ebv的核附加体”,参见margolski,(1992)curr.top.microbiol.immun.158:67)。
[0186]
在进一步的示例性实施方案中,aav rep/cap序列和腺病毒辅助序列由单个腺病毒辅助体提供。raav模板作为单独的复制型病毒载体提供。例如,raav模板可以由raav颗粒或第二重组腺病毒颗粒提供。
[0187]
根据前述方法,杂合腺病毒载体通常包含足以用于腺病毒复制和包装(即,腺病毒末端重复序列和pac序列)的腺病毒5'和3'顺式序列。aav rep/cap序列和raav模板(如果存在的话)嵌入腺病毒骨架中,并且侧接5'和3'顺式序列,从而可以将这些序列包装进腺病毒衣壳中。如上所述,在代表性实施方案中,腺病毒辅助序列和aav rep/cap序列未被aav包装序列(例如aav itr)侧接,使得这些序列未被包装到aav病毒粒子中。
[0188]
疱疹病毒也可以在aav包装方法中用作辅助病毒。编码aav rep蛋白的杂合疱疹病毒可以有利地促进更可扩大的aav载体生产方案。表达aav-2rep和cap基因的杂合单纯疱疹病毒i型(hsv-1)载体已经有描述了(conway等人,(1999)gene therapy 6:986和wo 00/
17377,其公开内容在此整体并入本文)。
[0189]
作为进一步的替换方案,可以使用杆状病毒载体在昆虫细胞中生成本发明的病毒载体,以递送rep/cap基因和raav模板,如urabe等人,(2002)human gene therapy 13:1935所描述的。
[0190]
生成aav的其他方法可使用稳定转化的包装细胞(参见例如美国专利第5,658,785号)。
[0191]
可通过本领域已知的任何方法获得不含污染辅助病毒的aav载体原种。例如,aav和辅助病毒能够很容易地根据大小进行区分。根据对肝素底物的亲和力,aav也可以与辅助病毒分离(zolotukhin等人,(1999)gene therapy 6:973)。在代表性实施方案中,可使用缺失的复制缺陷型辅助病毒,这样任何污染性辅助病毒不具有复制能力。作为进一步的替换方案,可以使用缺乏晚期基因表达的腺病毒辅助体,因为仅需要腺病毒早期基因表达来介导aav病毒的包装。晚期基因表达缺陷的腺病毒突变体是本领域已知的(例如,ts100k和ts149腺病毒突变体)。
[0192]
本发明的包装方法可用于产生高滴度的病毒颗粒原种。在具体的实施方案中,病毒原种的滴度为至少约105转导单位(tu)/ml,至少约106(tu)/ml,至少约107(tu)/ml,至少约108(tu)/ml,至少约109(tu)/ml或至少约10
10
(tu)/ml。
[0193]
在具体的实施方案中,本发明提供了药物组合物,其包含在药学上可接受的载体中的本发明的病毒载体以及任选的其他药用制剂、药物制剂、稳定剂、缓冲液、载体、佐剂、稀释剂等。用于注射时,载体通常是液体。对于其他给药方法,载体可以是固体或液体。对于吸入给药,载体将是可吸入的,并且将优选为固体或液体颗粒形式。
[0194]“药学上可接受的”是指没有毒性或其他不良效应的材料,即该材料可以施用给受试者而不会引起任何不希望的生物学效应。
[0195]
本发明的一个方面是将目标多核苷酸转移至体外细胞的方法。根据适用于特定靶细胞的标准转导方法,可以以合适的感染复数将病毒载体引入细胞。根据靶细胞类型和数量以及特定的病毒载体或衣壳,施用病毒载体或衣壳的滴度可以不同,并且可以由本领域技术人员确定而无需过多实验。在具体的实施方案中,将至少约103个感染单位,更优选至少约105个感染单位引入细胞。
[0196]
可引入病毒载体的细胞可以是任何类型,包括但不限于神经细胞(包括外周和中枢神经系统的细胞,特别是脑细胞,如神经元、少突胶质细胞、神经胶质细胞、星形胶质细胞)、肺细胞、眼细胞(包括视网膜细胞、视网膜色素上皮和角膜细胞)、上皮细胞(例如消化道和呼吸道上皮细胞)、骨骼肌细胞(包括成肌细胞、肌管和肌纤维)、隔膜细胞、树突细胞、胰腺细胞(包括胰岛细胞)、肝细胞、胃肠道细胞(包括平滑肌细胞、上皮细胞)、心脏细胞(包括心肌细胞)、骨细胞(例如骨髓干细胞)、造血干细胞、脾细胞、角质形成细胞、成纤维细胞、内皮细胞、前列腺细胞、关节细胞(包括例如软骨、半月板、滑膜和骨髓)、生殖细胞等。作为替换方案,所述细胞可以是任何祖细胞。作为另一种替换方案,所述细胞可以是干细胞(例如神经干细胞、肝干细胞)。作为另一种替换方案,所述细胞可以是癌症或肿瘤细胞(癌症和肿瘤如上所述)。此外,所述细胞可以来自任何来源的物种,如上所述。
[0197]
为了将修饰的细胞施用给受试者,可将病毒载体在体外引入细胞。在具体的实施方案中,所述细胞已经从受试者体内移出,病毒载体被引入其中,然后将细胞重新放回受试
者体内。从受试者体内移出细胞以进行离体处理,接着将其放回受试者体内的方法是本领域已知的(参见例如美国专利第5,399,346号)。作为替换方案,可以将重组病毒载体引入来自另一个受试者的细胞中,引入培养的细胞中或者引入来自任何其他合适来源的细胞中,并将所述细胞施用给有需要的受试者。
[0198]
用于离体基因治疗的合适细胞如上文所述。施用给受试者的细胞剂量将随受试者的年龄、状况和种族以及细胞类型、细胞表达的核酸、施用模式等有所变化。通常,施用在药学上可接受的载体中的每一剂量时将有至少约102至约108或约103至约106个细胞被施用。在具体的实施方案中,用病毒载体转导的细胞以有效含量与药物载体组合施用给受试者。
[0199]
在一些实施方案中,可以施用已经用病毒载体转导的细胞以引发针对被递送的多肽(例如,作为转基因表达或在衣壳中表达)的免疫原性反应。通常,将能表达有效量的多肽的一定量的细胞与药学上可接受的载体的组合施用。任选地,该剂量足以产生保护性免疫应答(如上文所定义)。所赋予的保护程度不必是完全或永久的,只要施用免疫原性多肽的有益效果超过其任何缺点即可。
[0200]
本发明的又一方面是将本发明的病毒载体施用给受试者的方法。在具体的实施方案中,所述方法包括将目标多核苷酸递送至动物受试者的方法,该方法包括:将有效量的本发明的病毒载体施用给动物受试者。可以采用本领域已知的任何手段将本发明的病毒载体施用给有需要的人类受试者或有需要的动物。任选地,所述病毒载体是在药学上可接受的载体中以有效剂量递送。
[0201]
本发明的病毒载体可以进一步施用给受试者以引发免疫原性应答(例如作为疫苗)。通常,本发明的疫苗包含与药学上可接受的载体组合的有效量的病毒。任选地,该剂量足以产生保护性免疫应答(如上文所定义的)。所赋予的保护程度不必是完全或永久的,只要施用免疫原性多肽的有益效果超过其任何缺点即可。受试者和免疫原如上文所述。
[0202]
待施用给受试者的病毒载体的剂量取决于施用模式、待治疗的疾病或病症、个体受试者的状况、具体的病毒载体和待递送的核酸,并且它们可以以常规方式确定。达到治疗效果的示例性剂量是病毒滴度为至少约105、106、107、108、109、10
10
、10
11
、10
12
、10
13
、10
14
、10
15
、10
16
、10
17
、10
18
个转导单位或更多,优选为约107或108、109、10
10
、10
11
、10
12
、10
13
、10
14
、10
15
、10
16
个转导单位,更优选地为约10
12-10
14
个转导单位。
[0203]
在具体的实施方案中,所述施用可以超过一次(例如,2次、3次、4次或更多次施用),以在各种时间间隔的时间段(例如每天、每周、每月、每年等等)实现期望的基因表达水平。
[0204]
示例性的施用模式包括口服、直肠、经粘膜、局部、鼻内、吸入(例如采用气雾剂)、含服(例如舌下)、阴道、鞘内、眼内、透皮、子宫内(或卵内)、肠胃外(例如,静脉内、皮下、皮内、肌肉内[包括施用至骨骼、隔膜和/或心肌]、皮内、胸膜内、大脑内和关节内)、局部(例如,施用至皮肤和粘膜表面,包括气道表面,和经皮施用)、淋巴内等,以及直接组织或器官注射(例如,施用至肝、骨骼肌、心肌、膈肌或大脑)。也可以施用至肿瘤(例如,在肿瘤或淋巴结内或附近)。在任何给定情况下,最合适的途径将取决于所治疗疾病的性质和严重程度以及所使用的具体载体的性质。
[0205]
向任意这些组织的递送也可以通过递送包含病毒载体的储库来实现,所述储库可以被植入到组织中,或者所述组织可以与包含病毒载体的膜或其他基质接触。这类可植入
基质或底物的示例在美国专利第7,201,898号中有所描述。
[0206]
本发明可以用于治疗组织或器官的病症。作为替换方案,实施本发明可以将核酸递送至组织或器官,所述组织或器官可作为平台使用,用于生成通常在血液中循环的蛋白质产物(例如酶)或非翻译rna(例如,rnai、微小rna、反义rna),或用于全身递送至其他组织,以治疗病症(例如代谢紊乱,比如糖尿病(例如,胰岛素)、血友病(例如,因子ix或因子viii)或溶酶体贮积症(例如,戈谢病[葡糖脑苷脂酶]、庞佩氏病[溶酶体酸α-葡糖苷酶]或法布里病[α-半乳糖苷酶a])或糖原贮积症(比如庞佩氏病[溶酶体酸α葡糖苷酶])。上面描述了用于治疗代谢紊乱的其他合适蛋白质。
[0207]
注射剂可以以常规形式制备,或者作为液体溶液或混悬剂、在注射前适于形成液体溶液或在液体中的混悬剂的固体形式,或者作为乳剂。作为替换方案,可以以局部而不是全身方式施用病毒载体,例如以储库或缓释制剂施用。此外,病毒载体可以被干燥的递送至可手术植入的基质,例如骨移植替代物、缝合线、支架等(例如,如美国专利7,201,898所描述的)。
[0208]
适于口服施用的药物组合物可以以离散单元存在,比如胶囊、扁囊剂、锭剂或片剂,每个含有预定量的本发明组合物;作为粉末或颗粒;作为水性或非水性液体中的溶液剂或混悬剂;或者作为水包油或油包水型乳剂。口服给药可以通过将本发明的病毒载体与能够经受动物肠道消化酶降解的载体复合来进行。如本领域已知的,这种载体的示例包括塑料胶囊或片剂。这类制剂通过任何合适的制药方法制备,其包括使组合物和合适的载体(其可以包含一种或多种如上所述的助剂)结合的步骤。通常,根据本发明实施方案的药物组合物按如下步骤制备:将组合物与液体或精细粉碎的固体载体或两者均匀且紧密地混合,然后如果需要,使所得混合物成型。例如,可以通过压制或模制含有所述组合物的粉末或颗粒(任选地,含有一种或多种助剂)制备片剂。通过在合适的机器中压缩自由流动形式的组合物(比如任选地与粘合剂、润滑剂、惰性稀释剂和/或表面活性剂/分散剂混合的粉末或颗粒)来制备压制片剂。通过在合适的机器中模制用惰性液体粘合剂润湿的粉状化合物来制备模制片剂。
[0209]
适于含服(舌下)给药的药物组合物包括含有在调味基料(通常为蔗糖和阿拉伯胶或黄蓍胶)中的本发明组合物的的锭剂;和含有在惰性基质(如明胶和甘油或蔗糖和阿拉伯胶)中的组合物的软锭剂。
[0210]
适用于肠胃外给药的药物组合物可以包含本发明组合物的无菌水性和非水性注射溶液,该制剂任选地与预期的接受者的血液等渗。这些制剂可含有抗氧化剂、缓冲剂、抑菌剂和溶质,它们使组合物与预期的接受者的血液等渗。水性和非水性无菌混悬剂、溶液剂和乳剂可以包括悬浮剂和增稠剂。非水溶剂的示例是丙二醇、聚乙二醇、植物油(如橄榄油)和可注射的有机酯(如油酸乙酯)。含水载体包括水、酒精/水溶液、乳液或悬浮液,包括盐水和缓冲介质。肠胃外载体包括氯化钠溶液、林格氏葡萄糖、葡萄糖和氯化钠、乳酸林格氏液或固定油。静脉内载体包括流体和营养补充剂、电解质补充剂(例如基于林格氏葡萄糖的那些)等。也可以含有防腐剂和其他添加剂,例如抗菌剂、抗氧化剂、螯合剂和惰性气体等。
[0211]
所述组合物可以以单位/剂量容器或多剂量容器存在,例如在密封的安瓿和小瓶中,并且可以以冷冻干燥(冻干)条件存储,仅需要在使用前即时添加无菌液体载体,例如,盐水或注射用水。
[0212]
即时注射溶液和混悬剂可以由前文所述种类的无菌粉末、颗粒和片剂制备。例如,可以提供在密封容器中的单位剂量形式的本发明可注射的、稳定的无菌组合物。所述组合物可以以冻干物的形式提供,其可以用合适的药学上可接受的载体重构,以形成适于向受试者注射的液体组合物。单位剂型可以含约1μg至约10g的本发明组合物。当所述组合物基本上不溶于水时,其可以包含足够量的生理上可接受的乳化剂,足以使所述组合物在含水载体中乳化。一种这样的有用的乳化剂是磷脂酰胆碱。
[0213]
适合于直肠给药的药物组合物可以以单位剂量栓剂形式提供。它们可以通过将所述组合物与一种或多种常规固体载体(例如,可可脂)混合然后使所得混合物成型来制备。
[0214]
适用于局部施用于皮肤的本发明药物组合物可以采用软膏、乳膏、洗剂、糊剂、凝胶、喷雾剂、气雾剂或油的形式。可以使用的载体包括但不限于凡士林、羊毛脂、聚乙二醇、乙醇、透皮增强剂以及它们中两种或更多种的组合。在一些实施方案中,例如,局部递送可以通过将本发明的药物组合物与能够通过皮肤的亲脂性试剂(例如,dmso)混合来进行。
[0215]
适于透皮施用的药物组合物可以是适于与受试者的表皮长时间紧密接触的离散贴剂的形式。适于透皮施用的组合物也可以通过离子电渗疗法递送(参见例如pharm.res.3:318(1986)),并且通常采取本发明组合物的任选缓冲水溶液的形式。合适的制剂可以包含柠檬酸盐或bis\tris缓冲液(ph 6)或乙醇/水,并且可以含有0.1至0.2m活性成分。
[0216]
本文公开的病毒载体可以通过任何合适的手段施用至受试者的肺,例如通过施用受试者吸入的包含病毒载体的可吸入颗粒的气雾剂混悬剂。可吸入颗粒可以是液体或固体。如本领域技术人员已知的,包含病毒载体的液体颗粒的气雾剂可采用任何合适的手段生产,比如使用压力驱动的气雾剂雾化器或超声波雾化器。参见例如美国专利第4,501,729号。采用制药领域已知的技术,同样可以用任何固体颗粒药物气雾剂发生器生产包含病毒载体的固体颗粒的气雾剂。
[0217]
生成本发明的因子ix蛋白质
[0218]
很多表达载体可用于创建基因工程细胞。一些表达载体被设计用于在有利于选择的高表达细胞的各种条件下、在扩增转染细胞后表达大量的重组蛋白。一些表达载体被设计用于在选定压力下表达大量的重组蛋白而不需要进行扩增。本发明包括根据本领域的方法标准生产基因工程细胞,并且不依赖于任何特定表达载体或表达系统的使用。
[0219]
为了创建基因工程细胞以生成大量fix蛋白,采用含有编码蛋白质的多核苷酸(例如cdna)的表达载体转染细胞。在一些实施方案中,用选择的共转染酶表达fix蛋白,该酶能使fix蛋白在给定细胞系统中发生适当的翻译后修饰。
[0220]
细胞可以选自多种来源,只要该细胞可以用含有编码fix蛋白的核酸分子(例如cdna)的表达载体转染。
[0221]
除非另有说明,否则本发明的实践采用的是在本领域技术范围内分子生物学、微生物学、重组dna和免疫学中的常规技术。这些技术在文献中都有详细的解释。参见例如sambrook等人,molecular cloning;a laboratory manual,第2版,(1989);dna cloning,第i和ii卷(d.n glover编辑,1985);oligonucleotide synthesis(m.j.gait编辑,1984);nucleic acid hybridization(b.d.hames&s.j.higgins编辑,1984);transcription and translation(b.d.hames&s.j.higgins编辑,1984);animal cell culture(r.i.freshney
编辑,1986);immobilized cells and enzymes(irl press,1986);b.perbal,a practical guide to molecular cloning(1984);系列书籍,methods in enzymology(academic press,inc.),特别是第154和155卷(分别由wu和grossman以及wu编辑);gene transfer vectors for mammalian cells(j.h.miller和m.p.calos编辑1987,cold spring harbor laboratory);immunochemical methods in cell and molecular biology,mayer和walker编辑,(academic press,london,1987);scopes,protein purification:principles and practice,第2版,1987(springer-verlag,n.y.);以及handbook of experimental immunology,i-iv卷(d.m.weir和c.c.blackwell编辑1986)。说明书中引用的所有专利、专利申请和出版物通过引用整体并入本文。
[0222]
基因工程技术
[0223]
采用基因工程生成克隆基因、重组dna、载体、转化细胞、蛋白质和蛋白质片段是公知的。参见例如bell等人的美国专利第4,761,371号,第6栏第3行至第9栏第65行;clark等人的美国专利第4,877,729号,第4栏第38行到第7栏第6行;schilling的美国专利第4,912,038号,第3栏第26行至第14栏第12行;及wallner的美国专利第4,879,224号,第6栏第8行至第8栏第59行。
[0224]
载体是可复制的dna构建体。在本文中的载体或者用于扩增编码fix蛋白的核酸和/或用于表达编码fix蛋白的核酸。表达载体是可复制的核酸构建体,其中编码fix蛋白的核苷酸序列可操作地连接至能够实现核苷酸序列表达的合适的控制序列,以在合适的宿主细胞中生成fix蛋白。对这种控制序列的需要将根据所选的宿主细胞和选择的转化方法而不同。通常,控制序列包括转录启动子、控制转录的任选操纵子序列、编码合适的mrna核糖体结合位点的序列以及控制转录和翻译终止的序列。
[0225]
载体包含质粒、病毒(例如,aav、腺病毒、巨细胞病毒)、噬菌体和可整合的dna片段(即通过重组整合到宿主细胞基因组中的片段)。载体可独立于宿主细胞基因组进行复制和起作用(例如通过瞬时表达),或可整合到宿主细胞基因组本身上(例如稳定整合)。表达载体可含有能与待表达的核酸分子可操作连接并且可在宿主细胞和/或生物体中操作的启动子和rna结合位点。
[0226]
当dna区域或核苷酸序列在功能上彼此相关时,它们能可操作地连接或可操作地相关联。例如,如果启动子控制序列的转录,则其与编码序列可操作地连接;或者如果核糖体结合位点的定位位置是用于允许序列翻译,则该核糖体结合位点与编码序列可操作地连接。
[0227]
合适的宿主细胞包括原核生物、酵母或高等真核细胞(如哺乳动物细胞和昆虫细胞)。源自多细胞生物体的细胞是特别合适的可用于重组fix蛋白质合成的宿主,并且尤其优选的是哺乳动物细胞。这些细胞在细胞培养中的繁殖已成为常规程序(tissue culture,academic press,kruse和patterson编辑,(1973))。有用的宿主细胞系的示例有vero和海拉细胞、中国仓鼠卵巢(cho)细胞系以及wi138、hek 293、bhk、cos-7、cv和mdck细胞系。这些细胞的表达载体通常包括(如果需要的话)复制起点、位于编码fix蛋白的核苷酸序列上游并与其可操作地相关联的启动子,以及核糖体结合位点、rna剪接位点(如果使用了包含内含子的基因组dna)、聚腺苷酸化位点和转录终止序列。在一个实施方案中,表达可以使用美国专利第5,888,809号的表达系统在中国仓鼠卵巢(cho)细胞中进行,所述专利通过引用整
体并入本文。
[0228]
用于转化脊椎动物细胞的表达载体中的转录和翻译控制序列通常由病毒来源提供。非限制性示例包括来源于多瘤病毒、腺病毒2和猿猴病毒40(sv40)的启动子。参见例如美国专利第4,599,308号。
[0229]
复制起点可以或者通过构建包含外源起源(例如可以来源于sv40或其他病毒(例如多瘤病毒、腺病毒、vsv或bpv)来源)的载体来提供,或者可以由宿主细胞染色体复制机制提供。如果载体整合到宿主细胞染色体中,后者通常就足够了。
[0230]
若不使用含有病毒复制起点的载体,可以通过采用利用选择性标记和编码fix蛋白的核酸分子共转化的方法转化哺乳动物细胞。合适的选择性标记的非限制性示例是二氢叶酸还原酶(dhfr)或胸苷激酶。该方法在美国专利第4,399,216号中有进一步的描述,该专利通过引用整体并入本文中。
[0231]
其他适于在重组脊椎动物细胞培养中合成fix蛋白的方法包括在gething等人,nature 293:620(1981);mantei等人,nature 281:40和levinson等人的欧洲专利申请117,060a和117,058a中描述的那些,其每一个的全部内容在此通过引用并入本文。
[0232]
可以用宿主细胞(如昆虫细胞(例如,培养的草地贪夜蛾(spodoptera frugiperda)细胞))和表达载体(如杆状病毒表达载体(例如,来源于苜蓿银纹夜蛾(autographa californica)mnpv、粉纹夜蛾(trichoplusia ni)mnpv、薄荷灰夜蛾(rachiplusia ou)mnpv,或galleria ou mnpv的载体))实施本发明,如smith等人的美国专利第4,745,051号和第4,879,236号描述的。一般来说,杆状病毒表达载体包含杆状病毒基因组,该基因组含有待表达的核苷酸序列,该核苷酸序列在从多角体蛋白转录起始信号至atg起始位点的范围中的位置处并在杆状病毒多角体蛋白启动子的转录控制下插入多角体蛋白基因中。
[0233]
原核生物宿主细胞分别包括革兰氏阴性或革兰氏阳性生物体,例如大肠杆菌(e.coli)或杆菌。如本文所述的,高等真核细胞包括哺乳动物来源建立的细胞系。示例性的细菌宿主细胞为大肠杆菌w3110(atcc 27,325)、大肠杆菌b、大肠杆菌x1776(atcc 31,537)和大肠杆菌294(atcc 31,446)。各种合适的原核生物和微生物载体都是可用的。通常使用pbr322转化大肠杆菌。在重组微生物表达载体中最常用的启动子包括β-内酰胺酶(青霉素酶)和乳糖启动子系统(chang等人,nature 275:615(1978);和goeddel等人,nature 281:544(1979))、色氨酸(trp)启动子系统(goeddel等人,nucleic acids res.8:4057(1980)和欧洲专利申请公开36,776)以及tac启动子(de boer等人,proc.natl.acad.sci.usa 80:21(1983))。启动子和shine-dalgarno序列(用于原核宿主表达)可与编码fix蛋白的核酸可操作地连接,即可定位它们的位置来促进来自dna的fix信使rna的转录。
[0234]
真核微生物(如酵母培养物)也可以用蛋白质编码的载体转化(参见例如美国专利第4,745,057号)。尽管许多其他菌株通常是可用的,但酿酒酵母是低等真核宿主微生物中最常使用的。酵母载体可含有来自2微米酵母质粒或自主复制序列(ars)的复制起点、启动子、编码fix蛋白的核酸、用于聚腺苷酸化和转录终止的序列以及选择基因。示例性质粒是yrp7,(stinchcomb等人,nature 282:39(1979);kingsman等人,gene 7:141(1979);tschemper等人,gene 10:157(1980))。酵母载体中合适的启动序列包括用于金属硫蛋白、3-磷酸甘油酸激酶的启动子(hitzeman等人,j.biol.chem.255:2073(1980)或其他糖酵解
酶(hess等人,j.adv.enzyme reg.7:149(1968);以及holland等人,biochemistry 17:4900(1978))。适于在酵母表达中使用的载体和启动子在r.hitzeman等人的欧洲专利公开73,657中有进一步的描述。
[0235]
本发明的克隆编码序列可编码任何来源物种的fix,包括小鼠、大鼠、狗、负鼠、兔、猫、猪、马、羊、牛、豚鼠、负鼠、鸭嘴兽和人,但优选编码人fix蛋白。也包括能与编码本文公开的蛋白质的核酸杂交的编码fix的核酸。与以标准原位杂交法编码本文公开的fix蛋白的核酸相比,这些序列的杂交可以在降低的严格条件或甚至在严格条件下(例如,以在60℃或甚至70℃下的0.3m nacl、0.03m柠檬酸钠、0.1%sds的洗涤严格性为代表的严格条件)进行。参见例如sambrook等人,molecular cloning,a laboratory manual(第2版,1989)冷泉港实验室)。
[0236]
根据本发明生成的fix蛋白可以通过已知方法在转基因动物中表达。参见例如美国专利第6,344,596号,其全部内容通过引用并入本文。简而言之,转基因动物可以包括但不限于农场动物(例如,猪、山羊、绵羊、牛、马、兔等)、啮齿动物(比如小鼠、大鼠和豚鼠)和家养宠物(例如,猫和狗)。在一些实施方案中,尤其优选的是家畜类动物,如猪、绵羊、山羊和牛。
[0237]
本发明的转基因动物通过将合适的编码本发明人fix蛋白的多核苷酸引入单细胞胚胎中生成,采用的方式为能使所述多核苷酸稳定整合到成熟动物生殖系细胞的dna中并以正常的孟德尔方式得到遗传。本发明的转基因动物将具有在体液和/或组织中生成fix蛋白的表型。fix蛋白质可以从这些流体和/或组织中移出并得到加工,例如用于治疗用途。(参见例如clark等人,“expression of human anti-hemophilic factor ix in the milk of transgenic sheep”bio/technology 7:487-492(1989);van cott等人,“haemophilic factors produced by transgenic livestock:abundance can enable alternative therapies worldwide”haemophilia 10(4):70-77(2004),它们的全部内容通过引用并入本文中)。
[0238]
可通过各种手段将dna分子引入胚胎,包括但不限于显微注射、磷酸钙介导的沉淀、脂质体融合或者全能或多能干细胞的逆转录病毒感染。然后将转化的细胞引入胚胎并整合进去,以形成转基因动物。产生转基因动物的方法描述在例如l.m.houdebine的transgenic animal generation and use,harwood academic press,1997中。转基因动物还可以使用例如campbell等人nature 380:64-66(1996)和wilmut等人,nature 385:810-813(1997)中所描述的使用胚胎或成人细胞系进行细胞核移植或克隆的方法产生。另外,可以使用利用细胞质注射dna的技术,如美国专利第5,523,222号中描述的。
[0239]
产生fix的转基因动物可以通过引入包含fix-编码序列的嵌合构建体来获得。获得转基因动物的方法是公知的。参见例如hogan等人,manipulating the mouse embryo,(cold spring harbor press 1986);krimpenfort等人,bio/technology 9:88(1991);palmiter等人,cell 41:343(1985),kraemer等人,genetic manipulation of the early mammalian embryo,(cold spring harbor laboratory press 1985);hammer等人,nature 315:680(1985);wagner等人,美国专利第5,175,385号;krimpenfort等人,美国专利第5,175,384号;janne等人,ann.med.24:273(1992),brem等人,chim.oggi.11:21(1993),clark等人,美国专利第5,476,995号,所有这些通过引用整体并入本文。
[0240]
在一些实施方案中,可以使用在乳腺组织中有“活性”的顺式作用调节区,因为在合成母乳的生理条件下,启动子在乳腺组织中比在其他组织中更有活性。这类启动子包括但不限于短和长乳清酸性蛋白(wap)、短和长α、β和κ酪蛋白、α-乳白蛋白和β-乳球蛋白(“blg”)启动子。根据本发明还可以使用信号序列,其指导表达的蛋白质分泌到其他体液,特别是血液和尿液中。这类序列的示例包括分泌的凝血因子的信号肽,包括fix、蛋白质c和组织型纤溶酶原激活剂的信号肽。
[0241]
在调节转录的有用序列中,除了前文讨论的启动子之外,还有增强子、剪接信号、转录终止信号、聚腺苷酸化位点、缓冲序列、rna加工序列和调节转基因表达的其他序列。
[0242]
优选地,所述表达系统或构建体包含在编码所需的重组蛋白的核苷酸序列下游的3'非翻译区。该区域可以提高转基因的表达。在这方面有用的3'非翻译区是提供poly a信号的序列。
[0243]
合适的异源3'-非翻译序列可以来源于例如sv40小t抗原、酪蛋白3'非翻译区或本领域公知的其他3'非翻译序列。核糖体结合位点在提高fix表达效率方面也很重要。同样,调节fix的翻译后修饰的序列在本发明中是有用的。
[0244]
上文已经描述了本发明,其将在下面的实施例中得到更详细地解释,包含在本发明中的这些实施例仅用于说明目的,它们不用于对本发明进行限制。
[0245]
实施例1
[0246]
基因表达盒的构建
[0247]
为了提高人因子ix基因的表达效率和寿命,我们已经做了许多努力来实现这一目标:1)通过合成许多设计者启动子来获得肝特异性和强活性;2)通过使用启动子之后的小内含子来提高转基因mrna加工的效率;并在基因的蛋白质编码区重新插入第二个小内含子;3)通过优化5'非翻译序列以减少二级结构等来提高转基因产物蛋白质合成的翻译效率;4)优化人类密码子使用、减少cpg基序以及减少长g和c轨道;5)使用双向聚腺苷酸化序列进行有效的polya合成并阻断来自aav的3'反向末端重复序列(itr)的残基反义启动子活性。
[0248]
我们设计并完全合成了许多含有保守的基础启动子元件和转录起始位点的人工启动子。所述基础启动子在其5'末端与许多用于肝特异性表达的肝特异性转录因子结合位点连接。由于尺寸小(188bp)以及使用萤光素酶报道基因和在人肝癌细胞系huh7中进行转染实验时体外初步筛选的高活性,选择名为lxp2.1(图1)(seq id no:1)的启动子(表4)。在将gaussia萤光素酶表达盒包装在aav8病毒颗粒中并注射到小鼠尾静脉后,我们进一步测试了lxp2.1启动子和体内普遍存在的强cmv启动子。在静脉注射5
×
10
10
个载体基因组(v.g.)/小鼠2周后,使用从小鼠获取的血清测定萤光素酶表达(表5)。lxp2.1启动子比cmv启动子强约4倍。
[0249]
表4
[0250][0251]
表5
[0252]
启动子荧光素酶活性/μl血清aav8-cmv-gluc22,543
±
15,308aav8-lxp2.1-gluc82,240
±
23,045
[0253]
为了提高体内因子ix的基因表达,我们采取了两种方法来实现这一目标。首先,我们使用geneart(invitrogen)的人密码子优化程序完全合成了人因子基因的编码序列,其目的是最大限度地利用更有效的密码子。另外,我们尝试减少或去除合成的因子ix基因中的所有cpg序列。已有文献记载,该基因中的cpg岛或基序可诱导先天性免疫反应(例如,toll样受体9(tlr9)介导的免疫应答(bauer等人,proc.natl.acad.sci.usa 98(16):9237(2001))并且也可能导致基因沉默。在因子ix基因-1(seq id no:6)和因子ix基因-2(seq id no:7)中,cpg基序被完全去除。然而,在因子ix基因-3(seq id no:8)中,仅去除了tcg和cgt序列。据报道,在人类细胞中,保守的cpg基序(gtcgtt)是触发tlr9应答的最有效的基序。去除tcg和cgt基序能有效去除gtcgtt元件。
[0254]
已有充分的文献记载内含子通过促进前mrna加工和提高基因表达来发挥其功能。人因子ix基因的天然内含子的大小相对较大,不适合作为我们的基因表达盒。为了进一步提高因子ix的基因表达,我们合成了小的人内含子(seq id nos:4和5)。将第一个内含子插入到aag和g之间的人工5'非翻译区(5'utr)(seq id no:4)中。将第二个内含子(seq id no:5)插入核苷酸cag和g之间的基因的5'编码区(共有的外显子/内含子连接位点)。带有人工内含子(seq id no:5)插入物的上述三种基因的完整dna序列分别列为seq id no:6、7和8。虽然我们没有检测在因子ix基因的编码序列中人工内含子1的插入和/或在5'utr中内含子2的插入,但我们预期可以获得相似的结果。
[0255]
实施例2
[0256]
基因表达盒的体外表达
[0257]
为了测试设计者人因子ix基因表达盒是否在细胞中起作用,我们将上述表达盒转染到huh7细胞系中。huh7通常用于测试在肝细胞中显示出活性的启动子。由于huh7细胞不产生任何内源性凝血因子ix,使用未转染的细胞作为阴性对照。该实验的目的是观察我们的新型因子ix构建体是否可以生成功能性因子蛋白质,该蛋白质在细胞外被分泌到人类细胞的细胞培养基中。转染后24小时,用无血清培养基代替细胞培养基并继续培养24小时。随后,收集细胞培养基并进行aptt测试,这是常用的体外凝血活性测试。我们的结果表明,我们的所有构建体均表达并分泌了高水平的因子ix蛋白质(图3)。我们的基因表达盒的功能性的这种证实促使我们在血友病b小鼠(一种临床相关的动物模型)中进行体内基因表达实验。
[0258]
实施例3
[0259]
基因表达盒的体内表达
[0260]
由于体外细胞培养物转染实验表明,带有人工内含子-2(seq id no:4)的密码子优化的人因子ix基因-1的基因表达盒更有效,我们选择侧接了aav反向末端重复序列(itr)的这种构建体,并将其包装到aav8血清型载体中,该载体是小鼠肝脏中用于高水平表达的强肝脏嗜性(liver-tropic)aav载体。为了研究密码子优化的人因子ix基因-1是否在其他血清型的aav载体中起作用,我们将其包装在具有工程化衣壳的新型aav载体(aavxl14)中。所述载体经两次cscl密度超离心纯化,对生理盐水透析并在page凝胶分离后通过dna斑点印迹和aav衣壳蛋白银染色进行滴定。同时,以前报道的人因子ix基因表达盒(wu等人,mol.ther.16(2):280(2008)),命名为f9-zwu,作为阳性对照被包装在aav8载体中。该盒含有肝脏特异性ttr启动子和不同密码子优化的人因子ix基因,但含有相同的氨基酸r338l突变(padua突变;simioni等人,n.engl.j.med 361(17):1671(2009))。
[0261]
为了测试因子ix表达盒在体内的有效性,我们选择使用六周龄的雄性因子ix基因敲除小鼠(通常使用的血友病b动物模型)。将上述载体以4种不同剂量1
×
10
10
vg/kg(载体基因组/kg体重)、4
×
10
10
vg/kg、1
×
10
11
vg/kg和4
×
10
11
vg/kg通过尾静脉进行静脉注射(表4)。使用未处理的年龄和性别匹配的因子ix ko小鼠作为阴性对照。使用标准方法经由眶后静脉每2周收集血浆。将血浆样品在-80℃下冷冻以用于进一步测试。为了定量评估人因子ix基因表达,使用逐级稀释在严重血友病b患者的血浆中的纯化重组人因子ix作为因子ix活性的标准曲线,对血浆样品进行常规aptt测试。
[0262]
我们的结果显示所有aav载体能在ko小鼠中表达人因子ix(表6)。但是,我们的fix基因-1表达盒比先前报道的阳性对照载体f9-zwu明显更有效(wu等人,mol.ther.16(2):280(2008))。例如,在1
×
10
11
vg/kg和4
×
10
11
vg/kg的载体剂量下,我们的载体达到的表达水平约为阳性对照载体的25和34倍。在载体剂量低至1
×
10
10
vg/kg体重时,我们的载体能够达到人因子活性的正常生理水平的大约140%。另外,在所有测试剂量下,人因子基因表达能稳定长达20周(图4和表7),这是体内实验的持续时间。因此,我们的结果表明,所述基因表达不仅强大而且长期。fix ko小鼠中持续高水平表达fix-1基因产物并未引起任何明显的不利影响。
[0263]
表6
[0264]
载体1
×
10
10
vg/kg4
×
10
10
vg/kg1
×
10
11
vg/kg4
×
10
11
vg/kgaav8.f9-1140.2
±
12.5324.6
±
64.2624.2
±
119.03557
±
600aavxl14f9-1未测试105.1
±
22.2未测试1651
±
659aav8-f9-zwu《1%未测试25.4
±
16.7105.3
±
102.6
[0265]
在载体注射后2周测量因子ix活化产物(n =7)。
[0266]
因子ix活性以正常人血浆水平的百分比显示。
[0267]
表7
[0268]
剂量w2w4w6w8w12w15w201
×
10
10
vg/kg140.3
±
11.5174.4
±
24.9142.7
±
5.6138.1
±
4.7122.0
±
17.7137.1
±
30.097.1
±
28.04
×
10
10
vg/kg324.7
±
64.3350.2
±
81.3354.0
±
90.4328.0
±
64.5318.0
±
61.1360.7
±
52.0319.2
±
67.81
×
10
11
vg/kg624.0
±
110.5939.9
±
196.21023.2
±
291.5959.2
±
290.8889.6
±
315.4822.4
±
220.1808.6
±
272.04
×
10
11
vg/kg3557.8
±
600.62815.7
±
655.23648.8
±
503.03361.3
±
578.63458.4
±
593.52847.2
±
650.32820.8
±
696.4
[0269]
因子ix活性采用正常人血浆水平的百分比显示。
[0270]
本领域技术人员将理解,在不脱离本发明的精神的情况下可以做出许多各种各样的修改。因此,应该清楚地理解,本发明的形式仅仅是说明性的,并不意图限制本发明的范围。
[0271]
所有出版物、专利申请、专利、专利公开、由数据库登记号表示的序列和本文引用的其他参考文献通过引用整体并入,用于对与这些参考文献所在的句子和/或段落相关的内容进行教导。
[0272]
以上内容是对本发明的说明,而不应被解释为对其进行限制。本发明由所附权利要求以及本发明所包含的所述权利要求的等同权利要求限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1