一株具有溶藻活性的路氏肠杆菌及其透性化微球制备方法
1.本发明属于功能微生物应用于水体环境治理技术领域,尤其涉及一株具有溶藻活性的路氏肠杆菌及其透性化微球制备方法。
背景技术:
2.由于工农业污水处理或排放不当,水体中氮、磷等营养物质含量过剩引起的富营养化使蓝藻水华现象频发,其带来的直接严重后果是破坏水体环境的同时,也对人畜产生危害,甚至直接威胁供水安全,影响生产生活用水质量。蓝藻水华频繁暴发已经成为世界范围内关注的环境问题,其主要危害之一是有害藻类水华(harmful algal blooms,habs)向水体中释放具有生物毒性的蓝藻毒素,包括微囊藻毒素、蛤蚌毒素、鱼腥藻毒素、节球藻毒素和柱孢藻毒素等对水生生物产生不利影响。同时,被这些毒素污染的水体通过灌溉会进入农田生态系统,进而影响作物生长,并可能通过生物富集效应经食物链威胁人类健康。物理、化学除藻方法不仅投入成本高、处理方式单一,还会产生二次污染等问题,而基于溶藻菌的微生物防治手段成为抑制藻类生长和改善水环境质量的有效途径。目前,已有多株溶藻菌被发现,主要是属于芽孢杆菌属的解淀粉芽孢杆菌、枯草芽孢杆菌等,但其中仅有少部分被应用于实际生产中。如公开号为:cn109593681a《一种防治水产养殖蓝藻水华的复合菌剂及其制备方法和应用》公开了一种枯草芽孢杆菌与解淀粉芽孢杆菌制成的复合菌剂对水产养殖蓝藻水华进行防治。公开号为:cn106148264a《一株具有增强的溶藻能力的解淀粉芽孢杆菌及其应用》公开了一种在解淀粉芽孢杆菌中导入sz多肽增强其溶藻能力的方法。公开号为:cn1563355a《一种肠杆菌及其制备方法和应用》公开了一种肠杆菌分离及其菌液对蓝藻水华的控制应用,其作用方式是直接利用肠杆菌菌液喷洒。现有公开的技术中还没有利用路氏肠杆菌防治蓝藻水华。
技术实现要素:
3.针对现有技术不足,本发明的目的在于提供一株具有溶藻活性的路氏肠杆菌及其透性化微球制备方法,采用路氏肠杆菌来防治蓝藻水华,所用路氏肠杆菌分离自再生水,无基因修饰,取其发酵上清液,无二次污染风险。
4.本发明提供如下技术方案:
5.一株具有溶藻活性的路氏肠杆菌及其透性化微球制备方法,包括以下步骤:
6.a:发酵上清液制备,在恒温摇床上培养路氏肠杆菌,离心去除菌体,得到发酵上清液;
7.b、固定化微球制备,生物质炭与发酵上清液按一定比例混合均匀,再与等体积的经过灭菌冷却至室温的聚乙烯醇和海藻酸钠溶液混合均匀,混合液用注射器滴加到cacl2溶液中,然后进行搅拌持续固定,用蒸馏水洗涤,得到直径为3-4mm的固定化微球;
8.c、固定化微球的透性化处理,将待处理的固定化微球经透性化处理后投入无菌水中洗涤,透性化处理后的微球通透性增加,反应表面积增大,反应的扩散能力提高。
9.优选的,恒温摇床在25-35℃、180rmp条件下培养路氏肠杆菌,8000rpm离心去除菌体,得到发酵上清液。
10.优选的,所述生物质炭与发酵上清液按质量比0.8-1.2:4.5-5.5混合均匀,所述聚乙烯醇和海藻酸钠溶液中聚乙烯醇和海藻酸钠的体积比为4.5-5.5:0.8-1.2。
11.优选的,所述混合液用医用注射器于10-15cm处滴加到20g/l cacl2溶液中,然后在磁力搅拌器中搅拌持续固定4h后,用蒸馏水洗涤3次。
12.优选的,在搅拌过程中采用顺时针和逆时针循环搅拌的方式进行搅拌,其中顺时针搅拌和逆时针搅拌时长相同,所述搅拌转速为50-80r/min,由顺时针搅拌切换至逆时针搅拌或者由逆时针搅拌切换至顺时针搅拌所用时间为30s,从而使固定化微球为近似球形,增加固定化微球的表面积和反应面积。
13.优选的,在混合液用医用注射器于10-15cm处滴加到20g/l cacl2溶液过程中,两个液滴之间的时间间隔不小于2s。
14.优选的,所述透性化处理为物理冻融法处理,将待处理的固定化微球在-20℃和4℃条件下反复冻融后投入无菌水中洗涤3-5次,反复冻融使微球中的冰晶结构破坏,形成的微囊结构相当于一个生物反应器,易于回收,可以实现重复利用。
15.优选的,所述固定化微球在-20℃环境下的时间t1和4℃环境下的时间t2,t1和t2之比t1:t2=1:1.2,从而减少冻融法透性化处理对微球的损坏。
16.优选的,所述生物质炭采用花生壳生物质炭,其具有丰富的多孔结构、吸附能力强、比表面积大的特点。
17.优选的,用于防治蓝藻水华。
18.优选的,所用路氏肠杆菌分离自再生水,无基因修饰,取其发酵上清液,无二次污染风险。
19.优选的,在固定化微球制备中,采用洗涤设备进行清洗,所述洗涤设备包括水槽和洗涤容器,所述洗涤容器的下侧设置有通孔,所述洗涤容器的上侧设置有振动电机,所述洗涤容器的下表面设置有弹簧,所述弹簧的另一端与水槽连接,在振动电机的作用下,所述洗涤容器的振动轨迹为圆形。
20.优选的,所述洗涤容器的内侧下表面设置有弧形限位道,所述弧形限位道之间形成清洗槽,在振动电机的作用下,所述固定化微球在清洗槽内滚动,同时,洗涤容器内的水对固定化微球形成冲击的作用,从而实现对固定化微球清洗的目的。
21.优选的,所述清洗槽的宽度为5-6mm,所述清洗槽的底部也设置有通孔。
22.与现有技术相比,本发明具有以下有益效果:
23.(1)本发明一株具有溶藻活性的路氏肠杆菌及其透性化微球制备方法,采用路氏肠杆菌来防治蓝藻水华,所用路氏肠杆菌分离自再生水,无基因修饰,取其发酵上清液,无二次污染风险。
24.(2)本发明一株具有溶藻活性的路氏肠杆菌及其透性化微球制备方法,采用透性化细胞制备的方法将发酵菌液的上清液制备成透性化微球,所得制剂安全无污染,可回收重复利用,成本低廉,应用前景广阔。
25.(3)本发明一株具有溶藻活性的路氏肠杆菌及其透性化微球制备方法,其培养易于操作,不会引入生物污染,适用于水处理领域实际推广应用。
26.(4)本发明一株具有溶藻活性的路氏肠杆菌及其透性化微球制备方法,选择花生壳生物质炭,其具有丰富的多孔结构、吸附能力强、比表面积大的特点,使透性化微球具有良好的防治蓝藻水华的效果。
附图说明
27.为了更清楚地说明本发明实施方式的技术方案,下面将对实施方式中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
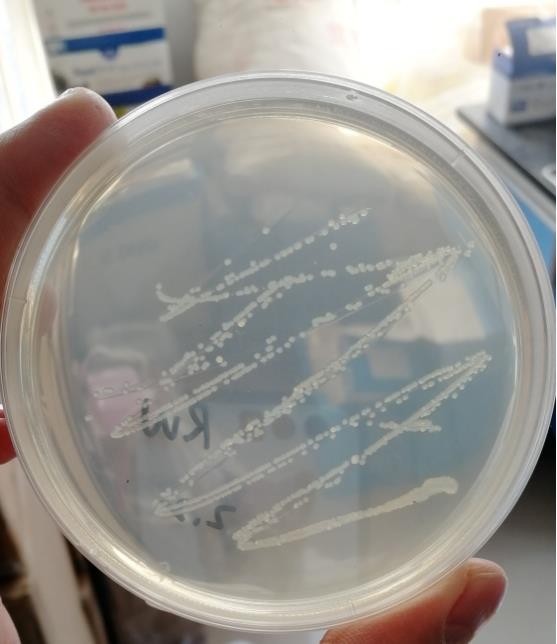
28.图1为本发明的路氏肠杆菌划线平板图。
29.图2为本发明的溶藻试验处理图。
30.图3为本发明的抑藻效率图。
31.图4为固定化微球图。
32.图5为透性化微球图。
33.图6为透性化微球溶藻效果图。
34.图7为本发明的洗涤设备示意图。
35.图8为本发明的洗涤容器底面示意图。
具体实施方式
36.为使本发明实施方式的目的、技术方案和优点更加清楚,下面将结合本发明实施方式中的附图,对本发明实施方式中的技术方案进行清楚、完整地描述。显然,所描述的实施方式是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
37.因此,以下对在附图中提供的本发明的实施方式的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
38.实施例一:
39.a:发酵上清液制备,在恒温摇床上培养路氏肠杆菌,离心去除菌体,得到发酵上清液;
40.b、固定化微球制备,生物质炭与发酵上清液按一定比例混合均匀,再与等体积的经过灭菌冷却至室温的聚乙烯醇和海藻酸钠溶液混合均匀,混合液用注射器滴加到cacl2溶液中,然后进行搅拌持续固定,用蒸馏水洗涤,得到直径为3-4mm的固定化微球,如图4所示;
41.c、固定化微球的透性化处理,将待处理的固定化微球经透性化处理后投入无菌水中洗涤,透性化处理后的微球通透性增加,反应表面积增大,反应的扩散能力提高,如图5所示;
42.恒温摇床在25-35℃、180rmp条件下培养路氏肠杆菌,8000rpm离心去除菌体,得到
发酵上清液。所述生物质炭与发酵上清液按质量比0.8-1.2:4.5-5.5混合均匀,所述聚乙烯醇和海藻酸钠溶液中聚乙烯醇和海藻酸钠的体积比为4.5-5.5:0.8-1.2。
43.所述混合液用医用注射器于10-15cm处滴加到20g/lcacl2溶液中,然后在磁力搅拌器中搅拌持续固定4h后,用蒸馏水洗涤3次。
44.在固定化微球制备时,在搅拌过程中采用顺时针和逆时针循环搅拌的方式进行搅拌,其中顺时针搅拌和逆时针搅拌时长相同,所述搅拌转速为50-80r/min,由顺时针搅拌切换至逆时针搅拌或者由逆时针搅拌切换至顺时针搅拌中间停留时间为30s,从而使固定化微球处于短暂的静止状态,然后在继续搅拌,从而使固定化微球为近似球形,增加固定化微球的表面积和反应面积。当由顺时针搅拌切换至逆时针搅拌或者由逆时针搅拌切换至顺时针搅拌中间停留时间少于30s时,固定化微球切换转向急速,对固定化微球的冲击多大,生成的固定化微球呈椭圆形结构,减小了固定化微球的反应面积。
45.在混合液用医用注射器于10-15cm处滴加到20g/l cacl2溶液过程中,两个液滴之间的时间间隔不小于2s。混合液从10-15cm处滴入至cacl2溶液中,其液滴滴入cacl2溶液的瞬间呈头大尾小状,整体结构呈椭圆形,与cacl2溶液的接触面积较大,与cacl2溶液接触后,在其重力的作用下和惯性的作用下,从而便于形成直径为3-4mm的固定化微球。当混合液与20g/l cacl2溶液距离大于15cm时,由于液滴与cacl2溶液之间的冲击力较大,生成的固定化微球呈扁平状,降低了固定化微球的溶藻率;当混合液与20g/l cacl2溶液距离小于10cm时,其液滴滴入cacl2溶液的瞬间呈球形,与cacl2溶液接触的面积较小,不利于固定化微球的固化过程,搅拌用于较长,效率较低。
46.所述透性化处理为物理冻融法处理,将待处理的固定化微球在-20℃和4℃条件下反复冻融后投入无菌水中洗涤3-5次,反复冻融使微球中的冰晶结构破坏,形成的微囊结构相当于一个生物反应器,易于回收,可以实现重复利用。
47.所述固定化微球在-20℃环境下的时间t1和4℃环境下的时间t2,t1和t2之比t1:t2=1:1.2,从而减少冻融法透性化处理对固定化微球的损坏。当满足所述固定化微球在-20℃环境下的时间t1和4℃环境下的时间t2,t1和t2之比t1:t2=1:1.2时,固定化微球的抑藻效率高达95.1%,当t1:t2=1:1.4时,固定化微球的抑藻效率为82.6%;当t1:t2=0.8:1.2时,固定化微球的抑藻效率为81.2%,可知,当t1:t2=1:1.2时,固定化微球的抑藻效率最高。
48.所述生物质炭采用花生壳生物质炭,其具有丰富的多孔结构、吸附能力强、比表面积大的特点。所述固定化微球用于防治蓝藻水华。
49.结合图7-8所示,在固定化微球制备中,采用洗涤设备进行清洗,所述洗涤设备包括水槽1和洗涤容器3,所述洗涤容器3的下侧设置有通孔,所述洗涤容器3的上侧设置有振动电机4,所述洗涤容器的下表面设置有弹簧7,所述弹簧7的另一端与水槽1连接,在振动电机的作用下,所述洗涤容器的振动轨迹为圆形。
50.所述洗涤容器3的内侧下表面设置有弧形限位道5,所述弧形限位道5之间形成清洗槽6,在振动电机的作用下,所述固定化微球在清洗槽6内滚动,同时,洗涤容器内的水对固定化微球形成冲击的作用,从而实现对固定化微球清洗的目的,洗涤效果较好。所述清洗槽6的宽度为5-6mm,所述清洗槽的底部也设置有通孔。
51.实施例二
52.a:发酵上清液制备,在恒温摇床上培养路氏肠杆菌,离心去除菌体,得到发酵上清液;
53.b、固定化微球制备,生物质炭与发酵菌液上清按质量比1:5混合均匀,再与等体积的经过灭菌冷却至室温的聚乙烯醇(pva)和海藻酸钠(sa)溶液混合均匀,聚乙烯醇(pva)和海藻酸钠(sa)的体积比为5:1,混合液用医用注射器于10cm处滴加到20g/l cacl2溶液中,然后在磁力搅拌器中搅拌持续固定4h后,用蒸馏水洗涤3次,得到直径约为3~4mm的固定化微球;
54.c、固定化微球的透性化处理,将待处理的固定化微球在-20℃和4℃条件下反复冻融后投入无菌水中洗涤3次,备用;反复冻融使微球中的冰晶结构破坏形成的微囊结构相当于一个生物反应器,易于回收,可以实现重复利用;
55.d:在培养至稳定期的铜绿微囊藻溶液中,按5%的量投加透性化微球,处理后的溶藻率达到90%以上。
56.实施例三
57.结合图1-8所示:
58.1、菌株分离与鉴定
59.该菌株从污水厂尾水中分离得到。具体方法如下:采集水样进行梯度稀释,用平板涂布方法培养后挑取单菌落进行溶藻试验,将具有高溶藻活性的菌落划线培养,如图1所示。该菌株30℃培养条件下在lb、pda、ashby培养基上均能够生长,菌落形态存在差异。lb培养基产生圆形略凸的淡黄色菌落,pda培养基产生凸起的粘稠状乳白色菌落,ashby培养基产生无色透明水滴状菌落,如图2所示;生理生化特征如表1所示:
60.表1肠杆菌生理生化特征
61.指标结果指标结果半固体琼脂+mr-vp试验+鸟氨酸脱羧酶肉汤+苯丙氨酸-赖氨酸脱羧酶肉汤+甘露醇+氨基酸脱羧酶对照-肌醇+西蒙氏枸橼酸盐+山梨醇+硫化氢-蜜二糖+尿素酶+核糖醇-蛋白胨水(色氨酸肉汤)-棉子糖-62.分子鉴定:提取菌株dna,利用细菌16s rrna基因特异性引物进行pcr扩增,将pcr产物送至上海生工生物工程股份有限公司测序,测序序列如下:
[0063][0064]
经过序列比对,菌株16s rrna编码基因与肠杆菌属中的路氏肠杆菌具有99%的相似性。
[0065]
2、溶藻试验
[0066]
将冰箱冷藏保存的已分离纯化并鉴定的路氏肠杆菌菌株,接种于高温高压灭菌的lb液体培养基中,置于恒温摇床在30℃及180rmp条件下活化培养。按2%接种量将活化后的菌液接种到新的lb培养基中培养48h,得到试验用培养菌液。选择引起我国水华爆发的优势种群铜绿微囊藻作为目标藻类,铜绿微囊藻(microcystis aeruginosa)(fachb-905)购自中国科学院淡水藻种库。
[0067]
(1)将试验用菌液8000rpm离心10min,收集离心后的菌体,用无菌的藻类bg11培养基重悬得到菌悬液;
[0068]
(2)将试验用菌液8000rpm离心10min,收集离心后的菌体,用无菌lb培养基重悬,得到含培养基菌悬液;
[0069]
(3)将试验用菌液8000rpm离心10min,收集离心后的上清液,利用0.22μm的针头式过滤器过滤除菌,得到无菌上清液;
[0070]
(4)将试验用菌液8000rpm离心10min,收集离心后的上清液,经过0.22μm的针头式过滤器过滤的无菌上清液,利用高温高压灭菌,得到高温处理的无菌上清液;
[0071]
(5)试验用菌液经过高温高压灭菌后,得到灭菌菌液;
[0072]
(6)将藻种从试管转入灭过菌的小三角瓶中(20-50ml),转接2/3藻种,转接时藻液:培养基(bg11)为1:2。放置到光照培养箱中培养,温度为25℃、光照强度为2000lux、光暗比12h:12h。培养二周左右。二周后观察,如生长较好后,再次进行转接,比例为1:5至1:6,并将剩余藻种转接。
[0073]
(7)取上述预处理的菌液、上清液,按2%接种量加入到铜绿微囊藻培养液中,并设置未经处理的bg11培养基为对照,置于25℃、光照强度为2000lux、光暗比12h:12h的光照培
养箱中共培养,在第0d、3d、7d和14d取样检测叶绿素a含量,并每天观察溶藻效果(黄化现象),实验结果如图3所示。
[0074]
具体的应用方式
[0075]
结合图6所示,1、菌悬液和发酵上清液制备:恒温摇床30℃、180rmp条件下培养路氏肠杆菌,8000rpm离心去除菌体,得到发酵上清液,菌体重悬于培养基得到菌悬液;
[0076]
2、藻类培养:将购买的铜绿微囊藻,于25℃、光照强度为2000lux、光暗比12h:12h的光照培养箱中静置培养,每天摇匀3次,培养一周后作为试验用藻种溶液;
[0077]
3、抑藻活性评价:分别取一定量菌悬液、发酵上清液加入到藻液中,对照为bg11培养基,进行抑藻试验,7d后检测叶绿素a含量,比较发酵菌液不同处理方式对铜绿微囊藻的抑制效果,发酵上清液的抑藻效率高达90%以上,结果表明路氏肠杆菌主要是通过间接方式,分泌胞外物质起到抑藻作用;
[0078]
4、将生物质炭和发酵上清液混匀后,再与聚乙烯醇和海藻酸钠制成固定化微球,经过反复冻融形成透性化微球。
[0079]
通过上述技术方案得到的装置是一株具有溶藻活性的路氏肠杆菌及其透性化微球制备方法,本发明中首次采用路氏肠杆菌来防治蓝藻水华,所用路氏肠杆菌分离自再生水,无基因修饰,取其发酵上清液,无二次污染风险;且本发明采用透性化细胞制备的方法将发酵菌液的上清液制备成透性化微球,所得制剂安全无污染,可回收重复利用,成本低廉,应用前景广阔。同时本发明提供一种肠杆菌发酵液上清制备透性化微球的方法,其培养易于操作,不会引入生物污染,适用于水处理领域实际推广应用。
[0080]
以上所述仅为本发明的优选实施方式而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化;凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1