复合片球菌制剂及其制备方法和应用与流程
1.本发明属于微生物应用技术领域,具体涉及复合片球菌制剂及其制备方法和应用。
背景技术:
2.目前,全球范围内大部分经济和商业上重要的鱼(虾)类群遭到破坏或过度捕捞,又面临水产品消费日益增长的需求,高产出率的水产养殖不仅有助于满足水产品消费的需求,还同时能源源不断的补偿一些稀缺的水产品资源,因此得到了水产行业的重视,发展比较迅速。目前来看,水产养殖产品的产量已经超过渔业捕捞量,成为水产品的主要来源,且越来越朝向集约型水产养殖的发展。
3.然而,在集约型水产养殖尤其是在大规模的集约型水产养殖中,由于水生物种与周围环境存在密切的互动情况,水产养殖中的微生物群对它们的健康和发育有直接影响。例如不良水环境流入养殖区时,鱼类可能会接触到各种传染性细菌疾病,在集约型水产养殖中极容易爆发并造成的严重养殖经济损失,也影响了水产养殖进行和限制了行业的可持续性发展。
4.当前,细菌性鱼类疾病在全球许多国家造成严重的养殖经济损失,弧菌病就是最常见的细菌性鱼类疾病之一,影响范围涉及重要的养殖虾、全球性的海洋鱼类和淡水鱼类等。虽然抗生素的使用能达到防治细菌性病原体,但是不加节制地选择抗生素进行预防,将通过食物链传播到陆地的风险,并最终会进入人体中并积累,此外,不加区分地使用抗生素会阻碍鱼类肠道微生物群中有益微生物的活性,改变微生物系统、破坏水环境和生理过程、降低鱼类的免疫能力和生鱼品质。
5.在追求高品质、高产出养殖鱼类的需求下,可持续和环境友好的水产养殖方式是未来养殖发展的主要目标之一。总之,在避免抗生素使用的前提,同时可用于抑制和控制水产养殖中弧菌性病原体,此外,营养物质量以及浮游微生物群接触水环境和动物肠道微生物群之间的相似性、关联性密切,也是鱼类中肠道微生物群的决定因素,改善营养物质质量、提高鱼类生存的水环境来达到预防营养环境弧菌病爆发也是重要的措施。因此急需一种多功能类型的复合球菌制剂用于解决上述问题。
技术实现要素:
6.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种复合片球菌制剂及其制备方法和应用,该复合片球菌制剂具备多层结构、适宜温度范围广,且工艺简单、可长期泡水、适合养殖户自用的新型水产养殖用复合片球菌制剂。
7.为实现上述目的,本发明采用以下技术方案:一种复合片球菌制剂的制备方法,包括以下步骤:(1)将复合片球菌颗粒与填充料混合,搅拌,粘连,过筛挤压,取筛下物干燥,得到复合颗粒层;
(2)将浆料a包裹在所述复合颗粒层的表面,冷却,得到隔水层包裹复合颗粒层;(3)将网丝剂加热熔融,送到喷丝机中喷出网丝,粘附在所述隔水层包裹复合颗粒层的表面,得到网纹层;(4)将所述网纹层的表面温度降至40-50℃,加入抑菌粉和造孔剂混合,继续冷却,再喷覆浆料b,加热至50-60℃,冷却,得到复合片球菌制剂;所述浆料a包括玉米淀粉胶、羧甲基纤维素、丙三醇;所述浆料b包括黄原胶、木薯淀粉、丙三醇。
8.优选地,步骤(1)中,所述复合颗粒层中含有至少一枚复合片球菌颗粒。
9.进一步优选地,所述复合颗粒层中含有二至四枚颗粒。
10.优选地,步骤(1)中,所述填充料是由猪浆粉、棉籽蛋白、海藻酸钠和水组成。
11.优选地,步骤(1)中,所述复合片球菌颗粒的制备过程为:将有效活菌数为0.5~8
×
108cfu/ml的片球菌、有效活菌数为0.01~2
×
108cfu/ml的丁酸梭菌、有效活菌数为0.01~1
×
108cfu/ml的贝莱斯芽孢杆菌、有效活菌数为0.01~1
×
108cfu/ml的枯草芽孢杆菌、20~100kg的基质料进行混合,喷雾造粒,即得。
12.进一步优选地,所述基质料是由猪浆粉、豆渣、棉籽蛋白、磷酸二氢钙、丁酸钠、维生素、羧甲基纤维素钠、鸡油按质量比为(5~20):(5~20):(20~40):(1~3):(0.1~0.8):(0.01~0.03):(0.01~0.05):(1~3)组成。
13.更优选地,所述猪浆粉的制备步骤为:(1)将猪骨、猪内脏粉碎,过筛,加入乙醇混合,在55~70℃下进行蒸发,再加入脱脂酶水混合,分离,浓缩,得到浓缩液;(2)将所述浓缩液与碱性蛋白酶、胰蛋白酶混合,在45~60℃下进行处理3~8h,得到酶分解产物,负压浓缩,干燥,得到猪浆粉。
14.进一步优选地,所述片球菌制备过程,包括以下步骤:将乳酸菌进行用mrs液体培养基活化,稀释,得到2.5
×
108cfu/ml菌液,接种于mrs液体培养基中,在37℃下培养24 h,于4℃下离心、过滤,取乳酸菌上清液,加入牛津杯孔中,以菌a为指示菌,且指示菌的接种浓度在0.1~2
×
10
8 cfu/ml、体积均为100μl,筛选出对各指示菌有明显抑菌圈的菌株,并在37℃下培养12小时,利用十字交叉法测量透明圈直径d,筛选各指示菌有明显抑菌圈的菌株;所述菌a为弧菌、气单胞菌、纤维菌、链球菌其中至少一种。
15.更优选地,所述mrs液体培养基包括以下物质:蛋白胨10.0g/l,牛肉浸粉8.0g/l,酵母浸粉4.0g/l,葡萄糖 20.0g/l,磷酸氢二钾2.0g/l,柠檬酸氢二铵2.0g/l,乙酸钠5.0 g/l,硫酸镁0.2g/l,硫酸锰0.04 g/l,吐温80.0 g/l。
16.进一步优选地,所述片球菌、丁酸梭菌、贝莱斯芽孢杆菌、枯草芽孢杆菌均用mrs液体培养基活化后,分别挑取各平板菌苔上的菌种于mrs培养基中,培养40-42h,菌液经3000-3500r/min离心处理10-30 min、洗涤、沉淀,然后将菌体沉淀悬于磷酸盐平衡生理盐水缓冲溶液中,经50倍稀释后,吸取0.1ml稀释液均匀涂布于固体培养基上,生化培养箱倒置培养48 h后计数,根据可见分光光度计600nm波长处测定细菌溶液的光密度值(od600值),与悬液中活菌数量的线性关系,在后面的养殖试验中直接用od600值计算菌液中菌数量。
17.优选地,步骤(2)中,所述浆料a是由玉米淀粉胶、羧甲基纤维素、丙三醇按质量比为(30~50):(10~15):(1~5)混合,在75~85℃下加热糊化得到。
18.优选地,步骤(2)中,所述包裹的次数为3-10次。
19.优选地,步骤(3)中,所述熔融的温度为80~85℃。
20.优选地,步骤(3)中,所述网纹层的具体制备步骤为:将网丝剂加热至80~85℃熔融得到网丝液,送至喷丝机的喂料单元,喂料单元挤出网丝液,送至计量单元,再送至熔喷单元,熔喷单元的喷丝头喷出网丝,将网丝粘附在滚动的已被隔水层包裹的复合片球菌制剂的表面。
21.进一步优选地,所述网丝剂为卡拉胶和水按照质量/体积比为(3~10)g:(50~80)ml混合而成。
22.优选地,步骤(4)的具体步骤为:将复合片球菌制剂的隔水层表面温度降至40-50℃,加入抑菌粉和造孔剂混合粘附,冷却至室温,用裹浆机将浆料b包裹在复合片球菌制剂表面,再加热至50-60℃,冷却至室温,得到微孔层包覆网纹层的复合片球菌制剂。
23.上述粘附是利用隔水层表面、网丝的黏性附着抑菌粉、造孔剂;上述加热至50-60℃可以分解造孔剂,并排出产生的气体,形成微孔层。
24.优选地,步骤(4)中,所述抑菌粉由枯萎念球菌、嗜热链球菌、长双歧杆菌、短双歧杆菌、地衣芽孢杆菌组成。
25.进一步优选地,所述枯萎念球菌、嗜热链球菌、长双歧杆菌、短双歧杆菌、地衣芽孢杆菌各自的有效活菌数在0.01~8
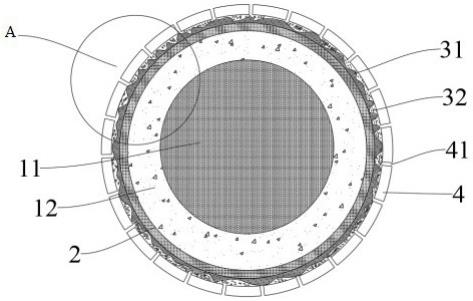
×
108cfu/ml。
26.优选地,步骤(4)中,所述抑菌粉加入量为复合片球菌制剂质量的0.05%~0.2%。
27.优选地,步骤(4)中,所述造孔剂为碳酸氢铵、碳酸铵中的至少一种。
28.优选地,步骤(4)中,所述造孔剂加入量为复合片球菌制剂质量的0.001%~0.1%。
29.优选地,步骤(4)中,所述浆料b是由黄原胶、木薯淀粉、丙三醇按照质量比为(20~50):(30~50):(1~5)混合,在65~75℃下加热糊化得到。
30.一种复合片球菌制剂,是由上述的制备方法制备得到,自里向外依次包括复合颗粒层、隔水层、网纹层、微孔层;所述复合颗粒层中含有至少一枚颗粒;所述复合片球菌制剂形状为不规则球体、椭球体、梭状、长棒形状、短棒状、片状、块状中的至少一种。
31.优选地,所述复合颗粒层是颗粒与颗粒结合的填充料组成;所述复合颗粒层中以填充料粘结单个或者多个颗粒;所述颗粒直径在0.2~3mm。
32.进一步优选地,所述复合颗粒层直径在0.35~6.5mm;更优选地,所述复合颗粒层直径为0.50~3.5mm。
33.优选地,所述隔水层包裹复合颗粒层;所述隔水层厚度在0.1~2mm。隔水层保护复合颗粒层不被浸润分散在水中,又保证复合颗粒层的完整性,能漂浮于水面。
34.进一步优选地,所述隔水层表面有网状结构附着的部分形成多个凹点,凹点内含有抑菌粉以及残留的造孔剂;所述微孔层上的孔隙可向水体中释放抑菌粉,并在释放抑菌粉过程中,微孔层逐渐分解于水体中,裸露出的网纹层接触水体。
35.优选地,所述网纹层以网状结构附着在隔水层表面;所述网纹层厚度在0.15~1mm。通过网纹层锚定隔水层,保持结构稳定性,减少隔水层破裂。
36.优选地,所述微孔层上分布多个孔隙,微孔层通过包覆网纹层形成一颗完整的复合片球菌制剂;所述微孔层的厚度在0.1~1.0mm。
37.优选地,所述微孔层溶解的时间为16~48h。
38.本发明还提供一种复合片球菌制剂在鱼养殖中的应用。
39.相对于现有技术,本发明的有益效果如下:
1、本发明通过制备得到复合颗粒层、隔水层、网纹层、微孔层四部分层级结构,利用不同层级实现不同的功能,且各个层级间紧密结合,得到多功能的复合片球菌制剂;其中,利用微孔层上的孔隙释放抑菌粉,抑菌粉含有的枯萎念球菌、嗜热链球菌、长双歧杆菌、短双歧杆菌、地衣芽孢杆菌能改善养殖环境:包括净化水质,抑制水体弧菌生长,同时,有利于水体浮游微藻的种群平衡繁殖;通过与微藻相互作用更能间接抑制病原菌,提高饲料利用率;还能是通过寄生控制有害弧菌的方式,进而裂解弧菌,降低环境中弧菌种群数量,从而减少其危害。其次,当微孔层遇水逐渐溶解时,隔水层表面上有网状结构网纹层,通过网纹层锚定隔水层,保持结构稳定性,减少隔水层破裂;而隔水层能紧紧贴住复合颗粒层,即保护复合颗粒层不被浸润分散在水中,能漂浮于水面,在没有鱼苗进食等干扰下,利用网纹层、隔水层相互联动的功能保持复合片球菌制剂的复合颗粒层长期的完整性,在整个生产期间保持其有效性。再者,复合颗粒层含有的片球菌以及丁酸梭菌、贝莱斯芽孢杆菌、枯草芽孢杆菌菌群,能提高养殖鱼类免疫力,主要表现在增加养殖鱼类的巨噬细胞数量,发明人发现:较多的吞噬细胞的刺激会导致大量生物活性物质的释放,如酶抑制剂、阳离子肽、补体组分,以及活性氧和氧化亚氮消除细菌,对伤口愈合起调控作用;能提高免疫球蛋白含量;与病原菌竞争营养、空间位点以及游离铁,为竞争抑制病原菌;通过自身分泌或者促进肠道菌群分泌各种消化酶类,提高养殖动物消化道酶活,促进基质料、填充料转化,促进消化,提高基质料、填充料利用率。最后,由于猪浆粉是由猪骨、猪内脏,而猪骨、猪内脏中含有大量骨髓和胶原蛋白,作为提取胶原蛋白和软骨素的来源,且经过酶解反应后产生了大量小肽和游离氨基酸,而多肽具有易消化吸收、低过敏性的特点,能促进钙、蛋白吸收,促进鱼类生长。
40.2、在本发明的网纹层制备过程中,通过喷丝机喷出网丝粘附隔水层上,网丝以网状结构附着在隔水层表面,网状结构即为网纹层,具有较好的结构稳定性,形成保护层,能防止包覆隔水层的复合片球菌制剂开裂,提高复合片球菌制剂的功能完整性;此外,在40~50℃时,隔水层以及表面的网丝仍能粘住抑菌粉以及造孔剂,且此温度下隔水层以及表面的网丝未糊化,形态完好。
41.3、在本发明的微孔层制备过程中,在50~60℃下加热,造孔剂分解释放气体,同时此温度下浆料b包裹的物质层将软化,气体越多,物质层膨胀产生小孔排出气体,冷却后,物质层上出现小孔隙,即为微孔层,抑菌粉将得以从微孔层上的小孔隙缓慢释放出来。
附图说明
42.图1为含1枚颗粒复合片球菌制剂的刨面的示意图;图2为复合片球菌制剂网纹层的正面示意图;图3为复合片球菌制剂外包微孔层的正面示意图;图4为图1示意图中a的放大图;图5为含2枚颗粒复合片球菌制剂的刨面的示意图;图6为含3枚颗粒复合片球菌制剂的刨面的示意图;图7为含4枚颗粒复合片球菌制剂的刨面的示意图;图8为含5枚颗粒复合片球菌制剂的刨面的示意图;图9为实施例1-14和对比例1-5的分类丰度前8的肠道细菌菌群。
43.图中,1为复合颗粒层,11为颗粒,12为填充料;2为隔水层;3为网纹层,31为网丝,32为凹点;4为微孔层,41为微孔。
具体实施方式
44.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
实施例
45.实施例1-4的复合片球菌制剂的制备方法,包括以下步骤:片球菌制备过程:将乳酸菌用mrs液体培养基活化,稀释得到2.5
×
108cfu/ml菌液,再接种于mrs液体培养基(mrs液体培养基:蛋白胨 10.0 g/l,牛肉浸粉8.0 g/l,酵母浸粉 4.0 g/l,葡萄糖 20.0 g/l,磷酸氢二钾2.0 g/l,柠檬酸氢二铵2.0 g/l,乙酸钠 5.0 g/l,硫酸镁 0.2g/l,硫酸锰 0.04 g/l,吐温 80.0 g/l)中,在37℃下培养24 h,于4℃下离心、过滤,取乳酸菌上清液500
µ
l,加入上层平板的牛津杯孔中,以弧菌和纤维菌为指示菌,且指示菌的接种浓度为0.1
×
10
8 cfu/ml、体积均为100μl,筛选出对各指示菌有明显抑菌圈的菌株,并在37℃的培养箱培养12小时,利用十字交叉法测量透明圈直径d,筛选各指示菌有明显抑菌圈的菌株,即得片球菌。
46.复合片球菌颗粒的制备过程为:将有效活菌数为0.5~8
×
10
8 cfu/ml的片球菌、有效活菌数为0.01~2
×
10
8 cfu/ml的丁酸梭菌、有效活菌数为0.01~1
×
10
8 cfu/ml的贝莱斯芽孢杆菌、有效活菌数为0.01~1
×
10
8 cfu/ml的枯草芽孢杆菌、10~100kg的基质料进行混合,喷雾造粒,即得。
47.计算活菌数过程:将片球菌、丁酸梭菌、贝莱斯芽孢杆菌、枯草芽孢杆菌均活化后,分别挑取各平板菌苔上的菌种于mrs液体培养基中,培养40h,菌液经3000 r/min离心处理10 min,洗涤,沉淀,取沉淀物悬于磷酸盐平衡生理盐水缓冲溶液中,进行50倍稀释,吸取0.1ml稀释液均匀涂布于固体培养基上,生化培养箱倒置培养48 h后计数,根据可见分光光度计600nm波长处测定细菌溶液的光密度值(od600值),与悬液中活菌数量的线性关系,在后面的养殖试验中直接用od600值计算菌液中菌数量。
48.(1)向100kg复合片球菌颗粒中加入20kg填充料搅拌,通过填充料粘连结合颗粒,再过筛孔挤压,取筛下物干燥,即得复合颗粒层(颗粒、填充料以及组成颗粒的基质料配比见表1;(2)用裹浆机将浆料a(玉米淀粉胶、羧甲基纤维素、丙三醇按照质量比为40:10:3混合,在80℃下加热糊化得到)包裹上述复合颗粒层的表面,冷却至室温,即得隔水层包裹复合颗粒层;(3)将网丝剂(将卡拉胶和水按照质量/体积比5g:60ml混合得到)加热至80℃熔融得到网丝液,送至喷丝机的喂料单元,喂料单元挤出网丝液,送至计量单元,再送至熔喷单元,熔喷单元的喷丝头喷出网丝,粘附在滚动的已被隔水层包裹复合颗粒层的表面;(4)待隔水层表面温度降至40℃时,加入抑菌粉(各2ml有效活菌数在0.15
×
108cfu/ml枯萎念球菌、嗜热链球菌、长双歧杆菌、短双歧杆菌、地衣芽孢杆菌组成)、200g的碳酸氢铵造孔剂混合粘附,冷却至室温时,用裹浆机将浆料b(黄原胶、木薯淀粉、丙三醇按照质量比为40:40:3混合,在70℃下加热糊化得到)包裹在隔水层表面,再加热60℃分解造孔剂,并排出产生的气体,冷却至室温,得到复合片球菌制剂。
49.实施例5-8的复合片球菌制剂的制备方法,包括以下步骤:片球菌制备过程:将乳酸菌用mrs液体培养基活化,稀释得到2.5
×
108cfu/ml菌液,再接种于mrs液体培养基(mrs液体培养基:蛋白胨 10.0 g/l,牛肉浸粉 8.0 g/l,酵母浸粉 4.0 g/l,葡萄糖 20.0 g/l,磷酸氢二钾 2.0 g/l,柠檬酸氢二铵 2.0 g/l,乙酸钠 5.0 g/l,硫酸镁 0.2g/l,硫酸锰 0.04 g/l,吐温 80.0 g/l)中,在37℃下培养24 h,于4 ℃下离心、过滤,取乳酸菌上清液500
µ
l,加入上层平板的牛津杯孔中,以弧菌和纤维菌为指示菌,且指示菌的接种浓度为0.5
×
10
8 cfu/ml、体积均为100μl,筛选出对各指示菌有明显抑菌圈的菌株,并在37℃的培养箱培养12小时,利用十字交叉法测量透明圈直径d,筛选各指示菌有明显抑菌圈的菌株,即得片球菌。
50.计算活菌数过程:将片球菌、丁酸梭菌、贝莱斯芽孢杆菌、枯草芽孢杆菌均活化后,分别挑取各平板菌苔上的菌种于mrs液体培养基中,培养40h,菌液经3000 r/min离心处理10 min,洗涤,沉淀,取沉淀物悬于磷酸盐平衡生理盐水缓冲溶液中,进行50倍稀释,吸取0.1ml稀释液均匀涂布于固体培养基上,生化培养箱倒置培养48 h后计数,根据可见分光光度计600nm波长处测定细菌溶液的光密度值(od600值),与悬液中活菌数量的线性关系,在后面的养殖试验中直接用od600值计算菌液中菌数量。
51.(1)向100kg复合片球菌颗粒中加入20kg填充料搅拌,通过填充料粘连结合颗粒,再过筛孔挤压,取筛下物干燥,即得复合颗粒层(颗粒、填充料以及组成颗粒的基质料配比见表1);(2)用裹浆机将浆料a(玉米淀粉胶、羧甲基纤维素、丙三醇按照质量比为40:10:3混合,在80℃下加热糊化得到)包裹上述复合颗粒层的表面,冷却至室温,即得隔水层包裹复合颗粒层;(3)将网丝剂(将卡拉胶和水按照质量/体积比5g:60ml混合得到)加热至80℃熔融得到网丝液,送至喷丝机的喂料单元,喂料单元挤出网丝液,送至计量单元,再送至熔喷单元,熔喷单元的喷丝头喷出网丝,粘附在滚动的已被隔水层包裹复合颗粒层的表面;(4)待隔水层表面温度降至40℃时,加入抑菌粉(各2ml有效活菌数在0.15
×
108cfu/ml枯萎念球菌、嗜热链球菌、长双歧杆菌、短双歧杆菌、地衣芽孢杆菌组成)、200g的碳酸氢铵造孔剂混合粘附,冷却至室温时,用裹浆机将浆料b(黄原胶、木薯淀粉、丙三醇按照质量比为40:40:3混合,在70℃下加热糊化得到)包裹在隔水层表面,再加热60℃分解造孔剂,并排出产生的气体,冷却至室温,得到复合片球菌制剂。
52.实施例9-11的复合片球菌制剂的制备方法,包括以下步骤:片球菌制备过程:将乳酸菌用mrs液体培养基活化,稀释得到2.5
×
108cfu/ml菌液,再接种于mrs液体培养基(mrs液体培养基:蛋白胨 10.0 g/l,牛肉浸粉 8.0 g/l,酵母浸粉 4.0 g/l,葡萄糖 20.0 g/l,磷酸氢二钾 2.0 g/l,柠檬酸氢二铵 2.0 g/l,乙酸钠 5.0 g/l,硫酸镁 0.2g/l,硫酸锰 0.04 g/l,吐温 80.0 g/l)中,在37℃下培养24 h,于4 ℃下离心、过滤,取乳酸菌上清液500
µ
l,加入上层平板的牛津杯孔中,以弧菌和纤维菌为指
示菌,且指示菌的接种浓度为1.0
×
10
8 cfu/ml、体积均为100μl,筛选出对各指示菌有明显抑菌圈的菌株,并在37℃的培养箱培养12小时,利用十字交叉法测量透明圈直径d,筛选各指示菌有明显抑菌圈的菌株,即得片球菌。
53.计算活菌数过程:将片球菌、丁酸梭菌、贝莱斯芽孢杆菌、枯草芽孢杆菌均活化后,分别挑取各平板菌苔上的菌种于mrs液体培养基中,培养40h,菌液经3000 r/min离心处理10 min,洗涤,沉淀,取沉淀物悬于磷酸盐平衡生理盐水缓冲溶液中,进行50倍稀释,吸取0.1ml稀释液均匀涂布于固体培养基上,生化培养箱倒置培养48 h后计数,根据可见分光光度计600nm波长处测定细菌溶液的光密度值(od600值),与悬液中活菌数量的线性关系,在后面的养殖试验中直接用od600值计算菌液中菌数量。
54.(1)向100kg复合片球菌颗粒中加入20kg填充料搅拌,通过填充料粘连结合颗粒,再过筛孔挤压,取筛下物干燥,即得复合颗粒层(颗粒、填充料以及组成颗粒的基质料配比见表1);(2)用裹浆机将浆料a(玉米淀粉胶、羧甲基纤维素、丙三醇按照质量比为40:10:3混合,在80℃下加热糊化得到)包裹上述复合颗粒层的表面,冷却至室温,即得隔水层包裹复合颗粒层;(3)将网丝剂(将卡拉胶和水按照质量/体积比5g:60ml混合得到)加热至80℃熔融得到网丝液,送至喷丝机的喂料单元,喂料单元挤出网丝液,送至计量单元,再送至熔喷单元,熔喷单元的喷丝头喷出网丝,粘附在滚动的已被隔水层包裹复合颗粒层的表面;(4)待隔水层表面温度降至40℃时,加入抑菌粉(各2ml有效活菌数在0.15
×
108cfu/ml枯萎念球菌、嗜热链球菌、长双歧杆菌、短双歧杆菌、地衣芽孢杆菌组成)、200g的碳酸氢铵造孔剂混合粘附,冷却至室温时,用裹浆机将浆料b(黄原胶、木薯淀粉、丙三醇按照质量比为40:40:3混合,在70℃下加热糊化得到)包裹在隔水层表面,再加热60℃分解造孔剂,并排出产生的气体,冷却至室温,得到复合片球菌制剂。
55.实施例12-14的复合片球菌制剂的制备方法,包括以下步骤:片球菌制备过程:将乳酸菌用mrs液体培养基活化,稀释得到2.5
×
108cfu/ml菌液,再接种于mrs液体培养基(mrs液体培养基:蛋白胨10.0 g/l,牛肉浸粉8.0 g/l,酵母浸粉 4.0 g/l,葡萄糖 20.0 g/l,磷酸氢二钾2.0 g/l,柠檬酸氢二铵 2.0 g/l,乙酸钠5.0 g/l,硫酸镁0.2g/l,硫酸锰0.04 g/l,吐温 80.0 g/l)中,在37℃下培养24 h,于4 ℃下离心、过滤,取乳酸菌上清液500
µ
l,加入上层平板的牛津杯孔中,以弧菌和纤维菌为指示菌,且指示菌的接种浓度为1.0
×
10
8 cfu/ml、体积均为100μl,筛选出对各指示菌有明显抑菌圈的菌株,并在37℃的培养箱培养12小时,利用十字交叉法测量透明圈直径d,筛选各指示菌有明显抑菌圈的菌株,即得片球菌。
56.计算活菌数过程:将片球菌、丁酸梭菌、贝莱斯芽孢杆菌、枯草芽孢杆菌均活化后,分别挑取各平板菌苔上的菌种于mrs液体培养基中,培养40h,菌液经3000 r/min离心处理10 min,洗涤,沉淀,取沉淀物悬于磷酸盐平衡生理盐水缓冲溶液中,进行50倍稀释,吸取0.1ml稀释液均匀涂布于固体培养基上,生化培养箱倒置培养48 h后计数,根据可见分光光度计600nm波长处测定细菌溶液的光密度值(od600值),与悬液中活菌数量的线性关系,在后面的养殖试验中直接用od600值计算菌液中菌数量。
57.(1)向100kg复合片球菌颗粒中加入20kg填充料搅拌,通过填充料粘连结合颗粒,
再过筛孔挤压,取筛下物干燥,即得复合颗粒层(颗粒、填充料以及组成颗粒的基质料配比见表1);(2)用裹浆机将浆料a(玉米淀粉胶、羧甲基纤维素、丙三醇按照质量比为40:10:3混合,在80℃下加热糊化得到)包裹上述复合颗粒层的表面,冷却至室温,即得隔水层包裹复合颗粒层;(3)将网丝剂(将卡拉胶和水按照质量/体积比5g:60ml混合得到)加热至80℃熔融得到网丝液,送至喷丝机的喂料单元,喂料单元挤出网丝液,送至计量单元,再送至熔喷单元,熔喷单元的喷丝头喷出网丝,粘附在滚动的已被隔水层包裹复合颗粒层的表面;(4)待隔水层表面温度降至40℃时,加入抑菌粉(各2ml有效活菌数在0.15
×
108cfu/ml枯萎念球菌、嗜热链球菌、长双歧杆菌、短双歧杆菌、地衣芽孢杆菌组成)、200g的碳酸氢铵造孔剂混合粘附,冷却至室温时,用裹浆机将浆料b(黄原胶、木薯淀粉、丙三醇按照质量比为40:40:3混合,在70℃下加热糊化得到)包裹在隔水层表面,再加热60℃分解造孔剂,并排出产生的气体,冷却至室温,得到复合片球菌制剂。
58.对比例1本对比例1与实施例3区别在于复合片球菌制剂的颗粒中未加入片球菌。
59.对比例2本对比例2与实施例7区别在于复合片球菌制剂的颗粒中未加入片球菌、丁酸梭菌、贝莱斯芽孢杆菌、枯草芽孢杆菌。
60.对比例3本对比例3与实施例9区别在于复合片球菌制剂的隔水层中未加入抑菌粉。
61.对比例4本对比例与实施例11区别在于复合片球菌制剂的未加入造孔剂,未形成微孔层。
62.对比例5本对比例与实施例11区别在于复合片球菌制剂的未设置隔水层。
63.表1实施例1-14配料质量比
基质料猪浆粉豆渣棉籽蛋白磷酸二氢钙丁酸钠维生素羧甲基纤维素钠鸡油实施例1-4510201.20.40.010.011.5实施例5-81012301.50.60.020.042实施例9-1115183520.70.030.052.5实施例12-1420204030.80.030.053颗粒片球菌有效活菌数丁酸梭菌有效活菌数贝莱斯芽孢杆菌有效活菌数枯草芽胞杆菌有效活菌数基质料
ꢀꢀꢀ
实施例1-41.2
×
108cfu/ml0.5
×
108cfu/ml0.1
×
108cfu/ml0.1
×
108cfu/ml实施例1-4分别为40kg、50kg、60kg、70kg
ꢀꢀꢀ
实施例5-82
×
108cfu/ml1.0
×
108cfu/ml0.3
×
108cfu/ml0.3
×
108cfu/ml实施例5-8分别为40kg、60kg、80kg、100kg
ꢀꢀꢀ
实施例9-113.2
×
108cfu/ml1.2
×
108cfu/ml0.4
×
108cfu/ml0.4
×
108cfu/ml
ꢀꢀꢀꢀ
实施例12-146
×
108cfu/ml1.5
×
108cfu/ml1
×
108cfu/ml1
×
108cfu/ml
ꢀꢀꢀꢀ
填充料猪浆粉棉籽蛋白海藻酸钠水/l
ꢀꢀꢀꢀ
实施例1-4825320
ꢀꢀꢀꢀ
实施例5-81540625
ꢀꢀꢀꢀ
实施例9-111550835
ꢀꢀꢀꢀ
实施例12-141860840
ꢀꢀꢀꢀ
表2实施例1-14复合片球菌制剂各结构中直径或厚度
ꢀ
实施例1-4实施例5-8实施例9-11实施例12-14颗粒直径0.27~1.3mm0.31~17mm0.26~1.3mm0.25~1.69mm复合颗粒层直径0.63~3.7mm0.64~3.9mm0.66~3.8mm0.71~4.3mm隔水层厚度0.36~0.98mm0.46~1.28mm0.32~1.75mm0.40~1.64mm网纹层厚度0.15~0.3mm0.12~0.49mm0.27~0.84mm0.32~0.73mm微孔层0.34~0.66mm0.33~0.70mm0.38~0.76mm0.33~0.78mm数据分析:1.1养殖鲈鱼投喂处理用于养殖鲈鱼的水是经过砂面过滤的养殖用水,曝气一天处理,共有19个养殖槽,每个养殖槽为长宽深2m*2m*2m大小的水槽,每个养殖槽水量为6m3,每15天更新养殖槽中一半的水;筛选鲈鱼大小为14~15cm/尾,鲈鱼质量为185~195g/尾,所有的鲈鱼驯养7天再投至养殖槽,每个养殖槽投放30尾鲈鱼(记录每个槽鲈鱼平均质量),并投放5ml副溶血性弧菌菌液(用无菌生理盐水溶液稀释副溶血性弧菌的活菌数为1.0~1.2
×
10
6 cfu/ml)。每天通过随机取各个养殖槽3尾鲈鱼,3尾鲈鱼体重总质量/3来计算得到鲈鱼每天平均体重,实施例1~14以及对比例1~5制备的制剂分别投喂至19个水槽中,投喂实施例1~14制备的复合片球菌制剂至对应的实施例1~14水槽,投喂对比例1~5制备的制剂至对应的对比例1~5水槽,每个养殖槽每天投喂的制剂质量为:鲈鱼平均体重
×
30
×
3.5%,连续30天,每天分别在8点、12点和16点各投喂一次。
64.1.2指标测定从实施例1-14和对比例1-5的养殖槽随机取5尾鱼,放入3l水中,使用烷基磺酸盐对鲈鱼麻醉,每l水加入0.2ml烷基磺酸盐,鲈鱼麻醉,使用酒精消毒液处理鲈鱼表面,取出鱼肠道,将其中肠道内含物挤出,放入无菌离心管中,液氮速冻,至于超低温(《-40℃)下冷冻保存,用于肠道菌群变化的分析。用mag-bind soil dna kit试剂盒提取肠道内含物中的微生物总dna。用刀刮除中部肠道中的分泌物、黏膜,置于低温冰箱静置4 h,于4℃下离心,收集上层清液,用紫外比色法测定胰蛋白酶(trypsin)活性,淀粉-碘比色法测定淀粉酶(ams)活性,纳米金比色法测定脂肪酶(lps)活性。
65.从对照组和试验组对应的每个养殖槽随机取5尾鱼,静脉取血,采集鲈鱼的血样置于低温冰箱静置4 h,于4℃下离心,收集上层血清用于血清免疫指标的检测。采用酶联免疫吸附试验法测定血清中巨噬细胞炎性蛋白-1β(mip-1β)、总蛋白(tp)、球蛋白(glb);谷胱甘肽过氧化物酶采用谷胱甘肽过氧化物酶(gsh-px)测定试剂盒(比色法)测定、过氧化氢酶(cat)采用过氧化氢酶试剂盒(紫外光法)测定、超氧化物歧化酶(sod)采用超氧化物歧化酶测试盒(羟胺法)。
66.从对照组和试验组对应的每个养殖槽随机取5尾鱼,测定每个养殖槽中鲈鱼长度(cm)、鲈鱼质量(g)、增长率、成活率,其中鲈鱼长度、鲈鱼质量、增长率取平均值,成活率=投喂第30天鲈鱼数量/投喂第1天鲈鱼数量*100%,增长率=(投喂第30天鲈鱼平均质量-投喂第1天鲈鱼平均质量)/30;并观察和记录鲈鱼的鳞皮、脾脏情况。
67.1.3制剂浮水测定实施例1~14以及对比例1~5制备的制剂各取10粒分别置于装养殖用水的水箱中,将水箱放置在养殖槽附近,保持各个水箱处于相同湿度和温度,记录实施例1~14以及对比
例1~5制备的制剂沉水所需时间,同时记录实施例1~14的制剂的微孔层首次溶解时间。其中沉50%为50%的制剂沉水所需时间,沉100%为全部制剂沉水所需时间。
68.1.4养殖槽中水质测定养殖水样取样时间为投放制剂后第31天上午的10:30~11:30,水样采集位置在养殖槽中心水面下的50cm处,总氮、氨氮和cod采用便携式水质多参数检测仪测定,溶解氧采用溶解氧分析仪测定,ph采用酸碱度ph检测仪测定。
69.以2000 g转速(离心半径8.5 cm)离心分离血清。采用酶联免疫吸附法测定血清 mip-1α、mip-1β和 mcp-1指标水平,实验试剂盒由北京康肽生物科技有限公司提供,实验步骤严格按照试剂盒说明书进行。
70.图表分析:图1以及图4中,填充料包裹颗粒得到颗粒层,颗粒层外为一层隔水层,网纹层包覆隔水层,图2中,网纹层含有网丝凹点,图2中,网纹层外包的为微孔层,微孔层上有好多小孔;图5-8为填充料包裹2、3、4、5枚颗粒复合片球菌制剂。肠道菌群提供了栖息生存环境,而肠道微生物对宿主的营养、健康、免疫等方面产生不可替代的影响。表1中相较于对比例1-5,实施例1-14制得的制剂养殖的鲈鱼肠道的厚壁菌门、变形菌门、拟杆菌门、赤杆菌门丰度均有所增加,且均为优势微生物,明显降低梭杆菌门、放线菌门,厚壁菌门、变形菌门、拟杆菌门、赤杆菌门优势微生物肠道微生物对宿主的营养、免疫等方面产生不可替代的作用,对宿主的健康具有一定相关性。而以对比例2中的制备未添加片球菌、丁酸梭菌、贝莱斯芽孢杆菌、枯草芽孢杆菌,肠道中各厚壁菌门、变形菌门、拟杆菌门、赤杆菌门丰度最低,说明添加片球菌、丁酸梭菌、贝莱斯芽孢杆菌、枯草芽孢杆菌对肠道微生物变化最大,有利于优势微生物生长;相较于对比例1-3,由于对比例4制备得到的复合片球菌制剂仅未有微孔层、对比例5制备得到的复合片球菌制剂仅未有隔水层,厚壁菌门、变形菌门、拟杆菌门、赤杆菌门略有增加,梭杆菌门、放线菌门略有降低,说明复合片球菌制剂去除微孔层、隔水层,对肠道微生物也有一定程度上的作用。
71.表3鲈鱼肠道酶活性情况 胰蛋白酶(u/mg
·
prot)淀粉酶(u/mg
·
prot)脂肪酶(u/mg
·
prot)实施例1145.74.7068.4实施例2137.84.2060.5实施例3136.44.4064.7实施例4143.24.6267.0实施例5146.84.8867.7实施例6148.04.6866.1实施例7148.84.7666.9实施例8150.54.8171.5实施例9145.74.7268.2实施例10146.84.6767.7实施例11141.14.5263.5实施例12146.84.8868.7实施例13144.74.6268.2
实施例14145.74.7067.7对比例1126.04.1960.7对比例2130.44.2160.3对比例3133.74.1762.6对比例4136.54.3962.9对比例5129.94.4663.3表4鲈鱼血清免疫指标数据 巨噬细胞炎性蛋白-1β(ng/l)总蛋白(g/l)球蛋白(g/l)谷胱甘肽过氧化物酶((u/ml))过氧化氢酶(u/ml)超氧化物歧化酶(u/ml)实施例147.936.1326.143423.7826.3实施例238.135.8625.783363.1825.4实施例341.735.9426.483373.6324.5实施例444.436.4026.843603.6225.9实施例541.736.0526.253393.9123.1实施例648.036.1325.923423.7925.5实施例746.835.8626.423513.5825.4实施例849.836.0726.393524.0126.2实施例945.035.7226.643473.8624.9实施例1044.235.8025.763453.6925.3实施例1142.535.8026.383533.7624.7实施例1246.036.0326.863343.6525.2实施例1341.735.6826.303363.6824.6实施例1447.835.2525.643213.6925.7对比例134.529.9823.483073.2522.3对比例234.328.2323.242943.3221.5对比例337.332.6925.162973.0822.8对比例433.833.7224.863093.2621.1对比例536.733.5324.753002.9221.3
表3为实施例1-14和对比例1-5制得的制剂养殖的鲈鱼肠道酶活性情况,表4为实施例1-14和对比例1-5制得的制剂养殖的鲈鱼血清免疫指标数据,实施例1-14制得的制剂养殖的鲈鱼肠道胰蛋白酶、淀粉酶、脂肪酶以及血清中巨噬细胞炎性蛋白、总蛋白、球蛋白、谷胱甘肽过氧化物酶、过氧化氢酶、超氧化物歧化酶均比对比例1-5制得的制剂养殖的鲈鱼肠道酶活性以及血清免疫指标有所增加,说明本发明实施例1-14制备的复合片球菌制剂增强了鲈鱼的体液免疫和细胞免疫,相对来说以对比例1-2鲈鱼肠道酶活性、血清免疫指标较差,这与图9中情况相似。
72.表5鲈鱼生长情况 长度(cm)质量(g)增长率(g/d)成活率(%)鳞皮、脾脏实施例130.13896.4996.7鳞皮、脾脏完好实施例228.93465.09100.0鳞皮、脾脏完好实施例329.53675.76100.0鳞皮、脾脏完好实施例429.93826.1296.7鳞皮、脾脏完好实施例530.13896.49100.0鳞皮、脾脏完好实施例630.13906.5196.7鳞皮、脾脏完好实施例730.33976.97100.0鳞皮、脾脏完好实施例830.44056.97100.0鳞皮、脾脏完好实施例930.13896.6296.7鳞皮、脾脏完好实施例1030.23976.70100.0鳞皮、脾脏完好实施例1129.73746.02100.0鳞皮、脾脏完好实施例1229.03495.14100.01尾小部分鳞皮褪色、其他脾脏完好实施例1329.93826.3396.7鳞皮、脾脏完好
实施例1429.43635.4896.7鳞皮、脾脏完好对比例128.63344.6586.77尾小部分鳞皮褪色、1尾鳞片脱落、3尾脾脏轻微出血对比例229.03254.3183.3有9尾小部分鳞皮褪色、2尾鳞片脱落、6尾脾脏轻微出血对比例328.33515.4386.7有6尾小部分鳞皮褪色、脾脏完好对比例428.13205.3293.3有3尾小部分鳞皮褪色、脾脏完好对比例528.13185.2090.02尾小部分鳞皮褪色、脾脏完好
表5为实施例1-14和对比例1-5制得的制剂养殖的鲈鱼生长情况,在鲈鱼喂养30天后,实施例1-14制得的制剂养殖的鲈鱼中的鲈鱼生长情况、成活率较好,对比例1、对比例2制得的制剂养殖的鲈鱼中增长率较低,对比例2制备的制剂处理鲈鱼存活率最低。通过观察鲈鱼鳞皮、脾脏来看,仅实施例12制得的制剂养殖的鲈鱼中1尾小部分鳞皮褪色,对比例1-5制得的制剂养殖的鲈鱼中有多尾鲈鱼小部分鳞皮褪色、鳞片脱落以及脾脏轻微出血。鳞皮褪色、鳞片脱落以及脾脏轻微出血是鲈鱼得副溶血性弧菌症状表现,说明实施例1-14制得的制剂对抑制副溶血性弧菌效果较好。
73.表6制剂沉水以及微孔层溶解的时间 沉100%(d)沉50%(d)首次溶解时间(h)实施例115626实施例215725实施例314723实施例413630实施例516626实施例613631实施例715526实施例814828实施例915526实施例1016827实施例1116524实施例1215523实施例1314528实施例1415724对比例115726对比例215625对比例313628对比例4231437对比例59314表6为实施例1-14和对比例1-5制得的制剂沉水以及微孔层溶解的时间,实施例1-14制得的制剂沉50%、100%、首次溶解时间分别在5-8天、13-16天、23-31h,对比例1-3制得的制剂沉50%、100%、首次溶解时间分别在6-7天、13-15天、26-28h与实施例1-14制得的制剂沉50%、100%、首次溶解时间区别不大,能保持较好的浮水情况好,而对比例4制得的制剂未有微孔层,沉50%、100%、首次溶解时间较长,对比例5制备得到的复合片球菌制剂未有隔水层,导致沉50%、100%、首次溶解时间最短,制剂溶于水中最快,不利于制剂浮水。
74.表7各水槽水质数据 ph溶解氧(mg/l)总氮(mg/l)氨氮(mg/l)cod(mg/l)实施例17.416.372.660.866.36实施例27.376.582.720.876.60实施例37.666.642.720.856.05实施例47.576.512.750.786.78实施例57.606.382.760.856.06实施例67.426.522.780.826.87实施例77.166.492.720.856.21实施例87.466.972.860.816.10实施例97.636.422.830.886.53实施例107.476.672.690.835.74实施例117.606.432.790.876.46实施例127.456.522.830.736.78实施例137.346.572.880.827.15实施例147.586.722.800.876.74对比例17.766.643.260.987.40对比例27.716.563.190.967.99对比例37.815.683.530.987.73对比例48.325.353.831.066.62对比例57.375.722.850.946.93表7为实施例1-14和对比例1-5制得的制剂投放的水槽的情况,相较于对比例1-5,各水槽水质的ph、溶解氧、总氮、氨氮、cod可见,实施例1-14情况较好,且对比例4制得的制剂投放的水槽水质较差,可能与对比例4制剂溶于水中最快,导致水质不佳。
75.本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下做出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1