一种O型口蹄疫病毒VP1蛋白的可溶性表达方法与流程
一种o型口蹄疫病毒vp1蛋白的可溶性表达方法
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种o型口蹄疫病毒vp1蛋白的可溶性表达方法。
背景技术:
2.口蹄疫是由口蹄疫病毒(foot-and-mouth disease virus, fmdv)感染偶蹄类动物后引起的一种急性、热性、高度接触性传染病。家畜中牛、猪、山羊、绵羊等均为易感动物,严重危害畜牧业健康发展和公共卫生安全,我国将其列为一类动物疫病,目前控制该病的主要方法是抗体检测和疫苗免疫相结合。fmdv属于小核糖核酸病毒科口蹄疫病毒属,主要有7个血清型,分别为a、c、o、sati、sat2、sat3以及asiai型,不同血清型的fmdv之间无交叉保护性,引起我国牲畜发病的血清型主要有o、a、asiai三个血清型,其中o型流行最为广泛。vp1蛋白作为o型fmdv的主要结构蛋白,包含大部分刺激机体产生中和抗体的中和性抗原位点,因此vp1抗体作为fmdv免疫产生的主要中和抗体,是评估疫苗免疫效果的重要依据。
3.原核表达系统是目前应用最为广泛同时也是最为经典的表达蛋白方法,其具有基因表达量高、生长繁殖快、培养周期短、成本低、可以大规模生产等优点,但是大肠杆菌原核表达系统表达的外源基因的表达形式多为包涵体表达,虽然这种表达的优点是表达量大,但是缺点是表达的蛋白往往因为蛋白表达过快而折叠错误,造成蛋白的活性缺失,且纯化的蛋白需要复性才能够使用,而蛋白的复性效率并不高。
技术实现要素:
4.本发明的目的在于提供一种o型口蹄疫病毒vp1蛋白的可溶性表达方法,以解决上述背景技术中提出的问题。
5.为实现上述目的,本发明提供如下技术方案:一种o型口蹄疫病毒vp1蛋白的可溶性表达方法,步骤如下:step1、fmdv-o-vp1蛋白基因合成:根据genbank公布的km243095.1基因为参考序列,该o cathay分离株为我国猪群中流行的o型口蹄疫病毒的主要拓扑型,且该病毒的结构蛋白vpl暴露在病毒颗粒的表面,是诱导产生中和抗体的主要成分,该目的基因所表达的蛋白可用于后续的检测和治疗用抗体的研发。由于大肠杆菌在进化过程中形成了一套与其相适应的常用密码子,在蛋白质翻译过程中,由trna转运氨基酸至核糖体中,当外源基因的密码子所对应的trna在宿主细胞中的表达量低时,则会影响蛋白的表达效率,所以,根据大肠杆菌对其常用密码子的偏好性,即密码子嗜性,优化目的基因序列,合成目的基因km243095,并在基因km243095引入bamhi酶切位点、xhoi酶切位点、his标签和终止子。其中酶切位点用于将该段目的基因连接到载体上,在羧基端引入his标签和终止子更有利于标签的暴露,使得在后续用镍柱对该蛋白进行纯化时效果更好;step2、pet32a-vp1重组质粒的构建:将目的基因重组至pet32a(+)载体,该载体含有t7启动子、his和trx标签,可以显著促进所表达的目的蛋白的表达量和可溶性,重组后将
质粒转化于大肠杆菌bl21(de3)感受态细胞,涂布于含氨苄青霉素抗性的lb平板上,37℃培养12h,挑取单个菌落接种到含有氨苄青霉素的lb培养基中,200r/min,37℃培养6h,12000r/min离心收菌体,提取质粒,对质粒进行酶切鉴定并测序;step3、fmdv-o-vp1蛋白诱导表达:将培养的菌液转移到含氨苄青霉素抗性的lb培养基中,200r/min,37℃培养至od
600
达到0.6-0.8时停止培养;取部分菌液加入iptg进行诱导表达,然后取诱导后的菌液于8000r/min离心5min,沉淀用超纯水洗涤1遍后用pbs溶液重悬,100℃煮沸10min,跑胶确定最佳诱导条件后大量诱导,收集菌体沉淀,冰浴超声破碎,跑胶确定蛋白表达形式,上清有表达;step4、fmdv-o-vp1蛋白纯化:将上清过0.45μm滤膜,镍柱经平衡液平衡后上样,用不同浓度咪唑洗涤目的蛋白,收集洗脱峰,跑胶确定目的蛋白所在洗脱浓度,超滤浓缩。
6.优选的,step1中,所述的目的基因编码序列由639bp碱基组成,优化序列为:将tac优化为tat,aag优化为aaa,gag优化为gaa,gac优化为gat,最终优化后形成的目的基因核苷酸系列号具体为:accacctctgcgggcgaatctgcggatcccgtgaccaccaccgtcgaaaattatggtggtgaaacacaagcccagaggcgccagcacacggatatagcgttcatactggataggttcgtaaaagtcaaaccaaaagaacaagtcaatgtattggatttgatgcagatccctgcccacaccttggtaggggcgctcctgcgaacggccacctattatttctctgatctggaactggccgtcaaacacgaaggcgatctcacctgggtcccaaacggtgcccccgaaacagcactggataacactaccaacccaacagcttatcacaaagaaccgctcacaaggttggcactgccttatacggctccccaccgcgtcttagcgaccgtctataacgggagcagtaaatatggtgatgccagcgctaacaacgtgaaaggtgaccttcaagtgctggctcagaagatagaaaaaactctacctacctccttcaacttcggtgccattaaagcaacccgtgtgactgaactgctctataggatgaaaagagccgaaacgtattgtcccaggccccttctcgccattcaaccgagtgatgctagacacaaacaaaaaattgtggcacccgcaaaacagcttctg。
7.优选的,step3中,iptg的终浓度为1mmol/l,诱导表达的条件为37℃诱导表达2h。
8.优选的,step3中,冰浴超声破碎条件为功率250w,超声4s,停4s,破碎30min,菌液澄清透光,破碎后12000r/min离心10min。
9.优选的,step4中,咪唑洗脱浓度为150mm。
10.优选的,step4中,fmdv-o-vp1蛋白纯化的具体流程为:平衡-上样-二次平衡-洗杂-洗脱-超滤浓缩。
11.与现有技术相比,本发明提供了一种o型口蹄疫病毒vp1蛋白的可溶性表达方法,具备以下有益效果:(1)本发明充分利用pet32a载体中的t7启动子、his纯化标签和trx促溶标签的优点,t7启动子受控于t7 rna聚合酶,而高活性的t7 rna聚合酶合成mrna的速度比大肠杆菌rna聚合酶快5倍,在诱导表达后可以很大程度上提高目的蛋白的表达量,有促表达的效果。his是一种高度可溶的多肽,当其与目的蛋白融合表达时,可极大的增加目的蛋白的可溶性。同时,目的蛋白与his标签共同表达,也有利于目的蛋白的纯化,同样地,trx促溶标签也可以显著促进所表达的目的蛋白的可溶性。利用该载体有利于目的蛋白的大量表达,并提高蛋白的可溶性,基于以上特点,本发明并未额外添加其他的促溶标签,相比已有发明,本发明对目的基因序列进行了密码子优化,避免了当外源基因的密码子所对应的trna在宿主细胞中的表达量低时会影响蛋白的表达效率,从而提高目的基因在大肠杆菌中的表达速度和表达量。结合诱导表达条件的优化,其中密码子的优化可以提高目的基因在大肠杆菌中
的表达速度和表达量,而诱导表达条件的优化可以获取更多的可溶性表达蛋白,实现了重组蛋白的可溶性表达,提高了纯化效率。
12.(2)本发明还在目的蛋白的羧基端加了his标签,并引入了终止子,相比在氨基端引入更有利于标签的暴露,使得在后续用镍柱对该蛋白进行纯化时效果更好。
附图说明
13.图1是本发明实施例中基因合成公司提供的pet32a-vp1重组质粒的鉴定结果图,图中,m:1kb ladder(10000,8000,6000,5000,4000,3000,2000,1500,1000,500);1:酶切前;2:bamhi和xhoi酶切后。
14.图2是本发明实施例提供的pet32a-vp1重组质粒在大肠杆菌中诱导表达结果图,图中,m:蛋白分子质量标准;1:iptg诱导前;2-4:1mm iptg诱导2、3、4小时后。
15.图3是本发明实施例提供的fmdv-o-vp1重组蛋白诱导表达形式的鉴定结果图,图中,m:蛋白分子质量标准;1:破碎后上清;2:破碎后沉淀。
16.图4是本发明实施例提供的fmdv-o-vp1重组蛋白过柱纯化的sds-page结果图,图中,m:蛋白分子质量标准;1:柱前;2:流穿液;3-5:50、150、300mm咪唑洗脱液。
17.图5是本发明实施例提供的fmdv-o-vp1重组蛋白超滤浓缩的sds-page结果图,图中,m:蛋白分子质量标准;1:超滤浓缩后fmdv-o-vp1重组蛋白。
具体实施方式
18.下面结合附图并通过具体实施方式对本发明做进一步的详细说明。可以理解的是,此处所描述的实施例仅用于解释本发明,而非对本发明的限定。基于本发明的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
19.一、材料与方法1、材料pet32a-vp1基因合成服务购于苏州金唯智公司,蛋白marker购于北京百奥莱博公司,异丙基-β-d-硫代半乳糖甘(iptg)购于biofroxx公司,氨苄青霉素购于阿拉丁公司,酵母膏、蛋白胨购于oxoid公司,氯化钠、琼脂粉、氯化钾、sds、triton x-100、甘油、kcl、kh2po4、edta
·
2na、nah2p04
·
2h20、na2hpo4
·
12h20购于国药,超滤管购于millipore公司,sds-page预制胶购于南京金斯瑞公司,tris-base、1m tris-hcl,ph8.0、5xsds loading buffer购于白鲨公司,mops、dtt、购于索莱宝公司,透析袋购于雷布斯公司,0.45um过滤器购于sartorius stedim,5ml镍柱购于纽龙。
20.2、fmdv-o-vp1基因的合成根据genbank公布的km243095.1基因为参考序列,该序列由639bp碱基组成,根据大肠杆菌密码子嗜性,将tac优化为tat,aag优化为aaa,gag优化为gaa,gac优化为gat,并在其中引入bamhi酶切位点、xhoi酶切位点、his标签和终止子,交由苏州金唯智生物公司合成vp1基因。
21.3、fmdv-o-vp1重组蛋白载体构建将目的基因重组至pet32a(+)载体,转化于大肠杆菌bl21(de3)感受态细胞,涂布
于含氨苄青霉素抗性的lb平板上,37℃培养12h,挑取单个菌落接种到含有氨苄青霉素的lb培养基中,200r/min,37℃培养6h,12000r/min离心收菌体,提取质粒,对质粒进行酶切鉴定并测序,该服务购于苏州金唯智生物公司。
22.4、fmdv-o-vp1重组蛋白诱导表达:将培养的菌液转移到1l含氨苄青霉素抗性的lb培养基中,200r/min,37℃培养至od600达到0.6-0.8时停止培养,取部分菌液加入iptg,使其终浓度为1mm,进行诱导表达,分别在诱导2h、3h和4h后取样,将诱导后的菌液于8000r/min离心5min,沉淀用超纯水洗涤1遍,后用pbs溶液重悬,100℃煮沸10min,跑sds page胶确定最佳诱导条件后大量诱导,收集菌体沉淀,用40ml菌体裂解液吹溶沉淀,冰浴超声破碎,超声条件为:功率250w,超4s,停4s,破碎30min,菌液澄清透光。破碎后收集至50ml离心管中离心 12000rpm离心10min。取上清和沉淀,跑sds page胶确定蛋白表达形式,其中破碎上清取40ul,破碎沉淀用100ul 1xpbs重悬取40ul 各加入10ul上样缓冲液(5x),沸水煮10min, 瞬间离心后,用12%浓度sds page胶,140v恒压电泳。
23.5、fmdv-o-vp1蛋白纯化1)平衡用平衡液以2.0ml/min平衡介质,直至基线平稳3-5个柱体积后调零。
24.2)上样样品经0.45um滤膜过滤后,以1ml/min进行上样,上样过程中当基线开始起峰时,收集流穿液。
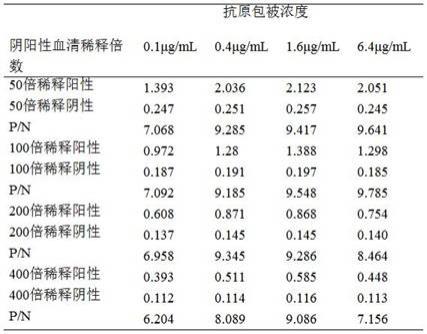
25.3)平衡上样结束后,用平衡液2.0ml/min平衡至基线平稳后开始洗杂。
26.4)洗杂用梯度洗脱液(50mm)以2.0ml/min洗杂,并收集洗杂液。
27.5)洗脱用100mm,150mm,300mm 3种浓度梯度洗脱的洗脱液以2.0ml/min洗脱,并收集洗脱液,将收集的洗脱液跑sds page胶,以确定目的蛋白所在洗脱浓度。
28.6)超滤浓缩用10kd的超滤管超滤换液,用1xpbs进行换液:5ml收集液与10ml 1xpbs吹溶离心换液:8000r/min离心 10min 每离完一次再加入10ml 1xpbs轻柔重悬,离心三次彻底换液,bca检测浓度,跑sds page胶。
29.6、间接elisa检测抗o型口蹄疫病毒vp1蛋白抗体方法的建立1)抗原包被将fmdv-o-vp1重组蛋白蛋白用cbs包被缓冲液稀释至0.1μg-6.4μg/ml,4倍梯度稀释,充分混匀。稀释完成后按100
ꢀµ
l/孔添加到微孔板中,盖好封板膜,放到37℃孵育两个小时,取出,用1
×
pbst(ph7.4),200
ꢀµ
l∕孔,洗涤5遍。
30.2)封板用rac封闭液,按200
ꢀµ
l /孔添加到微孔板中,37℃孵育2h,取出直接拍干。
31.3)血清孵育用1xpbs稀释阳性和阴性血清样品,稀释倍数为50倍、100倍,200倍,400倍。每孔加
入100ul,1xpbs作空白对照,37℃孵育30min,取出洗板5遍。
32.4)hrp酶标二抗孵育酶标二抗用1xpbs 3000倍稀释,每孔加入100ul,37℃孵育30min。洗板5次。
33.5)加入底物显色液每孔加入底物显色液,100ul/孔,置37℃恒温培养箱15min。
34.6)测定:每孔加入终止液50 μl,轻轻振荡混匀,5分钟内测定450 nm处吸光度值。
35.7、利用优化后的间接elisa法测试o型口蹄疫阴阳性样本,步骤同上。
36.二、结果分析1、pet32a-vp1重组质粒鉴定结果构建的重组质粒pet32a-vp1经bamhi和xhoi酶切鉴定,产物经琼脂糖凝胶电泳,如图1所示,结果显示酶切前的线性质粒约6500bp,酶切后的目的片段约639bp,与预期大小一致。
37.2、fmdv-o-vp1重组蛋白诱导表达条件摸索结果1mm iptg在37℃诱导2、3、4小时后,经sds-page结果显示,如图2所示,诱导后的重组蛋白的分子量约为42kd,与预期表达蛋白的大小一致,且诱导2小时即能达到最佳表达量。
38.3、fmdv-o-vp1重组蛋白诱导表达形式的确定将大肠杆菌诱导表达后超声破碎的上清和沉淀,经sds-page跑胶,结果如图3所示,目的蛋白表达于破碎上清。
39.4、fmdv-o-vp1重组蛋白过柱纯化fmdv-o-vp1重组蛋白主要存在于150mm咪唑洗脱液中。
40.5、fmdv-o-vp1重组蛋白超滤浓缩本发明所申请的方法纯化的fmdv-o-vp1重组蛋白浓度为5.34mg/ml,约得5ml,sds-page跑胶结果显示蛋白纯度较好。
41.6、间接elisa检测抗o型口蹄疫病毒vp1蛋白抗体方法的优化结果。
42.表1 不同抗原包被浓度、不同血清稀释倍数的elisa检测od
450nm
值
注:空白对照od值为0.058。
43.以阳性血清孔的od450nm值接近1.0, p/n≥2.0(血清样品孔od450nm值一空白孔od450nm值)/(阴性对照孔od450nm值一空白孔od450nm值)的vp1抗原及阳性对照血清最大稀释度作为vp1抗原及阳性血清的最适工作浓度。由上表可知,确定优化的包板浓度为0.4μg/ml、样品稀释浓度为100倍稀释,以od》0.3确定为阳性。
44.7、间接elisa抗o型口蹄疫病毒vp1蛋白抗体检测实际样本的结果用优化好的间接elisa方法检测30份已知口蹄疫vp1抗体阴阳性的猪血清,符合率达96.7%。
45.三、结论本发明根据大肠杆菌嗜性对o型fmdv的基因序列进行部分优化,结合his纯化标签和trx促溶标签的优点,使得fmdv-o-vp1重组蛋白可溶性表达,大大提高了原核表达效率,后续用该重组蛋白进行包板,建立了o型口蹄疫病毒vp1蛋白抗体的elisa检测方法,且检测实际样本的阳性符合率高达96.7%。
46.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1