海松烷二萜化合物及其制备方法与应用
1.本发明属于医药生物技术领域,具体涉及海松烷二萜化合物及其制备方法和在制备抗菌药物中的应用。
背景技术:
2.研究发现细菌能够通过形成的生物膜阻断药物作用而产生耐药性,使传统的抗生素失去疗效,为临床治疗带来极大的困难,因此新型抗耐药菌药物的研发迫在眉睫。
[0003] 群体感应(quorum sensing, qs)是一个依赖于细菌密度的细胞间信号传导系统,涉及产生和释放几种不同化学类别小的可扩散信号分子,细胞间通讯,以化学交流的方式精密地调节细菌群体行为,包括对细菌生物膜形成免疫逃逸、毒力因子基因表达、耐药性的产生、细菌运动和次级代谢的调控。通过阻断或干扰细菌的群体感应现象,在不影响细菌生长的情况下,特异性地抑制细菌致病因子的表达,干扰细菌生物被膜形成、毒力因子产生或致病基因的表达,最大限度的减少耐药突变体出现。因此,群体感应系统抑制剂成为目前抗感染领域药物研发的热点,成为治疗耐药菌感染的潜在途径。
[0004]
当今医院感染的首要致病菌之一的铜绿假单胞菌(pseudomonasaeruginosa,pa),其致病能力强且耐药机制复杂多变,在临床治疗上面临巨大挑战。研究发现,铜绿假单胞菌有3 种群体感应系统,分别是lasi /lasr信号系统、rhli /rhlr信号系统以及pqs喹诺酮信号系统。铜绿假单胞菌多种致病毒力因子的表达(如弹性蛋白酶、绿脓菌素、鼠李糖脂等)均受群体感应系统调控。另外,通过抑制细菌的群体感应,可调控造成病原菌耐药原因之一的生物被膜的形成,调控病原菌的运动行为能力,降低细菌对宿主的危害,达到预治或辅助抗生素治疗细菌感染的目的。因此,发现低毒、高活性的细菌群体感应抑制剂在防治铜绿假单胞菌细菌感染方面提供更有效的抗菌剂。
[0005]
海洋真菌由于其特殊的生长环境,使其具有独特的代谢途径和遗传背景,代谢并积累结构独特的活性次级代谢产物,在天然产物研究中占据了重要的地位。随着研究的深入,研究者们发现了越来越多的具有生物活性的海洋天然产物,为海洋新药的研发奠定了良好的基础,是发现新的抗耐药性抗菌药物的一大重要来源。
技术实现要素:
[0006]
本发明的第一个目的是提供具有抗菌活性的海松烷二萜类化合物。
[0007]
其结构如式(
і
)(ii)所示:。
[0008]
本发明的第二个目的是提供上述海松烷二萜类化合物的制备方法,其特征在于,
所述的式(
і
)化合物和式(ii)是从海洋链格孢属真菌alternaria porri 25#发酵培养物中分离制备得到。
[0009]
本发明的海洋链格孢属真菌alternaria porri 25#于2021年12月31日保藏于广东省微生物菌种保藏中心(gdmcc),其保藏编号为: gdmcc no. 62148。地址:广东省广州市先烈中路100号59号楼广东省科学院微生物研究所。
[0010]
优选地,具体步骤如下:a、制备海洋真菌alternaria porri 25#的固体发酵培养物。
[0011]
b、将发酵物用氯仿:甲醇(体积比1:1)浸提浓缩,得到氯仿-甲醇提取物浸膏,此浸膏再用水:乙酸乙酯(体积比1:1)分配萃取,浓缩乙酸乙酯层,得到乙酸乙酯粗浸膏。
[0012]
将得到的粗浸膏经过硅胶柱层析,用石油醚-乙酸乙酯以体积比为9:1, 4:1, 7:3, 3:2, 1:1, 3:7, 0:1依次作为洗脱剂,梯度洗脱,得7个组分fr.1-fr.7.收集石油醚:乙酸乙酯体积比4:1洗脱组分fr.2,继续采用硅胶柱层析,用石油醚-乙酸乙酯系统,体积比为9:1,9:2,9:3,4:1,1:1梯度洗脱顺序得5个组分fr.2.1-fr.2.5。
[0013]
将组分fr.2.2,继续经sephadex lh-20色谱分离,用二氯甲烷:甲醇(体积比1:1)作为洗脱剂洗脱,分离纯化得到式(ii)化合物。将组分fr.2.3,重结晶纯化得到式(
і
)化合物。
[0014]
所述的制备海洋真菌alternaria porri 25#的发酵产物是以海洋真菌lternaria porri 25#作为发酵菌株在放大发酵培养基中培养得到海洋真菌alternaria porri 25#的发酵产物;所述的放大培养基,为大米固体培养基:按单个培养基比例计,包括大米100 g,自制海水100 ml(海盐3克,水100 ml),ph 7.2-7.4。
[0015]
通过对式(
і
)化合物和式(ii)化合物的抑菌活性评价,发现式(
і
)化合物和式(ii)化合物对铜绿假单胞菌群体感应系统中的毒力因子绿脓菌素、鼠李糖脂、弹性蛋白酶的表达具有明显抑制作用,且有明显抑制铜绿假单胞菌生物膜形成的作用。
[0016]
因此,本发明的第三个目的是提供式(
і
)化合物和式(ii)化合物在制备细菌群体感应抑制剂抗耐药菌药物中的应用,并为该应用提供具有应用价值的最小有效浓度。
[0017]
优选地,所述的抗菌药物为抗铜绿假单胞菌药物。
[0018]
本发明的第四个目的是提供一种抗菌药物,包括有效量的作为活性成份的式(
і
)化合物和/或式(ii)化合物或其药用盐,和药学上可以接受的载体。
[0019]
优选地,所述的抗菌药物为抗铜绿假单胞菌药物。
[0020]
与现有技术相比,本发明提供的技术方案具有如下技术优点:本发明提供的海松烷二萜类化合物,在远小于致病菌生长的浓度下,对细菌群体感应系统具有显著的抑制作用,能显著降低由细菌群体感应系统介导的绿脓菌素、鼠李糖脂、弹性蛋白酶等毒力因子的分泌和表达,以及细菌生物被膜的形成,降低细菌的毒力。本发明中海松烷二萜类化合物来源于海洋真菌,微生物发酵简单,化合物分离纯化制备简单易控、安全性高、使用浓度低和不易产生耐药性等优点,可以用于制备抗耐药菌药物,用于预防和治疗耐药菌引起的感染。因此本发明为开发新的抗耐药菌药物提供候选化合物,对开发中国海洋药物资源具有重要的意义。
7:3, 3:2, 1:1, 3:7, 0:1依次作为洗脱剂,梯度洗脱,得7个组分fr.1-fr.7. 收集石油醚:乙酸乙酯体积比4:1洗脱组分fr.2(10.8 g),继续采用硅胶柱层析,用石油醚-乙酸乙酯系统,体积比为9:1,9:2,9:3,4:1,1:1梯度洗脱顺序得5个组分fr.2.1-fr.2.5。
[0042]
将组分fr.2.2(500 mg),继续经sephadex lh-20色谱分离,用二氯甲烷:甲醇(体积比1:1)作为洗脱剂洗脱,分离纯化得到化合物2(50.1 mg)。
[0043]
将组分fr.2.3(1.50 g),重结晶纯化得到化合物1(1.06 g)。
[0044]
4)化合物1和化合物2的结构鉴定1h-nmr、
13
c-nmr核磁共振谱图用bruker-advance 400m核磁共振光谱仪测定,以四甲基硅烷(tms)为内标;esi-ms数据用thermofisher ltq qrbitrap质谱仪测定。
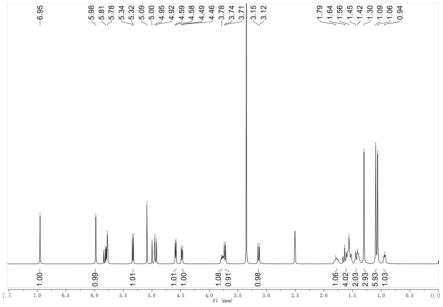
[0045]
如图1-6所示,图1是化合物1的1h nmr谱(dmso-d6);图2是化合物1的
13
c nmr谱(dmso-d6);图3是化合物1的esi-ms谱;图4是化合物2的1h nmr谱(dmso-d6);图5是化合物2的
13
c nmr谱(dmso-d6);图6是化合物2的esi-ms谱。
[0046]
对化合物1进行结构分析测试,得到以下理化性质数据,其核磁数据如表1所示:化合物1:无色晶体,esi-ms m/z 365.3 [m-h]
+
。检索文献对比,化合物1与化合物diaporthein a的核磁数据基本一致,确定化合物1为海松烷二萜diaporthein a。
[0047]
对化合物2进行结构分析测试,得到以下理化性质数据,其核磁数据如表1所示:化合物2:无色晶体,esi-ms m/z 363.3 [m-h]
+
。
[0048]
该化合物的 1
h nmr 和 13
c nmr 数据与化合物1非常相似。检索文献对比,化合物2与diporthein b 的核磁数据基本一致,确定化合物2为海松烷二萜diaportheins b。
[0049]
表1:化合物1和2的1h (400 mhz)和
13
c nmr (100 hmz)数据化合物活性测试所用的仪器与试剂:thermofisher varioskanlux酶标仪(美国赛默飞公司);
蔡司lsm 800 with airscan高分辨激光共聚焦显微镜(德国carl zeiss公司);罗氏lightcycler 96 实时荧光定量pcr 仪(瑞士罗氏公司);试剂盒enzchekfi protease assay kit e6638(美国赛默飞公司);试剂盒live/dead baclight bacterial viability kit(美国赛默飞公司);试剂盒hiscript
ꢀⅱꢀ
one step sybr green kit(南京诺唯赞公司)。
[0050]
实施例2:化合物1和2对铜绿假单胞菌最小抑菌浓度(mic)的测定待测样品:将本发明中的化合物diaportein a和diaportein b用dmso配制成200 mm,和阿奇霉素(aq,200 mm)待用;采用二倍稀释法测定样品抑制铜绿假单胞菌pao1(atcc15692)的mic值。细菌lb培养液(蛋白胨10.0 g,氯化钠5.0 g,葡萄糖1.0 g,酵母膏粉5.0 g,水 1000 ml,ph 7.0)。在96孔板中,加入od
600
为0.01的pao1菌液100 μl,再分别加入100 μl的待测样品化合物1、化合物2和阿奇霉素,使其终浓度为320 μm、160 μm、80μm、40μm、20μm、10μm;阳性对照组不加药物,阴性对照组不加细菌,每一个浓度平行6个复孔。37 ℃恒温培养24 h,然后每孔再加入20 μl 0.2%红四氮唑溶液,继续37 ℃恒温培养4 h后;观察细菌生长情况,无红色生成的最低待测样品浓度为最小抑菌浓度mic。
[0051]
试验结果表明:diaportein a,diaportein b对铜绿假单胞菌的最小抑菌浓度mic均大于320μm;阿奇霉素对铜绿假单胞菌的最小抑菌浓度mic值为80μm。
[0052]
实施例3:化合物1和化合物2对铜绿假单胞菌生长的影响含50 ml的铜绿假单胞菌(细菌终浓度:od
600
=0.01)的锥形瓶中,分别加入化合物1,化合物2,使其终浓度为40 μm(《 1/8 mic),对照组不加药物;置于37℃,摇床培养24 h;每隔2h分别取样测od
600
值,绘制成曲线图。
[0053]
试验结果表明(图7a、7b),diaportein a和diaportein b在40 μm浓度下对铜绿假单胞菌的生长曲线没有明显影响,表明diaportein a和diaportein b浓度为40 μm时对铜绿假单胞菌无杀菌作用,不影响铜绿假单胞菌的生长。实施例4:化合物1和2对群体感应调控的生物膜的影响结晶紫染色法测定化合物对生物膜的抑制作用方法:24孔板中接种500 μl铜绿假单胞菌pao1菌液,同时分别加入终浓度为40 μm的化合物1和化合物2,37℃孵化24 h。去掉孔内表层菌液后,用蒸馏水小心洗涤24孔板,洗去浮游细菌后干燥。然后在24孔板中加入1%结晶紫溶液1 ml,室温静置染色15 min,吸出多余的结晶紫溶液,用蒸馏水小心洗涤生物膜3次,再静置干燥。然后再加入33%冰醋酸溶解,振荡均匀,在酶标仪570 nm波长处,测od值。
[0054]
试验结果表明:化合物1和化合物2对铜绿假单胞菌生物膜的形成有一定的抑制作用,对生物膜产生量的抑制率分别为33%和32%。
[0055]
显微成像分析法检测化合物1和化合物2对生物膜形成的影响(1)普通光学显微镜成像分析法:24孔板中接种500 μl铜绿假单胞菌pao1菌液,同时分别加入终浓度40 μm的化合物1和化合物2,37℃孵化24 h后,吸掉孔内表层菌液,再用蒸馏水洗涤24孔板,洗去浮游细菌,洗涤三次后干燥;然后在24孔板中加入1%的结晶紫溶液
1 ml,室温静置染色15 min,吸出多余结晶紫溶液,用蒸馏水小心洗涤3次后干燥,置于普通光学显微镜观察膜。
[0056]
试验结果用imagej软件分析,如图8a所示,浓度为40 μm时,化合物1和化合物2对铜绿假单胞菌生物膜形成的抑制率分别为39%和42%。
[0057]
(2)激光共聚焦成像分析法:在35mm的波底培养皿接种1 ml铜绿假单胞菌pao1菌液,分别加入1 ml化合物1和化合物2,至其终浓度为40 μm,37℃孵化24 h后,吸掉孔内表层菌液,蒸馏水洗涤培养皿3次,洗去浮游细菌。然后加入细菌生存力试剂盒染料染色,在激光共聚焦显微镜下观察生物膜,绿色荧光syt9:激发波长483 nm,发射波长500 nm;红色荧光pi:激发波长305 nm,发射波长617 nm。
[0058]
试验结果用imagej软件分析,如图8b,浓度为40 μm时,化合物1和化合物2对铜绿假单胞菌生物膜产生量的抑制率分别为33%,44%。
[0059]
以上2种显微成像分析法的结果表明:化合物1和化合物2对铜绿假单胞菌生物膜的形成有明显的抑制作用。
[0060]
实施例5:对群体感应调控的毒力因子表达量的影响铜绿假单胞菌于lb培养液中过夜培养。将50 ml活化好的铜绿假单胞菌接种于锥形瓶中(细菌终浓度:od
600
=0.01),同时分别加入化合物1和化合物2,化合物的终浓度分别为10 μm、20 μm、40 μm;37℃,200 r/min,摇床培养24小时后,分别取200 ul菌液于96孔板,在600 nm波长处,测od
600
值。
[0061]
1)化合物1和2对毒力因子绿脓菌素分泌的抑制作用测试方法:将上述培养后的菌液转移至50 ml离心管中,10000 rpm/min,4℃离心10 min。离心后取上清液40 ml加入32 ml氯仿充分振荡进行提取,静置后取1ml氯仿层移至新管,加入0.6 ml 0.2 mol/l的盐酸萃取,离心分层后,取200 ul盐酸层放置96孔板,在酶标仪波长520 nm处,测其od值。
[0062]
注:a1为药物组绿脓菌素含量(od
520
/od
600
);a0为空白组绿脓菌素含(od
520
/od
600
)由图9所示实验结果可知,化合物1和化合物2对毒力因子绿脓菌素分泌的抑制率在10%-30%,且随浓度的增加抑制率增加,表明化合物1和化合物2对铜绿假单胞菌绿脓菌素的分泌起到抑制作用。
[0063]
2)化合物1和2对铜绿假单胞菌鼠李糖脂分泌的抑制作用测试方法:取培养后的菌液5 ml,10000 rpm/min,4℃离心10 min。取2 ml上清液于10 ml ep管中,加入4 ml乙醚震摇混匀萃取。取乙醚层1 ml于1.5 ml ep管中,放入通风橱中,除去乙醚。加入40 μl超纯水溶解提取出来的鼠李糖脂,加入360 μl苔黑酚溶液(0.19g苔黑酚粉末加入到50%浓硫酸中,定容至100ml),混匀之后80 ℃水浴锅煮30 min。冷却后取200 μl放置于96孔板中,在酶标仪波长421nm 处,测od值。
[0064]
注:b1为药物组鼠李糖脂含量(od
421
/od
600
);b0为对照组鼠李糖脂含量od
421
/od
600
试验结果发现(图10),化合物1对铜绿假单胞菌鼠李糖脂分泌的抑制率在40%-61%之间;化合物2对铜绿假单胞菌鼠李糖脂分泌的抑制率在19%-42%,且随浓度的增加抑制率
明显增加,表明化合物1和化合物2有明显抑制铜绿假单胞菌毒力因子鼠李糖脂分泌的作用。
[0065]
3)化合物1和2对铜绿假单胞菌弹性蛋白酶活性的抑制作用弹性蛋白溶液的配制:按照试剂盒enzchekfi protease assay kit e6638配制弹性蛋白溶液(注意避光)。
[0066]
将0.2 ml pbs加入含有bodipy fl弹性蛋白冻干底物的小瓶中,充分溶解后使bodipy fl弹性蛋白的浓度为1.0 mg/ml,然后用ph 7.8 tri-hcl缓冲液稀释弹性蛋白溶液至10 μg/ml。
[0067]
取上述培养后的菌液5 ml,10000 rpm/min,离心10 min后,用0.22 μm滤膜过滤,取100 μl滤液加入到10 μg/ml的 bodipy fl弹性蛋白溶液100 μl中,混匀,反应4小时,测其荧光强度rfu(激发波长400 nm,发射波长450 nm),计算其抑制率。
[0068]
由图11所示,试验结果发现,化合物1对铜绿假单胞菌弹性蛋白酶活性的抑制率在20%-55%之间,化合物2对铜绿假单胞菌弹性蛋白酶活性的抑制率在19%-67%之间,且随浓度的增加抑制率增加。表明化合物1和化合物2对铜绿假单胞菌弹性蛋白酶有明显的抑制作用。
[0069]
实施例7:化合物1和化合物2对铜绿假单胞菌群体感应系统相关基因表达的影响铜绿假单胞菌于lb培养液中过夜培养。将50 ml活化好的铜绿假单胞菌接种于锥形瓶中(细菌终浓度:od
600
=0.01),再分别加入终浓度为40 μm的化合物1和2,摇床培养24小时。
[0070]
取1 ml菌液,8000 rpm,离心3 min,去掉上清液,加入500 μl pbs液轻摇洗涤,离心,弃上清。再加入200 μl溶菌酶,振荡混匀后,加入800 μl的rna提取液,用枪头轻轻吹打破碎细胞,然后再加入250 μl三氯甲烷充分混匀,静置3min后,再离心10min。
[0071]
取400 μl上清液转移到新的离心管,加入0.8倍体积的异丙醇,混匀,-20℃放置15min后,离心10min,去除上清液,再加入1.5ml 75%乙醇洗涤沉淀,离心,沉淀即为rna。离心管中加入15 μl无菌无酶水溶解rna沉淀,用超微量核酸蛋白定量仪(nanodrop 2000)检测其浓度和纯度,最终用无菌无酶水配制其终浓度为200 ng/μl的rna溶液。
[0072]
按照sybr green qpcr试剂盒说明书,将待测基因的特异性引物,rna溶液和染料试剂混合后,设置反应条件,在lightcycler96 荧光定量pcr仪中进行实时定量pcr检测。以16s核糖体rna基因为内参,对pcr数据进行规范化处理。用2-δδct
法计算基因的表达水平。
[0073]
△
ct=ct目的基因-ct内参基因
△△
ct=
△
ct药物处理组基因
‑△
ct对照组基因使用 2-(
△△
ct)进行相对定量计算倍数变化(图 12),化合物1和化合物2在浓度40 μm时,对lasb、rhlr、pqsr基因的表达有显著的下调作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1