从微生物中回收油的方法与流程
从微生物中回收油的方法
1.对相关申请的交叉引用
2.本技术是申请号为201480069710.8的中国专利申请的分案申请,并且要求2013年12月20日提交的美国临时申请no.61/918,886的权益,其通过引用整体并入本文中。
3.背景
4.使用湿法提取方法或干燥提取方法可从诸如微藻类的微生物中提取油。在干燥提取方法中,通常在油提取之前收获和干燥微生物。然而,干燥是昂贵和高耗能步骤。此外,如果油中富含多不饱和脂肪酸(pufa)(例如,用于食品和营养补充应用),则由于干燥中涉及到的高温,该方法可导致pufa的严重氧化。
5.此外,通常使用诸如己烷的有机溶剂来进行从微生物中回收油的干燥提取方法,并且该方法需要结合用于获得适合出油率的机械细胞破裂方法。然而,机械破裂方法昂贵和高耗能,并且有机溶剂易燃、有毒,因而必须从最终油产品中去除有机溶剂。
6.概述
7.本文提供从微生物中回收油(即,脂质)的湿润、无溶剂方法。该方法用于例如获得营养油和/或脂质生物燃料。本文所述回收油的方法可任选作为整合生物工艺来进行,即,作为“一锅”法。
8.本文所述的从微生物群体中回收脂质的方法包括:在导致微生物破裂的条件下,使微生物群体接触一种或多种酶;浓缩破裂的微生物;以及在高温下、在盐的存在下和在不存在有机溶剂下,从破裂的微生物中提取脂质。任选地,接触步骤可在介于且包括5至8.5(例如,约8)的ph下进行。接触步骤任选在介于且包括约50℃至约70℃的温度下进行。接触步骤可进行一至二十小时(包括端值)(例如,一至八小时或四小时)。
9.任选地,在接触步骤中使用的酶为蛋白酶。酶任选为alcalase 2.4l。任选地,酶的浓度为约0.001%至约0.4%体积/体积(包括端值)(例如,介于0.05%至0.2%之间或约0.05%、0.1%或0.2%)。在55℃下、在介于0.05%至0.2%(包括端值)酶的存在下,可任选进行接触步骤持续且包括一至八小时。例如,在55℃下、在0.1%酶的存在下,可进行接触步骤四小时。任选地,在55℃下、在0.05%酶的存在下,进行接触步骤六小时。在接触步骤中,可将ph滴定为约8.0的ph。
10.任选地,接触步骤可包括通过通气或通过再循环发生的混合。任选地,混合不通过振荡发生。
11.接触步骤可在不存在表面活性剂下进行。任选地,在接触步骤之前,微生物群体未经浓缩。该方法还可包括预处理步骤,其中预处理步骤包括在接触步骤之前使细胞破裂。使用化学、机械或酶细胞破裂方法可进行预处理步骤。
12.浓缩步骤任选包括离心。任选地,浓缩步骤包括25%至95%水分去除(包括端值),(例如,50%至95%或85%水分去除)。
13.在提取步骤中高温可以为55℃至95℃(例如,75℃至95或85℃或90℃)。任选地,在提取步骤中加入的盐浓度为和包括1%至5%或3%至5%(例如,3%或5%)。在提取步骤中盐可以为硫酸钠。至少80%的脂质可以从破裂的微生物中提取。在油(例如,椰子油)或生物
燃料的存在下可进行提取步骤或者在不存在油或生物燃料下可进行提取步骤。
14.任选地,从本文所述的微生物群体中提取脂质的方法缺少巴氏灭菌步骤。任选地,从本文所述的微生物群体中提取脂质的方法缺少干燥步骤。
15.微生物群体可选自由以下组成的组:藻类、真菌、细菌和原生生物。任选地,微生物群体选自:破囊壶菌属(thraustochytrium)、裂殖壶菌属(schizochytrium)或其混合物。任选地,微生物群体为诸如以atcc登录号pta-6245保存的海洋破囊壶菌。
16.一个或多个实施方案的详细情况在附图和以下简述中说明。其他特征、目标和优势由说明书、附图和权利要求书会显而易见。
17.附图简述
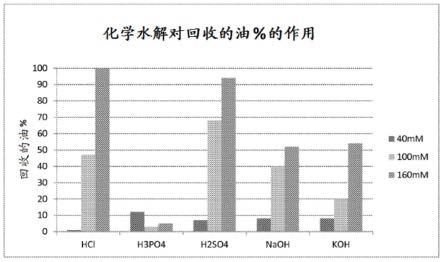
18.图1是显示从使用40mm(左侧条)、100mm(中间条)和160mm(右侧条)的盐酸、磷酸、硫酸、氢氧化钠和氢氧化钾水解的细胞中回收的油百分比的图。
19.图2是显示从使用0.2%(左侧条)和0.4%(右侧条)的viscozyme、alcalase、flavourzyme和mannaway酶进行酶水解的细胞中回收的油百分比的图。
20.图3是显示从使用40mm h2so4,160mm h2so4和0.2%(v/v)alcalase水解后未经洗涤(左侧条)和经洗涤(右侧条)的细胞中回收的油百分比的图。
21.图4是显示从在55℃下酶水解18小时和在70℃下酶水解4小时的细胞中回收的油百分比的图。
22.图5是显示tg藻油、生物燃料和ee藻油的脂质分类简图(lipid class profile)的图。
23.图6是在55℃下使用0.4%(v/v)alcalase水解18小时的生物质物料、在55℃下离心后将经水解生物质浓缩的生物质物料以及在55℃下离心后的培养基的示图(从左至右)。
24.图7a是使用na2so4处理和90℃加热的经浓缩的水解生物质物料的示图。
25.图7b是显示在90c下离心之后消耗生物质(左)和在90℃下离心之后回收油(右)的照片。
26.图8是显示作为水解时间函数的在55℃和ph 8.0下使用0.1%(v/v)alcalase酶水解之后从细胞中回收的油百分比和在培养基中氨基酸浓度的图。
27.图9是显示作为水解时间函数的在55℃和ph 8.0下使用0.05%(v/v)alcalase酶水解之后从细胞中回收的油百分比和在培养基中氨基酸浓度的图。
28.图10是显示在ph 3.5、4.5、5.5、6.5、7.5和8.0下酶水解的细胞中回收油百分比的图。
29.发明详述
30.本文描述从微生物群体中回收脂质的湿润、无溶剂方法。回收脂质的方法包括:在导致微生物破裂的条件下,使微生物群体接触一种或多种酶;浓缩破裂的微生物;以及从破裂的微生物中提取脂质。细胞破裂为湿法。在高温下、在盐的存在下和在不存在溶剂下进行提取。本文所述的方法可称为“一锅”或者“整合”工艺,因为微生物油生产和用于释放油的细胞破裂可任选在相同容器内进行。因此,下游加工步骤(例如,油提取和回收)可整合到上游加工步骤终点(例如,发酵)处。
31.i.微生物
32.本文所述的方法包括从微生物群体中回收脂质。本文所述的微生物群体可以为藻
类(例如,微藻类)、真菌(包括酵母)、细菌或原生生物。任选地,微生物包括破囊壶菌目(thraustochytriales)的破囊壶菌(thraustochytrids),更具体而言,破囊壶菌属的破囊壶菌和裂殖壶菌属。任选地,微生物群体包括如在美国专利no.5,340,594和5,340,742中所述的破囊壶菌目,其通过引用整体并入本文。微生物可以为海洋破囊壶菌,例如以atcc登录号pta-6245(即,onc-t18)保存的海洋破囊壶菌。
33.本文所述的方法中使用的微生物可产生各种脂质化合物。如本文所使用,术语脂质包括磷脂、游离脂肪酸、脂肪酸酯、三酰甘油、甾醇类和甾醇酯、类胡萝卜素、叶黄素(例如,含氧类胡萝卜素)、烃类和本领域普通技术人员已知的其他脂质。
34.任选地,脂质化合物包括饱和、单不饱和和/或多不饱和脂肪酸。
35.任选地,脂质化合物包括不饱和脂质。不饱和脂质可包括多不饱和脂质(即,包含至少2个诸如双键的不饱和碳-碳键的脂质)或者高度不饱和脂质(即,包含4个或多个不饱和碳-碳键的脂质)。不饱和脂质的例子包括ω-3和/或ω-6多不饱和脂肪酸,例如二十二碳六烯酸(即,dha)、二十碳五烯酸(即,epa)和其他天然存在的不饱和和多不饱和化合物。
36.ii.工艺
37.发酵
38.根据本领域已知的方法可培养本文所述的微生物。例如,破囊壶菌(例如,海洋破囊壶菌)可根据通过引用整体并入本文中的美国专利公开us 2009/0117194或us 2012/0244584中描述的方法来培养。微生物在生长培养基(也称为“培养基”)中生长。各种培养基中任一种均可适用于培养本文所述的微生物。任选地,培养基为微生物提供各种营养成分,包括碳源和氮源。
39.任选地,本文提供的微生物在增加生物质和/或目标化合物生成(例如,油或总脂肪酸(tfa)含量)的条件下培养。例如,破囊壶菌典型在盐水培养基中培养。任选地,破囊壶菌可在具有约2.0g/l至约50.0g/l的盐浓度培养基中培养。任选地,破囊壶菌在具有约2g/l至约35g/l(例如,约18g/l至约35g/l)的盐浓度培养基中培养。任选地,本文所述的破囊壶菌可在低盐条件下生长。例如,破囊壶菌可在具有约5g/l至约20g/l(例如,约5g/l至约15g/l)的盐浓度培养基中培养。培养基任选包括nacl。任选地,培养基包括天然或人工海盐和/或人工海水。
40.如与传统方法相比,在培养基中可降低氯浓度(即,减少量)。培养基可包括不含氯的钠盐(例如,硫酸钠)作为钠的来源。例如,很大一部分总钠可通过非钠盐提供,从而使得在培养基中约100%、75%、50%或25%的总钠不通过氯化钠提供。
41.任选地,培养基具有小于约3g/l、500mg/l、250mg/l或120mg/l的氯浓度。例如,培养基具有介于且包括约60mg/l和120mg/l之间的氯浓度。根据本方法适合使用的非氯钠盐的例子包括但不限于苏打灰(碳酸钠和氧化钠的混合物)、碳酸钠、碳酸氢钠、硫酸钠及其混合物。参见例如美国专利no.5,340,742和6,607,900,其各自以全部内容通过引用并入本文。
42.用于破囊壶菌培养的培养基可包括各种碳源的任一种。碳源的例子包括:脂肪酸;脂质;甘油;三甘油;糖类,例如葡萄糖、淀粉、纤维素、半纤维素、果糖、右旋糖、木糖、乳果糖、半乳糖、麦芽三糖、麦芽糖、乳糖、糖原、明胶、淀粉(玉米或小麦)、醋酸纤维、m-肌醇(来源于玉米浆)、半乳糖醛酸(来源于果胶)、l-岩藻糖(来源于半乳糖)、龙胆二糖、葡萄糖胺、
α-d-葡萄糖-1-磷酸(来源于葡萄糖)、纤维二糖、糊精和α-环糊精(来源于淀粉);蔗糖(来自糖蜜);多元醇,例如麦芽糖醇、赤藓糖醇、侧金盏花醇和油酸,例如丙三醇和吐温80;氨基糖,例如n-乙酰基-d-半乳糖胺、n-乙酰基-d-葡萄糖胺和n-乙酰基-β-d-甘露糖胺;以及任何类型的生物质或者废液。
43.任选地,培养基包括约5g/l至约200g/l浓度的碳源。培养基可具有介于约1:1至约40:1之间的c:n(碳:氮)比率。当使用两相培养时,则培养基的第一相可具有介于且包括约1:1至约5:1之间的c:n比率,而第二相为约1:1至约1:~0(即,不存在氮或者极少氮)。如本文所使用,术语极少是指小于约10%(例如,小于约9%、小于约8%、小于约7%、小于约6%、小于约5%、小于约4%、小于约3%、小于约2%、小于约1%、小于约0.9%、小于约0.8%、小于约0.7%、小于约0.6%、小于约0.5%、小于约0.4%、小于约0.3%、小于约0.2%或小于约0.1%)。例如,在培养基中极少氮可表示在培养基中小于约10%(例如,小于约9%、小于约8%、小于约7%、小于约6%、小于约5%、小于约4%、小于约3%、小于约2%、小于约1%、小于约0.9%、小于约0.8%、小于约0.7%、小于约0.6%、小于约0.5%、小于约0.4%、小于约0.3%、小于约0.2%或小于约0.1%)的氮。
44.用于破囊壶菌培养的培养基可包括各种氮源的任一种。示例性氮源包括铵溶液(例如,在h2o中nh4)、铵或胺盐(例如,(nh4)2so4,(nh4)3po4,nh4no3,nh4ooch2ch3(nh4ac))、蛋白胨、胰胨、酵母提取物、麦精、鱼粉、谷氨酸钠、大豆提取物、酪蛋白氨基酸和酒糟。在合适培养基中氮源浓度范围通常介于且包括约1g/l至约25g/l之间。
45.培养基任选包括磷酸盐,例如磷酸钾或磷酸钠。在培养基中无机盐和微量营养物可包括硫酸铵、碳酸氢钠、原钒酸钠、铬酸钾、钼酸钠、亚硒酸、硫酸镍、硫酸铜、硫酸锌、氯化钴、氯化铁、氯化锰、氯化钙和edta。诸如盐酸吡哆醇、盐酸硫胺素、泛酸钙、p-氨基苯甲酸、核黄素、烟酸、生物素、叶酸和维生素b12的维生素类可包括在内。
46.使用酸或碱(合适的情况下)和/或使用氮源,可将培养基的ph调整到介于且包括3.0至10.0之间。任选地,将培养基的ph调整到4.0至6.5(包括端值)。可将培养基消毒。
47.一般而言,用于培养微生物的培养基为液态培养基。然而,用于培养微生物的培养基可以为固体培养基。除了如本文所讨论的碳源和氮源之外,固体培养基可包含提供结构支持和/或使得培养基呈固态的一种或多种成分(例如,琼脂或琼脂糖)。
48.可将细胞在任何地方培养1天至60天。任选地,培养进行14天或更少、13天或更少、12天或更少、11天或更少、10天或更少、9天或更少、8天或更少、7天或更少、6天或更少、5天或更少、4天或更少、3天或更少、2天或更少、1天或更少。培养任选在约4℃至约30℃,例如约18℃至约28℃的温度下进行。培养可包括通风-振荡培养、振荡培养、静置培养、分批培养、半连续培养、连续培养、旋转分批培养、波动培养(wave culture)等。可使用常规搅拌发酵罐、泡罩塔发酵罐(分批培养或连续培养)、波动发酵罐等来进行培养。
49.可通过包括振荡的各种方法中一种或多种来通气培养物。任选地,振荡范围为约100rpm至约1000rpm,例如约350rpm至约600rpm或者约100至约450rpm。任选地,在生成生物质阶段和生成脂质阶段,使用不同的振荡速度来通气培养物。可选地或此外,振荡速度可根据培养容器类型(例如,烧瓶的形状或尺寸)来改变。
50.任选地,溶解氧(do)的水平在生物质生成阶段比它在脂质生成阶段高。因此,do水平在脂质生成阶段下降(即,do水平小于在生物质生成阶段中溶解氧的量)。任选地,将溶解
氧的水平降低到饱和度以下。例如,可将溶解氧的水平降低到非常低或甚至达到不可检测水平。
51.通过根据包括改变一个或多个培养条件以获得较高量的所需化合物的方法培养细胞可增加所需脂质生成。任选地,首先将细胞在最大化生物质的条件下培养,然后改变一个或多个培养条件为有利于脂质产率的条件。改变的条件可包括氧浓度、c:n比率、温度及其组合。任选地,进行两阶段培养,其中第一阶段有利于生物质生成(例如,使用高氧条件(例如,一般而言或者相对于第二阶段))、低c:n比率和环境温度),然后进行有利于脂质生成的第二阶段(例如,在第二阶段中,降低氧,增加c:n比率,并且降低温度)。
52.巴氏灭菌
53.任选地,将所得的生物质巴士灭菌以杀灭细胞和使生物质中存在的不需要的物质灭活。例如,可将生物质巴士灭菌以灭活化合物降解物质。巴氏灭菌步骤中,生物质可存在于发酵培养基中或者从发酵培养基中分离。通过加热生物质和/或发酵培养基到高温可进行巴士灭菌步骤。例如,可将生物质和/或发酵培养基加热到约且包括55℃至约且包括121℃(例如,约且包括55℃至约且包括90℃或者约且包括65℃至约且包括80℃)。任选地,可将生物质和/或发酵培养基加热约且包括4分钟至约且包括120分钟(例如,约且包括30分钟至约且包括120分钟或约且包括45分钟至约且包括90分钟或者约且包括55分钟至约且包括75分钟)。使用如本领域技术人员已知的合适加热方法可进行巴士灭菌,例如通过直接蒸汽喷射。
54.任选地,不进行巴氏灭菌步骤(即,该方法缺少巴氏灭菌步骤)。
55.收获和洗涤
56.任选地,根据本领域技术人员已知的方法可收获生物质。例如,可任选使用各种常见方法从发酵培养基中收集生物质,例如离心(例如,固体喷射离心)或过滤(例如,交叉流过滤),并且生物质也可包括使用用于加速细胞生物质收集的沉淀剂(例如,磷酸钠或氯化钙)。
57.任选地,使用水洗涤生物质。任选地,可将生物质浓缩至多约且包括30%固体。例如,可将生物质浓缩到约且包括5%至约且包括30%固体、约且包括7.5%至约且包括15%固体或者约且包括15%固体至约且包括20%固体或者在所述范围内任意比例。任选地,可将生物质浓缩到约30%固体或更少、约29%固体或更少、约28%固体或更少、约27%固体或更少、约26%固体或更少、约25%固体或更少、约24%固体或更少、约23%固体或更少、约22%固体或更少、约21%固体或更少、约20%固体或更少、约19%固体或更少、约18%固体或更少、约17%固体或更少、约16%固体或更少、约15%固体或更少、约14%固体或更少、约13%固体或更少、约12%固体或更少、约11%固体或更少、约10%固体或更少、约9%固体或更少、约8%固体或更少、约7%固体或更少、约6%固体或更少、约5%固体或更少、约4%固体或更少、约3%固体或更少、约2%固体或更少或者约1%固体或更少。
58.水解
59.使用化学法、酶法和/或机械法可进行细胞水解(即,细胞破裂)。任选地,本文所述的方法缺少干燥步骤。例如,在细胞水解之前,任选不干燥生物质。任选地,在发酵完成之后和接触步骤之前,未浓缩生物质。
60.用于水解细胞的化学方法可包括将酸加入至细胞,这在本文中称为酸水解。在酸
水解方法中,可使用诸如离心经水洗涤生物质,然后在水解细胞之前如上所述浓缩。任选地,将生物质浓缩到约15%含水固体。
61.然后将酸加入到经洗涤的湿润生物质。任选地,在加入酸之前,不干燥生物质。在酸水解步骤中使用的合适的酸包括硫酸、盐酸、磷酸、氢溴酸、硝酸、高氯酸以及本领域技术人员已知的其他强酸。可将适量酸加入经洗涤的湿润生物质中以得到约且包括100mm至约且包括200mm(例如,约且包括120mm至约且包括180mm或者约且包括140mm至约且包括160mm)的最终浓度。可将硫酸加入到经洗涤的湿润生物质中以得到160mm的最终浓度。
62.然后可将包括水、生物质和酸的所得混合物温育一段时间以水解细胞。任选地,可将混合物在约且包括30℃至约且包括200℃的温度下温育。例如,可将混合物在约且包括45℃至约且包括180℃、约且包括60℃至约且包括150℃或约且包括80℃至约且包括130℃的温度下温育。任选地,在121℃的温度下,将混合物温育在高压釜中。可将混合物温育一段时间,使适于水解至少50%细胞(例如,至少60%细胞、至少70%细胞、至少80%细胞、至少90%细胞、至少95%细胞或100%细胞)。温育细胞的时间段取决于温育温度。在较高温度下温育混合物可导致以更快速率进行水解(即,水解需要的时间段较短)。在一些例子中,可将细胞在60℃下温育1小时。
63.如上所述,使用酶方法可进行细胞水解(即,细胞破裂)。具体而言,可在导致微生物破裂的条件下使微生物群体接触一种或多种酶。任选地,该酶为蛋白酶。合适的蛋白酶的例子为alcalase 2.4l fg(novozymes;franklinton,north carolina)。任选地,在酶水解之前,未使用水洗涤细胞。任选地,在酶水解之前,未浓缩微生物群体。
64.在使微生物接触一种或多种酶之前,可任选将发酵培养基的ph调整到约且包括5至8.5,例如约且包括5.5至8.0或约且包括6.5至7.5,或者在所述范围内任何值。例如,可任选将发酵培养基的ph调整到5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4或8.5。可使用例如碱来调节ph,例如氢氧化钠(例如,1n naoh)、氢氧化铵、氢氧化钙、氢氧化镁或氢氧化钾。在接触步骤中也可调整发酵培养基的ph。任选地,在接触步骤之前或之中,将ph调整到约8.0的ph。
65.可使微生物接触一种或多种酶,同时微生物群体是在发酵培养基中(即,接触步骤在发酵培养基中发生)。任选地,在发酵之后和接触步骤之前,浓缩发酵培养基。任选地,在发酵之后和接触步骤之前,稀释发酵培养基。任选地,加入发酵培养基的酶浓度为约0.001%至约0.4%体积/体积(v/v)。例如,加入发酵培养基的酶浓度可以为0.05%(v/v)至0.4%(v/v)、0.05%至0.2%(v/v)或者0.1%至0.2%(v/v)。在一些例子中,加入发酵培养基的酶浓度为0.05%(v/v)、0.1%(v/v)、0.15%(v/v)、0.2%(v/v)、0.25%(v/v)、0.30%(v/v)、0.35%(v/v)或0.4%(v/v)。
66.在至少约45℃的温度下可进行接触步骤。任选地,在约且包括45℃至约且包括70℃、约且包括50℃至约且包括70℃、约且包括55℃至约且包括70℃或者在55℃的温度下进行接触步骤。可进行适当时间段的接触步骤,从而导致微生物破裂。例如,可进行接触步骤约且包括1小时至约且包括20小时,例如,1小时至18小时、1小时至6小时、4小时至6小时或者所述范围内任意时间段。任选地,可进行接触步骤约4小时。
67.最佳温度、时间、ph和酶浓度取决于具体酶,并且本领域普通技术人员能够视情况
调整给定酶的温度、时间、ph和酶浓度。
68.任选地,在约55℃下、在约0.05%(v/v)或约0.2%(v/v)酶存在下,进行接触步骤约1至6小时。例如,在55℃下、在0.1%(v/v)酶的存在下,可进行接触步骤四小时。任选地,在不存在表面活性剂下(即,表面活性剂不存在)进行接触步骤。
69.任选地,使用如本领域技术人员已知的其他化学和机械方法可进行细胞破裂。例如,使用碱水解、珠粒研磨、超声处理、洗涤剂水解、溶剂提取、急速减压(即,细胞炸弹法)或高剪切机械法、与化学制剂接触、均化作用、超声、研磨、剪切力、弗氏细胞压碎器、冷压、加热、干燥、渗透压冲击、压力振动、自溶基因的表达或者这些的组合可进行细胞破裂。
70.该方法还可包括预处理步骤,其中预处理步骤包括在接触步骤之前使细胞破裂。使用化学、机械或酶细胞破裂方法可进行预处理步骤。换而言之,使用两种或多种本文所述的化学、酶和/或机械方法的组合(例如,联合珠粒研磨的酶水解)可进行细胞破裂。可相继进行细胞破裂方法(例如,珠粒研磨后进行酶水解)。任选地,化学或机械方法可作为第一水解步骤来进行,之后酶细胞破裂作为第二水解步骤。在这些例子中,如与仅进行一个细胞破裂方法处所使用酶量相比,可在酶细胞破裂中使用更少量的酶。
71.浓缩
72.通过分离和去除发酵培养基可浓缩从酶水解得到的破裂的微生物,并且可浓缩从酶水解得到的破裂的微生物以提供用于后续步骤的所需浓度的破裂的微生物。任选地,通过离心和去除一种或多种物质来浓缩破裂的微生物,从而提供所需浓度。当使用离心时,离心可任选提供包括重层和轻层的两层或多层。重层包括可溶性发酵培养基成分和水,而轻层包括脂质形式的破裂的微生物以及消耗的生物质。轻层还可包括一些水。轻层可包括以乳剂形式的至少一部分脂质和生物质和水。
73.浓缩步骤包括去除在接触步骤中存在的一种或多种物质。例如,浓缩步骤可包括水分去除。任选地,浓缩步骤包括约且包括25%至约且包括95%水分去除(例如,约85%水分去除),以体积计。任选地,浓缩步骤包括例如通过将重层排出通过阀门或者通过抽吸或倾析重层来去除至少一部分重层。
74.任选地,在根据下述提取步骤从破裂的微生物中回收油之前,可使经浓缩的破裂的微生物静置一段时间。可使经浓缩的破裂的微生物静置至多24小时(例如,1小时、2小时、5小时、10小时、15小时、20小时或24小时)。
75.提取
76.如上所述,在高温下、在盐的存在下和在不存在有机溶剂下,从破裂的微生物中提取脂质。
77.在高温下可进行提取步骤。如本文所使用,高温是指至少约55℃(例如,约且包括55℃至约且包括95℃的温度)。例如,在约65℃或以上、约70℃或以上、约75℃或以上、约80℃或以上、约85℃或以上、约90℃或以上或者约95℃或以上的温度下,可使脂质和生物质混合物接触盐、油或生物燃料。
78.在盐的存在下进行提取步骤。盐可以为例如硫酸钠。在提取步骤中加入的盐浓度可以为约且包括1%至约且包括5%(v/v),以提取混合物体积计(例如,约且包括3%至约且包括5%(v/v))。例如,在提取步骤中加入的盐浓度可以为约1%、约2%、约3%、约4%或约5%。
79.在有机溶剂(例如,c
5-c
12
烷烃、氯化c
1-c6烷烃、c
1-c6醇或者超临界二氧化碳)的存在下,从破裂的微生物中提取脂质。如本文所使用,在不存在有机溶剂下是指以破裂的微生物的重量计,小于约0.5%溶剂(例如,小于约0.4%、小于约0.3%、小于约0.2%、小于约0.1%、小于约0.05%、小于约0.01%、小于约0.005%或者0%)。
80.任选地,通过加入油(例如,椰子油)或生物燃料可从破裂的微生物中提取脂质。
81.任选地,在提取步骤中加入的油可以为营养油(例如,由营养来源得到或获得的油)。在本文所述的方法中使用的合适营养油例子包括椰子油、棕榈油、菜籽油、葵花子油、大豆油、玉米油、橄榄油、红花油、棕榈仁油、棉籽油及其组合。也可使用任何那些油的衍生物,例如烷基化衍生物(例如,甲基化或乙基化的油)。
82.如本文所使用,生物燃料是指从生物质起始材料获得的任何燃料、燃料添加剂、芳香族和/或脂肪族化合物。例如,在本文所述的方法中使用的合适的生物燃料可由植物来源或藻类来源获得。生物燃料的合适来源的例子包括藻类、玉米、柳枝稷、甘蔗、甜菜、油菜籽、大豆等。
83.任选地,通过由生物来源收获油并且将油转化为生物燃料可得到生物燃料。转化由生物来源得到的油(例如,由植物和/或藻类来源中得到的油)的方法是本领域技术人员已知的。任选地,得到生物燃料的方法可包括:培养产油生物质(例如,藻类),提取油(例如,藻油),以及转化油(例如,藻油)以形成生物燃料。任选地,使用酯基转移可将油转化为生物燃料。如本文所使用,酯基转移是指通过另一种醇来交换酯中烷氧基的过程。例如,在本文所述的方法中使用的酯基转移过程可包括转化诸如三甘油酯的藻油为生物柴油,例如脂肪酸烷基酯和丙三醇。通过使用传统化学工艺如酸或碱催化反应或者通过使用酶催化反应可完成酯基转移。
84.如本文所使用,术语有机溶剂不包括生物燃料,因该术语由本文所定义,且其不包括营养油,例如椰子油、棕榈油、菜籽油、葵花子油、大豆油、玉米油、橄榄油、红花油、棕榈仁油、棉籽油或其烷基化(例如,甲基化或乙基化)衍生物。
85.任选地,用于从破裂的微生物中提取脂质的油或生物燃料随后不从提取的脂质中去除。不认为提取油的后续分馏会从提取的脂质中去除油或生物燃料,在提取的油中,加入的油或生物燃料仅保留在一种油馏分中。例如,在回收之后,可将本文所述的油合并到其他油中来用作本文所述的一种或多种产品或者并入到本文所述的一种或多种产品。可选地或者除了在回收过程结束之后合并回收的油之外,可将那些其他油或产品(例如生物燃料)中任一种加入到脂质和生物质的混合物中。在提取步骤中加入其他油可帮助反乳化和从消耗的生物质中分离脂质。
86.在依赖有机溶剂提取以从生物质中分离脂质的传统方法中,在回收之后必须将有机溶剂从脂质中去除,但之后通常残留至少痕量的溶剂。然而,在本文所述的方法中,在回收的油用作最终产品或并入最终产品时,在提取步骤中加入的任选超过约80%的油或生物燃料仍旧保留其中。也就是说,在回收的油用作最终产品或者并入最终产品之前,在提取步骤中加入的任选小于约20%的油或生物燃料从回收的油中去除。例如,在回收的油用作最终产品或者并入最终产品之前,在提取步骤中加入的任选小于约15%、小于约10%、小于约5%、小于约2%或者0%的油或生物燃料从回收的油中去除。
87.可将破裂的微生物或生物质与盐、油和/或生物燃料混合适于从破裂的微生物或
生物质中提取脂质的一段时间。例如,可将盐、油和/或生物燃料和破裂的微生物或生物质混合约10分钟或更久、20分钟或更久、30分钟或更久、40分钟或更久、50分钟或更久、1小时或更久或者2小时或更久。随后,通过离心溶液可从混合物的剩余成分中分离脂质。
88.任选地,使用该方法从破裂的微生物中提取至少65%的理论上通过微生物生成的脂质(即,该方法提供至少约65%产率)。例如,从破裂的微生物中提取的脂质产率可以为至少约70%、至少75%、至少80%或至少85%。
89.作为另外一种选择,在不存在油或生物燃料下可进行提取步骤。例如,使用机械方法可提取脂质。可将水解的生物质和微生物离心,并且可从成分剩余物中分离脂质。通过离心分离油可任选包括加入硫酸钠至生物质乳剂的步骤。任选地,在如本文所述高温下(例如,约55℃和以上,例如在约80℃下),可进行离心。任选地,脂质包含在离心材料的上层中,因而可通过抽吸或倾析例如从其他材料中去除。
90.任选地,使用该方法从破裂的微生物中提取至少约65%的通过微生物生成的脂质(即,该方法提供至少65%产率)。例如,从破裂的微生物中提取的脂质产率可以为至少60%、至少70%、至少80%或至少90%生成的总量。
91.iii.产品
92.根据本文所述方法生产的多不饱和脂肪酸(pufa)(例如,dha、epa)和其他脂质可用于各种应用的任一种中,例如,开发它们的生物或营养性质。任选地,化合物可用于药物、营养油(例如,营养油补充剂)、食品补充剂、动物饲料添加剂、化妆品、生物燃料等。根据本文所述方法生成的脂质也可用作生产其他化合物的中间产品。任选地,根据本文所述的方法生产的脂质可并入最终产品(例如,食品或饲料补充剂、婴儿配方、药物、燃料(例如,生物燃料)等)。
93.本文所述脂质可并入的合适的食品或饲料补充剂包括饮料,例如牛奶、水、运动型饮料、能量饮料、茶和果汁;糖果类,例如果冻和饼干;包含脂肪的食品和饮料,例如乳制品;加工食品产品,例如软米(或粥);婴儿配方;早餐谷物等。任选地,可将一种或多种生成的脂质并入饮食补充剂内,例如,复合维生素。任选地,根据本文所述的方法产生的脂质可包含入饮食补充剂,任选可直接并入食品或饲料(例如,食品补充剂)成分内。
94.通过本文所述方法产生的脂质可并入的饲料的例子包括宠物食品,例如猫粮、狗粮等;水族箱鱼、养殖鱼类或甲壳类动物饲料等;农场培育动物(包括家畜和鱼或水产养殖培育的甲壳类动物)的饲料。根据本文所述方法产生的脂质可并入的食品或饲料材料优选适合生物体味觉,生物体是预期接受者。该食品或饲料材料可具有目前已知的用于食物材料的任意物理性质(例如,固体、液体、软质)。
95.任选地,可将一种或多种产生的化合物(例如,pufa)并入药物中。这些药物例子包括各种类型的片剂、胶囊、可饮用试剂等。任选地,药物适于局部应用。剂型可包括例如胶囊、油类、颗粒、细粒剂、散剂、片剂、丸剂、锭剂等。
96.任选地,可将一种或多种产生的化合物用作生物燃料或者并入生物燃料内。例如,通过一种或多种产生的化合物的酯基转移可产生生物燃料。通过产生的油的碱催化酯基转移、油的酸催化酯基转移或油转化为其脂肪酸、然后转化为生物燃料可产生生物燃料。
97.通过联合各种试剂的任一种可将根据本文所述方法产生的脂质并入如本文所述的产品内。例如,使用一种或多种粘结剂或填料可合并这些化合物。在一些实施方案中,产
品可包括一种或多种螯合剂、颜料、盐、表面活性剂、保湿剂、粘度调节剂、增稠剂、软化剂、芳香剂、防腐剂等及其组合。
98.以下实例旨在进一步阐述本文所述的方法和组合物的某些方面,但并不是意图限制权利要求范围。
实施例
99.实施例1.巴氏灭菌、收获和洗涤以及化学水解
100.巴氏灭菌
101.在60℃下将t18生物质边搅拌边加热1小时以巴士灭菌细胞。
102.收获和洗涤
103.在环境温度下将经巴士灭菌的t18生物质在4150rpm下离心20分钟,从而从细胞糊状物中分离最终培养基。将培养基去除,然后将等效质量的水加入细胞糊状物以洗涤细胞。将细胞糊状物-水混合物振荡1分钟,重新离心,然后去除水相。
104.化学水解
105.使用水将经水洗涤的t18细胞糊状物调整到150g/l。取出子样品(10ml),并将其加入50ml离心管。使用酸或碱处理每个子样品到根据表1的最终浓度。在121℃下将混合物高压灭菌15分钟以水解细胞。在水解之后,使用己烷提取样品,从而通过质量平衡测定回收的油百分比(图1)。使用160mm hcl和h2so4水解得到超过85%的油回收。
106.表1:
107.样品编号酸/碱类型浓度(mm)油回收(%)1hcl4012hcl100473hcl1601004h3po440125h3po410036h3po416057h2so44078h2so4100689h2so41609410naoh40811naoh1004012naoh1605213koh40814koh1002015koh16054
108.实施例2.酶水解
109.使用水将经水洗涤的t18细胞糊状物调整到220g/l。使用1nnaoh调节ph到7.5。取出子样品(10ml),并将其加入50ml离心管。根据表2使用酶来处理每个子样品。在50℃下将混合物边振荡边温育22小时以水解细胞。在水解之后,使用己烷提取样品,从而通过质量平
衡测定回收的油百分比(图2)。单独使用alcalase或其联合另外的酶进行水解得到超过85%的油回收。
110.表2:
[0111][0112]
实施例3.酸和酶水解、洗涤作用
[0113]
将经巴士灭菌、未经洗涤的t18生物质(10ml)的子样品加入50ml离心管。将对照水洗,调整至170g/l水,并二次取样到50ml离心管内。根据表3使用酸或酶来处理每个子样品。在121℃下将经酸水解的样品高压灭菌15分钟以水解细胞。使用1n naoh将经酶水解的样品调节到ph 7.5,然后在50℃下边振荡边温育26小时以水解细胞。在酸或酶水解之后,使用己烷提取样品,从而通过质量平衡测定回收的油百分比(图3)。使用0.2%alcalase水解得到未经洗涤的油回收与经洗涤的油回收等效。
[0114]
表3:
[0115]
样品编号经洗涤/未经洗涤酸/酶处理浓度回收的油(%)1未经洗涤h2so440mm52经洗涤h2so440mm613未经洗涤h2so4160mm274经洗涤h2so4160mm915未经洗涤alcalase0.2%v/v936经洗涤alcalase0.2%v/v94
[0116]
实施例4.酶水解、温度/时间作用
[0117]
使用水将经水洗涤的t18细胞糊状物调整到210g/l。使用1nnaoh调节ph到7.5。将子样品(10ml)加入50ml离心管内。使用0.2%v/v alcalase处理每个子样品。在70℃下将混合物边振荡边温育4小时以水解细胞。在55℃下将对照边振荡边温育18小时。在水解之后,使用己烷提取样品,从而通过质量平衡测定回收的油百分比(图4)。通过增加温度到70℃,在4小时达到与在55℃下水解18小时等效的油回收。
[0118]
实施例5.酶水解、使用生物燃料提取
[0119]
使用水将经水洗涤的t18细胞糊状物调整到200g/l,然后使用1n naoh将ph调节到7.5。取出子样品(10ml),并将其加入50ml离心管。使用0.2%v/v alcalase来处理各个子样品。在55℃下将混合物边振荡边温育18小时以水解细胞。在水解之后,根据表5使用生物燃料来提取每个子样品,然后通过质量平衡和基于纯油类的脂质分类简图测定油百分比(图5和表5)。基于脂质分类简图,使用1:0.4(湿润生物质:生物燃料)提取得到超过85%的油回
收。将甘油三酯(tg)藻油乙醇化(ee),并将其用于油提取以及母体tg油(表6)。基于脂质分类简图,湿润生物质:ee藻油的所有比率均得到超过85%的油回收。
[0120]
表5:
[0121][0122]
表6:
[0123][0124]
实施例6.酶水解、无溶剂油提取
[0125]
将在224g/l固体浓度(159g/l生物质浓度)下200ml未经洗涤的t18生物质加热到55℃,并且使用1n naoh调节到ph 8。使用0.4%(v/v)alcalase来处理样品,然后在55℃下边振荡边温育18小时,从而水解细胞。在水解之后,在40℃下将样品在4600rpm下离心20min,从而分离培养基与经浓缩水解的生物质。去除85%的培养基。在水分去除之后,在40℃下将剩余样品在4600rpm下离心20min,从而从消耗的生物质中分离油。回收油,然后通过质量平衡测定回收的油%。在水解之后通过降低水含量,通过无溶剂油提取达到超过90%的油回收。
[0126]
实施例7.无溶剂油提取,大规模
[0127]
将在111g/l生物质浓度下的151,400kg未经洗涤的t18生物质加热到55℃,并且使用50n naoh调节到ph 8。将606l alcalase加入,将ph调整回到8,然后在55℃下将混合物在2个容器之间再循环18小时来混合水解。在水解之后,液体培养基的重量为160,400kg。将经水解的生物质维持在55℃下离心,从而分离培养基与经浓缩水解的生物质(图6)。去除134,400kg培养基,然后回收26,000kg经浓缩水解的生物质。在离心之前,使用1300kg na2so4处理和在90℃下边加热边混合经浓缩水解的生物质,从而从消耗的生物质中分离油(图7)。回
收7606kg油,达82%的总油回收。回收的油的过氧化值(pv)和酸值(av)分别为0.4meq/kg和0.38mg koh/g。
[0128]
实施例8.最佳酶浓度/时间(0.1%酶)
[0129]
将在143g/l生物质浓度下的未经洗涤的t18生物质样品加热到55℃,并且使用1n naoh调节到ph 8.0。将25ml子样品转移到50ml离心管内。根据表7来处理每个子样品。在55℃下将混合物边振荡边温育以水解细胞。在水解之后,将样品放置在100℃水浴中20min以使酶失活。在酶失活之后,在40℃下将样品在4600rpm下离心20min,从而分离培养基与经浓缩水解的生物质。去除约80%的培养基。使培养基通过0.25um过滤器,然后通过邻苯二甲醛(opa)方法来测定水解度(spellman,d.,mcevoy,e.,o'cuinn,g.和fitz,g.r.j.2003.proteinase and exopeptidase hydrolysis of whey protein:comparison of the tnbs,opa and ph stat methods for quantification of degree of hydrolysis.international dairy journal,13:447
–
453)。参见表7。
[0130]
使用5%(w/v)na2so4来处理经浓缩水解的生物质,然后在70℃下边加热边振荡60min。在处理之后,在40℃下将样品在4600rpm下离心20min,从而从消耗的生物质中分离油。回收油,然后通过质量平衡来测定回收的油%(图8)。在4小时之后,使用0.1%alcalase来完成水解。
[0131]
表7:
[0132]
样品编号酶浓度(v/v%)水解时间(h)油回收(%)氨基酸浓度(mm)100《5%26.420.1082.638.2302《5%24.340.1283.941.5504《5%22.660.1486.146.3706《5%23.680.1685.947.59024《5%23.5100.12489.151.5
[0133]
实施例9.最佳酶浓度/时间(0.05%酶)
[0134]
将在143g/l生物质浓度下的未经洗涤的t18生物质样品加热到55℃,并且使用1n naoh调节到ph 8.0。将25ml子样品转移到50ml离心管内。根据表8来处理每个子样品。在55℃下将混合物边振荡边温育以水解细胞。在水解之后,将样品放置在100℃水浴中20min以使酶失活。在酶失活之后,在40℃下将样品在4600rpm下离心20min,从而分离培养基与经浓缩水解的生物质。去除约80%的培养基。使培养基通过0.25um过滤器,然后通过opa方法来测定水解度(表b)。
[0135]
使用5%(w/v)na2so4来处理经浓缩水解的生物质,然后在70℃下边加热边振荡60min。在处理之后,在40℃下将样品在4600rpm下离心20min,从而从消耗的生物质中分离油。回收油,然后通过质量平衡来测定回收的油%(图9)。在6小时之后,使用0.05%alcalase来完成水解。
[0136]
表8:
[0137]
样品编号酶浓度(v/v%)水解时间(h)油回收(%)氨基酸浓度(mm)100《5%45.220.05069.749.0302《5%41.740.05285.752.6504《5%42.860.05482.555.6706《5%43.180.05679.156.99024《5%39.9100.052486.253.9
[0138]
实施例10.酶水解,低ph
[0139]
将未经洗涤的t18的150ml子样品移至250ml烧杯。使用1mhcl或naoh来处理每个子样品,从而调节到根据表9的ph。将每个ph条件的30ml子样品移至50ml离心管。使用0.5%(v/v)alcalase来处理每个子样品。在55℃下将混合物边振荡边温育16小时以水解细胞。在水解之后,在40℃下将样品在4600rpm下离心20min,从而分离培养基与经浓缩水解的生物质。去除约60%培养基。使用5%(w/v)na2so4来处理经浓缩水解的生物质,然后在70℃下边加热边振荡60min,从而从消耗的生物质中分离油。回收油,然后通过质量平衡来测定无溶剂回收的油%。图10。在ph 5.5和8下达到等效油回收。
[0140]
表9
[0141]
样品编号水解ph油回收(%)1866.9
±
2.323.5034.5045.560.3
±
5.956.570.4
±
1.067.571.0
±
5.6
[0142]
实施例11.酶水解,可替代的酶
[0143]
将未经洗涤的t18生物质的30ml子样品移至50ml离心管。使用0.5%(v/v)酶和根据表9来处理每个子样品。在55℃下将混合物边振荡边温育以水解细胞。在水解之后,在40℃下将样品在4600rpm下离心20min,从而分离培养基与经浓缩水解的生物质。去除约50%培养基。使用5%(w/v)na2so4来处理经浓缩水解的生物质,然后在70℃下边加热边振荡60min。在处理之后,将样品经己烷提取以通过质量平衡来测定回收的油%。尽管可替代的酶尚未经鉴定用于水解与alcalase一样有效,但是如有必要,挑选的酶(蛋白酶
‘
m’、savinase ultra、blaze evity或polarzyme)可用于代替alcalase。
[0144]
表10
[0145]
样品编号生物质浓度(g/l)酶ph油回收(%)
1171alcalase8892171蛋白酶
‘
m’6643171纤维素酶
‘
a’4.56.74171半纤维素酶904.56.15171蛋白酶/纤维素/半纤维素5286171蛋白酶/纤维素5127171蛋白酶/半纤维素5208171纤维素/半纤维素4.55.09138alcalase89810138savinase ultra89411138blaze evity89312138neutrase87.213150alcalase89214150polarzyme888
[0146]
实施例12.机械水解
[0147]
将在180g/l生物质浓度下的未经洗涤的t18生物质样品装入300ml dyno-mill multi lab不锈钢室内,该不锈钢室承载有0.6-0.8mm氧化锆研磨培养基(80%(v/v)珠粒体积)。在连续模式下,以10m/s的叶轮外缘速度和80ml/min的进料流速下操作珠粒研磨。将部分破裂的生物质的子样品返回通过破裂室来进行第二次传递。在40℃下将生物质浆料在4600rpm下离心20min,从而从消耗的生物质中分离油。回收油,然后通过质量平衡来测定回收的油%。1和2次传递得到70%的油回收。
[0148]
所附权利要求的组合物和方法的范围不受本文所述具体组合物和方法的限制,该具体组合物和方法旨在说明权利要求的某些方面,并且功能上等效的任何组合物和方法均在该公开的范围内。除了所显示和本文所述的那些之外,组合物和方法的各种变形均旨在落入所附权利要求的范围之内。而且,尽管仅具体描述了某些代表性组合物、方法和这些组合物和方法的某些方面,但其他组合物和方法和组合物和方法的各种特征组合均旨在落入所附权利要求的范围之内,即使其未被具体引用。因此,本文可明确提及步骤、元素、组分或成分的组合;但是步骤、元素、组分和成分的所有其他组合也包括在内,即使其并未明确规定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1