一种高效合成有机硅化合物的方法
1.本发明涉及有机物合成,具体涉及一种高效合成有机硅化合物的方法。
背景技术:
2.有机硅化合物因其具有独特的生物、物理和化学等特性,在以下几个方面具有很广的应用:1.有机硅化合物是重要的医药中间体,可以参与合成许多药物。如多西拉明(doxylamine)、氯雷他定(loratadine)、西拉-二甲他林(sila-dimetracrine)、氨西拉萝卜素(amsilarotene)、含硅脯氨酸(silaproline)、含硅丙氨酸(tms-alanine)和喜树碱(camptothecin)等。2.有机硅烷化合物也是有机化学中重要的中间体,对分子骨架进行修饰。3.其衍生物还广泛应用于高分子、半导体材料、药物设计等领域。由于有机硅烷化合物具有很广的应用前景和特别的一些生物活性,比如有重要的生理和药理活性,具有消炎和抗菌等其他生物活性,从而人们对其的研究也越来越深入。主要合成有机硅化合物的方法有以下三种:1.卤硅烷为硅源的合成方法(org.lett.2000,2,565,j.org.chem.2003,68,9384,org.lett.2000,2,3221,org.lett.2003,5,1899,org.lett.2006,8,765,j.org.chem.2004,69,8305),此方法主要是通过有机锂试剂或者格氏试剂与卤硅烷发生偶联反应合成有机硅化合物。该方法的优点是合成路线简单,但是对反应条件要求比较苛刻,反应必须在无水无氧条件下进行,并且该方法对很多官能团的耐受性较差,底物范围拓展受到一定的限制。所以,该合成路径在有机合成中的应用受到很大的限制。2.氢硅烷为硅源的合成方法(j.am.chem.soc.2003,125,13640,j.am.chem.soc.2003,125,30,org.lett.2015,17,4538,acs catal.2018,8,5896,org.lett.2018,20,5357,chem.rev.2018,118,6516),该方法选择性较好,但是氢硅烷价格昂贵、毒性较高,性质不稳定且难于合成,也限制了该方法实际应用。3.六甲基二硅烷为硅源的合成方法(chem.commun.2000,1895,organometallics,2006,25,4665,org.lett.2007,9,3785,j.am.chem.soc.2006,128,8152,j.am.chem.soc.2008,130,15982,j.org.chem.1996,61,5779,org.lett.2009,12,28,j.am.chem.soc.2008,130,16382,j.am.chem.soc.2010,133,409,org.lett.2000,2,3877)该方法具有高效、官能团容忍性好等优点。六甲基二硅烷是一种商业可用的、稳定的、毒性低的二硅烷试剂,广泛应用于硅基化合物的合成中。且与氢硅烷试剂相比,六甲基二硅烷具有价格低廉、对空气和水不敏感、性质较稳定、容易存放等优点。近年来,有机硅化合物在新型药物创造中有具有重要地位,其合成方法的研究也有很大的进展,2008年,chatani及其同事开发了吡啶基导向的rh催化芳基c-h键与六甲基二硅烷的邻位硅基化反应(chem.asian j.2008,3,1585),从而合成了有机硅化合物。这种方法虽然产率较高,但选择性不好,产物是单硅基和双硅基混合物。2014年,motomu kanai课题组利用8-氨基喹啉为导向基团,钯催化苯甲酰胺和羧酸酰胺类的c(sp2)-h和c(sp3)-h键的区域选择性活化,然后与二硅烷偶联合成有机硅烷的硅基化反应(org.lett.2014,16,1968)。该反应官能团耐受性较好,但底物需要预官能团化,原料合成不易。2015年,yingsheng zhao课题组进行了一种钯催化草酰胺保护的苯甲胺和苯乙胺与六甲基二硅烷的直接邻位
硅基化反应(org.lett.2015,17,3646)。该方法选择性较好,但是需要对氨基进行保护,步骤繁琐。2017年,debabrata maiti课题组实现了钯催化间位c-h键的选择性硅基化反应策略(organometallics,2017,36,2418)。该方法选择性较好,但是底物不易合成。2016年,bing-feng shi课题组实现了pd(ii)催化a-氨基酸和简单脂肪酸c-h键的分子间硅基化反应(angew.chem.int.ed.2016,55,13859),合成了各种β-硅基-a-氨基酸。该方法具有优异的区域选择性和立体选择性,但需要移除辅助基团,增加了反应步骤。2018年,yanghui zhang课题组开发了一种钯催化卤代芳烃高效合成双硅基化产物的方法(angew.chem.int.ed.2018,57,3233)。该方法产率较高,但底物范围较窄。上述这些合成方法存在很多缺点:反应条件苛刻,底物难合成,分离困难,反应过程惰性气体保护,对设备的要求高等。
技术实现要素:
3.本发明所要解决的技术问题是提供一种高效合成有机硅化合物的方法,该方法操作简单,使用原料便宜,合成成本低。
4.为解决上述技术问题,本发明所采取的技术方案是:一种高效合成有机硅化合物的方法,包括以下方法步骤:
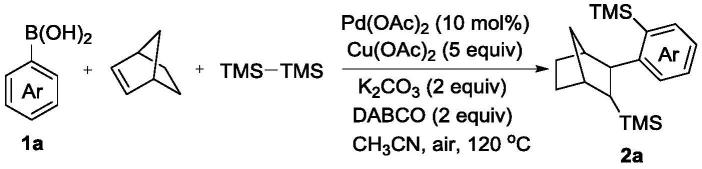
5.在反应容器中按摩尔比1:3~5:2~3依次加入苯硼酸类衍生物、六甲基二硅烷和降冰片烯,按0.5mmol苯硼酸加入3~4ml的溶剂,接着加入催化剂pd(oac)2、氧化剂cu(oac)2、碱k2co3、添加剂dabco,加入量分别为苯硼酸摩尔量的10.0%~15.0%、300%~500%、200%、100%~200%,乙腈4ml,空气氛围,120℃油浴条件下反应24~30h,冷却至室温,加水,用乙酸乙酯萃取三次,合并有机层,减压浓缩,产品经过柱层析纯化,得到产品有机硅化合物,合成方法的反应通式表示如下:
[0006][0007]
该方法合成的有机硅化合物其化学结构通式如下:
[0008][0009]
其中,r1为氢基、乙基、异丙基、甲氧基、氟基、氯基、三氟甲基、苯基或芳基;r2为氢基或甲基;r3为氢基、甲基、氟基或氯基;r4为氢基、甲基、氟基或氯基。
[0010]
所述苯硼酸类衍生物为苯硼酸、3-甲基苯硼酸、3-乙基苯硼酸、3-异丙基苯硼酸、3-甲氧基苯硼酸。
[0011]
所述溶剂为乙腈或n,n-二甲基甲酰胺。
[0012]
所述柱层析条件为:200~300目硅胶柱,洗脱剂为石油醚。
[0013]
本发明采用上述技术方案所设计的一种高效合成有机硅化合物的方法,其有益效
果为:
[0014]
1.本发明利用苯硼酸代替传统原料卤代芳烃和含导向基团底物的使用,反应操作比较简单;反应底物简单,来源广泛,适合各种官能团取代的苯硼酸,位阻效应对反应的影响小。
[0015]
2.本发明反应底物廉价,产率高、选择性好、易分离纯化、污染少,步骤简单,可以省略官能团的保护和去保护合成步骤,目标产物有机硅化合物广泛适用于有机化学反应的有机中间体、药物中间体和电子器件材料方面。
具体实施方式
[0016]
下面结合实施例对本发明一种高效合成有机硅化合物的方法作具体说明。
[0017]
实施例1
[0018]
一种三甲基(2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2a)的合成方法,包括以下步骤:
[0019]
在25ml schlenk反应管中加入0.5mmol(61mg)的苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2a)123.7mg,为无色油状液体,在真空条件下干燥后,计算其产率为78%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.42-7.40(m,2h),7.33-7.29(m,1h),7.17-7.14(m,1h),3.17(d,j=10.5hz,1h),2.36(dd,j=3.5hz,11.0hz,2h),1.99(d,j=10.0hz,1h),1.80-1.75(m,1h),1.64-1.59(m,1h),1.46-1.41(m,1h),1.39-1.34(m,2h),1.29-1.27(m,1h),0.34(s,9h),-0.35(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)152.7,138.9,134.2,129.2,126.6,125.1,51.1,44.9,43.5,38.9,38.5,32.8,32.2,1.0,-0.8.hrms(esi-tof)m/z calcd for c
19h33
si
2+
(m+h)
+
317.2115,found 317.2116。
[0020]
其中,所述的三甲基(2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2a)化学结构通式为:
[0021][0022]
实施例2
[0023]
一种三甲基(3-甲基-2-((1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2b)的合成方法,包括以下步骤:
[0024]
在25ml schlenk反应管中加入0.5mmol(67.5mg)的3-甲基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2b)137.4mg,为
无色油状液体,在真空条件下干燥后,计算其产率为83%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.40(d,j=5.0hz,1h),7.14-7.10(m,2h),3.53(d,j=11.0hz,1h),2.75(s,1h),2.56(s,3h),2.42(s,1h),2.04(d,j=9.5hz,1h),1.91-1.85(m,1h),1.67-1.54(m,2h),1.48(d,j=11.0hz,1h),1.45-1.38(m,2h),0.41(s,9h),-0.34(s,9h)..
13
c{1h}nmr(125mhz,cdcl3,δppm)148.5,142.1,135.2,134.2,133.1,125.4,53.9,44.9,41.0,39.8,38.9,33.5,32.2,23.1,2.1,-0.6.hrms(ei)m/z calcd for c
20h34
si
2+
(m)
+
330.2199,found 330.2196。
[0025]
其中,所述的三甲基(3-甲基-2-((1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2b)化学结构通式为:
[0026][0027]
实施例3
[0028]
一种(3-乙基-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2c)的合成方法,包括以下步骤:
[0029]
在25ml schlenk反应管中加入0.5mmol(74.5mg)的3-乙基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2c)141.0mg,为无色油状液体,在真空条件下干燥后,计算其产率为82%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.35-7.34(m,1h),7.18-7.17(m,1h),7.15-7.12(m,1h),3.47(d,j=11.0hz,1h),3.16-3.09(m,1h),2.63-2.56(m,2h),2.38(s,1h),2.01(d,j=9.5hz,1h),1.87-1.82(m,1h),1.61-1.56(m,1h),1.53-1.49(m,1h),1.43(d,j=11.0hz,1h),1.40-1.36(m,2h),1.24-1.21(m,3h),0.36(s,9h),-0.42(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)147.7,142.3,141.9,133.0,131.9,125.5,53.6,45.2,41.7,40.2,38.8,33.8,31.9,27.1,17.3,2.2,-0.8.hrms(ei)m/z calcd for c
21h36
si
2+
(m)
+
344.2356,found 344.2356。
[0030]
其中,所述的(3-乙基-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2c)化学结构通式为:
[0031][0032]
实施例4
[0033]
一种(3-异丙基-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2d)的合成方法,包括以下步骤:
[0034]
在25ml schlenk反应管中加入0.5mmol(82.0mg)的3-异丙基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋
酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2d)114.9mg,为无色油状液体,在真空条件下干燥后,计算其产率为64%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.37-7.31(m,2h),7.18-7.14(m,1h),3.60-3.52(m,2h),2.68(s,1h),2.39(s,1h),1.97(d,j=12.0hz,1h),1.88-1.82(m,1h),1.59(m,1h),1.53-1.47(m,2h),1.40(d,j=12.0hz,2h),1.34(d,j=8.0hz,3h),1.22(d,j=7.5hz,3h),0.38(s,9h),-0.36(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)147.4,147.1,142.5,133.2,128.0,125.6,53.8,44.5,42.0,40.5,39.2,34.0,31.9,28.3,27.9,23.5,2.4,-0.8.hrms(ei)m/z calcd for c
22h38
si
2+
(m)
+
358.2512,found 358.2511。
[0035]
其中,所述的(3-异丙基-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2d)化学结构通式为:
[0036][0037]
实施例5
[0038]
一种(3-甲氧基-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2e)的合成方法,包括以下步骤:
[0039]
在25ml schlenk反应管中加入0.5mmol(76.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2e)112.5mg,为无色油状液体,在真空条件下干燥后,计算其产率为65%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.18-7.15(m,1h),7.07(d,j=7.0hz,1h),6.85(d,j=8.0hz,1h),3.74(s,3h),3.22(d,j=10.5hz,1h),2.45(m,1h),2.33(m,1h),2.26(d,j=9.5hz,1h),1.83-1.78(m,1h),1.56-1.51(m,1h),1.44-1.40(m,1h),1.34-1.27(m,2h),1.18(d,j=9.0hz,1h),0.35(s,9h),-0.39(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)157.8,142.3,138.4,126.8,126.5,112.2,53.9,51.6,44.0,42.6,39.2,38.7,33.1,32.7,1.5,-0.9.hrms(ei)m/z calcd for c
20h34
osi
2+
(m)
+
346.2148,found 358.2150。
[0040]
其中,所述的(3-甲氧基-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2e)化学结构通式为:
[0041][0042]
实施例6
[0043]
一种(3-氟-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三
甲基硅烷(2f)的合成方法,包括以下步骤:
[0044]
在25ml schlenk反应管中加入0.5mmol(70.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2f)138.6mg,为无色油状液体,在真空条件下干燥后,计算其产率为83%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.26(d,j=7.2hz,1h),7.20-7.15(m,1h),7.04-7.00(m,1h),3.24(d,j=10.4hz,1h),2.52(s,1h),2.41(s,1h),2.20(d,j=9.2hz,1h),1.87-1.82(m,1h),1.67-1.61(m,1h),1.48-1.43(m,1h),1.36-1.26(m,2h),1.27(d,j=10.0hz,1h),0.39(s,9h),-0.30(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)161.3(d,j=246.4hz),143.6(d,j=3.0hz),137.0(d,j=12.1hz),130.2(d,j=2.7hz),127.1(d,j=7.9hz),117.6(d,j=24.7hz),50.1,44.0,42.8,39.3,38.2(d,j=14.8hz),33.0,32.5(d,j=1.6hz),1.3,-1.0(d,j=1.0hz).hrms(ei)m/z calcd for c
19h31
fsi
2+
(m)
+
334.1948,found.334.1951。
[0045]
其中,所述的(3-氟-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2f)化学结构通式为:
[0046][0047]
实施例7
[0048]
一种(3-氯-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2g)的合成方法,包括以下步骤:
[0049]
在25ml schlenk反应管中加入0.5mmol(78.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2g)136.5mg,为无色油状液体,在真空条件下干燥后,计算其产率为78%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.38(d,j=7.5hz,1h),7.31(d,j=7.5hz,1h),7.10-7.07(m,1h),3.42(d,j=11.0hz,1h),2.82(s,1h),2.39-2.35(m,2h),1.87-1.83(m,1h),1.62-1.57(m,1h),1.46-1.40(m,2h),1.38-1.34(m,1h),1.32(d,j=10.0hz,1h),0.37(s,9h),-0.33(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)147.0,145.0,133.5,133.0,132.9,126.7,53.3,45.1,41.2,40.1,38.9,33.3,32.4,1.8,-0.7.hrms(ei)m/z calcd for c
19h31
clsi
2+
(m)
+
350.1653,found 350.1652。
[0050]
其中,所述的(3-氯-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2g)化学结构通式为:
[0051][0052]
实施例8
[0053]
一种三甲基(3-(三氟甲基)-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环
[0054]
[2.2.1]庚烷-2-基)苯基)硅烷(2h)的合成方法,包括以下步骤:
[0055]
在25ml schlenk反应管中加入0.5mmol(95.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2h)136.3mg,为无色油状液体,在真空条件下干燥后,计算其产率为71%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.71(d,j=7.6hz,2h),7.26(t,j=7.6hz,1h),3.66(d,j=11.2hz,1h),2.37(s,1h),2.89(s,1h),1.99(d,j=10.0hz,1h),1.82(d,j=11.6hz,1h),1.62-1.58(m,1h),1.52(d,j=11.6hz,1h),1.48-1.43(m,1h),1.39-1.34(m,1h),1.25(d,j=10.0hz,1h),0.41(s,9h),-0.41(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)150.0,146.0,139.1,128.6(q,j=7.4hz),127.8(d,j=30.2hz),125.2,124.7(q,j=271.0hz),54.4,44.9,41.5(q,j=5.0hz),39.3,38.9(q,j=15.6hz),34.3,31.7,2.4,-0.8.hrms(ei)m/z calcd for c
20h31
f3si
2+
(m)
+
384.1916,found.384.1917。
[0056]
其中,所述的三甲基(3-(三氟甲基)-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2h)化学结构通式为:
[0057][0058]
实施例9
[0059]
一种三甲基(4-甲基-2-((1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2i)的合成方法,包括以下步骤:
[0060]
在25ml schlenk反应管中加入0.5mmol(68.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2i)102.3mg,为无色油状液体,在真空条件下干燥后,计算其产率为62%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.32(d,j=7.5hz,1h),7.22(s,1h),6.99(d,j=7.5hz,1h),3.16(d,j=10.5hz,1h),2.37-2.34(m,5h),2.02(d,j=10.0hz,1h),1.80-1.76(m,1h),1.64-1.59(m,1h),1.46-1.36(m,3h),1.28(d,j=10.0hz,1h),0.33(s,9h),-0.35(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)152.8,138.8,135.6,134.3,127.7,125.9,51.0,44.9,43.6,39.0,
38.5,32.8,32.2,21.4,1.0,-0.8.hrms(ei)m/z calcd for c
20h34
si
2+
(m)
+
330.2199,found 330.2195。
[0061]
其中,所述的三甲基(4-甲基-2-((1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2i)化学结构通式为:
[0062][0063]
实施例10
[0064]
一种三甲基(5-甲基-2-((1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2j)的合成方法,包括以下步骤:
[0065]
在25ml schlenk反应管中加入0.5mmol(68.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2j)104.0mg,为无色油状液体,在真空条件下干燥后,计算其产率为63%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.30(d,j=8.0hz,1h),7.21(s,1h),7.12(d,j=7.5hz,1h),3.14(d,j=10.0hz,1h),2.36-2.32(m,5h),1.98(d,j=9.5hz,1h),1.79-1.74(m,1h),1.63-1.57(m,1h),1.45-1.40(m,1h),1.37-1.35(m,2h),1.27-1.25(m,1h),0.34(s,9h),-0.34(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)149.7,138.7,134.8,134.1,130.0,126.5,50.7,45.0,43.5,38.8,38.5,32.8,32.1,21.1,1.0,-0.7.hrms(ei)m/z calcd for c
20h34
si
2+
(m)
+
330.2199,found 330.2196。
[0066]
其中,所述的三甲基(5-甲基-2-((1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2j)化学结构通式为:
[0067][0068]
实施例11
[0069]
一种三甲基(5-氟-2-((1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2k)的合成方法,包括以下步骤:
[0070]
在25ml schlenk反应管中加入0.5mmol(70.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2k)85.2mg,为无色油状液体,在真空条件下干燥后,计算其产率为51%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.36-7.34(m,1h),7.08-7.07(m,1h),6.98-6.95(m,1h),3.13(d,j=10.5hz,1h),
2.36(s,1h),2.28(s,1h),1.93(d,j=10.0hz,1h),1.78-1.73(m,1h),1.63-1.58(m,1h),1.43-1.26(m,4h),0.33(s,9h),-0.35(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)160.7(d,j=244.3hz),148.4(d,j=2.8hz),141.9(d,j=2.8hz),128.0(d,j=6.3hz),120.2(d,j=17.9hz),115.6(d,j=21.1hz),50.4,45.0,43.5,38.7,38.6,32.7,32.1,0.7,-0.7.hrms(esi)m/z calcd for c
19h31
fsi
2+
(m)
+
334.1948,found 334.1950。
[0071]
其中,所述的三甲基(5-氟-2-((1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)硅烷(2k)化学结构通式为:
[0072][0073]
实施例12
[0074]
一种(3,4-二甲基-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2l)的合成方法,包括以下步骤:
[0075]
在25ml schlenk反应管中加入0.5mmol(75.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2l)129.0mg,为无色油状液体,在真空条件下干燥后,计算其产率为75%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.27(d,j=7.2hz,1h),7.03(d,j=7.2hz,1h),3.52(d,j=10.8hz,1h),2.74(s,1h),2.40(s,4h),2.28(s,3h),2.05(d,j=9.6hz,1h),1.87(t,j=11.6hz,1h),1.62-1.61(m,1h),1.55-1.50(m,1h),1.7-1.39(m,3h),0.37(s,9h),-0.39(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)148.5,139.7,139.6,134.4,132.8,127.3,54.1,45.1,42.0,40.1,38.9,33.6,32.3,21.4,17.7,2.1,-0.7.hrms(ei)m/z calcd for c
21h36
si
2+
(m)
+
344.2356,found 344.2357。
[0076]
其中,所述的(3,4-二甲基-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2l)化学结构通式为:
[0077][0078]
实施例13
[0079]
一种(3,5-二甲基-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2m)的合成方法,包括以下步骤:
[0080]
在25ml schlenk反应管中加入0.5mmol(75.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析
法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2m)135.9mg,为无色油状液体,在真空条件下干燥后,计算其产率为79%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.11(s,1h),6.88(s,1h),3.43-3.41(d,j=10.8hz,1h),2.63(s,1h),2.44(s,3h),2.33(s,1h),2.24(s,3h),1.95(d,j=10.0hz,1h),1.83-1.77(m,1h),1.59-1.53(m,1h),1.48-1.43(m,1h),1.40(d,j=11.2hz,1h),1.35-1.28(m,2h),0.32(s,9h),-0.40(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)145.4,141.9,134.9,134.8,134.3,133.8,53.3,44.9,41.1,39.7,38.8,33.5,32.2,23.0,20.7,2.1,0.6.hrms(ei)m/z calcd for c
21h36
si
2+
(m)
+
344.2356,found 344.2356。
[0081]
其中,所述的(3,5-二甲基-2-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)苯基)三甲基硅烷(2m)化学结构通式为:
[0082][0083]
实施例14
[0084]
一种((1r,2s,3s,4s)-3-(4-氟-2-甲基-6-(三甲基硅基)苯基)双环[2.2.1]庚烷-2-基)三甲基硅烷(2n)的合成方法,包括以下步骤:
[0085]
在25ml schlenk反应管中加入0.5mmol(77.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2n)127.1mg,为无色油状液体,在真空条件下干燥后,计算其产率为73%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.03(d,j=9.0hz,1h),6.79(d,j=9.0hz,1h),3.45(d,j=11.0hz,1h),2.65(s,1h),2.50(s,3h),2.37(s,1h),1.96(d,j=9.5hz,1h),1.86-1.82(m,1h),1.61-1.57(m,1h),1.48-1.46(m,1h),1.42(d,j=11.0hz,1h),1.35-1.34(m,2h),0.36(s,9h),-0.35(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)160.6(d,j=244.5hz),145.1(d,j=2.6hz),144.2(d,j=2.6hz),137.6(d,j=2.5hz),119.8(d,j=19.8hz),119.1(d,j=18.1hz),53.1,45.0,41.1,39.8,38.9,33.5,32.2,23.1,1.8,-0.6.hrms(ei)m/z calcd for c
20h33
fsi
2+
(m+h)
+
348.2105,found 348.2101。
[0086]
其中,所述的((1r,2s,3s,4s)-3-(4-氟-2-甲基-6-(三甲基硅基)苯基)双环[2.2.1]庚烷-2-基)三甲基硅烷(2n)化学结构通式为:
[0087][0088]
实施例15
[0089]
一种((1r,2s,3s,4s)-3-(4-氯-2-氟-6-(三甲基硅基)苯基)双环[2.2.1]庚烷-2-基)三甲基硅烷(2o)的合成方法,包括以下步骤:
[0090]
在25ml schlenk反应管中加入0.5mmol(87.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2o)110.4mg,为无色油状液体,在真空条件下干燥后,计算其产率为60%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.18(d,j=2.0hz,1h),7.02(dd,j=1.5hz,11.5hz,1h),3.16(d,j=11.0hz,1h),2.43-2.37(m,2h),2.09(d,j=9.5hz,1h),1.81-1.77(m,1h),1.62-1.57(m,1h),1.41-1.37(m,1h),1.33-1.26(m,2h),1.22(d,j=10.0hz,1h),0.35(s,9h),-0.32(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)161.0(d,j=250.9hz),145.5(d,j=3.8hz),135.6(d,j=12.7hz),131.9(d,j=9.0hz),130.0(d,j=2.6hz),117.8(d,j=28.1hz),49.7(d,j=1.5hz),44.0,42.7(d,j=1.4hz),39.2,38.2(d,j=14.2hz),33.0,32.4,1.0,-0.9.hrms(ei)m/z calcd for c
19h30
clfsi
2+
(m)
+
368.1559,found 368.1550。
[0091]
其中,所述的((1r,2s,3s,4s)-3-(4-氯-2-氟-6-(三甲基硅基)苯基)双环[2.2.1]庚烷-2-基)三甲基硅烷(2o)化学结构通式为:
[0092][0093]
实施例16
[0094]
一种三甲基(1-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)萘-2-基硅烷(2p)的合成方法,包括以下步骤:
[0095]
在25ml schlenk反应管中加入0.5mmol(86.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2p)104.3mg,为白色固体,在真空条件下干燥后,计算其产率为57%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)8.65(d,j=7.5hz,1h),7.82(d,j=7.0hz,1h),7.70(d,j=8.0hz,1h),7.59(d,j=8.0hz,1h),7.45-7.44(m,2h),3.85(d,j=11.0hz,1h),3.10(s,1h),2.48(s,1h),2.37(d,j=9.0hz,1h),1.98-1.93(m,1h),1.73-1.72(m,1h),1.64-1.62(m,1h),1.60-1.58(m,1h),1.49-1.47(m,2h),0.46(s 9h),-0.68(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)148.4,139.0,135.3,132.4,131.4,128.6,126.7,126.1,125.5,124.4,54.2,45.7,42.7,40.4,39.3,34.0,32.2,2.1,-1.0.hrms(ei)m/z calcd for c
23h34
si
2+
(m)
+
366.2199,found 366.2196。
[0096]
其中,所述的三甲基(1-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)萘-2-基硅烷(2p)化学结构通式为:
1.42(m,2h),0.43(s,9h),-0.71(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)149.8,149.7,140.0,135.0,134.8,127.3,127.1,119.2,53.8,45.6,42.8,40.4,39.4,33.9,32.1,1.9,-1.0.hrms(esi-tof)m/z calcd for c
22h34
nsi
2+
(m+h)
+
368.2224,found 368.2227。
[0116]
其中,所述的6-(三甲基硅基)-5-(1s,2s,3s,4r)-3-(三甲基硅基)双环[2.2.1]庚烷-2-基)喹啉(2t)化学结构通式为:
[0117][0118]
实施例21
[0119]
一种三甲基((1r,2s,3s,4s)-3-(3-(三甲基硅基)-[1,1
’‑
联苯]-2-基)双环[2.2.1]庚烷-2-基)硅烷(2u)的合成方法,包括以下步骤:
[0120]
在25ml schlenk反应管中加入0.5mmol(99.0mg)的3-甲氧基苯硼酸,降冰片烯1.5mmol(141mg),然后加入1.5mmol六甲基二硅烷(219mg),11.3mg醋酸钯,452.5mg无水醋酸铜,138mg碳酸钾,112mg三乙烯二胺,4ml乙腈,在120℃条件下搅拌24小时,反应后(通过tlc监测)冷却至室温,将反应液过滤,然后用旋转蒸发仪将有机层减压旋干,最后用柱层析法对粗产物进行纯化(除非另有说明,否则为石油醚),得到所需目标产物(2u)115.7mg,为白色固体,在真空条件下干燥后,计算其产率为59%,纯度99.9%。1h nmr(500mhz,cdcl3,δppm)7.51(d,j=7.0hz,1h),7.42(d,j=7.0hz,1h),7.38-7.30(m,3h),7.28-7.26(m,1h),7.17-7.14(m,1h),7.03(d,j=7.0hz,1h),3.58(d,j=11.0hz,1h),2.65(s,1h),2.00(s,1h),1.63-1.58(m,1h),1.49-1.44(m,1h),1.35(d,j=11.0hz,1h),1.30-1.23(m,2h),0.54(d,j=9.5hz,1h),0.42,(s,9h),0.35(d,j=9.0hz,1h),-0.37(s,9h).
13
c{1h}nmr(125mhz,cdcl3,δppm)148.4,144.4,142.6,141.3,134.9,134.5,131.8,129.8,127.4,126.6,126.4,124.4,55.1,43.8,43.3,38.7,37.8,33.0,32.8,2.1,-0.5.hrms(ei)m/z calcd for c
25h36
si
2+
(m)
+
392.2356,found 392.2355。
[0121]
其中,所述的三甲基((1r,2s,3s,4s)-3-(3-(三甲基硅基)-[1,1
’‑
联苯]-2-基)双环[2.2.1]庚烷-2-基)硅烷(2u)化学结构通式为:
[0122]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1