一种CRISPR/Cas调控的DNA银纳米簇传感器及其检测肉类掺假的方法和应用
一种crispr/cas调控的dna银纳米簇传感器及其检测肉类掺假的方法和应用
技术领域
1.本发明属于食品安全检测技术领域,具体涉及一种crispr/cas调控的dna银纳米簇传感器及其检测肉类掺假的方法和应用。
背景技术:
2.近年,肉类掺假逐渐成为受到全球食品市场关注的问题,尽管国内外已经出台了许多法律来保证和监督肉类的品质,但是肉类掺假现象仍层出不穷。大多数肉类掺假都是将颜色质地相似的低价原料掺入较高价格的产品中,以此获得更高的经济效益,而这些行为不仅输入消费欺诈,还会造成过敏反应、食源性致病菌的传播以及部分人员被迫的宗教信仰违背问题。因此,开发敏感、准确、可靠的检测技术,以保证肉类的真实性和食品安全是十分必要的。
3.现存的肉类真实性检测方法主要包括以特征蛋白、特异性代谢物和dna为标志物的检测技术,例如,质谱(ms)、酶联免疫吸附法(elisa)、光谱方法、聚合酶链式反应(pcr)、定量pcr(qpcr)技术,以及新兴的无损检测(ndt)技术如近红外光谱(nirs)、高光谱成像(hsi)和拉曼光谱(rs)等。在这些方法中,质谱技术和光谱技术由于可以提供待测物的大量结构信息而具有很好的通用性。无损检测技术适用于需进行多次重复测量和自动化检测形式,在高通量分析和自动化分析方面展现出一定的优势。然而,蛋白质在热加工或较复杂的加工条件下容易降解或变性,因此以蛋白质为目标物的检测方法的可靠性不足。此外,代谢物受动物生长环境和肉类储存、加工条件的影响较大,并且代谢物的物种特异性目前还存在一些争议,因此基于代谢物图谱的技术在实现肉类掺假的检测方面还不具有足够的说服力。相比之下,核酸具有公认的物种特异性、种间多态性以及热稳定性,是一种具有特异性和准确性的标志物。传统的pcr和qpcr技术具有良好的特异性和敏感性,然而其广泛应用被精密的设备要求、严格的实验环境要求和专业的人员要求所限制。此外,由于复杂的食品基质,极低的目标dna含量以及多种多样掺假方法,更高特异性、更灵敏的检测技术亟待开发。
技术实现要素:
4.为了克服上述现有技术的缺点,本发明的目的在于提供一种crispr/cas调控的dna银纳米簇传感器及其检测肉类掺假的方法和应用,为肉类掺假检测提供检测方案。
5.为了达到上述目的,本发明采用以下技术方案予以实现:
6.本发明公开了一种crispr/cas调控的dna银纳米簇传感器,包括crispr/cas体系和dna模板化银纳米簇;
7.其中,crispr/cas体系由cas12a蛋白、crrna、rna酶抑制剂、缓冲液以及扩增后的目标掺假样品dna构成;dna模板化银纳米簇由含银离子的溶液、nabh4和dna模板合成得到;其中,crrna的识别序列与目标掺假样品dna片段互补;dna模板的序列如seq.id.no.9、seq.id.no.10、seq.id.no.11、seq.id.no.12、seq.id.no.13或seq.id.no.14所示。
8.优选地,所述掺假样品为鸭肉,鸭肉样品dna的核苷酸序列如seq.id.no.8所示;crrna的核苷酸序列如seq.id.no.7所示。
9.优选地,dna模板的序列为c-g4。
10.进一步优选地,扩增为环介导等温扩增,扩增所用引物包括鸭肉-fip引物、鸭肉-bip引物、鸭肉-f3引物、鸭肉-b3引物、鸭肉-lf引物和鸭肉-lb引物;其中,所述鸭肉-f3引物的核苷酸序列如seq.id.no.1所示,鸭肉-b3引物的核苷酸序列如seq.id.no.2所示,鸭肉-fip引物的核苷酸序列如seq.id.no3所示,鸭肉-bip引物的核苷酸序列如seq.id.no.4所示,鸭肉-lf引物的核苷酸序列如seq.id.no.5所示,鸭肉-lb引物的核苷酸序列如seq.id.no.6所示。
11.优选地,所述含银离子的溶液为agno3;dna模板、agno3和nabh4的摩尔比为1:(6~40):(6~40)。
12.进一步优选地,dna模板与ag
+
的摩尔比为1:30。
13.优选地,缓冲液为10
×
nebuffer 2.1。
14.优选地,dna模板的浓度为1、10、20、50、75或100μm。
15.进一步优选地,dna模板的浓度为50μm。
16.本发明还公开了上述一种crispr/cas调控的dna银纳米簇传感器检测肉类掺假的方法,首先提取目标掺假样品dna并进行lamp扩增,然后用扩增产物激活cas12a蛋白,以dna模板化银纳米簇作为cas12a蛋白酶切反应的底物,剪切完成后经荧光光谱仪扫描,以空白组和实验组在570nm处的荧光强度差为信号建立标准曲线,根据标准曲线测定含未知浓度的肉类样品中目标掺假样品dna含量。
17.优选地,dna模板化银纳米簇的制备方法为:将银纳米簇dna模板序列在95℃加热后,在室温下冷却,加入含银离子的溶液后,在4℃避光孵育1h,之后加入nabh4并涡旋,4℃避光孵育0~12h,制得dna模板化银纳米簇。
18.进一步优选地,银纳米簇dna模板序列的孵育时间为2h。
19.优选地,lamp扩增条件为65℃,30min;剪切条件为在37℃反应30min。
20.本发明还公开了上述一种crispr/cas调控的dna银纳米簇传感器在检测肉类掺假中的应用。
21.与现有技术相比,本发明具有以下有益效果:
22.本发明提供的一种crispr/cas调控的dna银纳米簇传感器,利用基因编程工具crispr/cas12a的特异性识别和反式切割活性来进行微量核酸的灵敏检测,该传感器克服了crispr/cas技术基于有机染料和猝灭剂的荧光信号输出过程中的问题,如有机化学荧光材料的生物相容性相对较差,成本较高,以及由于复杂基质中的各种离子、在激发光中过长时间的暴露、由散射光和自身荧光引起的背景干扰,导致荧光猝灭以及假阳性结果等等。传感器中的新型无标签荧光探针dna模板化银纳米簇(dna-agncs)是天然的集成探针,合成时无需化学修饰和荧光基团的连接,仅通过还原ag
+
来制备。合成的纳米材料由几个到几十个ag原子和dna支架稳定的纳米团簇组成,在成核区域金属核的形成对dna的化学性质的影响可忽略不计,而dna模板的降解会伴随着荧光强度的明显下降。dna-agncs具有易于合成、高光稳定性、毒性低及低成本等特点,生物相容性更好,能够表现出稳定的荧光,具有抗背景干扰和假阳性等特点,可以作为直接的信号输出方式,克服了传统荧光探针标记繁琐的过
程,不需要化学标记或有机染料的纳米材料,具有更高的生物相容性,更加适合crispr/cas等生物反应体系。该生物传感器检测的目标物质为dsdna,具有独特的dsdna识别能力,结合crispr/cas系统的特异性识别能力和高灵敏的信号转导特性,为痕量dsdna的检测提出了可靠的检测方法。将该传感器应用于肉类掺假的检测中,在没有掺假的样品中,没有目标核酸,合成的dna-agncs表现出较强的荧光;在掺假样品中,有目标核酸存在,crispr/cas12a的反式切割活性被激活,对包裹在agncs外侧的dna模板进行切割,因此体系的荧光强度随掺假浓度的增大而显著降低。经过该过程,样品中掺假物质的核酸信号转化为荧光信号输出。
23.本发明提供的一种crispr/cas调控的dna银纳米簇传感器检测肉类掺假的方法,该方法具有较宽的线性范围和较低的lod,基于crispr/cas12a对于核酸的特异性识别和快速、灵敏的反式切割活性,结合dna-agncs中富g的dna序列的荧光增强特性,来对鸭肉掺假进行检测,可以实现极低量的掺假样品的检测,对肉类掺假中的痕量核酸检测具有良好的特异性、高灵敏度,掺假量达到1.9pm即可检出,其表现出的环境友好性利于在更多的食品样本和其他复杂的生物样本中检测各种生物标志物。
附图说明
24.图1为本发明的crispr/cas调控的dna银纳米簇传感器的示意图;
25.图2为本发明的鸭肉基因经环介导等温扩增后的电泳图;
26.图3为本发明的dna-agncs合成中dna序列优化图;
27.图4为本发明的dna-agncs合成中dna浓度的优化图;
28.图5为本发明的dna-agncs合成中dna和ag
+
的摩尔比的优化图;
29.图6为本发明的dna-agncs合成中孵育时间的优化图;
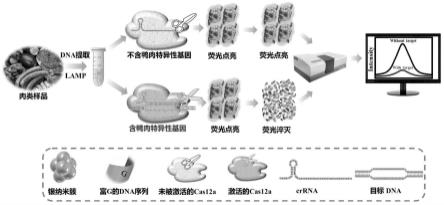
30.图7为本发明的dna-agncs合成之后稳定性的探究图;
31.图8为本发明的dna模板化银纳米簇传感器的检测不同浓度目标核酸的荧光光谱图;
32.图9为本发明的dna模板化银纳米簇传感器的标准曲线图。
具体实施方式
33.为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
34.需要说明的是,本发明术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
35.下面结合附图1~9对本发明做进一步详细描述:
36.1.材料和设备
37.(1)主要材料和试剂
38.dna marker、4s green核酸染色剂、琼脂糖和magk-mk动物基因组dna提取试剂盒(购自上海生工生物技术有限公司)。cas12a购自neb有限公司(北京,中国)。硼氢化钠(nabh4)、硝酸银(agno3)、磷酸氢二钠(na2hpo4)和磷酸二氢钠(nah2po4)购自sigma-aldrich公司(中国,上海)。crrna的设计采用crispor程序(http://crispor.tefor.net/),用目标dna中一个5'tttn原间隔邻近基序补充到目标位点。crrna由genscript(nanjing,china)合成。环介导等温扩增(lamp)引物(f3/b3、fip/bip、lf/lb)和用于dna-agncs的dna模板(序列如seq.id.no.9至seq.id.no.14所示)由上海生工生物技术有限公司合成。本发明中使用的寡核苷酸列于表1。羊肉样品和鸭肉在当地市场(中国西安当地市场)购买。
39.(2)主要仪器
40.透射电子显微镜(jem-2100f,japan electron optics laboratory ltd,jpn),在zetasizer nano(zs-90,malvern,uk),cd光谱仪(chirascan,applied phophysics ltd,uk)获得的,荧光分光光度计(fluoromax-4,fr),酶标仪(multiskan go,thermo scientific,美国)。
41.2.基于crispr/cas调控的dna银纳米簇传感器检测肉类掺假
42.本发明提供的一种crispr/cas调控的dna银纳米簇传感器,包括crispr/cas体系和dna模板化银纳米簇;
43.其中,crispr/cas体系由cas12a蛋白、crrna、rna酶抑制剂、缓冲液以及扩增后的目标掺假样品dna构成;dna模板化银纳米簇由含银离子的溶液、nabh4和dna模板合成得到;其中,目标掺假样品为鸭肉样品;dna模板的序列为g、g3、g4、c-g、c-g3或c-g4;crrna的识别序列与鸭肉样品dna片段互补,鸭肉样品dna的核苷酸序列如seq.id.no.8所示;含银离子的溶液为agno3;dna模板、agno3和nabh4的摩尔比为1:(6~40):(6~40)。
44.本发明提供的一种crispr/cas调控的dna银纳米簇传感器检测肉类掺假的方法,如图1,首先从样品中提取基因组并进行扩增,得到大量的目标核酸。其次,以含银离子的溶液、nabh4和dna模板为原料,通过nabh4对ag
+
的还原,以dna为支架合成dna模板化的银纳米簇并在4℃避光保存。在建立crispr/cas体系(包括cas12a蛋白、crrna和nebuffer2.1)之后,加入dna模板化的银纳米簇作为cas12a核酸酶的底物,再加入目标核酸激活cas12a核酸酶的剪切活性,促进cas12a对dna模板化的银纳米簇的剪切,使包裹在银纳米簇外侧的dna模板被剪切成dna片段,从而引起整个体系荧光发射强度的降低。
45.具体检测方法如下:
46.第一步,按照magk-mk动物基因组dna提取试剂盒说明书,从购买的鸭肉中提取基因组。
47.具体步骤为:将50mg新鲜的鸭肉组织加入液氮后用研钵研磨成粉末,然后加入400μl buffer macl、200μl buffer mcl和20μl protease k至干净的试管中。将该混合体系在65℃水浴中加热20min,离心后保留上清。加入缓冲液ma和magic mag beads,室温孵育1min,磁分离后用70%乙醇洗涤2次。将目标基因组dna用te buffer洗脱,存放于干净的离心管中。
48.第二步,对第一步提取到的基因组进行扩增。
49.具体步骤为:nd2(第一步提取到的目标基因组dna)用lamp引物(f3/b3、fip/bip、
lf/lb)65℃条件下反应30min以扩增,扩增产物用b-500紫外分光光度计(metash,shanghai,china)定量,在-20℃保存备用;琼脂糖凝胶电泳结果见图2;
50.其中,环介导等温扩增的引物(6条引物)参考行业标准sn/t 4419.21-2016选取,核苷酸序列如表1所示,扩增体系见表2:
51.表1:核苷酸序列
[0052][0053][0054]
表2:环介导等温扩增体系
[0055][0056][0057]
第三步,crrna序列的设计。
[0058]
选定的鸭肉线粒体基因nd2为目标dna,crrna与选定的鸭肉线粒体基因nd2(核苷酸序列如seq.id.no.8所示)互补,将鸭肉线粒体基因nd2的核苷酸序列输入http://crispor.tefor.net/网站,筛选剪切效率分数最高的片段,根据此片段结合crrna的骨架序列得到最终完整的crrna序列,所得crrna(由金斯瑞生物科技有限公司合成)序列如seq.id.no.7所示。
[0059]
第四步,合成dna-agncs。
[0060]
将10μl,50μm dna模板在95℃加热5min,冷却10min至室温,向其中加入磷酸盐缓冲液(pb,10μm,ph值7.4)90μl,及50μl 60μm agno3,该混合体系置于4℃避光孵育1h后,向其中加入100μl 60μm新制nabh4,涡旋1min后,在4℃下避光孵育2h,制得dna-agncs。使用前在4℃避光保存。
[0061]
第五步,crispr/cas12a传感体系的构建及检测。
[0062]
酶切体系:将1μl预合成的dna-agncs加入含有0.03μm cas12a、1.2μm crrna、0.4u rna酶抑制剂、1
×
nebuffer 2.1的20μl cas12a剪切体系中,最后将5μl目标dna加入剪切体系。对照组除目标dna外,与cas12a剪切体系相同。剪切体系在37℃反应30min。
[0063]
荧光信号检测:在酶剪切反应完成后,将20μl的反应液稀释至170μl,用荧光光谱仪测定体系在570nm处的荧光发射强度。
[0064]
1)建立检测dna模板化银纳米簇传感器的标准曲线
[0065]
按照上述方法测定含不同浓度鸭肉的羊肉样品dna的实验组(以鸭肉dna浓度1ng/μl对应鸭肉含量为100%)和空白组(即5μl超纯水代替酶切体系中的目标dna)在570nm处的荧光强度,得到空白组与实验组的荧光强度差值(δi),以该荧光强度差值(δi)为纵坐标,log(目标dna浓度)为横坐标建立标准曲线;
[0066]
2)计算羊肉中掺杂鸭肉的含量
[0067]
根据建立的标准曲线测定含未知浓度鸭肉的羊肉样品中目标dna含量(多次测定只需建立一次荧光传感器的标准曲线)。
[0068]
羊肉样品中掺杂鸭肉含量的具体计算方法为:将空白组与待测羊肉样品在在
570nm处的δi值带入标准曲线中得出对应目标dna浓度值,对应目标dna浓度值在总的目标dna浓度值(即纯鸭肉dna的浓度值)的占比即为羊肉中掺杂鸭肉的含量。
[0069]
上述步骤,即构建完成crispr/cas调控的dna银纳米簇传感器的肉类掺假检测方法。
[0070]
为了提高此dna模板化银纳米簇传感器的检测性能,本发明还研究了dna-agncs合成中dna序列、dna浓度、dna和ag
+
的摩尔比、孵育时间及dna-agncs纳米材料的稳定性对于该传感器性能的影响。如图3至图7所示。其中,图3验证了不同的核苷酸序列和长度会影响dna-agncs的荧光性质,其中胞嘧啶有助于agncs的形成,鸟嘌呤能够增强荧光强度。在设计的6个含有不同的胞嘧啶序列和鸟嘌呤数量的dna序列中,g、g3、g4、c-g、c-g3和c-g4的序列如seq.id.no.9至seq.id.no.14所示,g4(即g-四链体)比g、g3的增强效果好,而带有胞嘧啶序列的c-g、c-g3和c-g4更表现出显著增强的荧光发射,并且其中c-g4表现最好,这可能是由于胞嘧啶对ag
+
的亲和力远高于鸟嘌呤,有利于dna-agncs合成。图4中dna模板浓度优化范围为1、10、20、50、75和100μm,其中50μm的dna模板合成的dna-agncs荧光发射最强,因此选用50μm dna合成dna-agncs。如图5所示,dna与ag
+
的摩尔比优化范围为1:6~1:40。结果表明,荧光强度随着摩尔比的增加而增强,在1:30时达到最大值然后降低,因此选择dna与ag
+
的摩尔比为1:30。图6展示了dna-agncs合成过程中孵育时间的优化,结果表明,孵育2h后荧光强度达到最大值,因此选择了2h的孵育时间。图7展示了dna-agncs纳米材料的稳定性,将其置于4℃黑暗环境中保存14天,每2天检测一次荧光。结果显示,贮存6天和14天后,荧光强度分别降低了18.3%和26.3%,说明合成的dna-agncs在4℃黑暗环境下,14天内仍能保持稳定。
[0071]
3.评估crispr/cas调控的dna银纳米簇传感器的检测性能
[0072]
为了进一步说明上述crispr/cas调控的dna银纳米簇传感器的肉类掺假检测方法的检测性能,本发明做了以下评估,在上述最优条件下,将1μl预合成dna-agncs加入含有0.03μm cas12a、1.2μm crrna、0.4u rna酶抑制剂、1
×
nebuffer 2.1的20μl cas12a剪切体系中,再向其中加入5μl目标dna(从10pm到1μm按照10倍稀释),再加入样品中提取后并经过lamp扩增的基因,37℃孵育之后测定570nm处的荧光强度,结果如图8所示,随着掺假浓度的升高,反应体系浓度逐渐降低,且与对照组荧光强度的δi逐渐增大。
[0073]
实施例1
[0074]
用构建的crispr/cas调控的dna银纳米簇传感器检测纯羊肉制品,具体操作如下:
[0075]
第一步,按照magk-mk动物基因组dna提取试剂盒说明书,从购买的羊肉中提取基因组。
[0076]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第一步。
[0077]
第二步,提取出的基因组进行扩增。
[0078]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第二步。
[0079]
第三步,crrna序列的设计
[0080]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第三步。
[0081]
第四步,合成dna-agncs。
[0082]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第四步。
[0083]
第五步,crispr/cas12a传感体系的构建及检测
[0084]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第五步。
[0085]
荧光信号检测:在酶剪切反应完成后将20μl的反应液稀释至170μl,用荧光光谱仪测定体系在570nm处的荧光发射强度。
[0086]
1)建立检测荧光传感器的标准曲线
[0087]
按照上述方法测定含不同浓度鸭肉的羊肉样品dna的实验组(以鸭肉dna浓度1ng/μl对应鸭肉含量为100%)和空白组(即5μl超纯水代替酶切体系中的目标dna)在570nm处的荧光强度,得到空白组与实验组的荧光强度差值(δi),以该荧光强度差值(δi)为纵坐标,log(目标dna浓度)为横坐标建立标准曲线;
[0088]
2)计算羊肉中掺杂鸭肉的含量
[0089]
根据建立的标准曲线(如图9所示)测定含未知浓度鸭肉的羊肉样品中目标dna含量。该实验重复三次,计算得到570nm处的荧光强度的平均值与误差棒。
[0090]
所得荧光强度均在空白信号的误差范围内,表明该羊肉样品中不含鸭肉成分。
[0091]
实施例2
[0092]
用构建的crispr/cas调控的dna银纳米簇传感器检测市售羊肉样品是否掺假,具体操作如下:
[0093]
第一步,按照magk-mk动物基因组dna提取试剂盒说明书,从购买的羊肉中提取基因组。
[0094]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第一步。
[0095]
第二步,提取出的基因组进行扩增。
[0096]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第二步。
[0097]
第三步,crrna序列的设计
[0098]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第三步。
[0099]
第四步,合成dna-agncs。
[0100]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第四步。
[0101]
第五步,crispr/cas12a传感体系的构建及检测
[0102]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第五步。
[0103]
荧光信号检测:在酶剪切反应完成后将20μl的反应液稀释至170μl用荧光光谱仪测定体系在570nm处的荧光发射强度。
[0104]
1)建立检测荧光传感器的标准曲线
[0105]
按照上述方法测定含不同浓度鸭肉的羊肉样品dna的实验组(以鸭肉dna浓度1ng/μl对应鸭肉含量为100%)和空白组(即5μl超纯水代替酶切体系中的目标dna)在570nm处的荧光强度,得到空白组与实验组的荧光强度差值(δi),以该荧光强度差值(δi)为纵坐标,log(目标dna浓度)为横坐标建立标准曲线;
[0106]
2)计算羊肉中掺杂鸭肉的含量
[0107]
根据建立的标准曲线(如图9所示)测定含未知浓度鸭肉的羊肉样品中目标dna含量。该实验重复三次,计算得到570nm处的荧光强度的平均值与误差棒。
[0108]
所得荧光强度均在空白信号的误差范围内,表明该市售羊肉样品中不含鸭肉成分。
[0109]
实施例3
[0110]
用构建的crispr/cas调控的dna银纳米簇传感器检测市售羊肉制品1-5号是否掺假,具体操作如下:
[0111]
第一步,按照magk-mk动物基因组dna提取试剂盒说明书,从购买的羊肉中提取基因组。
[0112]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第一步。
[0113]
第二步,提取出的基因组进行扩增。
[0114]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第二步。
[0115]
第三步,crrna序列的设计
[0116]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第三步。
[0117]
第四步,合成dna-agncs。
[0118]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第四步。
[0119]
第五步,crispr/cas12a传感体系的构建及检测
[0120]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第五步。
[0121]
荧光信号检测:在酶剪切反应完成后将20μl的反应液稀释至170μl用荧光光谱仪测定体系在570nm处的荧光发射强度。
[0122]
1)建立检测荧光传感器的标准曲线
[0123]
按照上述方法测定含不同浓度鸭肉的羊肉样品dna的实验组(以鸭肉dna浓度1ng/μl对应鸭肉含量为100%)和空白组(即5μl超纯水代替酶切体系中的目标dna)在570nm处的荧光强度,得到空白组与实验组的荧光强度差值(δi),以该荧光强度差值(δi)为纵坐标,log(目标dna浓度)为横坐标建立标准曲线;
[0124]
2)计算羊肉中掺杂鸭肉的含量
[0125]
根据建立的标准曲线(如图9所示)测定含未知浓度鸭肉的羊肉样品中目标dna含量。该实验重复三次,计算得到570nm处的荧光强度的平均值与误差棒。
[0126]
所得荧光强度均在空白信号的误差范围内,表明市售羊肉样品1~5号中不含鸭肉成分。
[0127]
实施例4
[0128]
用构建的crispr/cas调控的dna银纳米簇传感器检测人为掺假的市售羊肉制品,具体操作如下:
[0129]
第一步,按照magk-mk动物基因组dna提取试剂盒说明书,从购买的羊肉中提取基因组。
[0130]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第一步。
[0131]
第二步,提取出的基因组进行扩增。
[0132]
制备了人为掺入1%,5%和10%鸭肉的羊肉样品,市售羊肉样品与制备的掺假样品中基因组的提取均使用magk-mk动物基因组dna提取试剂盒进行,其余操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第二步。
[0133]
第三步,crrna序列的设计
[0134]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第三步。
[0135]
第四步,合成dna-agncs。
[0136]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第四步。
[0137]
第五步,crispr/cas12a传感体系的构建及检测
[0138]
操作方法同上述crispr/cas调控的dna银纳米簇传感器的构建方法第五步。
[0139]
荧光信号检测:在酶剪切反应完成后将20μl的反应液稀释至170μl用荧光光谱仪测定体系在570nm处的荧光发射强度。
[0140]
1)建立检测荧光传感器的标准曲线
[0141]
按照上述方法测定含不同浓度鸭肉的羊肉样品dna的实验组(以鸭肉dna浓度1ng/μl对应鸭肉含量为100%)和空白组(即5μl超纯水代替酶切体系中的目标dna)在570nm处的荧光强度,得到空白组与实验组的荧光强度差值(δi),以该荧光强度差值(δi)为纵坐标,log(目标dna浓度)为横坐标建立标准曲线;
[0142]
2)计算羊肉中掺杂鸭肉的含量
[0143]
根据建立的标准曲线(如图9所示)测定含人为掺入鸭肉的羊肉样品中目标dna含量。该实验重复三次,计算得到570nm处的荧光强度的平均值与误差棒。
[0144]
对实验组市售五种羊肉样品用该方法进行检测,将所得δi代入实施例1所得图9的标准曲线,市售羊肉的检测结果在空白组的误差范围内,未检出鸭肉;掺入1%鸭肉的市售羊肉样品中鸭肉检出量为0.97~1.01%,掺入5%鸭肉的市售羊肉样品中鸭肉检出量为4.85~4.90%,掺入10%鸭肉的市售羊肉样品中鸭肉检出量为10.07~10.40%,其检测掺入量与实际掺入量的比值为97.09%~104.00%,接近100%,证实其具有良好的准确性。
[0145]
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1