一种高复苏率的冻存脐带血调节性T细胞的体外扩增方法
一种高复苏率的冻存脐带血调节性t细胞的体外扩增方法
技术领域
1.本发明属于细胞治疗领域,尤其涉及一种高复苏率的冻存脐带血调节性t细胞的体外扩增方法。
背景技术:
2.免疫性疾病是由于患者自身免疫紊乱导致多种器官组织功能受损,其疾病谱广泛,包括自身免疫糖尿病、系统性红斑狼疮等疾病。自身免疫性疾病也被列入我国中长期科技发展纲要的十类重大疾病之一。但目前其治疗现多依赖于免疫抑制剂等传统方法,但疾病主因—免疫调节紊乱并未得到解决。
3.调节性t细胞(regulatory t cell,treg)是一类特殊的t细胞亚群,通过抑制和调控效应t细胞维持动态免疫平衡。从上世纪末日本学者分离并鉴定了调节性t细胞后,其已成为近年来免疫领域研究的热点。国外已启动多项调节性t细胞相关的临床试验,其中较有代表性的调节性t细胞治疗移植物抗宿主病证实了该疗法应用于免疫性疾病的安全性及有效性。然而,调节性t细胞治疗免疫性疾病在中国仍是空白。调节性t细胞治疗能够使免疫系统重新达到平衡,阻止自身免疫反应对器官组织的进一步损伤,改善甚至逆转病情,从根本上治愈免疫性疾病。
4.越来越多的研究表明脐血中富含调节性t细胞,因其具未受抗原激活多为t细胞,体外扩增后的treg细胞功能良好且免疫原性低,因而为免疫性疾病治疗带来了新希望。本团队前期建立了脐血调节性t细胞的体外分离、扩增和功能鉴定方法并获批国家发明专利(专利号:201710613737.4),并在国际上首次开展了脐血调节性t细胞治疗自身免疫糖尿病的临床研究,初步明确了脐血调节性t细胞治疗自身免疫糖尿病的安全性和有效性的评估。2019 年和2020年,美国青少年糖尿病联盟(jdca)分别发表年度报告关于全球治疗1型糖尿病的技术,“脐血调节性t细胞“治疗技术连续被评为全球领先技术。目前通过应用脐血treg细胞来治疗免疫性疾病的临床试验在全球尚属空白。调节性t细胞可从脐血中提取,提取后扩增用后再进行应用,需要14-21天的时间,无法满足临床随需随取,冻存后的调节性t细胞复苏后再扩增,细胞会大量死亡,严重影响调节性t细胞的临床使用。因此,亟待建立一种冻存调节性t细胞高复苏率及体外扩增优化方法,并建立调节性t细胞库,满足临床患者的需求。
技术实现要素:
5.本发明所要解决的技术问题是,克服以上背景技术中提到的不足和缺陷,提供一种高复苏率的冻存脐带血调节性t细胞的体外扩增方法。
6.为解决上述技术问题,本发明提出的技术方案为:
7.一种高复苏率的冻存脐带血调节性t细胞的体外扩增方法,包括如下步骤:
8.(1)将一次扩增后的冻存脐带血调节性t细胞进行复苏,并用无血清培养液对细胞进行重悬得到重悬液;
9.(2)将所述重悬液加入扩培液进行二次扩增培养,初始培养1~2天后,每隔1~3天继代培养一次,共培养13天以上;
10.所述扩培液按体积份数比计包括无血清培养液70.54%-85.27%、4-羟乙基哌嗪乙磺酸缓冲液2.5%-5%、青霉素-链霉素溶液1%-2%、l-谷氨酰胺1%-2%、50-100umol/l2-巯基乙醇 0-1000u/ml重组白介素-2、50-200nmol/l雷帕霉素、ab血清10%-20%。
11.上述高复苏率的冻存脐带血调节性t细胞的体外扩增方法,优选的,所述一次扩增后的冻存脐带血调节性t细胞的获取方法包括如下步骤:制备调节性t细胞,然后在带有磁珠的调节性t细胞中加入扩培液进行一次扩增培养,初始培养1~2天后,每隔1~3天继代培养一次,共培养18天以上。
12.优选的,制备调节性t细胞的方法包括以下步骤:
13.s1、从脐带血中分离得到外周血单个核细胞层,并用红细胞裂解液除去其中的红细胞,清洗、计数,离心除去上清液,冻存,复苏并计数;
14.s2、离心除去上清液,用easy buffer将细胞重悬至5
×
107cell/ml,重悬后液体量为 0.5ml-6ml,即得到重悬液;
15.s3、将含有脐血调节性t细胞的重悬液转移至与磁极配套的无菌管中,加入cd25 positiveselection cocktail,孵育5min;涡旋releasable rapidsphere 30s以上,直至磁珠团块消失;加入releasable rapidsphere;加入cd4
+
t细胞富集抗体混合物,孵育5mim;加入easy buffer 定容至10ml,上下轻柔混匀2-3次;将无菌管放置于磁极上,孵育10mim;准备离心管收集 cd25-细胞,将磁极连同无菌管一起倾倒管内液体至该管内;从磁极上取下无菌管,向其中加入10ml easy buffer,轻柔混匀2-3次后放置于磁极上,孵育5min;加入easy buffer定容至初始重悬体积,将管壁上细胞全部冲下;加入磁珠去除缓冲液;加入cd127
high
去除抗体混合物,孵育5min;加入easy buffer定容至10ml,上下混匀2-3次;将无菌管放置于磁极上,孵育5min;准备离心管收集调节性t细胞,将磁极连同无菌管一起将液体倾倒至准备好的离心管内,即得。
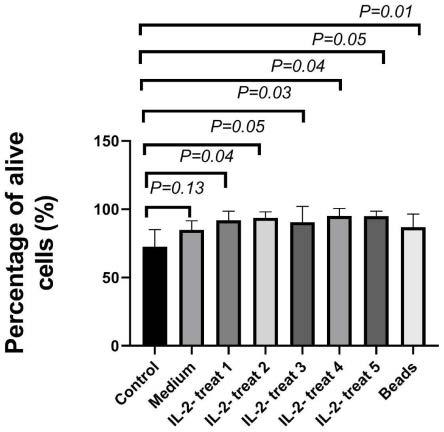
16.更优选的,所述cd25 positive selection cocktail的加入量为重悬体积
×
50ul,所述 releasable rapidsphere的加入量为重悬体积
×
30ul,所述cd4
+
t细胞富集抗体混合物的加入量为重悬体积
×
50ul,所述磁珠去除缓冲液的加入量为重悬体积
×
100ul,所述cd127
high
去除抗体混合物的加入量为重悬体积
×
50ul。
17.上述高复苏率的冻存脐带血调节性t细胞的体外扩增方法,优选的,所述扩增培养是按照每孔2~8
×
105/ml的浓度加入48孔板中,每孔加入0.5毫升扩培液进行培养。
18.优选的,所述初始培养和继代培养过程均在36~38℃,4~6%的co2条件下进行。
19.优选的,种板后第1~2天后,每孔细胞增加0.5ml~1ml扩培液,同时添加100~400u/ml 的rhil-2后培养。
20.更优选的,吸除孔内0.5ml的培养液,将剩余的培养液混匀细胞,每1孔传2孔,同时每孔补加培养液至1ml,在进行第3次传代培养时,除去抗cd3cd28磁珠,再按照磁珠:调节性t细胞的数目=1:1的比例添加新的抗cd3cd28磁珠。
21.上述高复苏率的冻存脐带血调节性t细胞的体外扩增方法,优选的,所述扩培液中还添加il-2;更优选的,所述扩培液中所含il-2的浓度为10-1000u/ml;更优选为200-600u/ml。
22.与现有技术相比,本发明的有益效果为:
23.1、本发明的方法,能够将已扩增过的冻存后的调节性t细胞进行再次复苏扩增,且复苏后二次扩增的调节性t细胞其活性能够达到90%以上,而且还可以继续扩增(如三次扩增、四次扩增),扩增后的细胞还可以用于临床治疗,大大缩短了临床患者等待调节性t细胞的时间,能够满足临床随需随取。
24.2、本发明二次扩增得到的脐血调节性t细胞,其流式结果表明二次扩增 cd4
+
cd25
+
cd127-细胞比例为99.6+0.15,cd3
+
cd8
+
细胞的比例为小于5%,调节性t细胞的质量达到临床研究的标准;cfse实验结果表明二次扩增得到的脐血调节性t细胞依然能明显抑制攻击性t细胞的增殖能力。
附图说明
25.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
26.图1和图2是冻存调节性t细胞在不同培养液(x-vivo培养液、扩培液、扩培液添加 il-2(设不同浓度il-2处理组)、扩培液添加磁珠条件下细胞复苏活率的比较。
27.图3和图4是冻存调节性t细胞在不同培养液(x-vivo培养液、扩培液、扩培液添加 il-2(设不同浓度il-2处理组)、扩培液添加磁珠条件下细胞数目的比较。
28.图5是本发明优选实施例的扩增后的脐血调节性t细胞扩增后的表型检测图。
29.图6是本发明优选实施例的扩增后的脐血调节性t细胞对糖尿病攻击性t细胞 (cd4+cd25-)的抑制作用图;其中:图6a为阴性对照组的抑制作用图;图6b为阳性对照组的抑制作用图;图6c为cd25-t细胞:调节性t细胞=1:1组的抑制作用图;图6d为cd25-t 细胞:调节性t细胞=2:1组的抑制作用图;图6e为cd25-t细胞:调节性t细胞=4:1组的抑制作用图。
具体实施方式
30.为了便于理解本发明,下文将结合说明书附图和较佳的实施例对本发明做更全面、细致地描述,但本发明的保护范围并不限于以下具体实施例。
31.除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
32.除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。
33.实施例:
34.一种高复苏率的冻存脐带血调节性t细胞的体外扩增方法,对调节性t细胞进行复苏和扩增培养以用于制备治疗免疫疾病药物,该体外扩增方法如下:
35.一、脐血调节性t细胞制备
36.1.对脐血袋进行消毒,制备脐血自体血浆:将脐血袋中的脐血转移至50ml离心管
中进行离心:离心条件:20℃,3000rpm,10min,+8,-9。取上清转移至新50ml离心管中进行第二次离心:离心条件:20℃,4000rpm,10min,+8,-9,吸取黄色澄清的血浆,56℃水浴灭活30分钟后放置冰箱备用。用与吸出血浆等体积的生理盐水重悬脐血。
37.2.将生理盐水重悬的脐血缓慢加至淋巴细胞分离液(脐血体积:淋巴细胞分离液体积=1:1) 离心,离心条件:20℃,*400rcf-*1610rcf,25min,+0,-0。离心结束后,脐血分层,用吸管吸取外周血单个核细胞(pbmc)层,动作缓慢轻柔,尽可能少吸取淋巴细胞液。
38.3.将pbmc层继续离心,离心条件:20℃,*580rcf,10min,+8,-9。取5ml-10ml 10
×
红细胞裂解液及45ml灭菌用水配置红裂液。在离心完成后,去上清液,加入红裂液2~10分钟后,加入了0.9%生理盐水至35ml定容终止红裂。离心,去除上清,离心条件:20℃,*290rcf, 10min,+8,-9。重复加入0.9%生理盐水定容,离心,去除上清的步骤2~3次。
39.4.离心完成后,去上清液,弹散细胞,加入0.9%的生理盐水,取10μl进行计数。剩余的加0.9%生理盐水至40ml定容再次离心,离心条件:20℃,*290rcf,10min,+8,-9。其中计数步骤具体为:将所取细胞液置于ep管内,取90μl台盼蓝加于ep管内混匀。取10μl在计数板上,快速操作和计数:(四角数目之和/4)
×
105个/ml*稀释倍数,线上细胞记上不记下,记左不计右。
40.5.离心完成后,去上清液,最后一点可以用移液枪(1000μl)尽可能吸尽,弹散细胞,缓慢滴加3ml冻存液至细胞内,轻轻吹匀,再将剩下的冻存液加入,吹匀,以4ml/管细胞液加入到5ml冻存管内,程序降温至-80度后转移至液氮罐中。其中冻存液的配置方法包括:90%自体血浆和dmso,根据细胞数5-10
×
106/ml配制冻存液,配方(10%dmso+90%脐血自体血浆)/ml,共配置40ml冻存液。配制时先加自体血浆再慢慢滴加dmso,取dmso时从底部往上抽加,以防其凝固,全程避光、冰上操作。
41.6.从液氮罐中取出冻存细胞的冻存管,迅速置于37℃水浴箱进行复苏。用无血清培养液对细胞进行重悬至15ml离心管中,同步骤4的方法进行细胞计数,然后进行离心:离心条件: 20℃,*150rcf-*390rcf,10min,+8,-9。
42.7.离心完毕后去上清液,每1
×
107/ml细胞加90μl macs buffer即(n
×
90)μl。每1
×
107/ml 细胞加10μl~20μl cd25 microbeadsii即(n
×
10)μl。涡旋。
43.8.用easy buffer将细胞重悬至5
×
107cell/ml,重悬后液体量为0.5ml-6ml。
44.9.将重悬后的细胞悬液转移至磁极配套的无菌管中。
45.10.加入cd25阳性选择抗体:加入量为重悬体积
×
50ul,混匀。
46.11.孵育5min。
47.12.涡旋可释放球体30s以上,直至磁珠团块消失。
48.13.加入可释放球体:加入量为重悬体积
×
30ul,混匀。
49.14.加入cd4
+
t细胞富集抗体混合物(t cell enrichment cocktail):加入量为重悬体积
×
50ul,混匀。
50.15.孵育5mim。
51.16.加入easy buffer定容至10ml,上下轻柔混匀2-3次。
52.17.将无菌管放置于磁极上,无需盖子。
53.18.孵育10mim。
54.19.准备离心管收集cd25-细胞,将磁极连同无菌管一起倾倒管内液体至该管内。
孔传2孔,同时添加具有100-400u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
73.5.种板后第7-10天,第3次传代:先去除培养皿中的抗cd3cd28磁珠,再添加洗净的新抗cd3cd28磁珠(按照磁珠:调节性t细胞的数目=1:1),在37℃、5%co2浓度下培养。
74.6.种板后第10-11天,第4次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每1 孔传2孔,同时添加具有100-400u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
75.7.种板后第11-12天,第5次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每1 孔传2孔,同时添加具有100-400u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
76.8.种板后第12-13天,第6次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每1 孔传2孔,同时添加具有100-400u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
77.9.种板后第13-14天,第7次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每1 孔传2孔,同时添加具有100-400u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
78.10.种板后第14-16天,第8次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每 1孔传2孔,同时添加具有100-400u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
79.11.种板后第16-18天,第9次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每 1孔传2孔,同时添加具有100-400u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
80.本实施例中调节性t细胞的扩培液按体积份数比计,各组分以体积的方式计量加入,具体加入的量以体积份数为标准,体积份数即为各组分的体积比。调节性t细胞的扩培液包括无血清培养液70.54%-85.27%、4-羟乙基哌嗪乙磺酸缓冲液2.5%-5%、青霉素-链霉素溶液 1%-2%、l-谷氨酰胺1%-2%、50-100umol/l2-巯基乙醇0-1000u/ml重组白介素-2、50-200nmol/l 雷帕霉素、ab血清10%-20%。
81.无血清培养液可以是lonza公司的x-vivo 15w/o gent or phenol red,货号04-744q。 4-羟乙基哌嗪乙磺酸缓冲液可以是hyclone公司的hepes缓冲液,货号sh3023701。青霉素
‑ꢀ
链霉素溶液可以是gibco公司的penicillin streptomycin,15140122。l-谷氨酰胺可以是sigma公司的l-glutamine solution,货号g7513-100ml。2-巯基乙醇可以是millipore公司的1000x 2-mercaptoethanol,货号es-007-e。重组白介素-2可以是r&d公司的rhrhil-2,货号202-il-010。雷帕霉素可以是sigma公司的rapamycin,货号r8781-200ul。当然其他公司生产的相同产品同样可以使用。ab血清是美国gemini公司的,货号100-512。
82.上述扩培液视具体使用情况,配置方法稍有不同,如调节性t细胞复苏种板时,扩培液可预先将各组分完全混合好之后配制之间加入孔板内,扩培液可将除重组白介素-2外的组分混合的预混液加入,再加重组白介素-2。由于继代培养时每孔的重组白介素-2基本消耗完,因此在其每孔传2孔,每孔补入预混液,如每孔补入0.5ml预混液至每孔的溶液1ml。此时需按1ml扩培液的量加入相应的重组白介素-2。
83.上述扩培试验的标准如下:
84.复苏相同数量的脐血调节性t细胞分为以下各组:x-vivo培养液组(control)、扩培液组、扩培液添加il-2组(设不同浓度il-2处理组:treat 1:10-75u/ml;treat 2:50-150u/ml; treat 3:100-250u/ml;treat 4:200-600u/ml;treat 5:300-1000u/ml)、扩培液添加磁珠组。细胞种置48孔板中进行复苏,1
×
106细胞/孔/ml,36~38℃,4~6%的co2环境培养48小时检测细胞的存活率和细胞数,随后细胞按照已建立的扩增条件进行扩增。其中扩培液的配方为: 42.69份无血清培养液、1.25份4-羟乙基哌嗪乙磺酸缓冲液、0.5份青霉素-链霉素溶液、0.5 份l-谷氨酰胺、0.05份2-巯基乙醇、0.01154份重组白介素-2、0.001份雷帕霉素和5份ab 血清。
85.各组的起始调节性t细胞数目相同,均为1
×
106。对各组的调节性t细胞数进行计数,计数步骤具体为:取10μl细胞悬液置于ep管内,取90μl台盼蓝加于ep管内混匀。取10μl 在计数板上,快速操作和计数:(四角数目之和/4)
×
105个/ml*稀释倍数,线上细胞记上不记下,记左不计右。细胞死活通过台盼蓝染色和流式检测,蓝染和阳性细胞为死亡细胞。
86.细胞复苏48小时后,x-vivo培养液、扩培液、扩培液添加il-2(设不同浓度il-2处理组10-1000u)、扩培液添加磁珠各组的活细胞比例分别是control:72.54
±
12.6;medium: 84.89
±
6.73;il-2treat 1:91.96
±
6.57;il-2treat 2:93.71
±
4.36;il-2treat 3:90.62
±
11.44;il-2 treat 4:95.03
±
5.56;il-2treat 5:94.93
±
3.6;beads:86.85
±
9.5;各组的细胞数目(
×
106)分别是control:0.56
±
0.11;medium:0.68
±
0.081;il-2treat 1:0.94
±
0.26;il-2treat 2:0.84
±
0.083; il-2treat 3:0.92
±
0.197;il-2treat 4:1.05
±
0.32;il-2treat 5:0.91
±
0.21;beads:0.4
±
0.187,结果提示传统的直接磁珠刺激方法不适合冻存treg细胞的扩增,添加il-2的扩培液体外复苏 48小时能够保护细胞的活力,可见本技术的扩培液能明显促进脐血调节性t细胞的增殖能力,其中il-2浓度在200-600u/ml为适合。
87.添加il-2的扩培液组的调节性t细胞扩培21天时调节性t细胞总数为3
×
107,流式表型和功能检测结果表明扩增的调节性t细胞具有免疫抑制能力,符合临床研究的标准。
88.实验1、扩增后脐血调节性t细胞的表型稳定
89.1.取1孔调节性t细胞(5-10
×
105),加入0.9%生理盐水至5ml(常温),离心,20℃, *570rcf,5min,+8,-9。
90.2.采用perfix-nc kit试剂盒(货号pn b10825,公司beckman)对调节性t细胞进行表型,该试剂盒里有3个buffer,buffer1:fixative reagent,pn b10827-75tests-liquid; buffer2:permeabilizing reagent,pn b10828-75tests-liquid;buffer 3:final 10
×
solution,pnb10829-75tests-liquid。用枪头去除离心后的上清,剩余50μl-100μl液体,加入5μl buffer1液体和5μl fc block抗体,震荡(力度适中),常温避光孵育15min。
91.3.加入cd4、cd25及查到cd127抗体各5μl,震荡(力度适中),常温避光孵育15~30min。
92.4.加入稀释成工作液的buffer3(buffer3:水=1:9)3ml,离心,20℃,*570rcf,5min,+8,
ꢀ‑
9。
93.5.流式上机检测,流式结果表明扩增18天cd4
+
cd25
+
cd127-细胞比例为97.07+2.03, cd3+cd8+细胞的比例为4.69+2.0,调节性t细胞的质量达到临床研究的标准。
94.实验2、扩增后脐血调节性t细胞明显抑制攻击性t细胞的增殖能力
95.1.复苏攻击性t细胞cd4(+)cd25(-)t细胞,取1
×
106个细胞。
96.2.无血清培养基1ml重悬细胞(1
×
106个细胞)。
97.3.每1ml中加入1μlcelltracestocksolution(celltrace
tm
cfse细胞增殖试剂盒(celltrace
tm
cfsecellproliferationkit),货号:c34554;thermofisherscientific公司。此试剂盒包含十份一次性瓶装的celltrace
tm
cfse(componenta),cfse(羧基荧光素二醋酸盐琥珀酰亚胺酯)和1份瓶装的dmso(componentb),dmso(二甲基亚砜),celltracestocksolution是指按照试剂盒说明书配置的混合液用于对细胞进行cfse染色:18uldmso+1份瓶装celltrace
tm
cfse。详见https://www.thermofisher.com/order/catalog/product/c34554)
98.4.37℃避光孵育20min。
99.5.加入5ml洗涤液(无血清培养液+10%fbs(牛胎血清))。
100.6.37℃避光孵育5min。
101.7.离心20℃,*290rcf,10min,+8,-9。
102.8.37℃预热的培养基(无血清培养液+10%fbs)重悬细胞。
103.9.取一孔调节性t细胞(treg细胞),去除磁珠,计数,离心,20℃,*290rcf,10min,+8,-9。
104.10.1
×
106个treg细胞在37℃预热的培养基(无血清培养液+10%fbs)重悬细胞。
105.11.将cd4(+)cd25-t细胞数目:调节性t细胞数目按照1:1;2:1;4:1(每孔供200μl,加3μl磁珠)的密度种植与96孔板中进行共培养。单独羧基荧光素二醋酸盐琥珀酰亚胺酯(cfse)处理的cd4(+)cd25-t细胞设为阴性对照组,cfse处理的cd4(+)cd25-t细胞组(磁珠刺激)设为阳性对照组。
106.12.流式检测脐血调节性t细胞的抑制功能。
107.13.cfse实验结果显示cd4(+)cd25-t:treg数目比率分别为1,2,4:1共培养时,cd4(+)cd25-t增殖被抑制率分别为77.27
±
15.5%、74.53
±
18.36%、74
±
17.1%、72.34
±
14.1%。结果表明扩增后的脐血调节性t细胞能明显抑制攻击性t细胞的增殖能力。
108.三、扩增后的调节性t细胞的冻存和复苏
109.1.收集扩增14-21天的调节性t细胞于含有扩培液的离心管中,离心完成后,去上清液,弹散细胞,加入0.9%的生理盐水,取10μl进行计数。剩余的加0.9%生理盐水至40ml定容再次离心,离心条件:20℃,*290rcf,10min,+8,-9。其中计数步骤具体为:将所取细胞液置于ep管内,取90μl台盼蓝加于ep管内混匀。取10μl在计数板上,快速操作和计数:(四角数目之和/4)
×
105个/ml*稀释倍数,线上细胞记上不记下,记左不计右。
110.2.离心完成后,去上清液,最后一点可以用移液枪(1000μl)尽可能吸尽,弹散细胞,缓慢滴加3ml冻存液至细胞内,轻轻吹匀,再将剩下的冻存液加入,吹匀,以4ml/管细胞液加入到5ml冻存管内,程序降温至-80度后转移至液氮罐中。其中冻存液的配置方法包括:90%自体血浆和dmso,根据细胞数5-10
×
106/ml配制冻存液,配方(10%dmso+90%ab血清)/ml,共配置40ml冻存液。配制时先加自体血浆再慢慢滴加dmso,取dmso时从底部往上抽加,以防其凝固,全程避光、冰上操作。
111.3.从液氮罐中取出冻存细胞的冻存管,迅速置于37℃水浴箱进行复苏。用无血清培养液对细胞进行重悬至15ml离心管中,同步骤1的方法进行细胞计数,然后进行离心:离
心条件: 20℃,*150rcf-*390rcf,10min,+8,-9。
112.4.按照2-8
×
105/ml细胞种植于48孔板中,第0天每孔加含10-2000u/ml的rhil-2的扩培液0.5ml,37℃,5%co2浓度培养。
113.5.种板后第1-3天(24h-72h)后,台盼蓝检测细胞的活率和数目(详细方法见上“一、脐血调节性t细胞制备”第四点),见图1-图4。每孔细胞增加0.5ml-1ml扩培液,同时添加磁珠(磁珠数:细胞数=1:1)和100-400u/ml的rhil-2,在37℃、5%co2浓度下培养。
114.6.种板后第3-4天,第1次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每1 孔传2孔,同时添加具有100-400u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。添加后每孔的扩培液1ml,rhil-2的加入量以1ml的扩培液的含量加入,其余步骤的 rhil-2加入量与该步骤相同。
115.7.种板后第5-6天,第2次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每1 孔传2孔,同时添加具有100-400u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
116.8.种板后第7-10天,第3次传代:先去除培养皿中的抗cd3cd28磁珠,再添加洗净的新抗cd3cd28磁珠(按照磁珠:调节性t细胞的数目=1:1),在37℃、5%co2浓度下培养。
117.9.种板后第10-11天,第4次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每1 孔传2孔,同时添加具有100-1000u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
118.10.种板后第11-12天,第5次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每 1孔传2孔,同时添加具有100-1000u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
119.11.种板后第12-13天,第6次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每 1孔传2孔,同时添加具有100-1000u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
120.12.种板后第13-14天,第7次传代:吸除0.5ml扩培液,将剩余的扩培液混匀细胞,每 1孔传2孔,同时添加具有100-1000u/ml的rhil-2的扩培液至1ml,在37℃、5%co2浓度下培养。
121.实验3、二次扩增后脐血调节性t细胞的表型稳定
122.1.取1孔调节性t细胞(5-10
×
105),加入0.9%生理盐水至5ml(常温),离心,20℃, *570rcf,5min,+8,-9。
123.2.采用perfix-nc kit试剂盒(货号pn b10825,公司beckman)对调节性t细胞进行表型,该试剂盒里有3个buffer,buffer1:fixative reagent,pn b10827-75tests-liquid; buffer2:permeabilizing reagent,pn b10828-75tests-liquid;buffer 3:final 10
×
solution,pnb10829-75tests-liquid。用枪头去除离心后的上清,剩余50μl-100μl液体,加入5μl buffer1液体和5μl fc block抗体,震荡(力度适中),常温避光孵育15min。
124.3.加入cd4、cd25及cd127抗体各5μl,震荡(力度适中),常温避光孵育15~30min。
125.4.加入稀释成工作液的buffer3(buffer3:水=1:9)3ml,离心,20℃,*570rcf,5min,+8,
ꢀ‑
9。
126.5.流式上机检测,流式结果表明扩增cd4
+
cd25
+
cd127-细胞比例为99.6+0.15, cd3
+
cd8
+
细胞的比例为小于5%,调节性t细胞的质量达到临床研究的标准,检测结果参见图5。
127.实验4、二次扩增后脐血调节性t细胞明显抑制攻击性t细胞的增殖能力
128.1.复苏攻击性t细胞cd4(+)cd25(-)t细胞,取1
×
106个细胞。
129.2.无血清培养基1ml重悬细胞(1
×
106个细胞)。
130.3.每1ml中加入1μl cell trace stock solution(celltrace
tm cfse细胞增殖试剂盒(celltrace
tm cfse cell proliferation kit),货号:c34554;thermofisher scientific公司。此试剂盒包含十份一次性瓶装的celltrace
tm cfse(componenta),cfse(羧基荧光素二醋酸盐琥珀酰亚胺酯)和1份瓶装的dmso(component b),dmso(二甲基亚砜),cell trace stocksolution是指按照试剂盒说明书配置的混合液用于对细胞进行cfse染色:18uldmso+1份瓶装celltrace
tm cfse。详见https://www.thermofisher.com/order/catalog/product/c34554)。
131.4.37℃避光孵育20min。
132.5.加入5ml洗涤液(无血清培养液+10%fbs(牛胎血清))。
133.6.37℃避光孵育5min。
134.7.离心20℃,*290rcf,10min,+8,-9。
135.8.37℃预热的培养基(无血清培养液+10%fbs)重悬细胞。
136.9.取一孔调节性t细胞(treg细胞),去除磁珠,计数,离心,20℃,*290rcf,10min, +8,-9。
137.10.1
×
106个treg细胞在37℃预热的培养基(无血清培养液+10%fbs)重悬细胞。
138.11.将cd4(+)cd25-t细胞数目:调节性t细胞数目按照1:1;2:1;4:1(每孔供200μl,加3μl磁珠)的密度种植与96孔板中进行共培养。单独羧基荧光素二醋酸盐琥珀酰亚胺酯 (cfse)处理的cd4(+)cd25-t细胞设为阴性对照组,cfse处理的cd4(+)cd25-t细胞组 (磁珠刺激)设为阳性对照组。
139.12.流式检测脐血调节性t细胞的抑制功能。
140.13.cfse实验结果显示cd4(+)cd25-t:treg数目比率分别为1,2,4:1共培养时, cd4
(+)
cd25-t增殖被抑制率分别为91.36
±
4.1%、83.2
±
7.4%、63
±
17.4%。结果表明二次扩增后的脐血调节性t细胞能明显抑制攻击性t细胞的增殖能力参见图6。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1