一种人工培养黏菌孢子形成原生质团的培养方法
1.本发明涉及微生物领域,特别是涉及一种人工培养黏菌孢子形成原生质团的培养方法。
背景技术:
2.黏菌隶属于原生生物界protista,变形虫门amoebozoa,黏菌纲myxogastria,是变形虫门下物种最丰富的群体。一般生长在潮湿阴暗处,黏菌主要应用于农业、科研领域,由于黏菌兼具了“动物”与“植物”的特征,因此,黏菌成为了动物界和植物界的联系纽带,是研究真核生物系统演化的模式生物,如多头绒泡菌physarum polycephalum schwein.常用于研究细胞生物学和发育生物学中细胞周期调控、细胞分化、细胞融合、dna复制及发育过程中的基因表达、组蛋白修饰等。
3.同时随着蘑菇产业的发展,黏菌成为蘑菇病害之一,已发现受害食用菌为平菇、香菇、草菇、木耳、羊肚菌、茶树菇,例如木耳“流耳”现象,黏菌还对铁皮石斛的生产采收造成危害,使农民经济受到极大损失。因此萌发黏菌孢子形成原质团,对开展细胞生物学、遗传学、以及经济作物病害等研究至关重要。但是根据目前研究发现,对于可萌发黏菌的种类,主要集中在绒泡菌目黏菌中,在团毛菌目黏菌中较少,据统计有9种被培养,仅占黏菌总物种数4.69%,在无丝菌目黏菌中更少,只有7种被培养,占总物种数的4.43%。
4.而针对部分无丝菌目、发网菌目、绒泡菌目和团毛菌目的黏菌尚未被研究者通过常规方法培养出来,因此,本发明拟设计一种新的人工培养方法,以解决常规方法无法培养获得部分无丝菌目、发网菌目、绒泡菌目和团毛菌目黏菌原生质团的技术问题,为后续科学研究奠定基础。
技术实现要素:
5.本发明的目的是提供一种人工培养黏菌孢子形成原生质团的培养方法,以解决上述现有技术存在的问题,该方法首次获得灯笼菌c.cancellata,半网灯笼菌c.mirabilis,孔膜菌r.splendens,美发菌c.pulchella和凹斑亮皮菌l.gulielmae的原生质团,缩短了部分萌发无丝菌目和发网菌目黏菌的时间,同时提高了部分无丝菌目和发网菌目黏菌孢子形成原质团的萌发率,为开展科学研究奠定基础。
6.为实现上述目的,本发明提供了如下方案:
7.本发明提供一种人工培养黏菌孢子形成原生质团的培养方法,将黏菌孢子悬浮液进行暗培养,至形成游动胞或黏变形体时,向其中加入细菌培养物,继续暗培养至形成合子,之后将其转移至燕麦琼脂培养基中进行培养,得到黏菌的原生质团。
8.进一步地,所述细菌培养物包括大肠杆菌,其浓度为1
×
107cfu/ml,加入量为10-20μl。
9.进一步地,所述黏菌孢子悬浮液的浓度为2
×
10
5-5
×
106个/ml,其通过将黏菌子实体加入反渗透水中制得。
10.进一步地,所述暗培养的温度为19-24℃,其培养至形成游动胞或黏变形体的时间为0.5-3d,加入细菌培养物,继续暗培养至形成合子的时间为3-8d。
11.进一步地,所述培养的条件为:19-24℃避光培养4-35d。
12.进一步地,所述燕麦琼脂培养基按以下步骤制得:将灭菌的燕麦粉散落在灭菌后凝固的水琼脂培养基表面,获得所述燕麦琼脂培养基。
13.进一步地,所述燕麦粉的加入量为20-200mg。
14.进一步地,所述黏菌包括灯笼菌cribraria cancellata、半网灯笼菌cribraria mirabilis、孔膜菌reticularia splendens、美发菌comatricha pulchella、凹斑亮皮菌lamproderma gulielmae、黑柄钙皮菌didymium nigripes、圈绒泡菌physarum gyrosum、鳞钙皮菌didymium squamulosum或灰团网菌arcyria cinerea。
15.本发明公开了以下技术效果:
16.本发明首次获得灯笼菌c.cancellata,半网灯笼菌c.mirabilis,孔膜菌r.splendens,美发菌c.pulchella,凹斑亮皮菌l.gulielmae的原生质团,缩短了部分萌发无丝菌目和发网菌目黏菌的时间,同时提高了部分无丝菌目和发网菌目黏菌孢子形成原质团的萌发率。并且本发明所用原料易得,成本低,培养过程简单易操作,易于推广应用。
附图说明
17.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
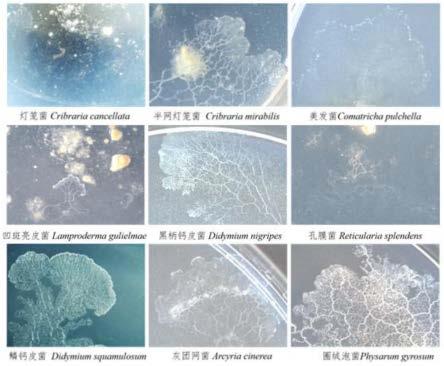
18.图1为9种黏菌形成的原生质团图;
19.图2为半网灯笼菌c.mirabilis在实验组和对照组1-3的培养基的生长状况对比图;a:培养0d;b:培养4d。
具体实施方式
20.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
21.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
22.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
23.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多
种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本发明说明书和实施例仅是示例性的。
24.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
25.1实验方法
26.1.1实验材料:灯笼菌cribraria cancellata,半网灯笼菌cribraria mirabilis,孔膜菌reticularia splendens,美发菌comatricha pulchella,凹斑亮皮菌lamproderma gulielmae,黑柄钙皮菌didymium nigripes,圈绒泡菌physarum gyrosum,鳞钙皮菌didymium squamulosum和灰团网菌arcyria cinerea,均由课题组前期研究采集获得,保存于吉林农业大学食药用菌教育部工程研究中心标本馆;大肠杆菌(atcc25922,由上海鲁微科技有限公司提供)。
27.1.2实验仪器:2ml ep管,反渗透水(ro水),镊子,培养皿,载玻片,血球计数板,温度计,燕麦粉(下述培养方法中,其加入量为20-200mg),水琼脂培养基,lb液体培养基,10μl移液枪,1000μl移液枪,光学显微镜,培养箱,分光光度计,高压灭菌器。
28.1.3培养方法
29.1.3.1培养灯笼菌c.cancellata形成原生质团
30.(1)吸取1000-1700μl反渗透水,加入到2ml ep管中。
31.(2)用镊子夹取黏菌子实体,放入2ml ep管中,并用镊子尖轻轻研磨使其释放孢子,形成孢子悬浮液,悬浮液浓度为2
×
10
5-5
×
106个/ml。
32.(3)制成孢子悬浮液后避光暗培养,培养温度24℃,培养时间为0.5-1d。
33.(4)培养0.5-1d后,形成黏菌的游动胞或黏变形体时加入大肠杆菌,大肠杆菌的浓度为1
×
107cfu/ml,加入大肠杆菌的体积为10μl。
34.(5)在加入大肠杆菌后继续避光培养4-8d,经减数分裂形成合子。
35.(6)水琼脂培养基经高压灭菌后,倒平板,静置凝固后加入灭菌的燕麦粉,使燕麦粉零星散落在培养基表面,备用。
36.(7)轻轻混匀步骤(5)培养后的孢子悬液,并将其转移至培养基中,放入培养箱避光培养,培养温度为19-23℃,培养时间为8-12d,电镜观察,得到树枝状分支的隐性原质团(见图1)。
37.1.3.2培养半网灯笼菌c.mirabilis形成原生质团
38.(1)吸取1000-1700μl反渗透水,加入到2ml ep管中。
39.(2)用镊子夹取黏菌子实体,放入2ml ep管中,并用镊子尖轻轻研磨使其释放孢子,形成孢子悬浮液,悬浮液浓度为2
×
10
5-5
×
106个/ml。
40.(3)制成孢子悬浮液后避光暗培养,培养温度24℃,培养时间为2-3d。
41.(4)培养2-3d后,形成黏菌的游动胞或黏变形体时加入大肠杆菌,大肠杆菌的浓度为1
×
107cfu/ml,加入大肠杆菌的体积为15μl。
42.(5)在加入大肠杆菌后继续避光培养5d,经减数分裂形成合子。
43.(6)水琼脂培养基经高压灭菌后,倒平板,静置凝固后加入灭菌的燕麦粉,使燕麦粉零星散落在培养基表面,备用。
44.(7)轻轻混匀步骤(5)培养后的孢子悬液,并将其转移至培养基中,放入培养箱避
光培养,培养温度为19-23℃,培养时间为4d,电镜观察,得到半圆形扇面的显性原质团(见图1)。
45.1.3.3培养美发菌c.pulchella形成原生质团
46.(1)吸取1000-1700μl反渗透水,加入到2ml ep管中。
47.(2)用镊子夹取黏菌子实体,放入2ml ep管中,并用镊子尖轻轻研磨使其释放孢子,形成孢子悬浮液,悬浮液浓度为2
×
10
5-5
×
106个/ml。
48.(3)制成孢子悬浮液后避光暗培养,培养温度23℃,培养时间为1d。
49.(4)培养1d后,形成黏菌的游动胞或黏变形体时加入大肠杆菌,大肠杆菌的浓度为1
×
107cfu/ml,加入大肠杆菌的体积为10μl。
50.(5)在加入大肠杆菌后继续避光培养3d,经减数分裂形成合子。
51.(6)水琼脂培养基经高压灭菌后,倒平板,静置凝固后加入灭菌的燕麦粉,使燕麦粉零星散落在培养基表面,备用。
52.(7)轻轻混匀步骤(5)培养后的孢子悬液,并将其转移至培养基中,放入培养箱避光培养,培养温度为23℃,培养时间为35d,电镜观察,得到半圆形扇面的显性原质团(见图1)。
53.1.3.4培养凹斑亮皮菌l.gulielmae形成原生质团
54.(1)吸取1000-1700μl反渗透水,加入到2ml ep管中。
55.(2)用镊子夹取黏菌子实体,放入2ml ep管中,并用镊子尖轻轻研磨使其释放孢子,形成孢子悬浮液,悬浮液浓度为2
×
10
5-5
×
106个/ml。
56.(3)制成孢子悬浮液后避光暗培养,培养温度24℃,培养时间为2-3d。
57.(4)培养2-3d后,形成黏菌的游动胞或黏变形体时加入大肠杆菌,大肠杆菌的浓度为1
×
107cfu/ml,加入大肠杆菌的体积为10μl。
58.(5)在加入大肠杆菌后继续避光培养5d,经减数分裂形成合子。
59.(6)水琼脂培养基经高压灭菌后,倒平板,静置凝固后加入灭菌的燕麦粉,使燕麦粉零星散落在培养基表面,备用。
60.(7)轻轻混匀步骤(5)培养后的孢子悬液,并将其转移至培养基中,放入培养箱避光培养,培养温度为19-23℃,培养时间为9d,电镜观察,得到不规则网状的显性原质团(见图1)。
61.1.3.5培养黑柄钙皮菌d.nigripes形成原生质团
62.(1)吸取1000-1700μl反渗透水,加入到2ml ep管中。
63.(2)用镊子夹取黏菌子实体,放入2ml ep管中,并用镊子尖轻轻研磨使其释放孢子,形成孢子悬浮液,悬浮液浓度为2
×
10
5-5
×
106个/ml。
64.(3)制成孢子悬浮液后避光暗培养,培养温度22℃,培养时间为0.5-1d。
65.(4)培养0.5-1d后,形成黏菌的游动胞或黏变形体时加入大肠杆菌,大肠杆菌的浓度为1
×
107cfu/ml,加入大肠杆菌的体积为10μl。
66.(5)在加入大肠杆菌后继续避光培养4-8d,经减数分裂形成合子。
67.(6)水琼脂培养基经高压灭菌后,倒平板,静置凝固后加入灭菌的燕麦粉,使燕麦粉零星散落在培养基表面,备用。
68.(7)轻轻混匀步骤(5)培养后的孢子悬液,并将其转移至培养基中,放入培养箱避
光培养,培养温度为19-23℃,培养时间为5d,电镜观察,得到扇形的显性原质团(见图1)。
69.1.3.6培养孔膜菌r.splendens形成原生质团
70.(1)吸取1000-1700μl反渗透水,加入到2ml ep管中。
71.(2)用镊子夹取黏菌子实体,放入2ml ep管中,并用镊子尖轻轻研磨使其释放孢子,形成孢子悬浮液,悬浮液浓度为2
×
10
5-5
×
106个/ml。
72.(3)制成孢子悬浮液后避光暗培养,培养温度23℃,培养时间为0.5-1d。
73.(4)培养0.5-1d后,形成黏菌的游动胞或黏变形体时加入大肠杆菌,大肠杆菌的浓度为1
×
107cfu/ml,加入大肠杆菌的体积为20μl。
74.(5)在加入大肠杆菌后继续避光培养4-8d,经减数分裂形成合子。
75.(6)水琼脂培养基经高压灭菌后,倒平板,静置凝固后加入灭菌的燕麦粉,使燕麦粉零星散落在培养基表面,备用。
76.(7)轻轻混匀步骤(5)培养后的孢子悬液,并将其转移至培养基中,放入培养箱避光培养,培养温度为19-23℃,培养时间为14d,电镜观察,得到半圆形的显性原质团(见图1)。
77.1.3.7培养鳞钙皮菌d.squamulosum形成原生质团
78.(1)吸取1000-1700μl反渗透水,加入到2ml ep管中。
79.(2)用镊子夹取黏菌子实体,放入2ml ep管中,并用镊子尖轻轻研磨使其释放孢子,形成孢子悬浮液,悬浮液浓度为2
×
10
5-5
×
106个/ml。
80.(3)制成孢子悬浮液后避光暗培养,培养温度23℃,培养时间为0.5-1d。
81.(4)培养0.5-1d后,形成黏菌的游动胞或黏变形体时加入大肠杆菌,大肠杆菌的浓度为1
×
107cfu/ml,加入大肠杆菌的体积为10μl。
82.(5)在加入大肠杆菌后继续避光培养4-8d,经减数分裂形成合子。
83.(6)水琼脂培养基经高压灭菌后,倒平板,静置凝固后加入灭菌的燕麦粉,使燕麦粉零星散落在培养基表面,备用。
84.(7)轻轻混匀步骤(5)培养后的孢子悬液,并将其转移至培养基中,放入培养箱避光培养,培养温度为19-23℃,培养时间为13-15d,电镜观察,得到树状的显性原质团(见图1)。
85.1.3.8培养灰团网菌a.cinerea形成原生质团
86.(1)吸取1000-1700μl反渗透水,加入到2ml ep管中。
87.(2)用镊子夹取黏菌子实体,放入2ml ep管中,并用镊子尖轻轻研磨使其释放孢子,形成孢子悬浮液,悬浮液浓度为2
×
10
5-5
×
106个/ml。
88.(3)制成孢子悬浮液后避光暗培养,培养温度23℃,培养时间为1-3d。
89.(4)培养1-3d后,形成黏菌的游动胞或黏变形体时加入大肠杆菌,大肠杆菌的浓度为1
×
107cfu/ml,加入大肠杆菌的体积为10μl。
90.(5)在加入大肠杆菌后继续避光培养1-3d,经减数分裂形成合子。
91.(6)水琼脂培养基经高压灭菌后,倒平板,静置凝固后加入灭菌的燕麦粉,使燕麦粉零星散落在培养基表面,备用。
92.(7)轻轻混匀步骤(5)培养后的孢子悬液,并将其转移至培养基中,放入培养箱避光培养,培养温度为23℃,培养时间为27d,电镜观察,得到半圆形的显性原质团(见图1)。
93.1.3.9培养圈绒泡菌p.gyrosum形成原生质团
94.(1)吸取1000-1700μl反渗透水,加入到2ml ep管中。
95.(2)用镊子夹取黏菌子实体,放入2ml ep管中,并用镊子尖轻轻研磨使其释放孢子,形成孢子悬浮液,悬浮液浓度为2
×
10
5-5
×
106个/ml。
96.(3)制成孢子悬浮液后避光暗培养,培养温度20-22℃,培养时间为1d。
97.(4)培养1d后,形成黏菌的游动胞或黏变形体时加入大肠杆菌,大肠杆菌的浓度为1
×
107cfu/ml,加入大肠杆菌的体积为10μl。
98.(5)在加入大肠杆菌后继续避光培养1d,经减数分裂形成合子。
99.(6)水琼脂培养基经高压灭菌后,倒平板,静置凝固后加入灭菌的燕麦粉,使燕麦粉零星散落在培养基表面,备用。
100.(7)轻轻混匀步骤(5)培养后的孢子悬液,并将其转移至培养基中,放入培养箱避光培养,培养温度为19-23℃,培养时间为9d,电镜观察,得到扇形的显性原质团(见图1)。
101.1.3.10
102.以半网灯笼菌c.mirabilis为例,设计对照组,如下:
103.对照组1:1.3.2培养方法中不添加大肠杆菌,培养基不添加燕麦粉(-ec,-oats):培养4d后,培养基中只有零星存在的污染细菌存在,并没有发现原质团原基出现。
104.对照组2:1.3.2培养方法中不添加大肠杆菌,培养基中添加燕麦粉(-ec,+oats):培养4d后,培养基中细菌污染较严重,原质团不存在。
105.对照组3:1.3.2培养方法中添加大肠杆菌,培养基中不添加燕麦粉(+ec,-oats):培养4d后,培养基中出现原质团原基,较弱,数量少。
106.实验组:按1.3.2培养方法培养半网灯笼菌c.mirabilis(+ec,+oats),培养4d后,培养基中出现大量原质团原基,其中还存在活力旺盛,菌脉强壮的原质团。图2为在实验组和对照组1-3的培养基培养的半网灯笼菌c.mirabilis的状况;a:培养0d;b:培养4d。
107.根据图2结果可知,与对照组1-3相比,本发明通过添加黏菌培养物(包括细菌培养物:大肠杆菌,及淀粉类培养物:燕麦粉),其中以细菌培养物为主要培养物,淀粉类培养物为次要培养物,经有饲培养,先培养得到黏菌的游动胞和黏变形体,游动胞或黏变形体结合经减数分裂形成合子,随之形成原质团原基,其菌脉弱,后原基逐渐成熟、菌脉及其前缘加厚,得到活力旺盛的黏菌原质团。而对照组1-3,因黏菌培养物的种类调整或省略,导致黏菌萌发所需营养提供不足,使黏菌孢子结合形成合子的能力降低,进而致使原质团未形成或原基较弱不易形成。同时本发明培养方法中的反渗透水与常规方法的无菌水相比,不需经过灭菌,保留水中原有的无机盐离子成分,可进一步促进孢子萌发,提高其萌发成活率,缩短萌发时间。
108.综合上述,本发明相比于常规培养方法,首次获得灯笼菌c.cancellata,半网灯笼菌c.mirabilis,孔膜菌r.splendens,美发菌c.pulchella,凹斑亮皮菌l.gulielmae的原生质团,缩短了部分萌发无丝菌目和发网菌目黏菌的时间,同时提高了部分无丝菌目和发网菌目黏菌孢子形成原质团的萌发率。并且培养中所需原料易得,成本低,培养过程简单易操作,易于推广应用。
109.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出
的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1