作为ATX抑制剂的二环化合物的制作方法
作为atx抑制剂的二环化合物
1.本技术是pct国际申请日为2016年9月20日,pct国际申请号为 pct/ep2016/072243、中国国家申请号为201680032818.9、发明名称为《作为atx抑制剂的二环化合物》的申请的分案申请。
2.本发明涉及可用于哺乳动物中的治疗或预防的有机化合物,并且特别涉及自分泌运动因子(autotaxin)(atx)抑制剂,其是溶血磷脂酸(lpa)生产的抑制剂,并且因此是lpa水平和相关信号传导的调节剂,用于肾脏病症、肝脏病症、炎性病症、神经系统病症、呼吸系统病症、血管和心血管病症、纤维变性疾病、癌症、眼病症、代谢病症、胆汁淤积性(cholestatic)及其他形式的慢性瘙痒症(pruritus)以及急性和慢性器官移植排斥反应的治疗或预防。
3.本发明提供新型的式(i)的化合物
[0004][0005]
其中
[0006]
r1是取代的苯基、取代的苯基-c
1-6-烷基、取代的苯氧基-c
1-6-烷基、取代的苯基-c
2-6-烯基、取代的苯基-c
2-6-炔基、取代的吡啶基、取代的吡啶基-c
1-6-烷基、取代的吡啶基-c
2-6-烯基、取代的吡啶基-c
2-6-炔基、取代的噻吩基、取代的噻吩基-c
1-6-烷基、取代的噻吩基-c
2-6-烯基或取代的噻吩基-c
2-6-炔基,其中取代的苯基、取代的苯基-c
1-6-烷基、取代的苯氧基
ꢀ‑c1-6-烷基、取代的苯基-c
2-6-烯基、取代的苯基-c
2-6-炔基、取代的吡啶基、取代的吡啶基-c
1-6-烷基、取代的吡啶基-c
2-6-烯基、取代的吡啶基-c
2-6-炔基、取代的噻吩基、取代的噻吩基-c
1-6-烷基、取代的噻吩基-c
2-6-烯基和取代的噻吩基-c
2-6-炔基被r3、r4和r5取代;
[0007]
y是-oc(o)-或-c(o)-;
[0008]
w是-c(o)-、-s(o)
2-或-cr6r
7-;
[0009]
r2选自以下环系统:b、f、l、m、o、z、af、ag、ah、aj、an、 ao、ap、aq、ar、as、at、au和av:
[0010]
[0011][0012]
r3是卤素、羟基、氰基、c
1-6-烷基、c
1-6-烷氧基、c
1-6-烷氧基-c
1-6-烷基、卤代-c
1-6-烷氧基、卤代-c
1-6-烷基、羟基-c
1-6-烷基、c
3-8-环烷基、c
3-8
‑ꢀ
环烷基-c
1-6-烷基、c
3-8-环烷基-c
1-6-烷氧基、c
3-8-环烷氧基、c
3-8-环烷氧基
ꢀ‑c1-6-烷基、c
1-6-烷基氨基、c
1-6-烷基羰基氨基、c
3-8-环烷基羰基氨基、c
1-6
‑ꢀ
烷基四唑基、c
1-6-烷基四唑基-c
1-6-烷基或杂环烷基-c
1-6-烷氧基;
[0013]
r4和r5独立地选自h、卤素、羟基、氰基、c
1-6-烷基、c
1-6-烷氧基、 c
1-6-烷氧基-c
1-6-烷基、卤代-c
1-6-烷氧基、卤代-c
1-6-烷基、羟基-c
1-6-烷基、 c
3-8-环烷基、c
3-8-环烷基-c
1-6-烷基、c
3-8-环烷基-c
1-6-烷氧基、c
3-8-环烷氧基、c
3-8-环烷氧基-c
1-6-烷基、c
1-6-烷基羰基氨基、c
3-8-环烷基羰基氨基、 c
1-6-烷基四唑基、c
1-6-烷基四唑基-c
1-6-烷基或杂环烷基-c
1-6-烷氧基;
[0014]
r6是h或c
1-6-烷基;
[0015]
r7是h、c
1-6-烷基、卤素、卤代-c
1-6-烷基或c
1-6-烷氧基;
[0016]
r9是卤素、c
1-6-烷基或c
1-6-烷氧基;
[0017]
m、n、p和q独立地选自1或2;
[0018]
r是1、2或3;
[0019]
或药用盐。
[0020]
自分泌运动因子(atx)是一种也称作外核苷酸焦磷酸酶/磷酸二酯酶2 或溶血磷脂酶d的分泌型酶,其对于将溶血磷脂酰胆碱(lpc)转化为生物活性的信号传导分子溶血磷脂酸(lpa)而言是重要的。已经表明,血浆lpa 水平与atx活性良好地相关,并且因此相信atx是胞外lpa的重要来源。早期用原型atx抑制剂的实验已经证实了,这样的化合物能够抑
制在小鼠血浆中的lpa合成活性。在1970年代和1980年代早期进行的工作证明了,lpa可以引起各种各样的细胞响应;包括平滑肌细胞收缩、血小板活化、细胞增殖、趋化性等等。lpa经由向若干g蛋白偶联受体(gpcr)发出信号来介导它的效果;第一批成员最初被表示为edg(内皮细胞分化基因)受体或心室区基因-1(vzg-1),但现在称为lpa受体。现在,原型群由 lpa1/edg-2/vzg-1、lpa2/edg-4和lpa3/edg-7组成。最近,已有人描述了三种另外的lpa受体lpa4/p2y9/gpr23、lpa5/gpr92和lpa6/p2y5,它们与原型lpa1-3受体相比,更加紧密地与核苷酸选择性嘌呤能受体相关。atx-lpa信号传导轴涉及多种多样的生理和病理生理功能,包括例如,神经系统功能、血管发育、心血管生理学、繁殖、免疫系统功能、慢性炎症、肿瘤转移和进展、器官纤维变性及肥胖症(obesity)和/或其他代谢疾病如糖尿病(diabetes mellitus)。因此,提高的atx活性和/或提高的lpa水平、改变的lpa受体表达和改变的对lpa的响应可以有助于与atx/lpa 轴相关的大量不同的病理生理病症的引发、进展和/或结果。
[0021]
按照本发明,可以将式(i)的化合物或它们的药用盐和酯用于治疗或预防与自分泌运动因子的活性和/或溶血磷脂酸(lpa)的生物活性相关的疾病、障碍或病症。
[0022]
本文的式(i)的化合物或它们的药用盐和酯抑制自分泌运动因子活性,并且因此抑制lpa生产和调节lpa水平及相关的信号传导。本文所述的自分泌运动因子抑制剂可用作用于治疗或预防疾病或病症的药剂:在所述疾病或病症中,atx活性和/或lpa信号传导参与、涉及所述疾病的病原学或病理学,或者以其他方式与所述疾病的至少一种症状相关。atx-lpa 轴已经牵连于例如血管发生、慢性炎症、自体免疫疾病、纤维变性疾病、癌症和肿瘤转移和进展、眼病症、代谢病症如肥胖症和/或糖尿病、病症如胆汁淤积性或其他形式的慢性瘙痒症以及急性和慢性器官移植排斥反应中。
[0023]
本发明的目的是式(i)的化合物和它们的上述的盐和酯,以及它们作为治疗活性物质的用途,用于制备所述化合物的方法,中间体,药物组合物,含有所述化合物的药物,它们的药用盐或酯,所述化合物、盐或酯用于治疗或预防与atx活性和/或溶血磷脂酸(lpa)的生物活性相关的障碍或病症的用途,特别是治疗或预防肾脏病症、肝脏病症、炎性病症、神经系统病症、呼吸系统病症、血管和心血管病症、纤维变性疾病、癌症、眼病症、代谢病症、胆汁淤积性及其他形式的慢性瘙痒症以及急性和慢性器官移植排斥反应,以及所述化合物、盐或酯用于制备药物的用途,所述药物用于治疗或预防肾脏病症、肝脏病症、炎性病症、神经系统病症、呼吸系统病症、血管和心血管病症、纤维变性疾病、癌症、眼病症、代谢病症、胆汁淤积性及其他形式的慢性瘙痒症以及急性和慢性器官移植排斥反应。更特别地,本发明的目的是式(i)的化合物和它们的上述的盐和酯,以及它们作为治疗活性物质的用途,制备所述化合物的方法,中间体,药物组合物,含有所述化合物的药物,它们的药用盐或酯,所述化合物、盐或酯用于治疗或预防眼病症(另外特别是青光眼)的用途。
[0024]
术语“c
1-6-烷氧基”表示式-o-r’的基团,其中r’是c
1-6-烷基。c
1-6-烷氧基的实例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基和叔丁氧基。特别的实例是甲氧基。
[0025]
术语“c
2-6-烯基”表示具有至少一个双键的2至6个碳原子的一价直链或支链烃基。特别的实例是乙烯基。
[0026]
术语“c
1-6-烷氧基-c
1-6-烷基”表示这样的c
1-6-烷基,其中该c
1-6-烷基的氢原子中的至少一个被c
1-6-烷氧基代替。特别的实例是甲氧基甲基、甲氧基乙基、乙氧基甲基、乙氧
基乙基、异丙氧基甲基和异丙氧基乙基。
[0027]
术语“c
1-6-烷基”表示1至6个碳原子的一价直链或支链饱和烃基。c
1-6
‑ꢀ
烷基的实例包括甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基和戊基。特别的烷基包括甲基、乙基、异丙基、正丁基和仲丁基。
[0028]
术语“c
1-6-烷基氨基”表示式-nh-r’的基团,其中r’是c
1-6-烷基。特别的c
1-6-烷基氨基是式-nh-r’的基团,其中r’是叔丁基。
[0029]
术语“c
1-6-烷基羰基氨基”表示式-nh-c(o)-r’的基团,其中r’是c
1-6
‑ꢀ
烷基。特别的c
1-6-烷基羰基氨基是式-nh-c(o)-r’的基团,其中r’是叔丁基。
[0030]
术语“c
1-6-烷基四唑基”表示被一个c
1-6-烷基取代的四唑基。特别的 c
1-6-烷基四唑基是甲基四唑基。
[0031]
术语“c
1-6-烷基四唑基-c
1-6-烷基”表示这样的c
1-6-烷基,其中该c
1-6-烷基的氢原子中的一个被c
1-6-烷基四唑基代替。特别的实例是甲基四唑基甲基。
[0032]
术语“c
2-6-炔基”表示具有至少一个三键的2至6个碳原子的一价直链或支链烃基。
[0033]
术语“氨基”表示-nh2基团。
[0034]
术语“氨基磺酰基”表示-s(o)
2-nh2基团。
[0035]
术语“氰基”表示-c≡n基团。
[0036]
术语“c
3-8-环烷氧基”表示式-o-r’的基团,其中r’是c
3-8-环烷基。
[0037]
术语“c
3-8-环烷氧基-c
1-6-烷基”表示这样的c
1-6-烷基,其中该烷基的氢原子中的至少一个被c
3-8-环烷氧基代替。
[0038]
术语“c
3-8-环烷基”表示3至8个环碳原子的一价饱和单环或二环烃基。二环表示由具有两个共同碳原子的两个饱和碳环组成的环系统。单环环烷基的实例是环丙基、环丁基、环戊基、环己基或环庚基。二环c
3-8-环烷基的实例是二环[2.2.1]庚基或二环[2.2.2]辛基。特别的c
3-8-环烷基是环丙基。
[0039]
术语“c
3-8-环烷基-c
1-6-烷氧基”表示这样的c
1-6-烷氧基,其中该烷基的氢原子中的至少一个被c
3-8-环烷基代替。
[0040]
术语“c
3-8-环烷基-c
1-6-烷基”表示这样的c
1-6-烷基,其中该烷基的氢原子中的至少一个被c
3-8-环烷基代替。
[0041]
术语“c
3-8-环烷基羰基氨基”表示式-nh-c(o)-r’的基团,其中r’是c
3-8
‑ꢀ
环烷基。
[0042]
术语“卤代-c
1-6-烷氧基”表示这样的c
1-6-烷氧基,其中该烷氧基的氢原子中的至少一个已经被相同或不同的卤素原子代替。特别的实例是三氟甲氧基。
[0043]
术语“卤素”和“卤代”在本文中可互换地使用,并且表示氟、氯、溴或碘。特别的卤素是氯和氟。
[0044]
术语“卤代-c
1-6-烷基”表示这样的c
1-6-烷基,其中该c
1-6-烷基的氢原子中的至少一个已经被相同或不同的卤素原子代替。特别的实例是三氟甲基。
[0045]
术语“杂环烷基”表示4至9个环原子的单价饱和或部分不饱和单环或二环环系统,其包含1、2或3个选自n、o和s的环杂原子,其余的环原子是碳。二环表示由具有两个共同环原子的两个环组成的,即将两个环分开的桥是单键或一个或两个环原子的链。单环饱和杂环烷基的实例是 4,5-二氢-唑基、氧杂环丁基、氮杂环丁基、吡咯烷基、2-氧代-吡咯烷-3
‑ꢀ
基、四氢呋喃基、四氢-噻吩基、吡唑烷基、咪唑烷基、唑烷基、异唑烷基、噻唑烷基、
哌啶基、四氢吡喃基、四氢噻喃基、哌嗪基、吗啉基、硫代吗啉基、1,1-二氧代-硫代吗啉-4-基、氮杂环庚基、二氮杂环庚基、高哌嗪基或氧杂氮杂环庚基。二环饱和杂环烷基的实例是8-氮杂-二环[3.2.1] 辛基、奎宁环基、8-氧杂-3-氮杂-二环[3.2.1]辛基、9-氮杂-二环[3.3.1]壬基、 3-氧杂-9-氮杂-二环[3.3.1]壬基或3-硫杂-9-氮杂-二环[3.3.1]壬基。部分不饱和杂环烷基的实例是二氢呋喃基、咪唑啉基、二氢-唑基、四氢-吡啶基或二氢吡喃基。杂环烷基的特别的实例是四氢吡喃基。
[0046]
术语“杂环烷基-c
1-6-烷氧基”表示这样的c
1-6-烷氧基,其中该烷基的氢原子中的至少一个被杂环烷基代替。杂环烷基-c
1-6-烷氧基的特别的实例是四氢吡喃基-c
1-6-烷氧基,更特别的是四氢吡喃基甲氧基。
[0047]
术语“羟基”表示-oh基团。
[0048]
术语“羟基-c
1-6-烷基”表示这样的c
1-6-烷基,其中该烷基的氢原子中的一个被羟基代替。特别的实例是羟甲基和羟乙基。
[0049]
术语“苯氧基”表示式-o-r’的基团,其中r’是苯基。
[0050]
术语“苯氧基-c
1-6-烷基”表示这样的c
1-6-烷基,其中该烷基的氢原子中的一个被苯氧基代替。
[0051]
术语“苯基-c
2-6-烯基”表示这样的c
2-6-烯基,其中该烷基的氢原子中的一个被苯基代替。苯基-c
2-6-烯基的特别的实例是苯基乙烯基。
[0052]
术语“苯基-c
1-6-烷基”表示这样的c
1-6-烷基,其中该烷基的氢原子中的一个被苯基代替。苯基-c
1-6-烷基的特别的实例是苯基甲基和苯基乙基。
[0053]
术语“苯基-c
2-6-炔基”表示这样的c
2-6-炔基,其中该烷基的氢原子中的一个被苯基代替。
[0054]
术语“吡啶基-c
2-6-烯基”表示这样的c
2-6-烯基,其中该烷基的氢原子中的一个被吡啶基代替。
[0055]
术语“吡啶基-c
1-6-烷基”表示这样的c
1-6-烷基,其中该烷基的氢原子中的一个被吡啶基代替。吡啶基-c
1-6-烷基的特别的实例是吡啶基甲基,更特别是2-吡啶基甲基。
[0056]
术语“吡啶基-c
2-6-炔基”表示这样的c
2-6-炔基,其中该烷基的氢原子中的一个被吡啶基代替。
[0057]
术语“噻吩基-c
2-6-烯基”表示这样的c
2-6-烯基,其中该烷基的氢原子中的一个被噻吩基代替。
[0058]
术语“噻吩基-c
1-6-烷基”表示这样的c
1-6-烷基,其中该烷基的氢原子中的一个被噻吩基代替。
[0059]
术语“噻吩基-c
2-6-炔基”表示这样的c
2-6-炔基,其中该烷基的氢原子中的一个被噻吩基代替。
[0060]
术语“药用盐”是指保持游离碱或游离酸的生物学效用和性质的那些盐,它们不是在生物学或其他方面不适宜的。所述盐采用以下酸形成:无机酸如盐酸、氢溴酸、硫酸、硝酸、磷酸等,特别是盐酸,以及有机酸如乙酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸、n-乙酰半胱氨酸等。此外,可以通过向游离酸中加入无机碱或有机碱来制备这些盐。衍生自无机碱的盐包括但不限于钠盐、钾盐、锂盐、铵盐、钙盐、镁盐等。衍生自有机碱的盐
包括但不限于以下各项的盐:伯、仲和叔胺,取代的胺,包括天然存在的取代的胺、环胺和碱性离子交换树脂,如异丙胺,三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、赖氨酸、精氨酸、n-乙基哌啶、哌啶、聚亚胺树脂等。特别的式(i)的化合物的药用盐是盐酸盐、甲磺酸盐和柠檬酸盐。
[0061]“药用酯”是指通式(i)的化合物可以在官能团处衍生以提供能够在体内转化回母体化合物的衍生物。这样的化合物的实例包括生理学上可接受的且在代谢上不稳定的酯衍生物,如甲氧基甲酯,甲硫基甲酯和新戊酰氧基甲酯。另外,类似于在代谢上不稳定的酯,能够在体内生成通式(i)的母体化合物的通式(i)的化合物的任何生理上可接受的等价物都在本发明的范围内。
[0062]
术语“保护基团”(pg)表示这样的基团,在与其在合成化学中相关的传统含义中选择性地阻挡多官能化合物中的反应性位点以使得化学反应可以在另一个未保护的反应性位点选择性地进行。可以将保护基团在合适的点移除。示例性保护基团是氨基-保护基团、羧基-保护基团或羟基-保护基团。特别的保护基团是叔丁氧基羰基(boc)、苄氧基羰基(cbz)、芴基甲氧基羰基(fmoc)和苄基(bn)基团。进一步特别的保护基团是叔丁氧基羰基 (boc)和芴基甲氧基羰基(fmoc)基团。更特别的保护基团是叔丁氧基羰基 (boc)基团。
[0063]
缩写um表示微摩尔浓度且等价于符号μm。
[0064]
缩写ul表示微升且等价于符号μl。
[0065]
缩写ug表示微克且等价于符号μg。
[0066]
式(i)的化合物可以含有数个不对称中心,并且能够以以下形式存在:光学纯的对映异构体,对映异构体的混合物(诸如例如外消旋体),光学纯的非对映异构体,非对映异构体的混合物,非对映异构体的外消旋体或非对映异构体的外消旋体的混合物。
[0067]
根据cahn-ingold-prelog convention,不对称碳原子可以为“r”或“s”构型。
[0068]
本发明的还一个实施方案是根据本文所述的式(i)化合物及其药用盐或酯,特别是根据本文所述的式(i)化合物及其药用盐,更特别是根据本文所述的式(i)化合物。
[0069]
本发明的一个特别的实施方案提供了根据如本文所述的式(i)的化合物,其中
[0070]
r1是取代的苯基-c
1-6-烷基或取代的吡啶基,其中取代的苯基-c
1-6-烷基和取代的吡啶基-c
1-6-烷基被r3、r4和r5取代;
[0071]
y是-oc(o)-或-c(o)-;
[0072]
w是-c(o)-;
[0073]
r2选自以下环系统:o、aj、an和ao;
[0074]
r3是卤代-c
1-6-烷氧基或四氢吡喃基-c
1-6-烷氧基;
[0075]
r4是h或c
3-8-烷氧基;
[0076]
r5是h;
[0077]
r6是c
1-6-烷基;
[0078]
r9是卤素、c
1-6-烷基或c
1-6-烷氧基;
[0079]
m、n、p和q是1;
[0080]
或药用盐。
[0081]
本发明的另一个实施方案提供了根据如本文所述的式(i)的化合物,其中r1是取代的苯基-c
1-6-烷基或取代的吡啶基,其中取代的苯基-c
1-6-烷基和取代的吡啶基-c
1-6-烷
基被r3、r4和r5取代。
[0082]
本发明的一个特别的实施方案提供了根据如本文所述的式(i)的化合物,其中y是-c(o)-。
[0083]
本发明的另一个实施方案提供了根据如本文所述的式(i)的化合物,其中r2选自以下环系统:o、aj、an和ao。
[0084]
本发明的一个特别的实施方案提供了根据如本文所述的式(i)的化合物,其中r2选自以下环系统:aj和ao。
[0085]
本发明的另一个实施方案提供了根据如本文所述的式(i)的化合物,其中r3是卤代-c
1-6-烷氧基或四氢吡喃基-c
1-6-烷氧基。
[0086]
本发明的另一个实施方案提供了根据如本文所述的式(i)的化合物,其中r4是h或c
3-8-环烷基。
[0087]
本发明的另一个实施方案提供了根据如本文所述的式(i)的化合物,其中r5是h。
[0088]
本发明的另一个实施方案提供了根据如本文所述的式(i)的化合物,其中r6是c
1-6-烷基。
[0089]
本发明的另一个的实施方案提供了根据如本文所述的式(i)的化合物,其中r7是h。
[0090]
本发明的另一个实施方案提供了根据如本文所述的式(i)的化合物,其中r9是c
1-6-烷氧基。
[0091]
本发明的另一个实施方案提供了根据如本文所述的式(i)的化合物,其中m、n、p和q是1。
[0092]
本发明的一个特别的实施方案提供了根据如本文所述的式(i)的化合物,其中
[0093]
r1是取代的苯基-c
1-6-烷基或取代的吡啶基,其中取代的苯基-c
1-6-烷基和取代的吡啶基-c
1-6-烷基被r3、r4和r5取代;
[0094]
y是-c(o)-;
[0095]
w是-c(o)-;
[0096]
r2选自环系统aj和ao;
[0097]
r3是卤代-c
1-6-烷氧基或四氢吡喃基-c
1-6-烷氧基;
[0098]
r4是h或c
3-8-环烷基;
[0099]
r5是h;
[0100]
r6是c
1-6-烷基;
[0101]
r7是h;
[0102]
r9是c
1-6-烷氧基;
[0103]
m、n、p和q是1;
[0104]
或药用盐。
[0105]
如本文所述的式(i)的化合物的特别的实例选自:
[0106]
反式-5-(1h-苯并三唑-5-羰基)-3a-氟-六氢-吡咯并[3,4-c]吡咯-2-甲酸4
‑ꢀ
三氟甲氧基-苄酯;
[0107]
反式-5-(1h-苯并三唑-5-羰基)-3a-甲氧基-六氢-吡咯并[3,4-c]吡咯-2-甲酸4-三氟甲氧基-苄酯;
[0108]
反式-1-[5-(1h-苯并三唑-5-羰基)-3a-甲氧基-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-3-[4-(三氟甲氧基)苯基]丙-1-酮;
[0109]
反式-[5-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-羰基]-3a-甲氧基
ꢀ‑
3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-(1h-苯并三唑-5-基)甲酮;
[0110]
反式-5-(1h-苯并三唑-5-羰基)-3a-甲基-六氢-吡咯并[3,4-c]吡咯-2-甲酸 4-三氟甲氧基-苄酯;
[0111]
反式-5-[3a-甲氧基-2-[3-[4-(三氟甲氧基)苯基]丙酰基]-3,4,6,6a-四氢
ꢀ‑
1h-吡咯并[3,4-c]吡咯-5-羰基]-3-甲基-1h-苯并咪唑-2-酮;
[0112]
反式-5-[5-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-羰基]-3a-甲氧基
ꢀ‑
3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-羰基]-3-甲基-1h-苯并咪唑-2-酮;
[0113]
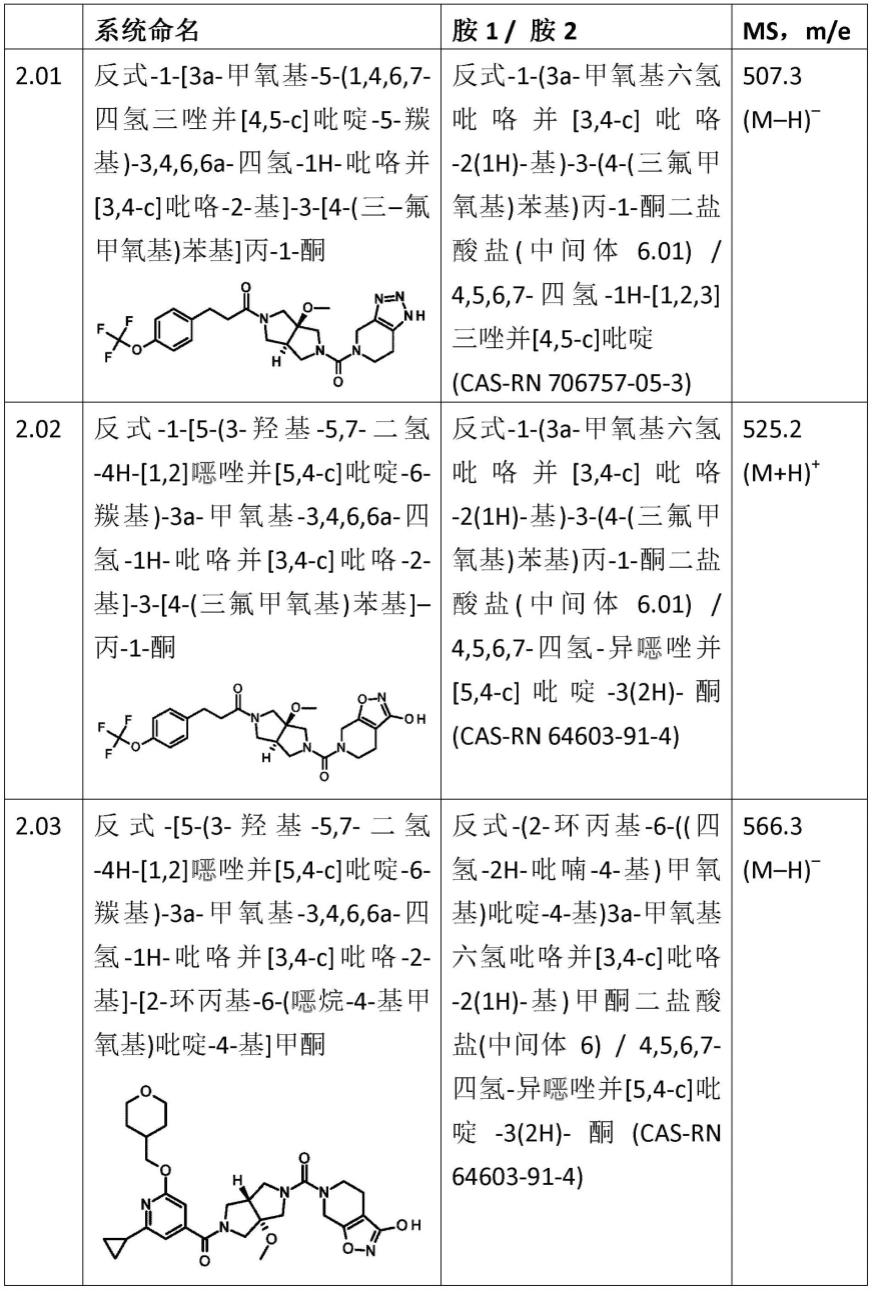
反式-[3a-甲氧基-5-(1,4,6,7-四氢三唑并[4,5-c]吡啶-5-羰基)-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-基] 甲酮;
[0114]
反式-1-[3a-甲氧基-5-(1,4,6,7-四氢三唑并[4,5-c]吡啶-5-羰基)-3,4,6,6a
‑ꢀ
四氢-1h-吡咯并[3,4-c]吡咯-2-基]-3-[4-(三氟甲氧基)苯基]丙-1-酮;
[0115]
反式-1-[5-(3-羟基-5,7-二氢-4h-[1,2]唑并[5,4-c]吡啶-6-羰基)-3a-甲氧基-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-3-[4-(三氟甲氧基)苯基]丙-1
‑ꢀ
酮;
[0116]
反式-[5-(3-羟基-5,7-二氢-4h-[1,2]唑并[5,4-c]吡啶-6-羰基)-3a-甲氧基-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-基]甲酮;
[0117]
反式-[3a-甲氧基-5-(1,4,6,7-四氢三唑并[4,5-c]吡啶-5-羰基)-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-基] 甲酮;
[0118]
反式-[5-(3-羟基-5,7-二氢-4h-[1,2]唑并[5,4-c]吡啶-6-羰基)-3a-甲氧基-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-基]甲酮;
[0119]
(+)-反式-5-(1h-苯并三唑-5-羰基)-3a-甲基-六氢-吡咯并[3,4-c]吡咯-2
‑ꢀ
甲酸4-三氟甲氧基-苄酯;
[0120]
(-)-反式-5-(1h-苯并三唑-5-羰基)-3a-甲氧基-六氢-吡咯并[3,4-c]吡咯-2
‑ꢀ
甲酸4-三氟甲氧基-苄酯;
[0121]
反式-[5-(3-羟基-5,7-二氢-4h-[1,2]唑并[5,4-c]吡啶-6-羰基)-3a-甲氧基-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-基]甲酮;
[0122]
(-)-反式-5-(1h-苯并三唑-5-羰基)-3a-甲基-六氢-吡咯并[3,4-c]吡咯-2-甲酸4-三氟甲氧基-苄酯;
[0123]
(+)-反式-5-(1h-苯并三唑-5-羰基)-3a-甲氧基-六氢-吡咯并[3,4-c]吡咯
ꢀ‑
2-甲酸4-三氟甲氧基-苄酯;
[0124]
及其药用盐。
[0125]
如本文所述的式(i)的化合物的进一步特别的实例选自:
[0126]
反式-1-[5-(1h-苯并三唑-5-羰基)-3a-甲氧基-3,4,6,6a-四氢-1h-吡咯并 [3,4-c]吡咯-2-基]-3-[4-(三氟甲氧基)苯基]丙-1-酮;
[0127]
反式-[5-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-羰基]-3a-甲氧基
ꢀ‑
3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-(1h-苯并三唑-5-基)甲酮;
[0128]
反式-[5-(3-羟基-5,7-二氢-4h-[1,2]唑并[5,4-c]吡啶-6-羰基)-3a-甲氧基-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-基]甲酮;
[0129]
及其药用盐。
[0130]
用于制备如本文所述的式(i)的化合物的方法是本发明的一个目的。
[0131]
本发明的式(i)的化合物的制备可以以顺序的或汇集的合成路线进行。本发明的合成显示在以下通用方案中。进行反应和所得产物的纯化所需的技能是本领域技术人员已知的。在反应过程中产生对映异构体或非对映异构体的混合物的情况下,可以通过本文描述的方法或者本领域技术人员已知的方法例如(手性)层析法或结晶法分离这些对映异构体或非对映异构体。以下方法的描述中使用的取代基和标志具有本文给出的含义。
[0132]
通式(i)的化合物可以使用本领域中熟知的方法合成自胺前体1和合适的试剂。
[0133]
本发明的式(i)的化合物的制备可以以顺序的或汇集的合成路线进行。本发明的合成显示在以下通用方案中。进行反应和所得产物的纯化所需的技能是本领域技术人员已知的。在反应过程中产生对映异构体或非对映异构体的混合物的情况下,可以通过本文描述的方法或者本领域技术人员已知的方法例如(手性)层析法或结晶法分离这些对映异构体或非对映异构体。以下方法的描述中使用的取代基和标志具有本文给出的含义。
[0134]
本发明提供新的式(i)的化合物
[0135][0136]
通式(i)的化合物可以使用本领域中熟知的方法合成自胺前体1和合适的试剂。
[0137][0138]
例如,使胺1与合适的式r
1-cooh(2)的羧酸反应,得到式(i)化合物,其中y是-c(o)-。该反应在偶联剂如1,1
′‑
羰基二咪唑、n,n
’‑
二环己基碳二亚胺、1-(3-二甲基氨基丙基)-3-乙基-碳二亚胺盐酸盐、o-(苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲(uronium)六氟-磷酸盐、o-(7-氮杂苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐或溴-三-吡咯烷基-六氟磷酸盐的存在下,在疏质子溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、n
‑ꢀ
甲基吡咯烷酮和它们的混合物中,在-40℃至80℃的温度,在存在或不存在碱如三乙胺、
二异丙基乙胺、4-甲基吗啉和/或4-(二甲基氨基)吡啶的情况下进行。
[0139]
也可以使胺1与合适的酰化试剂如式r
1-cocl(3)的酰氯反应,以得到式(i)化合物,其中y是-c(o)-。该反应在溶剂如二氯甲烷、四氢呋喃或 n,n-二甲基甲酰胺中,在碱如三乙胺或4-甲基吗啉存在下,在0℃至80℃的温度进行。
[0140]
备选地,使胺1与合适的式r
1-o-c(o)-cl(4)的氯甲酸酯或式(3)的咪唑-1-甲酸酯反应,得到式(i)的化合物,其中y是-oc(o)-。
[0141][0142]
该反应在合适的溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、乙腈、丙酮、水或其混合物中,在碱例如三乙胺、二异丙基乙胺、吡啶、碳酸氢钾、碳酸钾的存在下,在0℃至溶剂或溶剂混合物的沸点的温度进行。
[0143]
氯甲酸酯4是市售的,或可以通过与光气或光气等效物(例如二光气、三光气)反应由相应的式r
1-oh的醇合成,这如文献中所述。
[0144]
由相应的式r
1-oh的醇通过与1,1
′‑
羰基二咪唑反应来合成咪唑-1-甲酸酯5。该反应在溶剂如二氯甲烷、四氢呋喃或乙腈中在室温进行。典型地,不将咪唑-1-甲酸酯5分离而是直接与胺1如上所述反应。
[0145]
式r
1-oh的醇是市售的,或可以通过本文所述或本领域已知的方法制备。
[0146]
羧酸(2)和酰卤(3)是市售的,或可以如本文中或文献中所述制备。
[0147]
通式1的胺合成自适当保护的前体6。
[0148][0149]
合适的保护基(pg)是叔丁氧基羰基或苄氧基羰基。中间体6的去保护可以使用本领域中已知的方法和试剂进行。
[0150]
例如,在pg是苄氧基羰基的情况中,去保护可以通过在1巴至100 巴的压力下,在合适的催化剂如活性炭载钯的存在下,在20℃至150℃的温度,在溶剂如甲醇或乙醇中的氢化进行。
[0151]
备选地,在pg是叔丁氧基羰基的情况中,去保护可以在合适的酸,例如,盐酸或三氟乙酸的存在下,在溶剂如水、2-丙醇、二氯甲烷或1,4
‑ꢀ
二烷中,在0℃至30℃的温度进行。
[0152]
中间体6(其中a是n)由通式结构6a表示。
[0153]
[0154]
pg是合适的保护基,例如,叔丁氧基羰基或苄氧基羰基。
[0155]
中间体6a可以通过使用本领域中已知的方法与合适的试剂反应而制备自通式7的胺前体。
[0156][0157]
例如,将7与通式x-cr6r
7-r2(8)的烷基化剂(其中x是离去基团如cl、br、i或oso2ch3)反应,从而产生6a,其中w是-cr6r
7-。该反应在溶剂如四氢呋喃或n,n-二甲基甲酰胺中,在碱例如三乙胺或碳酸钾的存在下,在0℃至100℃的温度进行。
[0158]
备选地,对于其中w是-cr6r
7-,r6是氢、烷基或环烷基,并且r7是h的式6a的化合物,将胺7与通式r
6-c(o)-r2(9)的醛或酮在还原胺化反应中反应,从而产生6a。该反应在合适的还原剂例如硼氢化钠或三乙酰氧基硼氢化钠存在下,在溶剂如甲醇、乙酸、四氢呋喃、1,2-二氯乙烷或其混合物中,在0℃至50℃的温度进行。
[0159]
备选地,将胺7与合适的式r
2-cooh(10)的羧酸反应,从而产生式 6a的化合物,其中w是-c(o)-。该反应在偶联剂如1,1
′‑
羰基二咪唑、n,n
’‑ꢀ
二环己基碳二亚胺、1-(3-二甲基氨基丙基)-3-乙基-碳二亚胺盐酸盐、o-(苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐、o-(7-氮杂苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐或溴-三-吡咯烷基-六氟磷酸盐的存在下,在疏质子溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、n
‑ꢀ
甲基吡咯烷酮和它们的混合物中,在-40℃至80℃的温度,在存在或不存在碱如三乙胺、二异丙基乙胺、4-甲基吗啉和/或4-(二甲基氨基)吡啶的情况下进行。
[0160]
备选地,将胺7与合适的式r
2-so2cl(11)的磺酰氯反应,从而产生式 6a的化合物,其中w是-s(o2)-。该反应在合适的溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、乙腈、丙酮、水或其混合物中,在碱例如三乙胺、二异丙基乙胺、吡啶、碳酸氢钾、碳酸钾存在下,在0℃至溶剂或溶剂混合物的沸点的温度进行。
[0161]
备选地,将胺7与合适的式r
2-n(r
10
)-c(o)-cl(12)的n-(氯羰基)胺反应,从而产生式6a的化合物,其中w是-c(o)-nr
10-,或与式r
2-nco(13) 的异氰酸酯反应,从而产生式6a的化合物,其中w是-c(o)-nr
10-并且 r
10
是h。
[0162]
备选地,将胺7与光气或光气等效物(二光气、三光气),在碱(例如,吡啶、三乙胺)存在下,在溶剂如二氯甲烷或四氢呋喃中反应,从而提供相应的式14的n-(氯羰基)胺,然后将其与式hn(r
10
)r2(15)的胺,在碱如三乙胺或二异丙基乙胺存在下,在溶剂如二氯甲烷、四氢呋喃或n,n-二甲基甲酰胺中反应,从而产生式6a的化合物,其中w是-c(o)-nr
10-。
[0163][0164]
备选地,将胺7与光气或光气等效物(二光气、三光气),在碱(例如,吡啶、三乙胺)
六氟磷酸盐的存在下,在疏质子溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、n-甲基吡咯烷酮和它们的混合物中,在-40℃至80℃的温度,在存在或不存在碱如三乙胺、二异丙基乙胺、 4-甲基吗啉和/或4-(二甲基氨基)吡啶的情况下进行。
[0177]
羧酸18是市售的或可以如文献中所述地制备。
[0178]
式(i)的化合物(其中a是n)可以使用本领域中已知的方法由通式19的胺前体通过与合适的试剂反应而制备。
[0179][0180]
例如,将式19的胺与通式x-cr6r
7-r2(8)的烷基化剂(其中x是离去基团如cl、br、i或oso2ch3)反应,从而产生式(i)的化合物,其中a是 n和w是-cr6r
7-。该反应在溶剂如四氢呋喃或n,n-二甲基甲酰胺中,在碱例如三乙胺或碳酸钾存在下,在0℃至100℃的温度进行。
[0181]
备选地,将式19的胺与通式r
6-c(o)-r2(9)的醛或酮在还原胺化反应中反应,从而产生式(i)的化合物,其中a是n,w是-cr6r
7-,r6是氢、烷基或环烷基,并且r7是h。该反应在合适的还原剂例如硼氢化钠或三乙酰氧基硼氢化钠存在下,在溶剂如甲醇、乙酸、四氢呋喃、1,2-二氯乙烷或其混合物中,在0℃至50℃的温度进行。
[0182]
备选地,将胺19与合适的式r
2-cooh(10)的羧酸反应,从而产生式 (i)的化合物,其中a是n并且w是-c(o)-。该反应在偶联剂如1,1
′‑
羰基二咪唑、n,n
’‑
二环己基碳二亚胺、1-(3-二甲基氨基丙基)-3-乙基-碳二亚胺盐酸盐、o-(苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐、o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐或溴-三-吡咯烷基-六氟磷酸盐的存在下,在疏质子溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、n-甲基吡咯烷酮和它们的混合物中,在-40℃至80℃的温度,在存在或不存在碱如三乙胺、二异丙基乙胺、4-甲基吗啉和/或4-(二甲基氨基)吡啶的情况下进行。
[0183]
备选地,将胺19与合适的式r
2-so2cl(11)的磺酰氯反应,从而产生(i),其中a是n并且w是-s(o2)-。该反应在合适的溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、乙腈、丙酮、水或其混合物中,在碱例如三乙胺、二异丙基乙胺、吡啶、碳酸氢钾、碳酸钾存在下,在0℃至溶剂或溶剂混合物的沸点的温度进行。
[0184]
备选地,将胺19与合适的式r
2-n(r
10
)-c(o)-cl(12)的n-(氯羰基)胺反应,从而产生式(i)的化合物,其中w是-c(o)-nr
10-,或与式r
2-nco (13)的异氰酸酯反应,从而产生式(i)的化合物,其中w是-c(o)-nr
10-并且r
10
是h。该反应在合适的溶剂例如乙腈或n,n-二甲基甲酰胺中,任选地在碱例如二异丙基乙胺或三乙胺存在下,在0℃至100℃的温度进行。
[0185]
备选地,将胺19与合适的式r
2-o-c(o)-cl(16)的氯甲酸酯或咪唑-1
‑ꢀ
甲酸酯(17)反应,从而产生式(i)的化合物,其中w是-c(o)-o-。该反应在合适的溶剂例如乙腈或n,n-二甲基甲酰胺中,任选地在碱例如二异丙基乙胺或三乙胺存在下,在0℃至100℃的温度进行。
[0186]
备选地,将胺19与光气或光气等效物(二光气、三光气),在碱(例如,吡啶、三乙胺)存在下,在溶剂如二氯甲烷或四氢呋喃中反应,从而提供相应的式20的n-(氯羰基)胺,然后将其与式hn(r
10
)r2(15)的胺,在碱如三乙胺或二异丙基乙胺存在下,在溶剂如二氯甲烷、四
氢呋喃或n,n-二甲基甲酰胺中反应,从而产生式(i)的化合物,其中w是-c(o)-nr
10-。
[0187][0188]
备选地,将胺19与光气或光气等效物(二光气、三光气),在碱(例如,吡啶、三乙胺)存在下,在溶剂如二氯甲烷或四氢呋喃中反应,从而产生相应的式20的n-(氯羰基)胺,然后将其与式h-o或h-ao的胺,在碱如三乙胺或二异丙基乙胺存在下,在溶剂如二氯甲烷、四氢呋喃或n,n-二甲基甲酰胺中反应,从而产生式(i)的化合物,其中w是-c(o)-并且r2是o或 ao。
[0189]
胺19可以由式21的其氨基甲酸叔丁酯衍生物通过氨基甲酸酯去保护而合成。该去保护可以在合适的酸例如盐酸或三氟乙酸存在下,在溶剂如水、2-丙醇、二氯甲烷或1,4-二烷中,在0℃至30℃的温度进行。
[0190][0191]
氨基甲酸叔丁酯21可以使用本领域中熟知的方法合成自式22的胺前体和合适的试剂。
[0192][0193]
例如,将胺22与合适的式r
1-cooh(2)的羧酸反应,从而产生式21 的化合物,其中y是-c(o)-。该反应在偶联剂如1,1
′‑
羰基二咪唑、n,n
’‑ꢀ
二环己基碳二亚胺、1-(3-二甲基氨基丙基)-3-乙基-碳二亚胺盐酸盐、o-(苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐、o-(7-氮杂苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐或溴-三-吡咯烷基-六氟磷酸盐的存在下,在疏质子溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、n
‑ꢀ
甲基吡咯烷酮和它们的混合物中,在-40℃至80℃的温度,在存在或不存在碱如三乙胺、二异丙基乙胺、4-甲基吗啉和/或4-(二甲基氨基)吡啶的情况下进行。
[0194]
也可以将胺22与合适的酰化剂如式r
1-cocl(3)的酰基氯反应,以提供式21的化合物,其中y是-c(o)-。该反应在溶剂如二氯甲烷、四氢呋喃或n,n-二甲基甲酰胺中,在碱如三乙胺或4-甲基吗啉存在下,在0℃至80℃的温度进行。
[0195]
备选地,使胺22与合适的式r
1-o-c(o)-cl(4)的氯甲酸酯或式5的咪唑-1-甲酸酯反应,得到式21的化合物,其中y是-oc(o)-。该反应在合适的溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、乙腈、丙酮、水或其混合物中,在碱例如三乙胺、二异丙基乙胺、吡啶、碳酸氢钾、碳酸钾的存在下,在0℃至溶剂或溶剂混合物的沸点的温度进行。
[0196]
备选地,可以在碱(例如吡啶)的存在下,在合适的溶剂例如二氯甲烷中,在-78℃至+20℃的温度,可以使胺22与光气或光气等效物(例如三光气)反应以得到相应的n-氯羰基胺22a。然后将n-氯羰基胺22a与式 r
1-oh的醇反应,得到式21的化合物,其中y是-oc(o)-。该反应在合适的溶剂(例如乙腈或二氯甲烷)中,在合适的碱(例如氢化钠、吡啶或聚苯乙烯结合的2-叔丁基亚氨基-2-二乙氨基-1,3-二甲基全氢-1,3,2-二氮杂磷杂苯(diazaphosphorine)的存在下,在20℃至溶剂的沸点的温度下进行。
[0197][0198]
式22的胺是市售的或可以如本文或文献中所述的制备。
[0199]
式22的胺是市售的或可以如本文或文献中所述的制备。
[0200]
式(i)的化合物(其中a是ch并且w是-c(o)-nr
10-)可以由通式23的羧酸前体通过与合适的通式hn(r
10
)r2(15)的胺试剂反应而制备。类似地,式(i)的化合物(其中a是ch,w是c(o),并且r2是o或ao)可以使用本领域中已知的方法由通式19的羧酸前体通过与合适的通式h-o或 h-ao的胺试剂反应而制备。
[0201][0202]
例如,该反应在偶联剂如1,1
′‑
羰基二咪唑、n,n
’‑
二环己基碳二亚胺、 1-(3-二甲基氨基丙基)-3-乙基-碳二亚胺盐酸盐、o-(苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐、o-(7-氮杂苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐或溴-三-吡咯烷基-六氟磷酸盐的存在下,在疏质子溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、n
‑ꢀ
甲基吡咯烷酮和它们的混合物中,在-40℃至80℃的温度,在存在或不存在碱如三乙胺、二异丙基乙胺、4-甲基吗啉和/或4-(二甲基氨基)吡啶的情况下进行。
[0203]
式(i)的化合物(其中a是ch并且w是-c(o)-o-)可以使用本领域中已知的方法由通式23的羧酸前体通过与合适的通式r2-oh的醇反应而制备。
[0204]
例如,该反应在偶联剂如1,1
′‑
羰基二咪唑、n,n
’‑
二环己基碳二亚胺、 1-(3-二甲基氨基丙基)-3-乙基-碳二亚胺盐酸盐、o-(苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐、o-(7-氮杂苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐或溴-三-吡咯烷基-六氟磷酸盐的存在下,在疏质子溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、n
‑ꢀ
甲基吡咯烷酮和它们的混合物中,在-40℃至80℃的温度,在存在或不存在碱如三乙胺、二异丙基乙胺、4-甲基吗啉和/或4-(二甲基氨基)吡啶的情况下进行。
[0205]
备选地,该反应分两步进行,其中首先使用本领域中已知的方法和试剂如亚硫酰氯或草酰氯将羧酸19转化为酰氯24。然后将酰氯24与醇 r
2-oh在合适的溶剂例如二氯甲烷或乙腈中,任选地在催化剂例如吡啶或 4-(二甲基氨基)吡啶存在下,在-40℃至+100℃的
温度反应。
[0206][0207]
羧酸23可以使用本领域中已知的方法和试剂由相应的酯前体25(其中 ra是低级烷基,例如甲基或乙基)制备。例如,该反应在碱例如氢氧化钾、氢氧化钠或氢氧化锂存在下,在溶剂如水、甲醇、乙醇、四氢呋喃或其混合物中,在20℃至100℃的温度进行。
[0208][0209]
式25的化合物可以使用本领域中熟知的方法由式26的胺前体和合适的试剂合成。
[0210][0211]
例如,将胺21与合适的式r
1-cooh(2)的羧酸反应,从而产生式25 的化合物,其中y是-c(o)-。该反应在偶联剂如1,1
′‑
羰基二咪唑、n,n
’‑ꢀ
二环己基碳二亚胺、1-(3-二甲基氨基丙基)-3-乙基-碳二亚胺盐酸盐、o-(苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐、o-(7-氮杂苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐或溴-三-吡咯烷基-六氟磷酸盐的存在下,在疏质子溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、n
‑ꢀ
甲基吡咯烷酮和它们的混合物中,在-40℃至80℃的温度,在存在或不存在碱如三乙胺、二异丙基乙胺、4-甲基吗啉和/或4-(二甲基氨基)吡啶的情况下进行。
[0212]
也可以将胺25与合适的酰化剂如式r
1-cocl(3)的酰基氯反应而产生式26的化合物,其中y是-c(o)-。该反应在溶剂如二氯甲烷、四氢呋喃或n,n-二甲基甲酰胺中,在碱如三乙胺或4-甲基吗啉存在下,在0℃至 80℃的温度进行。
[0213]
备选地,使胺26与合适的式r
1-o-c(o)-cl(4)的氯甲酸酯或式5的咪唑-1-甲酸酯反应,得到式25的化合物,其中y是-oc(o)-。该反应在合适的溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、乙腈、丙酮、水或其混合物中,在碱例如三乙胺、二异丙基乙胺、吡啶、碳酸氢钾、碳酸钾的存在下,在0℃至溶剂或溶剂混合物的沸点的温度进行。
[0214]
备选地,可以在碱(例如吡啶)的存在下,在合适的溶剂例如二氯甲烷中,在-78℃至+20℃的温度,使胺26与光气或光气等效物(例如三光气)反应以得到n-氯羰基胺26a。然后将n-氯羰基胺26a与式r
1-oh的醇反应,得到式25的化合物,其中y是-oc(o)-。该反应在合适的溶剂 (例如乙腈或二氯甲烷)中,在合适的碱(例如氢化钠、吡啶或聚苯乙烯结合的2-叔丁基亚氨基-2-二乙氨基-1,3-二甲基全氢化-1,3,2-二氮杂磷杂苯 (diazaphosphorine))的存在下,在20℃至溶剂的沸点的温度下进行。
[0215][0216]
通式26的胺合成自合适保护的前体27。
[0217][0218]
合适的保护基(pg)是叔丁氧基羰基或苄氧基羰基。中间体27的去保护可以使用本领域中已知的方法和试剂进行。
[0219]
例如,在pg是苄氧基羰基的情况中,去保护可以通过在1巴至100 巴的压力,在合适的催化剂如活性炭载钯存在下,在20℃至150℃的温度,在溶剂如甲醇或乙醇中的氢化进行。
[0220]
备选地,在pg是叔丁氧基羰基的情况中,去保护可以在合适的酸例如盐酸或三氟乙酸存在下,在溶剂如水、2-丙醇、二氯甲烷或1,4-二烷中,在0℃至30℃的温度进行。
[0221]
酯27(其中ra是甲基或乙基)使用本领域中已知的方法和试剂制备自羧酸18。例如,将18分别用甲基碘或乙基溴,在碱例如碳酸钾存在下,在溶剂如n,n-二甲基甲酰胺中,在-20℃至+30℃烷基化,从而产生甲酯或乙酯27。
[0222]
同样的本发明的实施方案是用于制备如上所限定的式(i)的化合物的方法,所述方法包括式(ii)的化合物在式(iii)的化合物存在下的反应;
[0223][0224]
其中r1、r2、r9、m、n、p和q如以上所限定并且w是-c(o)-。
[0225]
特别地,所述反应在偶联剂如1,1
′‑
羰基二咪唑、n,n
’‑
二环己基碳二亚胺、1-(3-二甲基氨基丙基)-3-乙基-碳二亚胺盐酸盐、o-(苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐、o-(7-氮杂苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐或溴-三-吡咯烷基-六氟磷酸盐的存在下,特别是在o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟
‑ꢀ
磷酸盐的存在下,在疏质子溶剂如二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、n-甲基吡咯烷酮和它们的混合物中,特别是在n,n-二甲基甲酰胺中,在存在或不存在碱如三乙胺、二异丙基乙胺、4-甲基吗啉和/或4-(二甲基氨基)吡啶的情况下,特别是在存在4-甲基吗啉的情况下,在-78℃至回流的温度,特别是在-10℃至室温的温度进行。
[0226]
此外,本发明的一个目的是如本文所述的根据式(i)化合物,所述化合物用作治疗
(tuberous sclerosis)、纤维神经瘤(neurofibromatosis)、代谢存储障碍 (metabolic storage disorders)、家族性间质性肺病(familial interstitial lungdisease)),辐射引起的纤维变性,矽肺病,石棉引起的肺纤维变性(pulmonaryfibrosis)或急性呼吸窘迫综合征(acute respiratory distress syndrome) (ards)。
[0235]
神经系统病症包括,但是不限于,神经痛(neuropathic pain),精神分裂症(schizophrenia),神经炎症(neuro-inflammation)(例如星形胶质细胞增生 (astrogliosis)),外部和/或自发的(糖尿病)神经病(neuropathies)等。
[0236]
血管病症包括,但是不限于,动脉粥样硬化(atherosclerosis),血栓形成性血管疾病(thrombotic vascular disease)以及血栓形成性微血管病 (thrombotic microangiopathies),增生性动脉病(proliferative arteriopathy)(如被粘蛋白的细胞外基质包围的肿胀肌内膜细胞和小结增厚),动脉粥样硬化 (atherosclerosis),降低的血管顺应性(如刚性、降低的腔室顺应性和降低的血管顺应性),内皮机能障碍(endothelial dysfunction)等。
[0237]
心血管病症包括,但是不限于,急性冠状动脉综合征(acute coronarysyndrome),冠心病(coronary heart disease),心肌梗死(myocardial infarction),动脉的和肺部的高血压(hypertension),心率失常(cardiac arrhythmia)如心房颤动(atrial fibrillation),卒中(stroke)及其他血管损伤。
[0238]
纤维变性疾病包括,但是不限于心肌和血管纤维变性,肾纤维变性,肝纤维变性,肺纤维变性,皮肤纤维变性,硬皮病(scleroderma)和被囊性腹膜炎(encapsulating peritonitis)。
[0239]
癌症和癌症转移包括,但是不限于,乳腺癌、卵巢癌、肺癌、前列腺癌、间皮瘤(mesothelioma)、神经胶质瘤(glioma)、肝癌、肠胃癌和它们的进展和转移性侵占(metastatic aggressiveness)。
[0240]
眼病症包括,但是不限于,增殖性和非增殖性(糖尿病)视网膜病 (retinopathy)、干性和湿性老年黄斑退化(age-related macular degeneration) (amd)、黄斑水肿(macular edema)、主动脉/静脉闭塞(central arterial/venousocclusion)、外伤性损伤、青光眼(glaucoma)等。特别地,所述眼病症是青光眼。
[0241]
代谢病症包括,但是不限于,肥胖症和糖尿病。
[0242]
此外,本发明的一个实施方案是根据所述方法中任一种制备的如本文所述的式(i)化合物。
[0243]
测定步骤
[0244]
具有和不具有his标记的人全长atx的制备
[0245]
自分泌运动因子(atx-enpp2)克隆:cdna由商用人造血细胞总 rna制备,并且在重叠pcr中用作模板以产生具有或不具有3
’‑
6xhis标记的全长人enpp2 orf。将这些全长插入物克隆到pcdna3.1v5-histopo(invitrogen)载体中。检验若干个单克隆的dna序列。来自正确全长克隆的dna用于转染hek293细胞以检验蛋白表达。编码enpp2的序列符合swissprot条目q13822,具有或不具有额外的c-末端6xhis标记。
[0246]
atx发酵:通过在20l受控的搅拌槽生物反应器(sartorius)中大规模瞬时转染制备重组的蛋白。在细胞生长和转染期间,将温度、搅拌速度、 ph和溶解氧浓度分别保持在37
℃、120rpm、7.1和30%do。在freestyle293培养基(invitrogen)中悬浮培养freestyle 293-f细胞(invitrogen),并使用x-tremegene ro-1539(商品,roche diagnostics)作为复合剂以约1-1.5x 10e6细胞/ml用上述质粒dnas转染。将细胞进料至浓缩的营养液(j immunol methods 194(1996),19,1-199(第193页))并在转染后72h由丁酸钠(2mm)诱导及在转染后96h收获。表达通过western blot、酶测定和/ 或分析型imac层析分析。在将细胞悬浮液在流通式热交换器中冷却至 4℃之后,通过经过zeta plus 60m02e16(cuno)和sartopore 2xlg (sartorius)过滤单元的过滤,进行细胞分离和上清液的无菌过滤。在纯化之前,将上清液在4℃储存。
[0247]
atx纯化:通过添加brij 35至0.02%的最终浓度和通过使用1m hcl 来调节ph至7.0,由此调节20升的培养物上清液用于超滤。随后首先将上清液经过0.2μm ultran-pilot open channel pes过滤器(whatman)微过滤,随后通过具有30kda mwco的ultran-pilot screen channel pes过滤器(whatman)浓缩至1升。在imac层析之前,加入niso4至1mm的最终浓度。随后将澄清后的上清液施加至预先在50mm na2hpo
4 ph 7.0、0.5 m nacl、10%甘油、0.3%chaps、0.02%nan3中平衡的histrap柱(gehealthcare)。分别用相同的含有20mm、40mm和50mm咪唑的缓冲液分步洗涤该柱。随后使用线性梯度至0.5m咪唑,以15柱体积洗脱蛋白。使用配备有30kda pes过滤膜的amicon池将含有atx的级分汇集并浓缩。随后在superdex s-200制备级(xk 26/100)(ge healthcare)上,在20mmbicine ph8.5、0.15m nacl、10%甘油、0.3%chaps、0.02%nan3中,通过尺寸排阻层析将蛋白进一步纯化。在纯化后蛋白的最终收率为5-10 mg atx/升培养物上清液。将蛋白在-80℃储存。
[0248]
人atx酶抑制测定
[0249]
使用特别标记的底物模拟物(mr121底物),通过荧光猝灭测定,测量 atx抑制。为了获得此mr121底物,用mr121荧光团(cas185308-24-1, 1-(3-羧基丙基)-11-乙基-1,2,3,4,8,9,10,11-八氢-二吡啶并[3,2-b:2’,3
’‑
i]吩嗪-13-)在乙醇胺侧的游离胺上标记boc和tbs保护的6-氨基-己酸 (r)-3-({2-[3-(2-{2-[2-(2-氨基-乙氧基)-乙氧基]-乙氧基}-乙氧基)-丙酰氨基]-乙氧基}-羟基-磷酰氧基)-2-羟基-丙酯(ferguson等,org lett 2006,8 (10),2023),并随后,在脱保护后,接着用色氨酸在氨基己酸侧上标记。
[0250]
测定工作溶液按如下制备:
[0251]
测定缓冲液(50mm tris-hcl、140mm nacl、5mm kcl、1mm cacl2、 1mm mgcl2、0.01%triton-x-100、ph 8.0;
[0252]
atx溶液:atx(人his-标记的)储备溶液(1.08mg/ml,在20mm n
‑ꢀ
二(羟乙基)甘氨酸中,ph 8.5、0.15m nacl、10%甘油、0.3%chaps、 0.02%nan3),在测定缓冲液中稀释至1.4-2.5x最终浓度;
[0253]
mr121底物溶液:mr121底物储备溶液(800μm mr121底物,在 dmso中),在测定缓冲液中稀释至2-5x最终浓度。
[0254]
在384孔样品板(corning costar#3655)中获得测试化合物(10mm储备,在dmso中,8μl),并用8μl dmso稀释。通过将8μl的cpd化合物溶液转移至下一行直至第o行,进行逐行地连续稀释。将化合物和对照溶液混合五次,并将2μl转移至384孔测定板(corning costar#3702)。随后,添加15μl的41.7nm atx溶液(30nm最终浓度),混合五次并随后在30℃温育15分钟。添加10μl的mr121底物溶液(1μm最终浓度),混合30次,随后在30℃温育15分
钟。随后每2分钟测定荧光,持续1 小时(perkin elmer板:视觉多模态读出装置);光强度:2.5%;exp.时间: 1.4秒,过滤器:fluo_630/690nm),且从这些读数计算ic
50
值。
[0255][0256]
本文所述的式(i)化合物和它们的药用盐或酯具有0.00001μm至1000 μm之间的ic
50
值,特别的化合物具有0.0005μm至500μm之间的ic
50
值,进一步特别的化合物具有0.0005μm至50μm之间的ic
50
值,更特别的化合物具有0.0005μm至5μm的ic
50
值。这些结果已经通过使用上述酶测定获得。
[0257]
式(i)化合物及其药用盐可以用作药物(例如以药物制剂的形式)。药物制剂可以以下列方式内部给药:如经口(例如以片剂,包衣片剂,糖衣丸,硬和软明胶胶囊,溶液剂,乳剂或混悬剂的形式),经鼻(例如以鼻喷雾的形式)或经直肠(例如以栓剂的形式)或局部经眼部(例如以溶液,软膏,凝胶或水溶性聚合物插入物的形式)。然而,给药也可以在肠胃外实现,如肌肉内、静脉内或眼内(例如以无菌注射液的形式)。
[0258]
式(i)化合物及其药用盐可以用药物惰性的、无机或有机辅料处理,用于制备片剂、包衣片剂、糖衣丸、硬明胶胶囊、注射液或局部制剂。例如可以使用乳糖、玉米淀粉或其衍生物、滑石、硬脂酸或其盐等作为这样的用于片剂、糖衣丸和硬明胶胶囊的辅料。
[0259]
合适的用于软明胶胶囊的辅料是例如植物油、蜡、脂肪、半固体物质和液体多元醇等。
[0260]
合适的用于制备溶液剂和糖浆剂的辅料是例如水、多元醇、蔗糖、转化糖、葡萄糖等。
[0261]
合适的用于注射液的辅料是例如水、醇、多元醇、甘油、植物油等。
[0262]
合适的用于栓剂的辅料是例如天然或硬化油、蜡、脂肪、半固体或液体多元醇等。
[0263]
合适的用于局部眼部制剂的辅料是例如环糊精、甘露醇或本领域中已知的许多其他载体和赋形剂。
[0264]
此外,药物制剂可以含有防腐剂、增溶剂、增粘物质、稳定剂、润湿剂、乳化剂、增甜剂、着色剂、香料、用于调节渗透压的盐、缓冲剂、掩蔽剂或抗氧化剂。它们还可以含有其它
有治疗价值的物质。
[0265]
剂量可以在宽范围内变化,并且当然将适合每种特定情况下的个体需求。通常,在经口给药的情况下,每kg体重为约0.1mg至20mg、优选每kg体重为约0.5mg至4mg(例如每人约300mg)的每日剂量,优选分成 1-3个可以例如由相同量组成的单个剂量,这应当是适合的。在局部给药的情况中,制剂可以包含0.001重量%至15重量%的药物,并且所需剂量 (可以为0.1至25mg)可以通过每天或每周单次剂量给药,或通过每天多次剂量(2至4)给药,或通过每周多次剂量给药。然而,将清楚的是,当明确指示时,可以超过本文给出的上限或下限。
[0266]
以下通过非限制性的实施例阐明本发明。
[0267]
在制备实施例是作为对映异构体混合物的形式获得的情况下,可以通过本文中描述的方法或本领域技术人员已知的方法诸如例如手性层析法或结晶来获得纯的对映异构体。
实施例
[0268]
如果不另外规定,所有实施例和中间体都在氮气氛下制备。
[0269]
缩写:aq.=水性的;cas-rn=化学文摘服务注册号;hplc=高效液相色谱;ms=质谱;ps-bemp=聚苯乙烯结合的2-叔丁基亚氨基-2
‑ꢀ
二乙氨基-1,3-二甲基全氢-1,3,2-二氮杂磷杂苯;sat.=饱和的。
[0270]
实施例1
[0271]
反式-5-(1h-苯并三唑-5-羰基)-3a-氟-六氢-吡咯并[3,4-c]吡咯-2-甲酸4
‑ꢀ
三氟甲氧基-苄酯
[0272][0273]
在室温向反式-3a-氟-六氢-吡咯并[3,4-c]吡咯-2-甲酸4-三氟甲氧基-苄酯盐酸盐(中间体4.01;139mg;361μmol)、4-甲基吗啉(183mg,1.81mmol) 和1h-苯并[d][1,2,3]三唑-5-甲酸(cas-rn 23814-12-2;58.9mg,361μmol) 在n,n-二甲基甲酰胺(3ml)中的悬浮液加入o-(7-氮杂苯并三唑-1
‑ꢀ
基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐(137mg,361μmol),然后在16h后将反应混合物在饱和碳酸氢钠水溶液和乙酸乙酯/2甲基四氢呋喃(4∶1)之间分配。将有机层用饱和氯化铵水溶液和盐水洗涤,用硫酸镁干燥,过滤并蒸发。层析法(硅胶;二氯甲烷至二氯甲烷/甲醇/25%氨水溶液90∶10∶0.25 的梯度)得到标题化合物(158mg 89%)。浅黄色泡沫,ms:494.2(m+h)
+
。
[0274]
类似实施例1,用合适的胺替代反式-3a-氟-六氢-吡咯并[3,4-c]吡咯-2
‑ꢀ
甲酸4-三氟甲氧基-苄酯盐酸盐并且用合适的羧酸替代1h-苯并[d][1,2,3] 三唑-5-甲酸,产生以下实施例。
[0275][0276]
[0277][0278]
实施例2
[0279]
反式-[3a-甲氧基-5-(1,4,6,7-四氢三唑并[4,5-c]吡啶-5-羰基)-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-基] 甲酮
[0280][0281]
步骤1:反式-2-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-羰基]-3a-甲氧基-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-5-碳酰氯
[0282]
在0℃向(2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)吡啶-4-基)(反式-3a
‑ꢀ
甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-基)甲酮二盐酸盐(中间体6;288mg, 577μmol)和n,n-二异丙基乙胺(186mg,1.44mmol)在二氯甲烷(10ml)中的溶液中加入三光气(85.6mg,288μmol)在二氯甲烷(10ml)中的溶液。在 11/2h后将冰浴除去,然后在另外21/2h后将反应混合
物在1m盐酸水溶液和二氯甲烷之间分配。将有机层用硫酸镁干燥,过滤并蒸发以提供标题化合物(230mg,86%),将其直接用于下个步骤。白色固体。
[0283]
步骤2:反式-[3a-甲氧基-5-(1,4,6,7-四氢三唑并[4,5-c]吡啶-5-羰基)-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-基]甲酮
[0284]
在室温向反式-2-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-羰基]-3a-甲氧基-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-5-碳酰氯(140mg,302μmol)在二氯甲烷(10ml)中的澄清无色溶液中,加入n,n-二异丙基乙胺(117mg,905 μmol)和4,5,6,7-四氢-1h-[1,2,3]三唑并[4,5-c]吡啶(cas-rn 706757-05-3; 37.5mg,302μmol)在n,n-二甲基甲酰胺(10ml)中的溶液,然后在15h 后将反应混合物在水和二氯甲烷之间分配。将有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发。层析法(硅胶;二氯甲烷至二氯甲烷/甲醇/25%氨水溶液90∶10∶0.25的梯度)得到标题化合物(85mg,51%)。白色固体。ms:550.3 (m-h)-。
[0285]
类似实施例2,用合适的胺1替代(2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)吡啶-4-基)(反式-3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-基)甲酮二盐酸盐并用合适的胺2替代4,5,6,7-四氢-1h-[1,2,3]三唑并[4,5-c]吡啶,产生以下实施例。
[0286][0287]
实施例3和4
[0288]
反式-[3a-甲氧基-5-(1,4,6,7-四氢三唑并[4,5-c]吡啶-5-羰基)-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-基] 甲酮,对
映异构体1和对映异构体2
[0289]
通过制备型hplc,使用chiralpak ad作为固定相和庚烷/乙醇/乙酸铵 60∶40∶0.004作为洗脱液,分离外消旋的反式-[3a-甲氧基-5-(1,4,6,7-四氢三唑并[4,5-c]吡啶-5-羰基)-3,4,6,6a-四氢-1h-吡咯并[3,4-c]吡咯-2-基]-[2-环丙基-6-(烷-4-基甲氧基)吡啶-4-基]甲酮(实施例2;85mg,154μmol)。这产生较快洗脱的对映异构体1(实施例3;22mg,26%;浅黄色泡沫,ms:552.4 (m+h)
+
),以及较慢洗脱的对映异构体2(实施例4;16mg,19%;白色泡沫,ms:552.4(m+h)
+
)。
[0290]
类似实施例3和4,使用如下所示的固定相和洗脱液,通过手性hplc 分离来产生以下实施例。
[0291][0292][0293]
中间体
[0294]
中间体1
[0295]
反式-3a-甲基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯
[0296]
步骤1:反式-1-苄基-3-甲基吡咯烷-3,4-二甲酸二甲酯
[0297]
在0-5℃将n-苄基-1-甲氧基-n-((三甲基甲硅烷基)甲基)甲胺(cas-rn 93102-05-7;1.74g,17.0mmol)在二氯甲烷(5ml)中的溶液加入到2-甲基富马酸二甲酯(cas-rn 617-53-8;1.00g,6.32mmol)和三氟乙酸(79.3mg, 696μmol)在二氯甲烷(10ml)的冰冷混合物中。允许所得的黄色溶液在20h 内达到室温,然后在饱和碳酸氢盐水溶液和二氯甲烷之间分配。将有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发。层析法(硅胶;二氯甲烷至二氯甲烷/甲醇/25%氨水溶液95∶5∶0.25的梯度)得到标题化合物(1.61g,87%)。浅黄色油状物,ms:292.2(m+h)
+
。
[0298]
步骤2:反式-3-甲基吡咯烷-1,3,4-三甲酸1-叔丁基3,4-二甲基酯
[0299]
将反式-1-苄基-3-甲基吡咯烷-3,4-二甲酸二甲酯(1.56g,5.35mmol)和二甲酸二叔丁酯(1.29g,5.89mmol)在甲醇(20ml)中的溶液在氢气氛(1巴) 下,在钯(10%于活性炭上,165mg,1.55mmol)存在下在室温搅拌。在3h 后,通过硅藻土过滤除去不溶物质并且将滤液浓缩。层析法(硅胶;庚烷至乙酸乙酯/庚烷1∶1的梯度)得到标题化合物(1.47g,91%)。无色油状物, ms:202.1(m+h-me3coco)
+
。
[0300]
步骤3:反式-3,4-二(羟甲基)-3-甲基吡咯烷-1-甲酸叔丁酯
[0301]
将反式-3-甲基吡咯烷-1,3,4-三甲酸1-叔丁基3,4-二甲基酯(1.47g,4.87 mmol)在四氢呋喃(12ml)中的溶液冷却至0℃并且用硼氢化锂溶液(2m 于四氢呋喃中,5.47ml,10.9mmol)处理,然后在30min后将冰浴除去并且将反应混合物在室温搅拌。在18h后,通过在0℃缓慢加入1m盐酸水溶液至ph 1来破坏过量试剂。将所得的澄清溶液用二氯甲烷萃取,将有机层用水和盐水洗涤,用硫酸镁干燥,过滤并蒸发。层析法(硅胶,庚烷-乙酸乙酯梯度)得到标题化合物(1.05g,88%)。无色粘性油状物,ms: 190.1(m+h-异丁烯)
+
。
[0302]
步骤4:反式-3-甲基-3,4-二(((甲基磺酰基)氧基)甲基)吡咯烷-1-甲酸叔丁酯
[0303]
在0℃将甲磺酰氯(1.41g,12.4mmol)逐滴加入到冷却至0℃的反式
ꢀ‑
3,4-二(羟甲基)-3-甲基吡咯烷-1-甲酸叔丁酯(1.01g,4.12mmol)和n,n-二异丙基乙胺(3.19g,24.7mmol)在二氯甲烷(10ml)中的澄清无色溶液中。在30min后,将反应混合物在饱和氯化铵水溶液和二氯甲烷之间分配。将有机层用饱和碳酸氢钠水溶液和盐水洗涤,用硫酸镁干燥,过滤并蒸发。层析法(硅胶,庚烷-乙酸乙酯梯度)得到标题化合物(1.53g,92%)。黄色粘性油状物,ms:346.1(m+h-异丁烯)
+
。
[0304]
步骤5:反式-5-苄基-3a-甲基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯
[0305]
向反式-3-甲基-3,4-二(((甲基磺酰基)氧基)甲基)吡咯烷-1-甲酸叔丁酯 (1.52g,3.79mmol)在甲苯(20ml)中的溶液加入三乙胺(1.15g,11.4mmol) 和苄胺(811mg,7.57mmol)。将反应混合物在回流加热,然后在20h后加入另一部分的三乙胺(l.15g,11.4mmol)和苄胺(811mg,7.57mmol),然后在另外20h后在回流将反应混合物用1m氢氧化钠水溶液和盐水洗涤,用硫酸镁干燥,过滤并蒸发。层析法(硅胶,庚烷-乙酸乙酯梯度)得到标题化合物(875mg,73%)。浅黄色固体,ms:317.2(m+h)
+
。
[0306]
步骤6:反式-3a-甲基六氢吡咯并[3.4-c]吡咯-2(1h)-甲酸叔丁酯
[0307]
将(3ar,6ar)-5-苄基-3a-甲基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯 (870mg,2.75mmol)在甲醇(10ml)中的溶液在氢气氛(1巴)下,在钯(10%于活性炭上,146mg,1.37mmol)存在下在室温搅拌,然后在5h后,通过硅藻土过滤除去不溶物质。将滤液
蒸发以提供标题化合物(640mg, 93%),含有大约10%的甲醇。无色粘性油状物,ms:227.2(m+h)
+
。
[0308]
中间体2
[0309]
反式-3a-氟六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯
[0310]
类似中间体1,用2-氟富马酸二乙酯(cas-rn 4495-77-6)替代2-甲基富马酸二甲酯,产生标题化合物。无色粘性油状物,ms:231.2(m+h)
+
。
[0311]
中间体3
[0312]
反式-3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯
[0313]
类似中间体1,用2-甲氧基富马酸二甲酯(cas-rn 2215-05-6)替代2
‑ꢀ
甲基富马酸二甲酯,产生标题化合物。无色粘性油状物,ms:243.2(m+h)
+
。
[0314]
中间体4
[0315]
反式-3a-甲基-六氢-吡咯并[3,4-c]吡咯-2-甲酸4-三氟甲氧基-苄酯盐酸盐
[0316]
步骤1:反式-3a-甲基四氢吡咯并[3,4-c]吡咯-2,5(1h,3h)-二甲酸2-叔丁基5-(4-(三氟甲氧基)苄基)酯
[0317]
向(4-(三氟甲氧基)苯基)甲醇(474mg,2.47mmol)在乙腈(20ml)中的溶液中,加入1,1
’‑
羰基二咪唑(413mg,2.47mmol)并且将反应混合物加热至 50℃,然后在3h后加入三乙胺(1.25g,12.3mmol)和反式-3a-甲基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯(中间体1;621mg,2.47mmol)并且将反应混合物在回流加热。在15h后,将反应混合物在乙酸乙酯和饱和碳酸氢钠水溶液之间分配。将有机层用饱和氯化铵水溶液和盐水洗涤,用硫酸镁干燥,过滤并蒸发。层析法(硅胶;二氯甲烷至二氯甲烷/甲醇/25%氨水溶液95∶5∶0.25的梯度)得到标题化合物(821mg,75%)。浅黄色油状物, ms:389.2(m+h-异丁烯)
+
。
[0318]
步骤2:反式-3a-甲基-六氢-吡咯并[3,4-c]吡咯-2-甲酸4-三氟甲氧基-苄酯盐酸盐
[0319]
将反式-3a-甲基四氢吡咯并[3,4-c]吡咯-2,5(1h,3h)-二甲酸2-叔丁基 5-(4-(三氟甲氧基)苄基)酯(812mg,1.83mmol)和盐酸溶液(5-6m于2-丙醇中,10.2ml,51.2mmol)在2-丙醇(5ml)中的溶液在室温搅拌15h,然后浓缩至干燥。将剩余物在叔丁基甲基醚中研磨并且通过过滤收集沉淀从而产生标题化合物(662mg,95%)。白色固体,ms:345.1(m+h)
+
。
[0320]
中间体4.01
[0321]
反式-3a-氟-六氢-吡咯并[3,4-c]吡咯-2-甲酸4-三氟甲氧基-苄酯
[0322]
类似中间体4,用反式-3a-氟六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯 (中间体2)替代反式-3a-甲基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁基,产生标题化合物。白色固体,ms:349.1(m+h)
+
。
[0323]
中间体5
[0324]
反式-3a-甲氧基-六氢-吡咯并[3,4-c]吡咯-2-甲酸3-(2,2-二甲基-丙酰氨基)-5-三氟甲基-吡啶-2-基甲酯二盐酸盐
[0325]
步骤1:反式-5-(氯羰基)-3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯
[0326]
在0℃向反式-3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯(中间体3;440mg,1.82mmol)和吡啶(646mg,8.17mmol)在二氯甲烷(5ml) 中的溶液逐滴加入三光气(242mg,817μmol)在二氯甲烷(4ml)中的溶液。在30min后将冰浴除去,然后在4h后将反应混
合物在二氯甲烷和1m盐酸水溶液之间分配。将有机层用水和盐水洗涤,用硫酸镁干燥,过滤并蒸发从而提供标题化合物(372mg,67%),为浅黄色泡沫。
[0327]
步骤2:反式-3a-甲氧基四氢吡咯并[3,4-c]吡咯-2,5(1h,3h)-二甲酸2-叔丁基5-((3-新戊酰氨-5-(三氟甲基)吡啶-2-基)甲基)酯
[0328]
向反式-5-(氯羰基)-3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯(370mg,1.21mmol)在乙腈(25ml)中的溶液中,加入n-(2-(羟甲基)-5-(三氟甲基)吡啶-3-基)新戊酰胺(中间体8;335mg,1.21mmol)和 ps-bemp(cas-rn 1446424-86-7;1.5g,1.21mmol)。将橙色悬浮液在回流加热21h,然后通过过滤除去不溶物质。向滤液加入ps-三羟甲基氨基甲烷(trisamine)(cas-rn 1226492-10-9;315mg,1.21mmol)并将反应混合物在室温搅拌18h,然后通过过滤除去不溶物质并将滤液蒸发。层析法(硅胶;二氯甲烷至二氯甲烷/甲醇/25%氨水溶液95∶5∶0.25的梯度)得到标题化合物(333mg,50%)。白色泡沫,ms:545.3(m+h)
+
。
[0329]
步骤3:反式-3a-甲氧基-六氢-吡咯并[3,4-c]吡咯-2-甲酸3-(2,2-二甲基-丙酰氨基)-5-三氟甲基-吡啶-2-基甲酯二盐酸盐
[0330]
将反式-3a-甲氧基四氢吡咯并[3,4-c]吡咯-2,5(1h,3h)-二甲酸2-叔丁基 5-((3-新戊酰氨-5一(三氟甲基)吡啶-2-基)甲基)酯(325mg,597μmol)和盐酸溶液(5-6m于2-丙醇中,3.34ml,16.7mmol)在2-丙醇(2ml)中的溶液在室温搅拌18h,然后将反应混合物浓缩至干燥。将剩余物在叔丁基甲基醚中研磨并且通过过滤收集沉淀,从而得到标题化合物(291mg,94%)。白色固体,ms:445.2(m+h)
+
。
[0331]
中间体6
[0332]
反式-(2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)吡啶-4-基)3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-基)甲酮二盐酸盐
[0333]
步骤1:反式-5-(2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)异烟酰基)-3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯
[0334]
向反式-3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯(500mg, 2.06mmol)在n,n-二甲基甲酰胺(40ml)的溶液中加入2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)异烟酸(中间体7;572mg,2.06mmol)和4-甲基吗啉(1.04g,10.3mmol)。将溶液冷却至0℃,然后加入o-(7-氮杂苯并三唑
ꢀ‑
1-基)-n,n,n’,n
’‑
四甲基脲六氟-磷酸盐(824mg,2.17mmol)。将冰浴除去,然后在96h后将反应混合物在碳酸氢钠溶液和乙酸乙酯/2-甲基四氢呋喃(4∶1)之间分配。将有机层用饱和氯化铵水溶液和盐水洗涤,用硫酸镁干燥,过滤并蒸发。层析法(硅胶;二氯甲烷至二氯甲烷/甲醇/25%氨水溶液90∶10∶0.25的梯度)得到标题化合物(977mg;94%)。黄色粘性油状物, ms:502.3(m+h)
+
。
[0335]
步骤2:反式-(2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)吡啶-4-基)3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-基)甲酮二盐酸盐
[0336]
将反式-5-(2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)异烟酰基)-3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯(977mg,1.95mmol)和盐酸溶液(5-6m于2-丙醇中,8.57ml,42.8mmol)在2-丙醇(8ml)中的溶液在室温搅拌16h,然后将反应混合物浓缩至干燥。将剩余物在叔丁基甲基醚中研磨并且通过过滤收集沉淀从而得到标题化合物(858mg,88%)。白色固体,ms:402.3(m+h)
+
。
[0337]
中间体6.01
[0338]
反式-1-(3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-基)-3-(4-(三氟甲氧基) 苯基)丙-1-酮二盐酸盐
[0339]
类似实施例6,用3-(4-(三氟甲氧基)苯基)丙酸替代2-环丙基-6-((四氢
ꢀ‑
2h-吡喃-4-基)甲氧基)异烟酸,产生标题化合物。褐色粘性油状物,ms: 359.2(m+h)
+
。
[0340]
中间体7
[0341]
2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)异烟酸
[0342]
步骤1:6-环丙基-2-氧代-1,2-二氢吡啶-4-甲酸甲酯
[0343]
将6-环丙基-2-氧代-1,2-二氢吡啶-4-甲酸(cas-rn 150190-28-6;400 mg,2.23mmol)在甲醇(4ml)和硫酸(12μl)中的悬浮液在70℃加热48h,然后在真空中浓缩。将剩余物悬浮在二氯甲烷(10ml)中,然后通过过滤除去不溶物质并将滤液蒸发从而产生标题化合物(427mg,99%)。浅褐色半固体,ms:194.1(m+h)
+
。
[0344]
步骤2:2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)异烟酸甲酯
[0345]
向搅拌的6-环丙基-2-氧代-1,2-二氢吡啶-4-甲酸甲酯(212mg,1.1mmol) 在乙腈(5ml)中的悬浮液加入碳酸钾(455mg,3.29mmol)和4-(碘甲基)四氢-2h-吡喃(cas-rn 101691-94-5;744mg,3.29mmol)。将反应混合物在 80℃加热16h,然后在真空中蒸发。将剩余物通过层析法(硅胶;庚烷
‑ꢀ
乙酸乙酯梯度)纯化从而产生标题化合物(188mg,59%)。无色油状物,ms: 292.2(m+h)
+
。
[0346]
步骤3:2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)异烟酸
[0347]
向2-环丙基-6-((四氢-2h-吡喃-4-基)甲氧基)异烟酸甲酯(184mg,632 μmol)在四氢呋喃(2ml)和水(2ml)中的溶液加入氢氧化锂一水合物(53.0 mg,1.26mmol)并将所得的混合物在室温搅拌16h。将混合物部分蒸发以除去四氢呋喃。将水相在1m盐酸水溶液和乙酸乙酯之间分配。将有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发从而产生标题化合物(218mg,定量)。无色油状物,ms:276.1(m-h)-。
[0348]
中间体8
[0349]
n-(2-(羟甲基)-5-(三氟甲基)吡啶-3-基)新戊酰胺
[0350]
步骤1:3-新戊酰氨-5-(三氟甲基)甲基吡啶酸甲酯
[0351]
在0℃向3-氨基-5-(三氟甲基)甲基吡啶酸甲酯(cas-rn 866775-17-9; 2.00g,8.63mmol)在吡啶(25ml)中的褐色溶液加入新戊酰氯(2.08g,17.3 mmol)。在20min后将冰浴除去,然后在5h后将反应混合物在1m盐酸水溶液和乙酸乙酯之间分配。将有机层用水和盐水洗涤,用硫酸镁干燥,过滤并蒸发。层析法(硅胶;庚烷-乙酸乙酯梯度)得到标题化合物(2.46g, 92%)。浅黄色固体,ms:305.1(m+h)
+
。
[0352]
步骤2:n-(2-(羟甲基)-5-(三氟甲基)吡啶-3-基)新戊酰胺
[0353]
向3-新戊酰氨-5-(三氟甲基)甲基吡啶酸甲酯(2.45g,8.05mmol)在四氢呋喃(60ml)中的澄清浅黄色溶液加入氯化钙(1.79g,16.1mmol)在乙醇(60 ml)中的溶液,然后将硼氢化钠(914mg,24.2mmol)经30min的时间分3 部分加入。将白色悬浮液在室温搅拌90min,然后在水和饱和氯化铵水溶液中分配。将有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发。层析法(硅胶;庚烷-乙酸乙酯梯度)得到标题化合物(1.97g;89%)。浅黄色粘性油状物,ms:277.1(m+h)
+
。
[0354]
中间体9
[0355]
3-氟-4-(反式-3a-氟八氢吡咯并[3,4-c]吡咯-2-羰基)苯磺酰胺盐酸盐
[0356]
步骤1:反式-3a-氟-5-(2-氟-4-氨磺酰苯甲酰基)六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯
[0357]
类似中间体6,步骤1,用反式-3a-氟六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯替代反式-3a-甲氧基六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯且用2-氟-4-苯磺酰苯甲酸(cas-rn714968-42-0)替代2-环丙基-6-((四氢-2h
‑ꢀ
吡喃-4-基)甲氧基)异烟酸替代。浅黄色泡沫,ms:432.2(m+h)
+
。
[0358]
步骤2:3-氟-4-(反式-3a-氟八氢吡咯并[3,4-c]吡咯-2-羰基)苯磺酰胺盐酸盐
[0359]
类似中间体6,步骤2,从反式-3a-氟-5-(2-氟-4-氨磺酰苯甲酰基)六氢吡咯并[3,4-c]吡咯-2(1h)-甲酸叔丁酯产生标题化合物。白色固体,ms: 332.0(m+h)
+
。
[0360]
实施例a
[0361]
式(i)的化合物可以以本身已知的方式作为活性成分用于制备以下组合物的片剂:
[0362][0363]
实施例b
[0364]
式(i)的化合物可以以本身已知的方式作为活性成分用于制备以下组合物的胶囊:
[0365]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1